休克尔规则的教学分析
2017-12-20秦永华赵新梅张雅娟张新波严兰兰
秦永华,赵新梅,张雅娟,张新波,严兰兰
(浙江医药高等专科学校 , 浙江 宁波 315100)
休克尔规则的教学分析
秦永华,赵新梅,张雅娟,张新波,严兰兰*
(浙江医药高等专科学校 , 浙江 宁波 315100)
休克尔规则是大学有机化学中判断分子芳香性与否的重要经验规则。本文通过介绍休克尔规则中对共轭体系和π电子数的要求,分析了满足规则的共轭体系类型及π电子数的计算方法,并在教学实践活动中进行了运用,取得了很好的教学效果。
休克尔规则 ;教学 ;分析; 有机化学
休克尔规则是有机化学中用于判断非苯系化合物芳香性与否的重要经验规则。1932年德国化学家休克尔利用分子轨道法计算环的稳定性,所得结论为:一个具有环状闭合共平面的共轭体系的单环烯烃,若其π电子数满足4n+2规律时(n取非负整数),分子才具有芳香性。这个规则被称为休克尔规则[1]。休克尔规则不仅可用于判断单环烯烃的芳香性,还可用于判断多环烯烃、杂环的芳香性。
1 学生学习障碍分析
在实际教学过程中,学生往往对休克尔规则的具体应用难以掌握和理解,主要存在两个方面的原因。在教材方面,多数有机化学教材,如由王礼琛[2]、张斌[2]、高占先[3]等主编出版的教科书中,都对休克尔规则作了介绍,但内容的详细度不够,仅对休克尔规则的概念作了说明,并辅以常见化合物的结构作为支撑,没有剖析休克尔规则中对共轭体系的要求及π电子如何计算的问题,缺乏实施步骤,给学生自学带来很大的困扰。
在学生方面,我校高职药学类专业的学生,由于本身化学基础薄弱,学习兴趣不浓,又缺乏积极性和主动性,在遇到难以理解的概念或定律时,往往无从下手,对知识内容的学习囫囵吞枣,只重表面,抓不住重点。
基于学生对于休克尔规则的学习障碍,有必要在课堂教学中有针对性的进行教学设计,以学生已有的理论基础为依据,通过合理适当的方法引导,使学生能真正的掌握休克尔规则的实质与运用,提高教学质量与教学效果。
2 休克尔规则的教学分析
在教学设计中,紧紧围绕休克尔规则的“两个中心思想”展开,即对环系共轭体系的要求和对π电子数的满足。
2.1 环系共轭体系的要求
具有芳香性的非苯系化合物,要求具有“环状闭合共平面”的共轭体系。可以说分子结构的平面或近平面性是应用休克尔规则的必要条件。在课本之前的学习内容中,涉及到共轭体系类型的主要有四种,即:π-π共轭、p-π共轭、 -π超共轭和 -p超共轭。从共轭体系的形成过程来看,通常情况下π-π共轭和p-π共轭要求参与共轭的各单元共平面,以便各原子上未参与杂化的p轨道可以相互平行而重叠,如1,3-丁二烯分子中的π-π共轭,见图1。
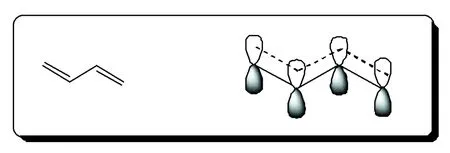
图1 1,3-丁二烯分子的π-π共轭
-π超共轭和 -p超共轭,由于参与共轭的一方是与π键或p轨道相邻的碳氢 键, 键所处方位无法与p轨道或形成π键的p轨道相平行(不能位于同一平面),故重叠程度微弱,称为超共轭,如丙烯中的 -π超共轭,见图2。
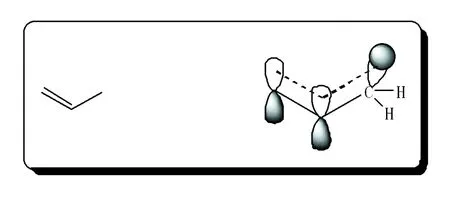
图2 丙烯分子的 -π超共轭
由此可见,适用于休克尔规则共轭体系要求的主要是π-π共轭与p-π共轭。
2.2 带电体系π电子数的计算
学生往往对于共轭体系的判断比较纯熟,但在π电子的计算上存在较大的难度。需要指出的是,休克尔规则中π电子应为环系中参与共轭的电子数,而不仅仅是形成普通π键的电子数。从π键的形成过程来看,共轭体系中形成π键的原子,各自提供1个p电子参与了共轭,如图2丙烯分子中的π键。因此,体系中每个不饱和的原子所贡献的π电子数为1。非苯系化合物有时为了满足休克尔规则对于共轭体系的要求,需要在结构中引入正电荷或负电荷,当分子有电性时,带电部分的π电子计算方法如下。
2.2.1 电荷位于饱和原子上
以环丙烯为例。环丙烯分子共平面的闭合共轭,不满足休克尔规则对共轭体系的要求,但当环丙烯中饱和碳原子显正电或负电性时,由于形成了p-π共轭,则具有了一个闭合共平面的共轭体系。当饱和碳原子显正电性时,可以知道此时饱和碳由sp3杂化态转变为sp2杂化,其参与p-π共轭的p轨道中没有任何电子,故饱和碳原子显正电性时,对π电子无贡献,整个体系的π电子总数为2,满足4n+2规则(n=0),具有芳香性;当饱和碳原子上显负电性时,其杂化态也为sp2杂化,但参与共轭的p轨道中有2个电子,故可以知道,当一个饱和碳原子显负电性时,其对π电子的贡献为2,整个体系中π电子数为4,不满足4n+2规则,不具有芳香性。详细图解见图3。

图3 环丙烯正负离子结构
2.2.2 电荷位于不饱和原子上
以环丁二烯为例。环丁二烯分子中存在π-π共轭体系,具有共平面闭合的共轭体系,但其π电子数为4,不符合4n+2规则,不具有芳香性。当环上不饱和碳显电性时,主要对π电子数有影响,并不会影响到共轭体系的总体构成。当环丁二烯分子带两个正电荷时,形成共轭的不饱和碳原子p轨道中的π电子相应的减少了2个,而当其带两个负电荷时,不饱和碳原子p轨道中的π电子则相应的增加了2个,见图4。
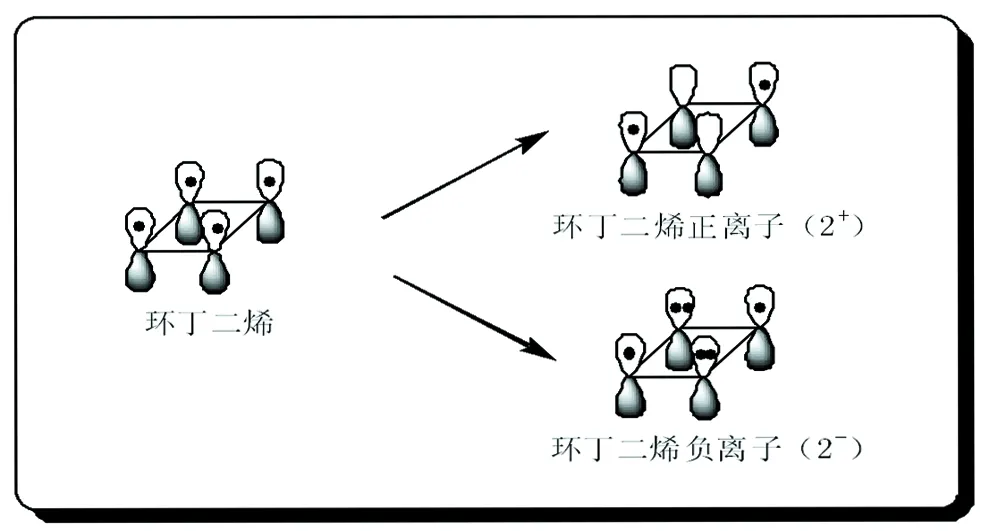
图4 环丁二烯正负离子结构
环丁二烯正离子(2+)中π电子数为2,符合休克尔规则,具有芳香性;环丁二烯负离子(2-)中π电子数为6,符合休克尔规则,也具有芳香性。由上所知,正电荷出现在不饱和原子上时,体系π电子会随正电荷的增加相应的减少;负电荷出现在不饱和原子上时,体系π电子会随负电荷的增加相应的增加。
2.3 杂环体系π电子数的计算
杂环中除了碳原子外,还存在非碳杂原子。对于π电子数,牢牢的把握住参与共轭体系这一重要特征来计算。如呋喃中,氧上孤电子对参与了闭合共轭体系,环系的π电子为6(4+2),符合4n+2规则;吡啶中,虽然氮原子上有孤电子对,但参与共轭的是氮原子的成单电子,在计算π电子时,氮只提供了1个,而不是2个,吡啶分子也符合休克尔规则,具有芳香性,见图5。
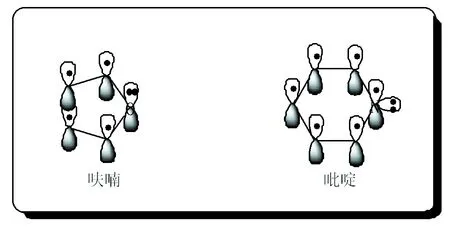
图5 呋喃和吡啶的结构
3 教学反思
芳香性是有机化学中的一个重要概念,而休克尔规则是判断芳香性的重要手段,虽然学生反映休克尔规则在理解上有难度,但我们应该看到,从本源上讲解规则中π电子的计算是能否掌握好该规则的关键所在。在我校的教学实践中,通过讲解分析,学生多能接受该理论并很好的运用,教学效果良好。休克尔规则不仅可用来判断文中所述经典的分子芳香性,也可用来判断大环轮烯、稠环多烯、富瓦烯型分子等的芳香性,在教学过程中,可以将这些分子作为拓展,来进一步加深学生对休克尔规则的理解与掌握。
[1] 王礼琛.有机化学[M].1版,南京:东南大学出版社,2004:138.
[2] 张 斌.药用有机化学[M].2版,北京:中国医药科技出版社,2013:73.
[3] 高占先.有机化学[M].2版,北京:高等教育出版社,2009:200-202.
TeachingAnalysisofHuckelRules
QinYonghua,ZhaoXinmei,ZhangYajuan,ZhangXinbo,YanLanlan
(Zhejiang Pharmaceutical College, Ningbo ,Zhejiang Province 315100,China)
Huckel Rules is a important empirical rules to analysize the aromaticity in organic chemistry.The demands of conjugative systems and the number of π-electron are introduced in this paper to analysize their types and calculation methods which must conform to huckel rules.And good teaching effects are obtained when the analysis is applied in the teaching practice.
Huckel rules;teaching;analysis;organic chemistry
2017-09-21
宁波市服务型教育重点建设专业二级项目《药用化学基础》课程建设(Y039)部分研究成果;浙江医药高等专科学校第三批课堂创新改革项目(KTCX201603003)
通讯联系人:严兰兰(1986—),实验师,研究方向为药学。
G642.0
A
1008-021X(2017)22-0153-02
(本文文献格式:秦永华,赵新梅,张雅娟,等.休克尔规则的教学分析[J].山东化工,2017,46(22):153-154.)
