白花蛇舌草对大肠癌耐药细胞microRNAs表达的影响
2017-12-20林久茂李琼瑜严兆坤赖子君靳祎祎
林久茂 李琼瑜 严兆坤 赖子君 靳祎祎 彭 军
(1 福建中医药大学中西医结合研究院,福州,350122; 2 福建省中西医结合老年性疾病重点实验室,福州,350122)
中药研究
白花蛇舌草对大肠癌耐药细胞microRNAs表达的影响
林久茂1,2李琼瑜1严兆坤1赖子君1靳祎祎1彭 军1,2
(1 福建中医药大学中西医结合研究院,福州,350122; 2 福建省中西医结合老年性疾病重点实验室,福州,350122)
目的:探讨白花蛇舌草(Hedyotic Diffusa Wilid,HDW)对大肠癌5-FU耐药细胞miRNAs表达的调控作用,进一步揭示其逆转大肠癌多药耐药(Multidrug Resistance,MDR)作用机制。方法:通过体外培养HCT-8/5-FU细胞,经HDW处理,采用MTT检测细胞活力、倒置显微镜观察细胞形态、microRNA(miRNA)表达谱芯片分析、QPCR验证差异miRNA表达、GO及Pathway分析预测差异miRNA调控的信号通路。结果:HDW可显著抑制大肠癌HCT-8/5-FU耐药细胞的活力,降低细胞密度;HDW调控57个miRNA差异表达,其中上调23个,下调34个;QPCR验证HDW上调miR-92b-5p、miR-1247-3p、miR-4800-5p的表达,下调miR-4454、miR-4443、miR-483-5p的表达;信号通路预测显示HDW可调控PI3K/Akt、TGF-β/Smad、MAPK、P53、Wnt、JAK-STAT等多条与细胞耐药、迁移、侵袭、增殖、凋亡有关的信号通路。结论:HDW对大肠癌5-FU耐药细胞HCT-8/5-FU具有显著的抑制作用,通过调控miRNAs表达是其逆转大肠癌耐药的作用机制之一。
白花蛇舌草;大肠癌;microRNA;耐药
大肠癌(Colorectal Cancer,CRC)是常见的消化道恶性肿瘤之一,据美国癌症协会调查研究报道,每年全球逾60万人死于CRC,具有高发病率和死亡率,严重危害人类健康[1]。化疗是治疗CRC术后复发及失去手术机会或转移性CRC的主要手段。5-氟尿嘧啶(5-fluorouracil,5-FU)是临床上肠癌化疗的基础用药,常导致CRC细胞产生5-FU耐药性,进而产生继发性多药耐药,是导致5-FU治疗失败的主要因素。肿瘤细胞MDR产生的机制非常复杂,与细胞内药物的蓄积、药物在细胞的分布及MDR基因过表达密切相关,越来越多的研究表明肿瘤耐药与细胞相关蛋白及信号通路有关,并受到相关信号通路的调控。microRNA(miRNA)表观遗传学调控与肿瘤MDR密切相关[2]。miRNA是一类分布广泛的由约19~24个核苷酸组成的一类内源性非编码(Non-protein-coding)单链RNA[3]。miRNA在转录后水平通过结合和降解耐药相关靶基因的mRNA抑制其翻译,从而在肿瘤的耐药中也扮演了重要的角色[4]。
白花蛇舌草(HedyotisDiffusaWilld,HDW)性寒,味甘苦,归心、肝、大肠经,具有清热解毒、消痈散结的功效[5]。白花蛇舌草广泛应用于中医临床抗CRC的治疗,具有显著疗效。研究表明白花蛇舌草对多种恶性肿瘤疗效确切[6-8],前期证实白花蛇舌草可通过多条途径诱导CRC细胞凋亡[9]、抑制CRC细胞增殖[10-12]、抑制CRC血管新生[13]、逆转CRC MDR的作用[14]。但白花蛇舌草逆转肿瘤MDR的作用机制仍为阐明。为进一步揭示白花蛇舌草的作用机制,对其干预CRC 5-FU耐药细胞后的miRNAs表达进行芯片筛选,并结合生物信息学方法分析归纳,以期为其调控miRNA抑制CRC耐药细胞生长提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞 CRC耐药细胞HCT-8/5-FU(南京凯基生物科技发展有限公司);HDW(福建中医药大学附属第三人民医院)。
1.1.2 试剂与仪器 无水乙醇(天津福晨化学工业有限公司生产);RPMI-1640培养基、胎牛血清(FBS)、胰酶、磷酸盐缓冲液(PBS,美国Hyclone公司);RNAiso Plus、SYBR PrimeScipt miRNA RT-PCR试剂盒(中国宝生物工程有限公司生产);酶标仪(ELX800,美国BioTek公司);超微量核酸分析仪(ND-2000C,美国Thermo公司);实时荧光定量PCR仪(7500 Fast,美国life公司);倒置显微镜(DMI4000B,德国Leica公司)。
1.2 方法
1.2.1 HDW提取物的制备 HDW(0.1 kg)用85%乙醇1 L回流提取2次,合并后过滤,浓缩滤液,真空干燥成粉末。HDW提取物粉末用PBS配制成200 mg/mL溶液,-20 ℃贮存备用。用前采用直径0.22 μm微孔滤膜过滤。
1.2.2 细胞培养 HCT-8/5-FU细胞用含5FU(15 μg/mL)的10%FBS的RPMI 1640培养液置于37 ℃二氧化碳培养箱中培养。细胞生长汇合度达90%后,去除培养液加入0.25%含EDTA胰酶进行消化,细胞变圆脱落后加入5倍胰酶体积的完全培养液终止消化,收集单细胞悬液于离心管中,1 000 r/min离心5 min,弃上清,HCT-8/5-FU细胞细胞用RPMI-1640完全培养液重悬后进行传代或接种。
1.2.3 细胞活力分析 取对数生长期HCT-8/5-FU消化计数,按1.0×105个/mL接种于96孔培养板中,100 μL/孔。细胞生长至50%~60%时加入终浓度为0.5~2.0 mg/mL HDW,对照组加等体积的PBS。HDW干预24 h后,每孔加入0.5 mg/mL的MTT溶液100 μL,37 ℃孵育4 h,吸弃MTT,每孔加入DMSO 100 μL,室温振荡混匀后,ELX800酶标仪(波长570 nm)测定各孔吸光度值(即A值),细胞活力(%)=(HDW干预组A值/对照组A值)×100%;细胞抑制率(%)=对照组细胞活力-药物组细胞活力。
1.2.4 细胞形态学观察 取对数期生长的HCT-8/5Fu消化计数,按5×105个/mL接种于6孔培养板中,细胞生长至50%~60%时加入终浓度为0.5~2.0 mg/mL HDW。以不加药细胞作为对照组(加等体积的PBS),用DMI4000B倒置显微镜进行细胞形态的观察并拍照。
1.2.5 miRNA芯片分析 取对数生长期HCT-8/5Fu细胞,按照1.0×106/孔的密度接种于6孔板中。分为对照组和HDW干预组(1.0 mg/mL),细胞经药物干预24 h后,弃上清,用PBS清洗,每孔加RNAiso Plus 1 mL提取总小RNA,ND-2000 C超微量核酸分析仪测定RNA浓度和纯度并芯片分析。本文选取上海欣景公司的miRNA表达谱芯片进行实验。芯片探针版本为HmiOA 4.1,Human miRNA探针有1 087条,共涵盖人源相关miRNA基因1090个。
1.2.6 定量PCR(Quantitative Real Time Polymerase Chain Reaction,QPCR)验证 取对数生长期的HCT-8/5-FU细胞,以5×105个/mL接种于6孔培养板,2 mL/孔,培养过夜后加入终浓度0.5 mg/mL HDW干预24 h。按上述方法进行miRNA提取。取500 ng RNA进行Poly(A)加尾反应。混匀后,37 ℃ 60 min,85 ℃ 5 s。向反应液中添加无RNA酶的去离子水至100 μL。QPCR反应体系20 μL,即:cDNA溶液2 μL,SYBR Premix Ex Taq II(2×)10 μL,PCR Forward Primer(10 μM)0.8 μL,Uni-miR qPCR Primer(10 μM)0.8 μL,ROX Reference Dye II(50×)0.4 μL,6 μL dH2O。引物:miR-92b-5p、miR-1247-3p、miR-4800-5p、miR-4454、miR-4443、miR-483-5p、U6由引物由中国宝生物工程(大连)有限公司提供。混匀后,于7500Fast QPCR仪进行miRNA表达分析。
1.2.7 Gene Ontology(GO)及pathway分析 采用Cytoscape及其插件BINGO(http://www.Cytoscape.Org/)对miRNA靶基因进行GO分析。GO分析包括了基因参与的生物过程(Biological Process)、发挥的分子功能(Molecular Function)、所处的细胞位置(Cellular Component)等3个方面的功能信息,并用BiNGO进行GO显著性分析,差异有统计学意义(P<0.05)。将靶基因向KEGG pathway数据库映射,使用分析软件DAVID进行分析并根据统计检验方法(P-value)选显著富集的分类。通过Fisher Exact Test计算分析表达差异miRNAs调控的信号转导通路。

2 结果
2.1 HDW对CRC耐药细胞HCT-8/5FU生长的影响 HDW对人结肠癌5-FU耐药细胞HCT-8/5-FU生长具有显著的抑制作用。随HDW浓度的增加,HCT-8/5-FU细胞的活力逐渐降低,细胞的生长受到抑制,呈剂量依赖效应。与对照组比较,差异有统计学意义(P<0.01)。见表1。

表1 HDW对HCT-8/5-FU细胞生长的影响
注:与HDW-0 mg/mL组比较,*P<0.05
2.2 HDW对CRC耐药细胞HCT-8/5-FU形态的影响 HCT-8/5-FU细胞经不同浓度HDW干预后,与对照组比较,HCT-8/5-FU细胞密度具有不同程度减少。当EEHDW浓度达到1 mg/mL时,HCT-8/5-FU细胞密度明显减少,细胞形态发生改变,出现一些漂浮的脱落细胞;当EEHDW浓度达到2 mg/mL时,细胞密度进一步减少,细胞变圆、变小,大部分细胞脱落死亡。该结果进一步表明了HDW可显著抑制CRC耐药细胞HCT-8/5-FU的生长,呈明显的剂量效应。见图1。
2.3 HDW对CRC耐药细胞HCT-8/5-FU miRNA表达的影响 miRNAs表达谱芯片分析,结果发现HDW对CRC耐药细胞HCT-8/5-FU的miRNA表达具有调控作用,共有57个miRNA发生了显著的表达变化,HDW上调23个miRNA表达,下调34个miRNA表达。进一步采用QPCR验证,结果证实HDW上调miR-92b-5p、miR-1247-3p、miR-4800-5p等表达,下调miR-4454、miR-4443、miR-483-5p等表达,与芯片结果相符。见图2。
2.4 通路分析预测结果 采用miRNA靶标基因数据库进行miRNA靶基因预测,结果显示,预测的靶基因有1 775个(略)。针对以上1775个靶基因,将其分别投射至GO的3个功能上,结果显示预测的靶基因分别富集于肿瘤细胞耐药、迁移、侵袭、增殖、凋亡有关的信号通路。在此基础上,进一步对基因进行细胞信号通路富集分析。HCT-8/5-FU细胞经HDW处理前后结果显示,在经典通路数据库KEGG中miRNA显著富集于PI3K/Akt通路、TGF-β/Smad通路、MAPK通路、P53通路、Wnt通路、JAK-STAT通路等许多重要的生物途径包括细胞耐药、迁移、侵袭、增殖、凋亡等,差异有统计学意义(P<0.05)。见表2。

图1 HDW对HCT-8/5Fu细胞形态的影响
注:A.HDW-0 mg/mL组;B.HDW-0.5 mg/mL组;C.HDW-1.0 mg/mL组;D.HDW-2.0 mg/mL组
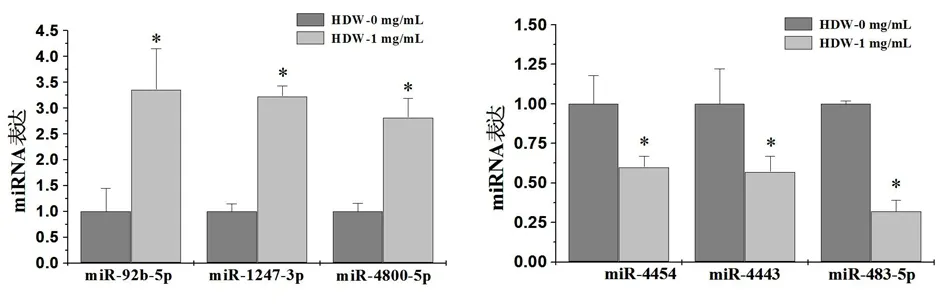
图2 QPCR验证HDW对HCT-8/5FU细胞miRNA表达的影响
注:与HDW-0 mg/mL组比较,*P<0.05

表2 miRNA预测靶基因的通路富集分析
3 讨论
肿瘤细胞MDR产生涉及到多条信号通路的异常激活,以及下游耐药基因、药物代谢酶以及凋亡调控因子的表达异常。近年来的研究表明miRNA等表观遗传学调控机制在MDR相关信号通路活化及相关基因表达的调控中发挥了重要作用[15-16]。前期实验中,也发现HDW可以增加CRC HCT-8/5-FU细胞对5FU的敏感性,通过下调ABC转运蛋白家族成员ABCG2,从而增加5-FU的蓄积[14],然而具体的机制尚未完全阐明。为了进一步揭示HDW抑制耐药CRC细胞生长的机制,首先通过MTT实验观察HDW对HCT-8/5-FU耐药细胞活力的影响,结果表明HDW对HCT-8/5-FU细胞具有显著抑制作用;并从miRNA表观遗传学调控进一步探讨HDW抑制CRC耐药细胞的作用机制,采用miRNA表达谱芯片分析,结果发现HDW对HCT-8/5-FU细胞的miRNA表达具有显著的调控作用。为进一步验证miRNA表达谱芯片结果的正确性和可靠性,对部分差异表达的miRNAs(miR-92b-5p、miR-1247-3p、miR-4800-5p、miR-4454、miR-4443、miR-483-5p)进行Q-PCR验证,结果表明HDW对miRNAs表达的调控与芯片结果相一致。通过生物信息学的方法,利用靶基因预测软件对miRNA靶基因进行分析,并进一步结合GO分析和Pathway分析,发现HDW对HCT-8/5FU细胞包括PI3K/Akt、TGF-β/Smad、MAPK、p53、Wnt和JAK-STAT等许多重要的细胞信号转导通路均有调控作用,涉及细胞的耐药、迁移、侵袭、增殖、凋亡等多个方面,提示HDW可通过多靶点、多途径、多环节发挥其抑制CRC作用及逆转CRC耐药作用。
总之,本文证实了HDW能通过抑制CRC耐药细胞HCT-8/5-FU的活力发挥抑制细胞增殖的作用;HDW对CRC耐药细胞HCT-8/5-FU的miRNAs表达具有显著的调控作用,提示HDW通过调控miRNA表达对其相关信号通路发挥调控作用,进一步为临床应用HDW治疗CRC提供依据。但本研究涉及HDW调控耐药细胞的miRNAs为首次报道,其与药物敏感性的相关性还有待进一步深入探讨。
[1]Siegel R,Miller K,Ahmedin Jemal DVM.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7-30.
[2]Magee P,Shi L,Garofalo M.Role of microRNAs in chemoresistance[J].Ann Transl Med,2015,3(21):332.
[3]Dehghanzadeh R,Jadidi-Niaragh F,Gharibi T,et al.MicroRNA-induced drug resistance in gastric cancer[J].Biomed Pharmacother,2015,74(8):191-199.
[4]Acunzo M,Romano G,Wernicke D,et al.MicroRNA and cancer-a brief overview[J].Adv Biol Regul,2015,57(1):1-9.
[5]Chen R,He J,Tong X,et al.The hedyotis diffusa willd.(Rubiaceae):a review on phytochemistry,pharmacology,quality control and pharmacokinetics[J].Molecules,2016,21(6):710.
[6]Li YL,Zhang J,Min D,et al.Anticancer effects of 1,3-Dihydroxy-2-methylanthraquinone and the ethyl acetate fraction of hedyotis diffusa willd against HepG2 carcinoma cells mediated via apoptosis[J].Plos One,2016,11(4):e0151502.
[7]Zhang Y,Xie RF,Xiao QG,et al.Hedyotis diffusa willd extract inhibits the growth of human glioblastoma cells by inducing mitochondrial apoptosis via AKT/ERK pathways[J].J Ethnopharmacol,2014,158(12):404-411.
[8]Wang N,Li DY,Niu HY,et al.2-hydroxy-3-methylanthraquinone from hedyotis diffusa willd induces apoptosis in human leukemic U937 cells through modulation of MAPK pathways[J].Arch Pharm Res,2013,36(6):752-758.
[9]Lin JM,Chen YQ,Wei LH,et al.Hedyotis difFusa willd extract induces apoptosis via activation of the mitochondrion-dependent pathway in human colon carcinoma cells[J].Int J Oncol,2010,37(5):1331-1338.
[10]Cai QY,Lin JM,Wei LH,et al.Hedyotis difFusa willd inhibits colorectal cancer growth in Vivo via inhibition of STAT3 signaling pathway[J].Int J Mol Sci,2012,13(5):6117-6128.
[11]Lin MH,Lin JM,Wei LH,et al.Hedyotis difFusa willd extract inhibits HT29 cell proliferation via cell cycle arrest[J].Exp Ther Med,2012,4(2):307-310.
[12]Lin JM,Wei LH,Xu W,et al.Effect of hedyotis difFusa willd extract on tumor angiogenesis[J].Mol Med Rep,2011,4(6):1283-1288.
[13]Lin JM,Wei LH,Shen AL,et al.Hedyotis difFusa willd extract suppresses sonic hedgehog signaling leading to the inhibition of colorectal cancer angiogenesis[J].Int J Oncol,2013,42(2):651-656.
[14]Li Q,Wang X,Shen A,et al.Hedyotis diffusa willd overcomes 5-fluorouracil resistance in human colorectal cancer HCT-8/5-FU cells by downregulating the expression of P-glycoprotein and ATP-binding casette subfamily G member 2[J].Exp Ther Med,2015,10(5):1845-1850.
[15]Li Q,Liang X,Wang Y,et al.miR-139-5p inhibits the epithelial-mesenchymal transition and enhances the chemotherapeutic sensitivity of colorectal cancer cells by downregulating BCL2[J].Sci Rep,2016,6(5):27157.
[16]Luo W,Lin Y,Meng S,et al.miRNA-296-3p modulates chemosensitivity of lung cancer cells by targeting CX3CR1[J].Am J Transl Res,2016,8(4):1848-1856.
EffectsofHerbaHedyotisDiffusaeonExpressionofmicroRNAsinColorectalCancerDrugResistantCells
Lin Jiumao1,2,Li Qiongyu1,Yan Zhaokun1,Lai Zijun1,Jin Yiyi1,Peng Jun1,2
(1AcademyofIntegrativeMedicine,FujianUniversityofTraditionalChineseMedicine,Fuzhou350122,China;2FujianKeyLaboratoryofIntegrativeMedicineonGeriatrics,Fuzhou350122,China)
Objective:To study the regulatory effect of Herba Hedyotis Diffusae on multidrug-resistance (MDR)-related microRNAs (miRNAs) in colorectal cancer,and further explore the underlying mechanisms of its MDR reversion.MethodsThe signal pathway regulated by miRNA was forecasted by MTT assays,morphology observation,miRNA array analysis,QPCR validation,GO and Pathway analysis through treatment of HDW in HCT-8/5-FU cells.ResultsHDW significantly inhibited colorectal cell viability and decreased density of HCT-8/5-FU cells.There were 23 up-regulated and 34 down-regulated in 57 miRNA differential expression after HDW treatment; and QPCR verification confirmed that HDW increased expression of miR-92b-5p,miR-1247-3p and miR-4800-5p and decreased expression of miR-4454,miR-4443,miR-483-5p; and the signal pathway prediction showed that HDW could control PI3K/Akt,TGF-β/Smad,MAPK,P53,Wnt and JAK-STAT signaling pathways regulating MDR,migration,invasion,proliferation and apoptosis.ConclusionHDW can remarkably suppress proliferation in HCT-8/5-FU cells,and it is one of the mechanisms to reverse the drug resistance of colorectal cancer by regulating miRNAs expression.
Herba Hedyotis Diffusae; Colorectal cancer; microRNA; Drug resistance
教育部博士点基金博导类项目(20133519110003);陈可冀中西医结合发展基金项目(CKJ2015007,CKJ2014013)
林久茂(1975.02—),男,博士,副研究员,研究方向:中西医结合抗肿瘤的机制研究,E-mail:jiumaolin@hotmail.com
彭军(1969.11—),男,博士,研究员,研究方向:生化与分子生物学,E-mail:pjunlab@hotmail.com
R285.5
A
10.3969/j.issn.1673-7202.2017.11.052
(2016-08-10收稿 责任编辑:张文婷)
