工业碳酸钠产品中铁含量分析方法的探讨
2017-12-20,
,
(连云港碱业有限公司,江苏 连云港 222042)
工业碳酸钠产品中铁含量分析方法的探讨
刘西洲,谢佃村
(连云港碱业有限公司,江苏 连云港 222042)
通过对目前工业碳酸钠检验中铁含量的分析方法进行研究,探讨了如何提高检验数据的准确性和代表性,更好地把好出厂产品质量关,提高产品竞争力。
纯碱;产品分析;铁含量;精密性;质量检验
铁含量是纯碱产品的一个重要质量指标,纺织、洗涤、高端玻璃等行业对纯碱的铁含量都有严格的要求。纯碱中铁含量的测定方法国内外标准都是采用邻菲啰啉分光光度法,国标中要求铁含量(以Fe计)≤0.0035,但一般大的纯碱生产厂家都能控制在0.002%以下。现对铁含量的分析方法进行研究,以提高检验数据的准确性和代表性。
1 国标检验方法
1.1 方法提要
用抗坏血酸将试液中的三价铁还原成二价铁,在pH=4~6时,二价铁离子可与邻菲啰啉生成稳定的橙红色络合物,于分光光度计最大吸收波长510 nm处测量其吸光度。
1.2 试剂
盐酸:1+1及1+3;
氨水:2+3及1+9;
乙酸-乙酸钠缓冲溶液:pH≈4.5;
抗坏血酸:2%溶液,该溶液的使用期限为10天;
邻菲罗啉:0.2%溶液,该溶液应避光保存,仅能是使用无色溶液;
铁标准溶液:1 mL含有0.100 mg 铁及1 mL含有0.010 mg 铁。
1.3 仪器
分光光度计:带有厚度为3 cm的吸收池。
1.4 铁工作曲线的绘制
1.4.1 操作步骤
在7个100 mL的小烧杯中分别加入0,1.0,2.0,4.0,6.0,8.0,10.0 mL铁标准溶液,用水稀至约40 mL,用1+3HCl溶液或2+3 NH3·H2O溶液调至pH约为2,全部移入100 mL容量瓶中,分别加入2.5 mL 20 g/L抗坏血酸,10 mL pH=4.5 Hac-NaAc缓冲溶液,5 mL 2 g/L邻菲啰啉溶液,稀至刻度,摇匀,用3 cm吸收皿,以蒸馏水为空白,于510 nm处测量其吸光度,以铁含量为横坐标,对应的吸光度为纵坐标,绘制工作曲线。
测定条件:时间2017年5月19日,室温28 ℃
仪器:7230G型分光光度计
铁标液:0.01 mg/mL
1.4.2 测定结果

表1 铁标液吸光度测定
根据以上数据计算以铁含量为横坐标(X)、吸光度(减空白后)为纵坐标(Y)的线性回归方程为:
Y=5.8523X+0.001463
相关系数r=0.99998
摩尔吸光系数ε=1.10×105(L mol-1cm-1)
可见吸光度与铁含量之间具有较好的线性相关关系,在测定铁含量的浓度范围内,符合朗伯-比耳吸收定律。
1.4.3 绘制铁标准曲线
根据表1数据,以铁含量为横坐标(X)、吸光度(减空白后)为纵坐标(Y)绘制铁标准曲线如图1。

图1
1.5 试样的测定步骤
称取试样精确至0.01 g,置于烧杯中,加少量水湿润,滴加35 mL盐酸溶液(1+1),煮沸3~5 min,冷却(必要时过滤),移入250 mL容量瓶中,加水至刻度,摇匀。
用移液管移取25 mL试验溶液,置于100 mL烧杯中;另取3.5 mL盐酸溶液(1+1)于另一烧杯中,用氨水(2+3)中和后,与试验溶液一并用氨水(1+9)和盐酸溶液(1+3)调节pH值为2(用精密pH试纸检验)。分别移入100 mL容量瓶中,加2.5 mL抗坏血酸溶液、10 mL乙酸-乙酸钠缓冲溶液、5 mL邻菲啰啉溶液,稀至刻度,摇匀,用3 cm吸收皿于510 nm处,以水为参比,测量试液和试剂空白溶液的吸光度。用试验溶液的吸光度减去空白试验溶液的吸光度,从工作曲线上查出相应的铁的质量。
结果计算:铁(Fe)的质量分数ω3(数值以%表示)按下式计算:
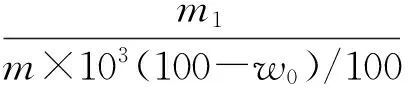
式中:m1——从工作曲线上查出的铁的质量的数值,单位为毫克(mg);
m——移取试验溶液中所含试料的质量的数值,单位为克(g);
w0——测得的烧失量的质量分数的数值,以%表示。
2 方法精密度的试验
分别准备1#~4#样品,按照1.5节的分析步骤测定纯碱中的铁含量,每个样平行测定8次,结果统计如表2。
从表2四个样品的测定结果看出,该方法具有较高的精密度。
3 几种分析过程的影响
3.1 称样量的影响
称取1#纯碱试样按取样量5 g、10 g、20 g分别平行进行试验8次,结果与表2中1#样数据对比如表3。
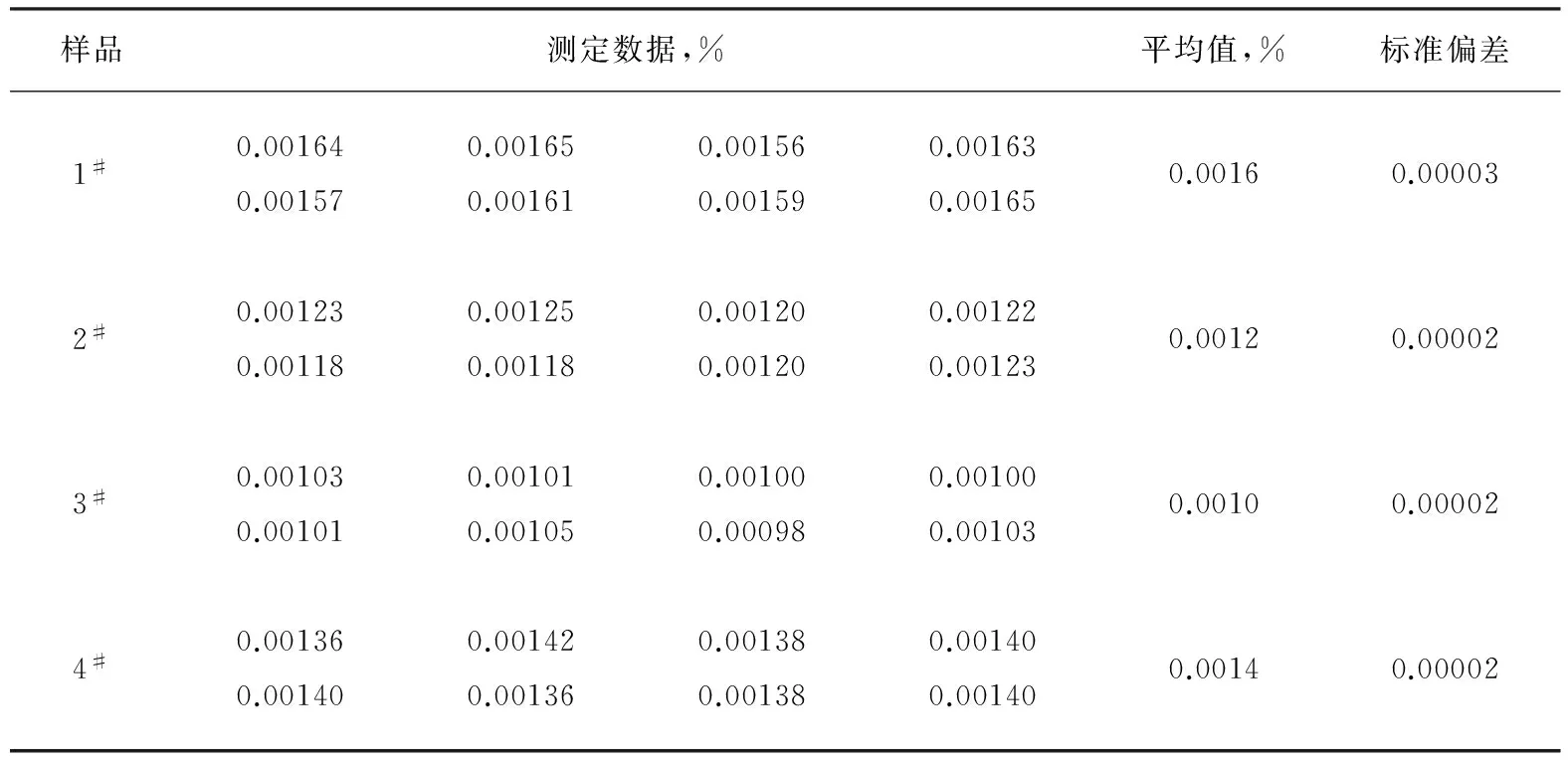
表2 纯碱中铁含量测定
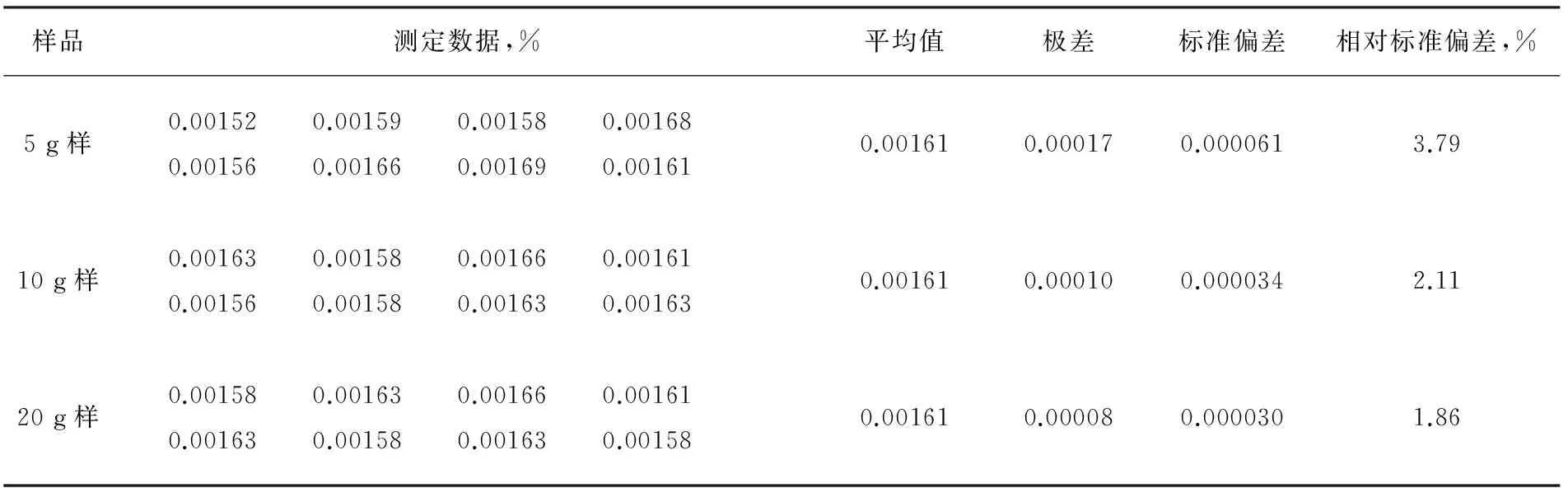
表3 不同样品量下测定的铁含量
从以上试验结果可以看出,称样量为5 g、10 g、20 g 对铁含量的测定结果几乎没有影响,只是称样量为5 g时测定结果的精密度稍差点,可能是由于铁的微小黑点分布不均匀所至,称10 g和20 g的结果的精密度基本一致,故一般选择称10 g即可。
3.2 溶液酸度的影响
在酸性溶液中二价铁离子可以与邻菲啰啉生成1∶3的橙红色络合物,该有色络合物非常稳定(Pk=21.3),在100 mL溶液中含Fe2+为0.01~0.03 mg时,其颜色与Fe2+浓度成正比,符合光的吸收定律。
实验步骤:分别配制 pH≈3、pH≈4.5、pH≈6的三种HAc-NaAc缓冲溶液。 取2#样品10.00 g按1.5节的步骤溶解于250 mL容量瓶中,分别取25.00 mL加入以上三种不同的缓冲溶液显色后测量其吸光度,空白试验溶液也分别加入三种不同的缓冲溶液,根据测定的吸光度计算样品的铁含量如表4。

表4 不同酸度下测定的铁含量
从以上结果看出,在三种不同的pH缓冲溶液条件下,对铁含量的测定结果没有影响。
3.3 抗坏血酸的影响
因为只有Fe2+才与邻菲啰啉生成橙红色络合物,而纯碱中铁以Fe2+、Fe3+两种形式存在,加入抗坏血酸可以把Fe3+还原为Fe2+。因此抗坏血酸是否加入、加入的量的多少对测定结果都有影响。
试验中取2#样品10.00 g按1.5节的步骤溶解于250 mL容量瓶中,分别取25.00 mL试液,在加入的步骤中分别加入抗坏血酸0 mL、1.0 mL、2.5 mL、5.0 mL,显色后后测量其吸光度,空白试验溶液也分别加入对应量的抗坏血酸。根据测定的吸光度计算样品的铁含量如表5。
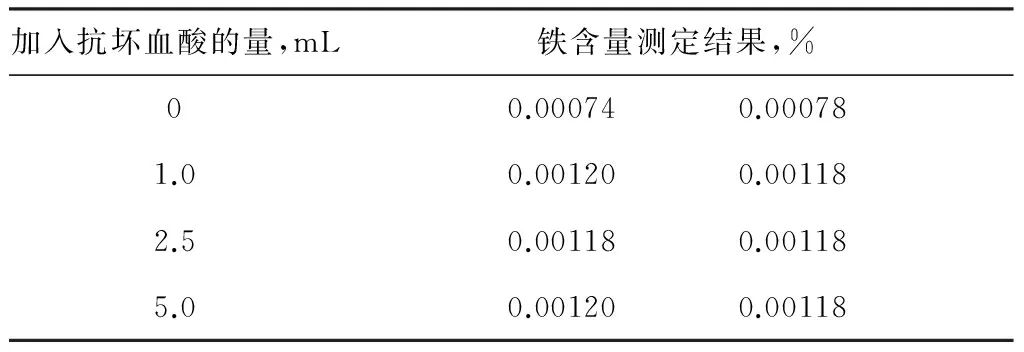
表5 不同量抗坏血酸下测定的铁含量
从上表可以看出,不加入抗坏血酸时结果偏低很大,而加入抗坏血酸1.0 mL以上则结果没有变化。所以在考虑生产质量波动时,如铁在一等品或合格品时的情况,选择加入2.5 mL抗坏血酸较适宜。
在实际操作中还应注意抗坏血酸溶液的颜色,当其颜色发黄时表示已失效(一般在冬季10 d,夏季7 d左右),应重新配制,否则会造成较大误差。
3.4 溶样时间的影响
纯碱样在加入盐酸溶解是要促进铁的溶解,要使完全溶解,一般2~3 min即可,但在之后继续加热煮沸是否对测定结果有影响呢?实验中采用3#、4#样,分别称三个试样,溶解后分别加热到2 min、5 min、10 min,对比数据如表6。
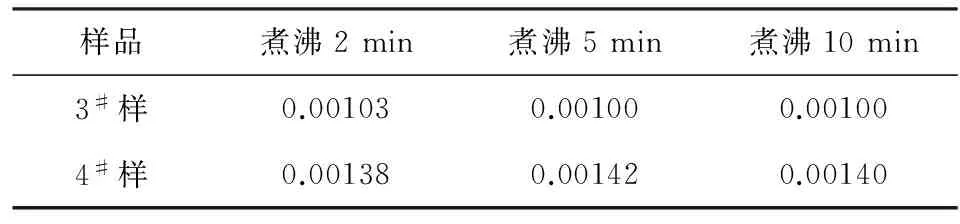
表6 不同煮沸时间下的铁含量
从以上数据看出,加热煮沸2 min已经使铁离子溶解完全,再继续加热对结果没有影响,故一般加热煮沸2~3 min即可。但要注意在检验设备大修后出现的铁高碱时,由于碱中会出现铁渣,煮沸时间应适当延长,直至其完全溶解。
3.5 显色时间的影响
采用3#、4#样,溶解显色后分别在2 min、10 min、30 min时测定其吸光度,计算铁含量如表7。
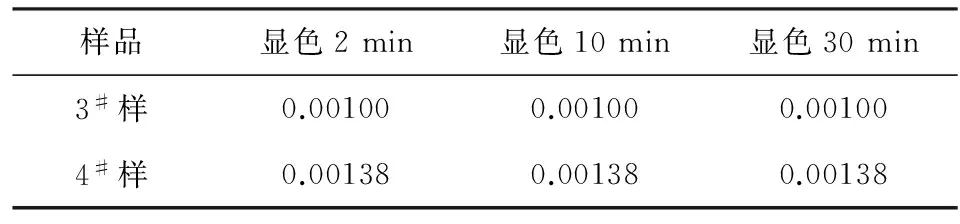
表7 不同显色时间下的铁含量
从以上数据可以看出,显色时间为2 min、10 min、30 min时,测定的溶液吸光度几乎没有变化,说明二价铁离子与邻菲啰啉生成的橙红色络合物非常稳定,所以一般在显色后2~3 min进行测量即可。
3.6 纯碱白度与铁含量的关系
目前好多高端的用户对纯碱的白度都提出了指标要求,白度和铁含量密切相关。一般铁含量在0.001%左右,轻灰白度在94以上,重灰白度在88以上;如果设备大修后或出现生产异常后,铁分升高,白度就随之下降,当超出优等品指标时(>0.0035%),白度就低于80,外观就开始变为微红色直至出现红碱。
因此根据纯碱的外观颜色可以初步判断其铁含量的高低。另外在还要密切注意生产过程的变化,提前报警,预防不合格品的包装出现。
[1] 武汉大学.分析化学[M].2版.北京:高等教育出版社,1978
[2] 李国瑞,陈歆文.纯碱生产分析[M].沈阳:辽宁科学技术出版社,1989
[3] [美]I.M.科尔索夫等著.南京化工学院分析化学校研室译.定量化学分析(中册)[M].北京:高等教育出版社,1987
[4] 漆德瑶等.理化分析数据处理手册[M].北京:中国计量出版社,1991
[5] GB210-2004工业碳酸钠及其试验方法[S]
[6] GB3049-86无机化工产品中铁含量测定的通用方法 邻菲啰啉分光光度法[S]
[7] GB3051-2000无机化工产品中氯化物含量测定的通用方法 汞量法[S]
TQ114.17
A
1005-8370(2017)06-21-04
2017-08-01
刘西洲(1972—),现为连云港碱业有限公司石灰车间主任。
