黔产9种薯蓣属植物分子鉴别及亲缘关系研究
2017-12-20魏怡冰魏升华王志威严福林
魏怡冰,魏升华,王志威,严福林
(贵阳中医学院,贵州 贵阳 550000)
黔产9种薯蓣属植物分子鉴别及亲缘关系研究
魏怡冰,魏升华*,王志威,严福林
(贵阳中医学院,贵州 贵阳 550000)
为揭示黔产薯蓣属植物9个种之间的亲缘关系,根据叶绿体matK、rbcL、psbA-trnH序列片段对其进行种间分子鉴别研究。结果表明,黔产薯蓣属植物9个种的matK、psbA-trnH、rbcL序列长度分别为1 076~1 144 bp、361~382 bp、1 160~1 209 bp,当空位始终做缺失处理时,其变异位点分别占序列总长度的14.3%、7.8%及8.7%。系统进化分析显示,来自9个种31份样本的薯蓣属植物分为了4个大组。其中,黄独单独为一组,为基生翅组;黑珠芽薯蓣和高山薯蓣聚为一组,为复叶组;光亮薯蓣和毛胶薯蓣聚为一组,为顶生翅组;光叶薯蓣、薯莨、日本薯蓣以及薯蓣聚为一组,为周生翅组。表明matK、rbcL、psbA-trnH序列片段对薯蓣属植物的系统分类具有明显的指导价值。
薯蓣属; DNA条形码;matK;rbcL;psbA-trnH
薯蓣科植物中,我国仅有薯蓣属(Dioscorea)1个属,共52种,分为8个组[1-2]。贵州分布的薯蓣属植物共有25种以及1变种、1引种[3],大多可作为民族药材入药,主要用于脾虚泄泻、消渴、带下、风湿性关节炎、胃痛、跌打损伤、无名肿毒等症。但近年来研究发现,原有的薯蓣属植物分类与分子鉴别试验结果吻合度不高,对药用的准确性造成了一定影响[4-5]。
分子鉴定方法是指用于动植物进化关系及系统学研究的DNA序列、分子标记和指纹图谱等各种分析技术的总称。该方法于20世纪90年代中期开始用于药用植物的鉴定,例如Cheung等[6]、曹晖等[7]先后采用AP-PCR、RAPD等方法鉴定人参、苦地胆等中药材。近年来,针对传统分子遗传标记技术遇到的瓶颈问题,有学者利用DNA条形码的技术优势,将其成功应用于鹿茸、赤芍和威灵仙等中药材及其混伪品的鉴别中[8-10]。Guo等[11]利用DNA条形码psbA-trnH、rbcL、matK 3个片段对唇形科药用植物黄芩及其3种混伪品进行了鉴别;Sui等[12]也利用DNA条形码的这3个片段对6种清风藤属植物和7种市场混淆品进行鉴定。而薯蓣属植物药用易混淆,以常规鉴别方法难以准确区分其种类,因此,为保证薯蓣属植物的用药准确性,选用rbcL、matK及psbA-trnH序列,对薯蓣属9个种31份样本进行分子鉴定,分析薯蓣属植物9个种之间的亲缘关系,为薯蓣属植物的系统分类研究提供科学依据。
1 材料和方法
1.1 材料
野外采集薯蓣属植株活体,引种至贵阳中医学院种质圃,经魏升华副教授鉴定,凭证标本保存于贵阳中医学院生药教研室标本室,其样本具体信息如表1所示。共31份样本,均为生长状况良好的植株中部健康叶片,去掉主脉后用70%乙醇擦去叶面灰尘,用于总DNA的提取。
1.2 试剂
Ezup柱式植物基因组DNA抽提试剂盒、TaqPCR Master Mix、4S Green Plus染料、DNA Marker等均购自生工生物工程(上海)股份有限公司,引物(表2)合成及序列测序由生工生物工程(上海)股份有限公司完成。
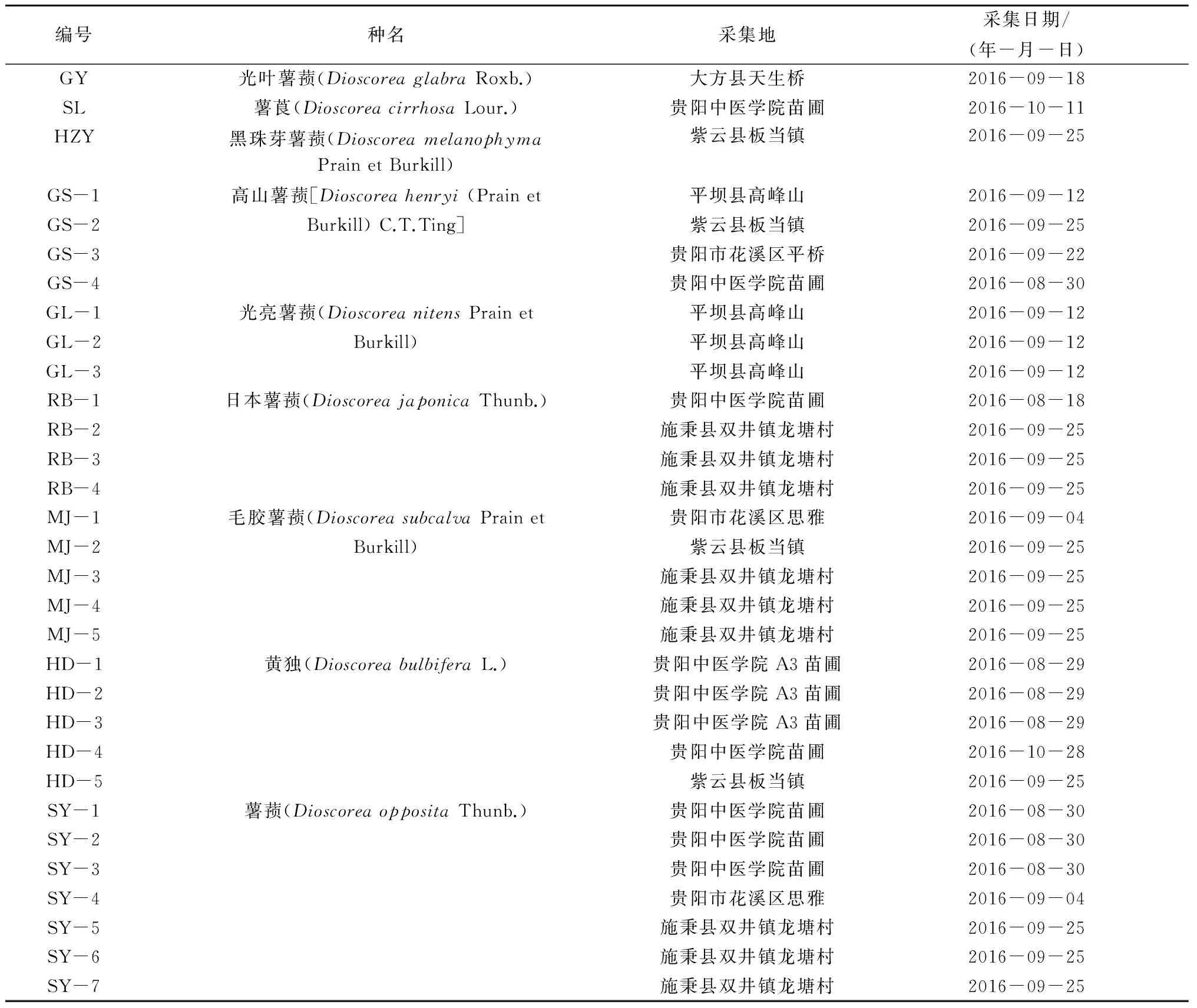
表1 9个种31份薯蓣属植物来源
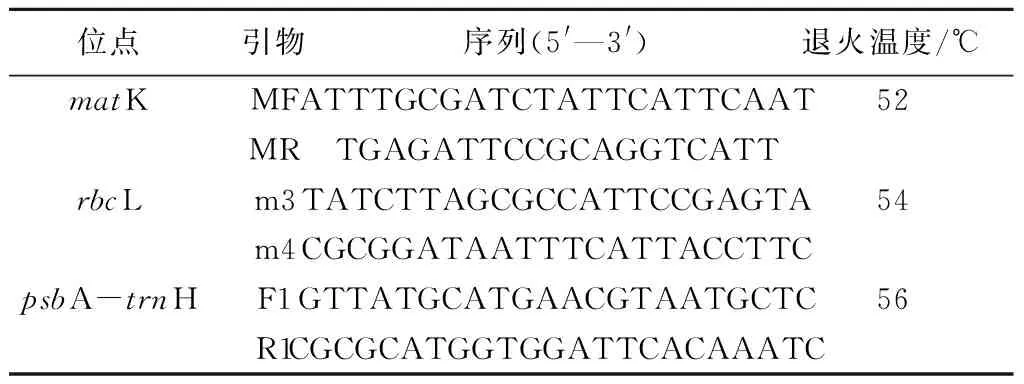
表2 试验所用引物
1.3 试验方法
1.3.1 总DNA提取 总DNA的提取按照生工生物工程(上海)股份有限公司的Ezup柱式植物基因组DNA抽提试剂盒操作说明书进行,提取所得基因组DNA在-20 ℃保存备用。
1.3.2 PCR扩增 对9种薯蓣属植物共计31份样本的matK、rbcL及psbA-trnH片段分别进行PCR扩增,PCR扩增反应在ProFlex PCR System上进行。反应体系为50 μL,其中包括:2 μL DNA模板、正向和反向引物各2 μL、TaqPCR Master Mix 24 μL,以ddH2O补齐。PCR反应程序为:95 ℃预变性4 min;95 ℃变性30 s,适度退火30 s,72 ℃延伸90 s,35个热循环;72 ℃后延伸2 min。取2 μL PCR产物在1.5%琼脂糖凝胶中电泳,经4S Green Plus染色,用凝胶图像分析系统观察并拍照。PCR产物经电泳检测后,送样至生工生物工程(上海)股份有限公司测序,测序引物为PCR引物。
1.3.3 数据分析 得到测序结果后,将所有序列用Muscle 3.6软件进行排序,然后利用Gblock 0.91b软件进行序列保守区的选择并将两端切平。利用Mega 4.0对处理好的序列构建Maximum Parsimony(MP)树,设置Close-neighbor-interchange(CNI)水平为3,Random Addition trees为10。获取50%一致性系统进化树(50% Majority rule consensus tree),进行靴带法(Bootstrap analysis)检测,抽样次数为1 000。根据靴带支持率(BS)评估各分支可靠性。BS≤50为不支持;BS介于51~75为低支持,BS介于76~85为中度支持;BS≥86为高支持或强烈支持。
2 结果与分析
2.1 matK、rbcL及psbA-trnH片段扩增
测序后所得的各片段长度及碱基含量如表3所示,薯蓣属植物9个种31份样本的3条基因片段matK、psbA-trnH、rbcL长度分别为1 076~1 144 bp、361~382 bp、1 160~1 209 bp。序列经比对,排序后两端切平,31份材料中3条基因片段的序列总长度在2 628~2 710 bp,(G+C)含量在38.24%~39.38%。

表3 matK、rbcL及psbA-trnH 3条片段扩增结果
2.2 matK、psbA-trnH、rbcL片段的序列分析
31份材料的片段扩增中,matK序列排序后两端切平,当空位始终做缺失处理时,序列长1 032 bp,含变异位点148个,占序列总长度的14.3%;psbA-trnH序列排序后两端切平,当空位始终做缺失处理时,序列长361 bp,含变异位点28个,占序列总长度的7.8%;rbcL序列排序后两端切平,当空位始终做缺失处理时,序列长1 103 bp,含变异位点96个,占序列总长度的8.7%。
2.3 基于matK、psbA-trnH、rbcL联合片段的系统发育分析
从图1可以看出,基于对matK、psbA-trnH、rbcL联合片段的MP分析,来自9个种31份样本的薯蓣属植物分为了4组。其中,来自贵阳中医学院A3苗圃(HD-1—HD-3)、贵阳中医学院苗圃(HD-4)和紫云县板当镇(HD-5)的黄独单独为一组,为基生翅组;来自紫云县板当镇(HZY)的黑珠芽薯蓣和来自平坝县高峰山(GS-1)、紫云县板当镇(GS-2)、贵阳市花溪区平桥(GS-3)及贵阳中医学院苗圃(GS-4)的高山薯蓣聚为一组,为复叶组;来自平坝县高峰山(GL-1—GL-3)的光亮薯蓣和来自贵阳市花溪区思雅(MJ-1)、紫云县板当镇(MJ-2)、施秉县双井镇龙塘村(MJ-3—MJ-5)的毛胶薯蓣聚为一组,为顶生翅组;来自大方县天生桥(GY)的光叶薯蓣,来自贵阳中医学院苗圃(SL)的薯莨,来自贵阳中医学院苗圃(RB-1)、施秉县双井镇龙塘村(RB-2—RB-4)的日本薯蓣,来自苗圃(SY-1—SY-3)、贵阳市花溪区思雅(SY-4)、施秉县双井镇龙塘村(SY-5—SY-7)的薯蓣聚为一组,为周生翅组。
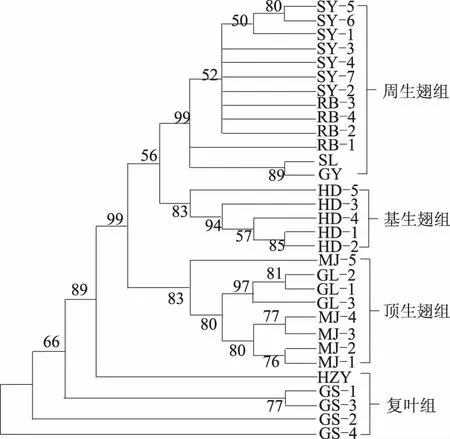
图1 matK、psbA-trnH、rbcL联合片段的MP进化树分析
3 结论与讨论
从叶绿体基因组中选择植物DNA条形码对植物进行分类鉴别是可行的[13],但是,单一片段解决全球植物的分类鉴定问题不太可能,Kress等[14]提出的多片段组合方法得到了广泛认可。生命条形码联盟建议将叶绿体基因matK、rbcL、psbA-trnH和核基因ITS作为陆地植物通用的DNA条形码。matK基因全长约1 500 bp,是叶绿体基因组的蛋白质编码基因中进化速率最快的基因之一,常用于分析被子植物中科级水平的系统关系[15-16]。其变异较为均一,在构建系统树时不必对不同类型的变异进行加权,极大地增强了分子系统树的可靠性[15]。rbcL基因全长约1 434 bp,进化速率较低,常用于分析远缘属间及科以上水平的系统发育问题[16]。psbA-trnH间隔序列较短,通用性好,且具有足够变异,对近缘种有较好的识别能力。ITS片段在物种水平上变异较大,且已广泛应用于物种分类及系统进化研究,但扩增成功率是ITS作为条形码应用的一个限制因素[17-18]。
本研究采集了贵州省8个不同环境的9种薯蓣属植物,共计31个样本,分别对其进行了DNA条形码3条序列的扩增。结果显示,matK序列的变异位点占序列总长度的14.3%,psbA-trnH序列的变异位点占总长度的7.8%,rbcL序列变异位点占总长度的8.7%。相对而言,在黔产9种薯蓣属植物中,matK片段显示出较高的变异速率。由遗传相似性分析可知,基于对matK、psbA-trnH、rbcL联合片段的MP分析,来自9个种31份材料的薯蓣属植物被分为周生翅组、基生翅组、顶生翅组和复叶组。其中,黄独单独为一组。黑珠芽薯蓣和高山薯蓣聚为一组,且该分支下黑珠芽薯蓣与高山薯蓣得到较为明显的区分。而在周生翅组中,光叶薯蓣、薯莨和日本薯蓣及薯蓣聚为一组,且光叶薯蓣、薯莨与后两者有较为明显的区分,但是,日本薯蓣与薯蓣在系统进化树中并未得到明显的区分。光亮薯蓣和毛胶薯蓣聚为一组,且分支下有种间交错现象。从本研究所得的系统进化结果来看,单纯的DNA条形码(matK、psbA-trnH、rbcL)研究可以满足薯蓣属下9个种绝大多数植物的鉴别,而对于毛胶薯蓣与光亮薯蓣、薯蓣与日本薯蓣等极为相近的种,需做进一步的条形码引物筛选。
[1] 杭悦宇,徐珞珊,史德荣,等.中国薯蓣属植物地下茎淀粉粒形态特征及其分类学意义[J].植物资源与环境学报,2006,15(4):1-8.
[2] Ding Z Z,Michael G.Flora of China(Vol.24)[M].Beijing:Science Press,2002.
[3] 《贵州植物志》编辑委员会.贵州植物志第6卷[M].成都:四川民族出版社,1989:455-482.
[4] 郑玉红,夏冰,杭悦宇,等.山药原植物薯蓣及其近缘种的分子鉴别和亲缘关系研究[J].南京农业大学学报,2007,30(2):55-59.
[5] 郭文,郭华春.4种薯蓣属植物的分子鉴别和亲缘关系研究[J].热带亚热带植物学报,2014,22(3):225-232.
[6] Cheung K S,Kwan H S,But P H,etal.Pharmacognostical identification of American and Oriental ginseng roots by genomic fingerprinting using arbitrarily primed polymerase chain reaction(AP-PCR)[J].Journal of Ethnopharmacology,1994,42(1):67-69.
[7] 曹晖,毕培曦.中药材苦地胆的DNA指纹鉴定[J].中药材,1996,19(12):608-612.
[8] 张蓉,刘春生,黄璐琦,等.鹿茸饮片的DNA条形码鉴别研究[J].中国药学杂志,2011,46(4):263-266.
[9] 孙稚颖,宋经元,姚辉,等.基于ITS2条形码的中药材赤芍及其易混伪品的DNA分子鉴定[J].世界科学技术-中医药现代化,2011,13(2):407-411.
[10] 曾旭,李莉,业宁,等.基于ITS2条形码的中药材威灵仙与其易混伪品的鉴定[J].环球中医药,2011,4(4):264-269.
[11] Guo X,Wang X,Su W,etal.DNA barcodes for discriminating the medicinal plantScutellariabaicalensis(Lamiaceae) and its adulterants[J].Biol Pharm Bull,2011,34(8):1198-1203.
[12] Sui X Y,Huang Y,Tan Y,etal.Molecular authentication of the ethnomedicinal plantSabiaparvifloraand its adulterants by DNA barcoding technique[J].Planta Med,2011,77(5):492-496.
[13] 刘宇婧,刘越,黄耀江,等.植物DNA条形码技术的发展及应用[J].植物资源与环境学报,2011,20(1):74-82.
[14] Kress W J,Wurdack K J,Zimmer E A,etal.Use of DNA barcodes to identify flowering plants[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(23):8369-8374.
[15] 李保进.叶籽银杏matK和ITS序列分析及系统发育研究[D].泰安:山东农业大学,2008.
[16] Wolfe K H,Li W H,Sharp P M.Rates of nucleotide substitution vary greatly among plant mitochondrial,chloroplast,and nuclear DNAs[J].Proceedings of the National Academy of Sciences of the United States of America,1987,84(24):9054-9058.
[17] 宁淑萍,颜海飞,郝刚,等.植物DNA条形码研究进展[J].生物多样性,2008,16(5):417-425.
[18] 张彬.当归属药用植物及药材的DNA条形码鉴别研究[D].北京:中国中医科学院,2012.
Molecular Identification and Genetic Relationship of 9 Dioscorea Species in Guizhou Province
WEI Yibing,WEI Shenghua*,WANG Zhiwei,YAN Fulin
(Guiyang University of Chinese Medicine,Guiyang 550000,China)
In order to reveal the genetic relationship between 9 species ofDioscoreain Guizhou province,the molecular identification of the species was conducted using the sequence fragments of chloroplast genesmatK,rbcL andpsbA-trnH.The results showed that the lengths ofmatK,psbA-trnH andrbcL in 9 species ofDioscoreain Guizhou province were 1 076—1 144 bp,361—382 bp and 1 160—1 209 bp.When the vacancy was treated as deletion,the ratio of the mutation site in the total length was 14.3%,7.8% and 8.7%,respectively.Phylogenetic analysis showed that 9 species ofDioscoreaderived from the 31 provenances were divided into four groups.Among them,DioscoreabulbiferaL.belonged to the cluster of Sect.Opsophyton Uline.DioscoreamelanophymaPrain et Burkill andDioscoreahenryi(Prain et Burkill) C.T.Ting belonged to the cluster of Sect.Lasiophyton Uline.DioscoreasubcalvaPrain et Burkill andDioscoreanitensPrain et Burkill belonged to the cluster of Sect.Shannicorea Prainet Burkill.DioscoreaglabraRoxb.,DioscoreacirrhosaLour.,DioscoreajaponicaThunb.andDioscoreaoppositaThunb.belonged to the cluster of Sect.Enantiophyllum Uline.The results show thatmatK,rbcL andpsbA-trnH have obvious guidance for systematic classification ofDioscorea.
Dioscorea; DNA barcode;matK;rbcL;psbA-trnH
S567.23+9
A
1004-3268(2017)11-0108-05
2017-05-08
国家中医药管理局项目
魏怡冰(1994-),女,河北赵县人,在读硕士研究生,研究方向:中药与民族药品质鉴定。
E-mail:1530112096@qq.com
*
魏升华(1965-),男,贵州黔西人,教授,主要从事药用植物资源、引种驯化、中药材生产与民族医药开发等教学和研究。E-mail:weishenghua6512@126.com
