同侧多原发灶乳腺癌病灶间异质性的研究
2017-12-20王歆光刘毅强何英剑解云涛
王歆光,刘毅强,何英剑,解云涛
1.北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺中心,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;
2.北京大学肿瘤医院暨北京市肿瘤防治研究所病理科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
同侧多原发灶乳腺癌病灶间异质性的研究
王歆光1,刘毅强2,何英剑1,解云涛1
1.北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺中心,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142;
2.北京大学肿瘤医院暨北京市肿瘤防治研究所病理科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
背景与目的:同侧多原发灶乳腺癌临床并不鲜见,既往对于病灶间异质性的研究多数基于术后标本。本研究比较了术前空芯针穿刺确诊的同侧多原发灶乳腺癌病灶间的异质性,探讨其对临床决策的影响。方法:回顾性分析北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺中心2013-2016年间空芯针穿刺确诊的同侧多原发灶乳腺癌资料,比较不同病灶组织学及雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)和Ki-67等免疫组织化学结果的异质性,并根据免疫组织化学结果判定病灶分子分型。结果:共75例同侧多原发灶乳腺癌纳入本研究。已完成腋窝评价的69例患者中腋窝淋巴结阳性51例(68.0%)。9例(12.0%)病灶间组织学类型和组织学分级存在异质性。ER、PR、HER-2和Ki-67结果病灶间存在异质性的患者分别为1例(1.3%)、10例(13.3%)、1例(1.3%)和9例(12.0%)。10例(13.3%)病灶之间分子分型存在异质性。按照现行指南进行免疫组织化学检查,4例(5.3%)治疗决策可能会受到影响。结论:空芯针穿刺确诊同侧多原发灶乳腺癌病灶间组织学结果及免疫组织化学结果存在异质性,仅对主要病灶进行免疫组织化学检测可能影响部分患者的治疗决策。
乳腺癌;多灶;多中心;肿瘤异质性;分子分型
同侧多原发灶乳腺癌中,病灶位于同一象限的情况为多灶性乳腺癌,病灶位于不同象限的情况为多中心性乳腺癌[1]。由于该标准存在明显的主观因素,多数文献并不对多灶和多中心性乳腺癌进行严格区分,或在分析时归为一组[2]。文献报道同侧多原发灶乳腺癌的发生率差异很大,达6%~60%。造成这种差异的主要原因包括是否纳入原位癌,采用的病理检查手段不同等[3]。近年来,由于影像学检查技术的进步,更多的患者被诊断为多原发灶乳腺癌[4]。
现有同侧多原发灶乳腺癌的研究绝大多数基于术后病理检查确定病灶数目,只有少数研究纳入了一部分空芯针穿刺确诊的患者[5]。空芯针穿刺确诊的多原发灶乳腺癌,病灶之间组织学分型和分级、免疫组织化学结果及肿瘤分子分型的异质性,以及对治疗策略的影响,国内外均鲜见报道。
本研究回顾性分析了北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺中心空芯针穿刺确诊的同侧多原发灶乳腺癌,研究多原发灶乳腺癌病灶间的异质性及对临床决策的影响。
1 资料和方法
1.1 患者资料
本研究为回顾性研究,纳入2013年—2016年间于北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺中心经空芯针穿刺确诊的同侧多原发灶乳腺癌患者。所有患者患侧乳腺超声发现至少2处可疑病灶,并经超声引导下空芯针穿刺确诊为浸润性乳腺癌,所有病灶均在确诊同时进行免疫组织化学检测。排除标准为穿刺诊断原位癌、肿瘤复发、炎性乳腺癌及远处转移患者。共75例患者符合入组条件纳入本研究。其中72例患侧乳腺内确诊2个浸润性病灶,3例患侧乳腺内确诊3个浸润性病灶。下列患者和肿瘤特征资料从我中心资料库中调取:年龄,绝经情况,肿瘤大小,肿瘤位置,病理类型和分级,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)的免疫组织化学结果,淋巴结转移情况,治疗决策。本研究设计经北京大学肿瘤医院伦理委员会批准。
1.2 诊断和治疗
所有患者均进行腋窝超声检查,存在异常淋巴结的患者进行针吸细胞学(fine needle aspiration,FNA)检查。未发现异常淋巴结或FNA未见肿瘤细胞的患者接受前哨淋巴结活检(sentinel lymph node biopsy,SLNB)。SLNB的时机可安排在新辅助治疗开始前或新辅助治疗结束后。本组共28例(37.3%)患者确诊后接受手术治疗,14例(18.7%)患者接受新辅助内分泌治疗,33例(44.0%)患者接受新辅助化疗。截止到2017年3月尚有6例患者新辅助化疗进行中。
1.3 病理学检查
肿瘤病灶按照WHO标准进行组织学分型,按照Nottingham分级进行组织学分级(包括腺管形成,细胞核多形性及核分裂相)。ER、PR和HER-2的免疫组织化学结果按照美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)和美国病理学家学会(College of American Pathologists,CAP)的标准定义为阳性、阴性或不确定[6-7]。对HER-2免疫组织化学检查不确定的患者,进行荧光原位杂交(fluorescence in situ hybridization,FISH)检测。
1.4 统计学处理
统计学分析采用SPSS 19.0软件,对计量资料描述视其分布描述其中位数、最小值和最大值。对分类指标描述其各类的例数及百分数。
对同侧乳腺内不同病灶间病理类型、组织学分级和免疫组织化学结果构成情况组间比较采用卡方检验或Fisher精确概率法。所有的统计分析采用双侧检验,P<0.05为差异有统计学意义。
2 结 果
入组患者中位年龄50岁(21~83岁)。本研究定义乳腺中最大的浸润性癌灶为主要病灶(N=75),其余病灶为额外病灶(N=78)。主要病灶超声测量直径中位数为23 mm(8~65 mm),额外病灶超声测量直径中位数为13(6~46) mm。本组患者特点见表1,所有确诊病灶的病理学特点见表2。
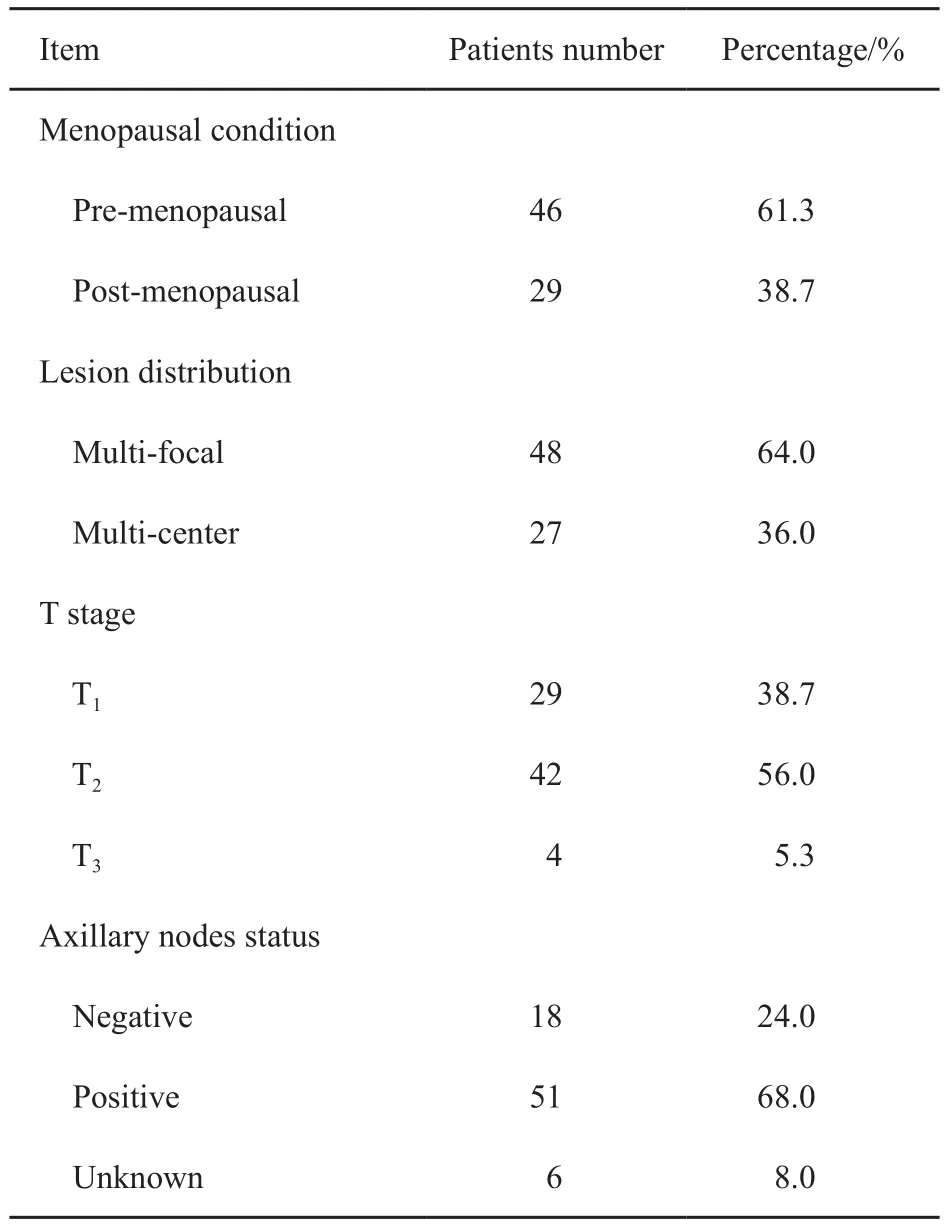
表 1 入组患者特点Tab. 1 The charicteristics of the patients
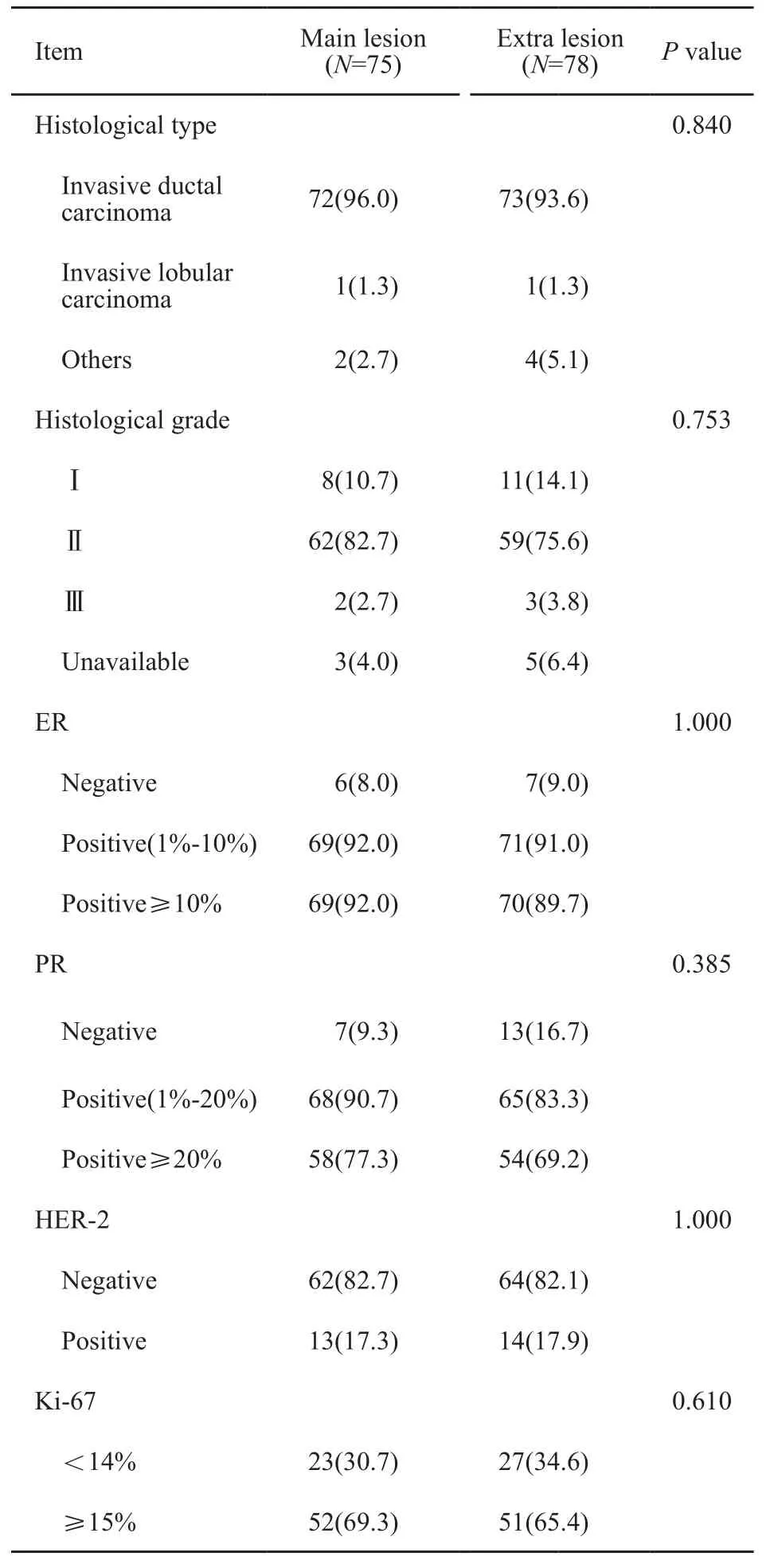
表 2 确诊病灶的病理学特点Tab. 2 The charicteristics of pathological features of conf i rmed lesions[n (%)]
73例(97.3%)患者经空芯针诊断主要病灶与额外病灶组织学类型一致,另有2例(2.7%)主要病灶为浸润性导管癌,额外病灶为浸润性乳头状癌。组织学类型一致的73例中,66例(90.4%)组织学分级一致,7例(9.6%)组织学分级存在异质性。其中3例额外病灶的组织学分级高于主要病灶。共9例(12.0%)病灶间组织学类型或分级存在异质性。
所有病灶均进行免疫组织化学染色。若定义染色大于1%为阳性,74例(98.7%)病灶间ER结果一致,1例(1.3%)主要病灶ER阳性,额外病灶ER阴性;65例(86.7%)病灶间PR结果一致,10例(13.3%)病灶间PR结果存在异质性,其中2例为主要病灶PR阴性,额外病灶PR阳性,8例为主要病灶PR阳性,额外病灶PR阴性。ER阳性的患者中,若以阳性大于等于10%定义为ER强阳性,1例主要病灶ER强阳性,次要病灶ER弱阳性。PR阳性的患者中,若以阳性大于等于20%定义为PR强阳性,11例病灶间PR是否强阳性存在异质性,其中2例主要病灶PR弱阳性,额外病灶PR强阳性;9例主要病灶PR强阳性,额外病灶PR弱阳性。74例(98.7%)HER-2结果一致,1例(1.3%)主要病灶HER-2阴性,额外病灶HER-2阳性。若以Ki-67阳性大于等于15%定义为Ki-67强阳性,9例(12.0%)病灶间Ki-67是否强阳性存在异质性,其中3例主要病灶Ki-67弱阳性,额外病灶Ki-67强阳性,6例主要病灶Ki-67强阳性,额外病灶Ki-67弱阳性。本组患者免疫组织化学结果异质性见表3。
所有病灶按照St. Gallen 2013共识[8]使用免疫组织化学结果作为替代指标进行分子分型,10例(13.3%)病灶间分子分型存在异质性,其中4例主要病灶为Luminal A型,额外病灶为Luminal B型;5例主要病灶为Luminal B型,额外病灶为Luminal A型;另有1例主要病灶为Luminal B型,额外病灶为三阴性乳腺癌(triple-negative breast cancer,TNBC)。病灶分子分型异质性见表4。
本组患者中31例(41.3%)腋窝FNA见肿瘤细胞,20例(26.6%)接受SLNB的患者见淋巴结转移癌(SLNB均在新辅助治疗前进行),6例(8.0%)目前新辅助治疗尚未结束,未行SLNB。
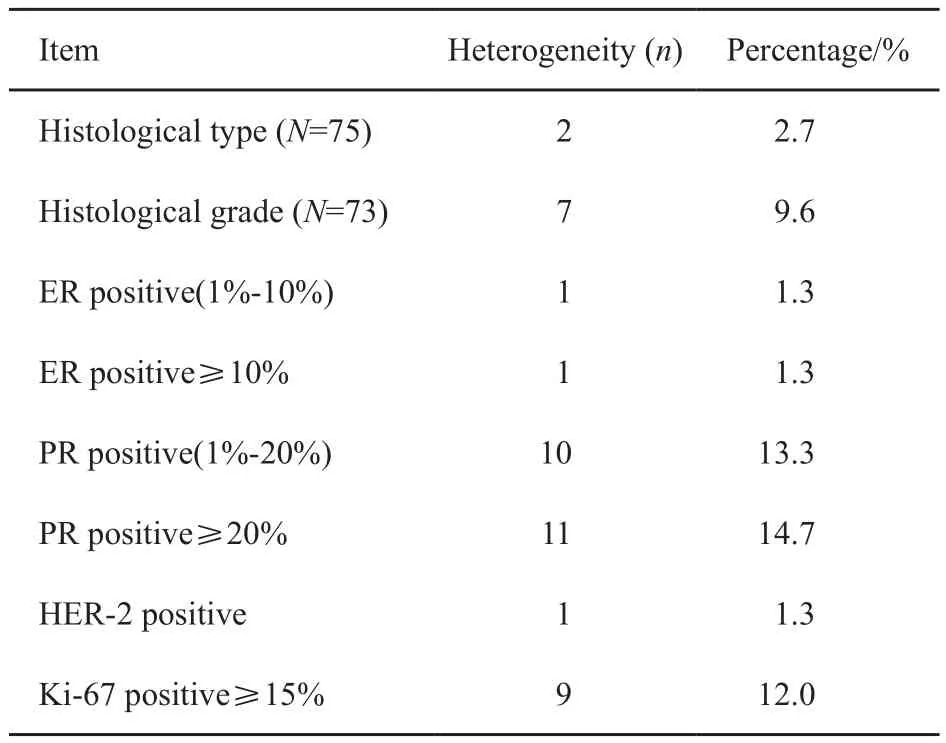
表 3 组织学及免疫组织化学结果异质性Tab. 3 Heterogeneity of histology and immunohistochemistry results

表 4 病灶分子分型异质性Tab. 4 Heterogeneity of molecular type
3 讨 论
对于同侧多原发灶乳腺癌,现行TNM分期依据最大浸润病灶进行T分期,而不考虑其他病灶。多数指南推荐在病灶间形态学表现相似的情况下,只对最大病灶进行免疫组织化学检测[9-10]。这种检测模式存在低估肿瘤负荷及后续治疗强度不足的潜在风险。现阶段多数原发性乳腺癌通过空芯针穿刺确诊的条件下,尚无研究对这种潜在风险进行具体分析。
早期研究报告多数同侧多原发灶乳腺癌组织学表现相同[1,11],Boros等[12]和Andea等[13]则报告其中组织学类型存在异质性的分别占12.0%和15.8%,组织学分级存在异质性的分别占10.0%和4.9%。本组患者中9例(12.0%)组织学类型或分级存在异质性,其中3例额外病灶的组织学分级高于主要病灶。
East等[14]和Choi等[15]分别研究了不同病灶间免疫组织化学结果的异质性,报告免疫组织化学结果存在异质性的病灶之间组织学类型或分级均存在差异,并认为如果病灶分化差或病灶之间组织学表现不同,才需要分别进行免疫组织化学检测。然而,有些研究的结果却对此提出了质疑。Buggi等[16]比较了113例病灶组织学表现相似的同侧多原发灶乳腺癌,免疫组织化学结果存在异质性的比例,ER为4.4%,PR为15.9%,HER-2为9.7%,Ki-67为15.0%。Boros等[17]报道132例组织学表现相似的同侧多原发灶乳腺癌,71例(53.78%)存在病灶间免疫组织化学结果的异质性。因此有作者指出,应该对所有病灶进行免疫组织化学检测[18]。
由于成本低和操作简单,临床常见使用免疫组织化学结果作为替代指标判断乳腺癌的分子分型,并预测复发转移风险和制定治疗策略[8]。Pekar等[19]比较了110例同侧多原发灶乳腺癌,报告依据使用的分型标准不同,10.0%~12.7%的患者存在分子分型的异质性。本研究中乳腺癌分子分型依据St. Gallen 2013版共识,分别使用20%和14%作为判断PR和Ki-67强阳性的界值[8]。
本组患者中10例(13.3%)病灶间分子分型存在异质性。其中4例主要病灶为Luminal A型,额外病灶为Luminal B型的患者由于额外病灶的结果选择全身化疗。另有1例额外病灶ER阴性选择全身化疗,1例额外病灶HER-2阳性选择抗HER-2治疗。因此本组患者中共有6例(8.0%)额外病灶的免疫组织化学结果及由其判定的病灶分子分型,对全身治疗的选择产生了影响。按照目前指南,若只在主要病灶和额外病灶的组织学表现存在差异的情况下,才对额外病灶进行免疫组织化学检测,6例中4例(5.3%)组织学表现相同的患者,将影响全身治疗的决策。文献报道由于病灶间免疫组织化学结果异质性改变治疗策略的患者分别占10.0%[14]和12.4%[16]。
有研究提示多原发灶乳腺癌淋巴结转移的风险高[2,20]。其可能的原因是现行的分期标准低估了多原发灶乳腺癌的肿瘤负荷,或者多原发灶乳腺癌本身的生物学特性易于扩散。Andea等[13]和Coombs等[20]的研究均发现依据最大病灶进行T分期,同侧多原发灶是腋窝淋巴结转移的独立危险因素。本组69例腋窝淋巴结转移状态明确的患者中,腋窝淋巴结阳性率为68.0%,明显高于T分期类似的单一病灶乳腺癌患者。
本研究为回顾性研究,样本量较小,其结果易受选择偏倚的影响。本研究只比较了病灶间组织学表现、免疫组织化学结果和分子分型的异质性,要更深入地了解同侧多原发灶乳腺癌的生物学特征,需要长期的随访和生存资料。
[1] MIDDLETON L P, VLASTOS G, MIRZA N Q, et al.Multicentric mammary carcinoma: evidence of monoclonal proliferation[J]. Cancer, 2002, 94(7): 1910-1916.
[2] LYNCH S P, LEI X, CHAVEZ-MACGREGOR M, et al.Multifocality and multicentricity in breast cancer and survival outcomes[J]. Ann Oncol, 2012, 23(12): 3063-3069.
[3] YERUSHALMI R, KENNECKE H, WOODS R, et al. Does multicentric/multifocal breast cancer differ from unifocal breast cancer? An analysis of survival and contralateral breast cancer incidence[J]. Breast Cancer Res Treat, 2009,117(2): 365-370.
[4] HOUSSAMI N, CIATTO S, MACASKILL P, et al. Accuracy and surgical impact of magnetic resonance imaging in breast cancer staging: systematic review and meta-analysis in detection of multifocal and multicentric cancer[J]. J Clin Oncol, 2008, 26(19): 3248-3258.
[5] KANUMURI P, HAYSE B, KILLELEA B K, et al.Characteristics of multifocal and multicentric breast cancers[J]. Ann Surg Oncol, 2015, 22(8): 2475-2482.
[6] HAMMOND M E, HAYES D F, DOWSETT M, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer(unabridged version)[J]. Arch Pathol Lab Med, 2010,134(7): e48-72.
[7] WOLFF A C, HAMMOND M E, SCHWARTZ J N, et al.American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer[J]. J Clin Oncol, 2013, 31(31): 3997-4013.
[8] GOLDHIRSCH A, WINER E P, COATES A S, et al.Personalizing the treatment of women with early breast cancer:highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013[J]. Ann Oncol, 2013, 24(9): 2206-2223.
[9] GOLDHIRSCH A, WOOD W C, COATES A S, et al. Strategies for subtypes-dealing with the diversity of breast cancer:highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747.
[10] CARLSON R W, ALLRED D C, ANDERSON B O, et al.National Comprehensive Cancer Network: Invasive breast cancer: clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2011, 9(2): 136-222.
[11] MOUTAFOFF C, COUTANT C, BÉZU C, et al. Prognostic and predictive factors in multifocal breast carcinoma[J].Gynecol Obstet Fertil, 2011, 39(7-8): 425-432.
[12] BOROS M, MARIAN C, MOLDOVAN C, et al. Morphological heterogeneity of the simultaneous ipsilateral invasive tumor foci in breast carcinoma: a retrospective study of 418 cases of carcinomas[J]. Pathol Res Pract, 2012, 208(10): 604-609.
[13] ANDEA A A, WALLIS T, NEWMAN L A, et al. Pathologic analysis of tumor size and lymph node status in multifocal/multicentric breast carcinoma[J]. Cancer, 2002, 94(5):1383-1390.
[14] EAST E G, PANG J C, KIDWELL K M, et al. Utility of estrogen receptor, progesterone receptor, and HER-2/neu analysis of multiple foci in multifocal ipsilateral invasive breast carcinoma [J]. Am J Clin Pathol, 2015, 144(6): 952-959.
[15] CHOI Y, KIM E J, SEOL H, et al. The hormone receptor,human epidermal growth factor receptor 2, and molecular subtype status of individual tumor foci in multifocal/multicentric invasive ductal carcinoma of breast[J]. Hum Pathol, 2012, 43(1): 48-55.
[16] BUGGI F, FOLLI S, CURCIO A, et al. Multicentric/multifocal breast cancer with a single histotype: is the biological characterization of all individual foci justified?[J]. Ann Oncol, 2012, 23(8): 2042-2046.
[17] BOROS M, ILYES A, NECHIFOR BOILA A, et al.Morphologic and molecular subtype status of individual tumor foci in multiple breast carcinoma. A study of 155 cases with analysis of 463 tumor foci[J]. Hum Pathol, 2014, 45(2):409-416.
[18] PEKMEZCI M, SZPADERSKA A, OSIPO C, et al. Evaluation of biomarkers in multifocal/multicentric invasive breast carcinomas[J]. Int J Surg Pathol, 2013, 21(2): 126-132.
[19] PEKAR G, GERE M, TARJAN M, et al. Molecular phenotype of the foci in multifocal invasive breast carcinomas: inter tumoral heterogeneity is related to shorter survival and may influence the choice of therapy[J]. Cancer, 2014, 120(1):26-34.
[20] COOMBS N J, BOYAGES J. Multifocal and multicentric breast cancer: does each focus matter?[J]. J Clin Oncol,2005, 23(30): 7497-7502.
Intertumoral heterogeneity in patients with ipsilateral multifocal/multicentric breast cancer diagnosed by core needle biopsy
WANG Xinguang1, LIU Yiqiang2, HE Yingjian1, XIE Yuntao1(1. Key Laboratory of Carcinogenesis and Translational Research, Ministry of Education/Beijing, Breast Center, Peking University Cancer Hospital and Institute, Beijing 100142, China; 2. Key Laboratory of Carcinogenesis and Translational Research, Ministry of Education/Beijing, Department of Pathology,Peking University Cancer Hospital and Institute, Beijing 100142, China)
XIE Yuntao E-mail: yuntaoxie@hotmail.com
Background and purpose:Multifocal/multicentric (MF/MC) breast cancer is frequently encountered in clinical practice. Most studies comparing the heterogeneity of lesions are based on pathological outcomes after upfront surgery. We sought to describe the histological and immunohistochemical characteristics of each lesion in patients with MF/MC breast cancer diagnosed by core needle biopsy.Methods:We retrospectively reviewed the tumor type, grade, and immunohistochemical characteristics [estrogen receptor (ER), progesterone receptor(PR), human epidermal growth factor receptor 2 (HER-2) and Ki-67] of ipsilateral MF/MC breast cancer patients and assessed the heterogeneity among the lesions. Molecular phenotype was determined by immunohistochemistry.Results:A total of 75 MF/MC breast cancer patients were included. At the time of the manuscript writing, 51 patients proved to be lymph node positive either by fi ne needle aspiration cytology or sentinel lymph node biopsy. Intertumoral heterogeneity in tumor type and grade was detected in 9 of 75 patients (12.0%). Intertumoral heterogeneity in ER, PR,HER-2 and Ki-67 was detected in 1 (1.3%), 10 (13.3%), 1 (1.3%) and 9 (12.0%) patients, respectively. Intertumoral heterogeneity in molecular phenotype was detected in 10 patients (13.3%). Immunohistochemistry tests carried out according to current guideline may result in suboptimal treatment in 4 patients (5.3%).Conclusion:Histological and immunohistochemical heterogeneity can be found among lesions of ipsilateral MF/MC breast cancer diagnosed by core needle biopsy. Immunohistochemistry tests carried out in the index tumor only may result in suboptimal treatment in these patients.
Breast neoplasms; Multifocality; Multicentricity; Intertumoral heterogeneity; Molecular phenotype
10.19401/j.cnki.1007-3639.2017.10.008
R737.9
A
1007-3639(2017)10-0809-06
解云涛 Email:yuntaoxie@hotmail.com
2017-04-01
2017-08-09)
