急性镉胁迫对大弹涂鱼血清铁代谢指标的影响
2017-12-19杜静雅李明云穆方申侯红红
杜静雅, 苗 亮, 李明云, 穆方申, 侯红红, 赵 亮
(宁波大学 应用海洋生物技术教育部重点实验室,宁波 315211)
急性镉胁迫对大弹涂鱼血清铁代谢指标的影响
杜静雅, 苗 亮, 李明云, 穆方申, 侯红红, 赵 亮
(宁波大学 应用海洋生物技术教育部重点实验室,宁波 315211)
研究了不同浓度(0.05、0.25、0.5和5 mg/L)的急性镉胁迫(0~24 h)对大弹涂鱼血清铁含量、总铁结合力、铁蛋白含量等铁代谢指标的影响。结果显示:镉胁迫后大弹涂鱼血清铁浓度均呈先降低后升高的变化(P<0.05),并且镉浓度越高血清铁的变化幅度越大,4个浓度组血清铁的最低值均出现在胁迫后6 h时,24 h时均显著高于胁迫前(P<0.05)。总铁结合力在镉胁迫后呈先降后升的变化,但低浓度下变化差异不显著(P>0.05)。除最高浓度组外,其他浓度组24 h时的总铁结合力均已回升到或超过胁迫前的水平。浓度较低的2个镉胁迫组中血清铁蛋白浓度均未出现显著变化,而另2个浓度较高的组则在胁迫12 h后显著升高(P<0.05),并且升高幅度与镉浓度和胁迫时间均呈正相关,研究结果可为深入研究镉通过干扰铁代谢对大弹涂鱼产生毒性的机理提供参考资料。
大弹涂鱼;镉胁迫;铁代谢指标
大弹涂鱼(Boleophthalmuspectinirostris)是栖息于港湾和河口潮间带的滩涂性鱼类,属硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、弹涂鱼科(Boleophthalmus),其多项生理指标都对环境污染物较为敏感[1],因此被用作反映海洋近岸污染情况的指示生物,并且与用作环境污染指示生物的虾、蟹、贝类等无脊椎动物相比,大弹涂鱼分类地位和食物链等级更高,在研究污染物对环境生物(特别是脊椎动物)的影响以及在食物链中的富集情况方面有一定的优势[2-4]。镉是环境重金属污染物之一,有致癌、致畸和致突变作用。在人类的生产、生活中,排入水体的镉污染物会在河流入海口和近岸滩涂处沉积,破坏海洋生态环境,除直接影响近岸海域生物外,还会通过食物链传递、富集浓缩危害人体健康[5]。因此,近海海域镉污染的生物危害性也越来越多地受到研究者的重视[6]。
急性攻毒试验表明镉对大弹涂鱼为高毒物质,会造成鳃、肾等的组织损伤[7]。研究显示镉胁迫会影响大弹涂鱼血细胞同工酶活性、引起同工酶谱带变化[8],并会导致血细胞的遗传损伤[9];肝脏超氧化物歧化酶(SOD)活性也随镉胁迫时间的延长而降低,并且降低幅度与镉离子浓度之间呈正相关性[10]。但镉作为一种致癌物并没有直接的遗传毒性[11],其致畸作用也不是由直接造成DNA损失所引起的[12],镉对生物的毒性主要表现在干扰多种生物必需金属元素(如铁、锌、铜、锰等)的正常代谢,进而诱导产生活性氧自由基(reactive oxygen species, ROS),并抑制多种金属依赖性酶(如铁硫蛋白、超氧化物歧化酶等)的活性[11]。铁是动物生命活动必不可少的金属元素,参与多种细胞代谢,是多种关键酶和重要生物分子的必要组成部分。镉和铁都属于过渡族金属元素,具有相似的化学性质,在人及哺乳类中的研究显示镉进入机体内后会与铁形成竞争性关系,在酶和活性蛋白中占据或取代铁的位置,影响其生物学功能,导致铁代谢失衡[13]。在哺乳动物中已经明确干扰铁代谢、破坏铁平衡是镉生物毒性作用的重要途径之一[14],但在鱼类中这方面研究较少。
镉对大弹涂鱼的毒性作用可能也与铁代谢紊乱有关,但镉对大弹涂鱼铁代谢的影响及其作用机制尚不清楚。血液在动物体内除行使运输功能外,在防御、免疫、体液调节及维持内环境稳态中都发挥重要作用,动物血液的生理生化特征既是长期进化的结果,也是对外界环境适应的反映。鱼类作为低等的水生脊椎动物,其血液指标与水环境因子及鱼体自身的生理状况密切相关,因此血液指标变化是研究环境因子及污染物对鱼类影响和监测的重要资料[15]。铁在体内的转运是通过血液进行的,检测血液铁代谢指标可直接反映出机体的铁平衡状态。本研究对大弹涂鱼进行不同浓度的急性镉胁迫实验,检测镉胁迫后血清铁含量、总铁结合力和铁蛋白含量等铁代谢指标的变化,以期为研究镉对大弹涂鱼的毒性机理提供参考资料。
1 材料与方法
1.1 实验动物
大弹涂鱼购自宁波市路林市场,体重22.1~28.3 g,体长11~15 cm。
1.2 镉胁迫
实验用水为用曝气3 d的自来水加入海水晶配制的人工海水(盐度18)。参考国家渔业水质标准中所规定的镉离子浓度≤0.005 mg/L,设置4个镉胁迫组,浓度分别为标准浓度的10倍、50倍、100倍和1000倍,用氯化镉(CdCl2)进行配制。另设置一个不加入氯化镉的对照组。每个组均设3个重复。
镉胁迫实验在规格为60 cm×40 cm×40 cm的塑料箱中进行,每个箱中装水4 L,放45尾大弹涂鱼。实验期间不投喂,每天更换相同Cd2+浓度的人工海水1次,换水量约1/2。实验期间维持水温20℃。
分别在镉胁迫前(0 h)和胁迫后6 h、12 h、24 h时取样,将鱼用丁香酚麻醉后用一次性注射器从尾静脉采集血液,置于离心管中。血样在4℃下静置2 h,低速离心后吸取上层血清,放入-20℃冰箱中过夜,次日将血清解冻后再次低速度离心,吸取上层液体保存于-20℃备用。
1.3 铁代谢指标的测定
用南京建成生物工程研究所的血清铁测定测试盒、总铁结合力(TIBC)测定试剂盒和铁蛋白(Fer)试剂盒分别测定血清中铁、总铁结合力、铁蛋白等铁代谢指标。
血清铁浓度测定:在酸性溶液和还原剂作用下,使转铁蛋白中的铁与蛋白分离,使血清中高铁还原成亚铁,后者与双吡啶结合成粉红色的络合物,测定520 nm处的吸光度(OD值)。在一定范围内,铁离子的多少与色泽成正比。血清铁浓度(μmol/L)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准浓度。
血清总铁结合力的测定:向血清内加入过量的铁,使血清中转铁蛋白全部与铁结合,再加入铁吸附剂将多余的铁吸附掉,然后依据血清铁的检测方法测定铁含量,即总铁结合力。血清总铁结合力(μmol/L)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准浓度。
铁蛋白含量测定采用酶联免疫吸附法(ELISA):用纯化的铁蛋白抗体包被微孔板制成固相抗体,向微孔中加入待测血清样品,再加入酶标记抗体,37℃孵育30 min,形成抗体-抗原-酶标抗体复合物,洗去未结合组分后加入显色液显色,显色液的吸光度与血清中铁蛋白成正比。测定450 nm下的吸光度(OD值),通过标准曲线计算铁蛋白浓度。
测定中各步骤的具体操作均按照试剂盒说明书进行,每一样品重复检测3次。
1.4 数据处理

2 结果
2.1 镉胁迫对大弹涂鱼血清铁浓度的影响
由图1可见,实验期间(0~24 h)对照组大弹涂鱼血清铁浓度虽略有波动但无显著性变化(P>0.05),而经不同浓度的镉胁迫后大弹涂鱼血清铁浓度均呈先降低后升高的变化,并且镉浓度越高血清铁浓度的变化幅度越大。胁迫6 h时4个实验组大弹涂鱼的血清铁浓度均显著降低(P<0.05),并且降幅与镉浓度呈正相关:0.05、0.25、0.5和5 mg/L镉胁迫组的血清铁浓度分别由(22.3±1.99)μmol/L降至(18.64±1.21)μmol/L、(24.69±2.62)μmol/L降至(16.33±1.32)μmol/L、(23.26±2.35)μmol/L降至(13.53±1.55)μmol/L、(22.3±2.11)μmol/L降至(11.02±1.26)μmol/L,降幅分别为16.41%、33.86%、41.83%和50.58%。镉胁迫6 h后各组的血清铁浓度均逐渐升高,12 h时4个镉胁迫组的血清铁浓度均比6 h时显著升高(P<0.05),但程度不同:0.05 mg/L镉胁迫组的血清铁浓度已显著高于胁迫前(0 h),0.25 mg/L镉浓度组略低于胁迫前但无显著差异(P>0.05),0.5和5 mg/L镉浓度组虽比6 h时显著升高但仍显著低于胁迫前(P<0.05)。24 h时,0.05、0.25、0.5和5 mg/L 4个实验组的血清铁浓度分别为(28.14±3.11)μmol/L、(32.05±3.67)μmol/L、(33.4±3.23)μmol/L和(34.56±3.44)μmol/L,除镉浓度最低的0.05 mg/L组外其他3个实验组的血清铁浓度均比12 h时出现显著升高(P<0.05);与胁迫前(0 h)相比,此时4个实验组的血清铁浓度分别升高了1.26、1.30、1.44和1.55倍。
2.2 镉胁迫对大弹涂鱼血清总铁结合力的影响
镉胁迫对大弹涂鱼血清总铁结合力的影响见图2。0.05和0.25 mg/L浓度的镉胁迫对大弹涂鱼血清总铁结合力影响不大,其中0.05 mg/L镉浓度组在胁迫24 h期间总铁结合力略有波动但差异均不显著(P>0.05),0.25 mg/L镉浓度组在胁迫6 h和12 h时大弹涂鱼血清总铁结合力有所降低但与胁迫前(0 h)相比无显著性差异(P>0.05);24 h时总铁结合力由12 h时的(59.56±2.97)μmol/L显著升高(P>0.05)至(69.34±2.39)μmol/L,此时的总铁结合力也显著高于胁迫前(63.76±2.58)μmol/L(P>0.05)。当镉浓度升高至0.5和5 mg/L时,血清总铁结合力均呈先显著降低再显著升高的变化(P<0.05),两组的最低值均出现在胁迫6 h时分别为(52.73±3.47)μmol/L和(39.20±4.22)μmol/L,分别比胁迫前(64.53μmol/L±4.11μmol/L和65.55μmol/L±5.31μmol/L)降低了18.29%和40.20%;胁迫12 h时,两组的总铁结合力均比6 h时略有升高,仍显著低于胁迫前(P<0.05);胁迫24 h时,两组的总铁结合力均比6 h时出现显著升高(P<0.05),此时0.5 mg/L镉浓度组的总铁结合力(70.99±5.14)μmol/L已高于胁迫前的水平但差异不显著(P>0.05),而5 mg/L镉浓度组(53.73±4.15)μmol/L仍显著低于胁迫前(P<0.05)。

图1 镉胁迫对大弹涂鱼血清铁浓度的影响
注:同一浓度组中不同时间点无相同小写字母表示存在显著性差异;下同

图2 镉胁迫对大弹涂鱼血清总铁结合力的影响
2.3 镉胁迫对大弹涂鱼血清铁蛋白含量的影响
由图3显示,低浓度(0.05和0.25 mg/L)的镉胁迫24 h对大弹涂鱼血清铁蛋白含量无显著影响(P>0.05),但有随胁迫时间延长而升高的趋势;而在镉胁迫浓度较高的0.5 mg/L组和5 mg/L组,胁迫12 h和24 h时大弹涂鱼血清铁蛋白含量显著升高(P<0.05),并且升高幅度与镉浓度和胁迫时间均呈正相关:与胁迫前相比[0.5 mg/L组为(41.55±3.55)μmol/L,5 mg/L组(40.40±2.95)μmol/L],12 h时两组分别升高了26.55%和32.57%,达到(52.58±4.04)μmol/L和(53.56±3.99)μmol/L;24 h时再次显著升高(P<0.05)至(64.28±5.11)μmol/L和(79.25±7.85)μmol/L,分别为胁迫前的1.55倍和1.96倍。
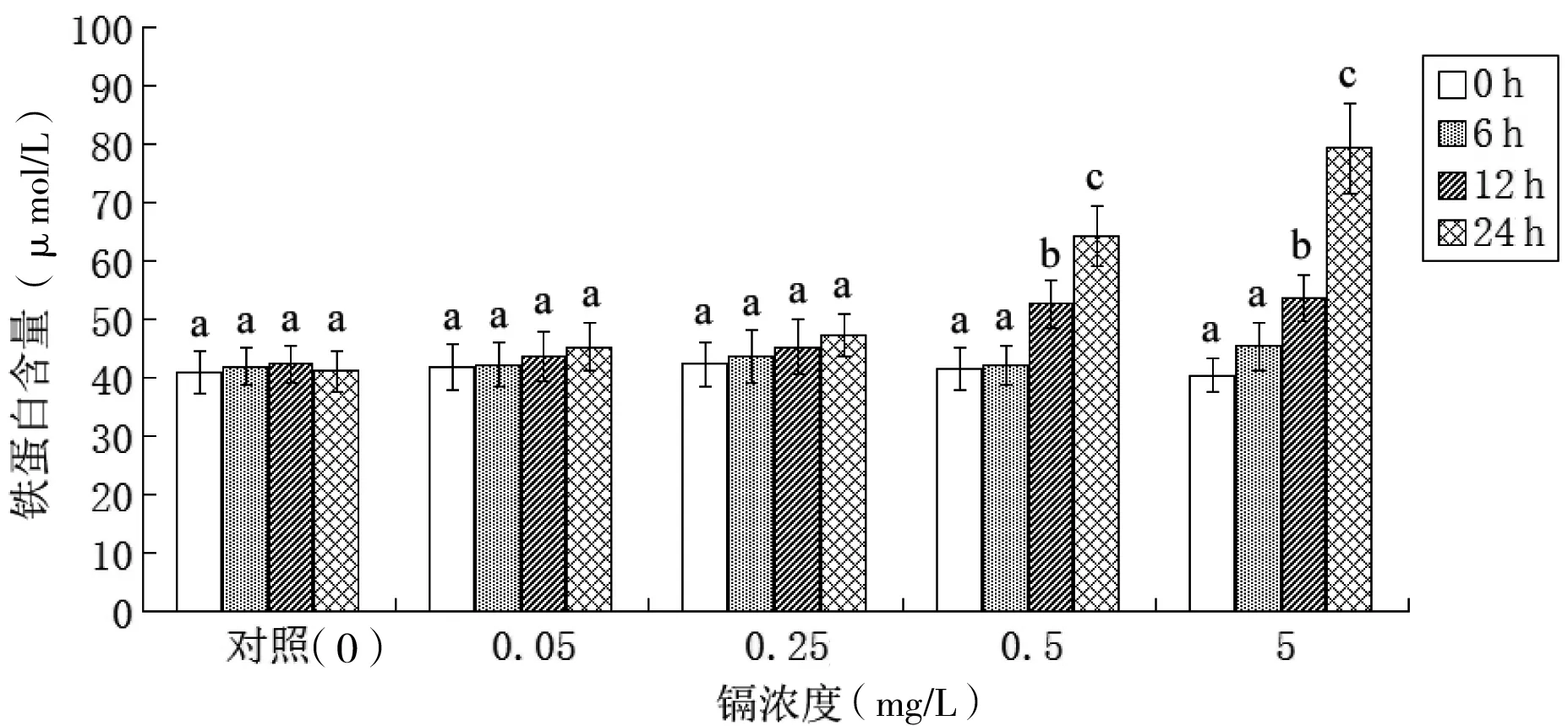
图3 镉胁迫对大弹涂鱼血清铁蛋白含量的影响
3 讨论
血清铁是指血清中有生理活性的铁离子,它能反应血清中铁离子的浓度[16]。在哺乳动物中的研究显示镉会损伤消化道黏膜和阻碍小肠对铁的吸收,导致血浆铁含量降低[17],南方鲇在镉胁迫后也出现缺铁性贫血[18]。本研究中,大弹涂鱼在镉胁迫24 h期间血清铁含量呈先降低后升高的表现,刘宗平等[19]在绵羊的镉暴露实验中也观察到了相似的结果,这表明镉胁迫导致铁吸收减少后,机体会调整自身代谢以应对缺铁状态,例如从巨噬细胞、网状内皮等处释放出铁,以保持体内的铁稳态。在4个大弹涂鱼镉胁迫组中,血清铁含量降低和升高的幅度均随镉浓度的升高而增大,表明镉浓度越高对鱼体铁稳态的干扰越大,这与马振祥等[20]观察到的镉处理浓度越高小鼠贫血状况越严重的结果相一致。
总铁结合力是血清中转铁蛋白全部与铁结合后铁的总量,实际反映的也是血清中转铁蛋白的水平[16]。转铁蛋白是一种急性反应蛋白,主要由肝细胞合成,在急性反应中往往降低。镉胁迫后大弹涂鱼血清总铁结合力降低,这可能与镉胁迫影响肝脏功能、造成肝脏损伤有关[10]。南方鲇在急性镉胁迫后肝脏组织受损,肝细胞界限模糊,细胞变形、萎缩[18];在大弹涂鱼中虽然已发现急性镉攻毒后鳃和肾出现不同程度的组织变化[7],但肝脏的具体组织损伤情况未见报道。另外,金慧英等[21]观察到急性镉中毒时大鼠肝脏功能在6 h内受到显著抑制,之后会逐渐恢复;临床上发现急性缺铁性贫血时血中转铁蛋白水平降低,而非急性的缺铁性低血色素贫血患者则由于转铁蛋白合成增加而水平升高[22]。本研究中大弹涂鱼血清总铁结合力的最低值出现在镉胁迫后6 h时,之后逐渐升高,表明大弹涂鱼肝脏对镉胁迫造成的损伤有一定的修复能力,在大鼠中这种修复与金属硫蛋白的保护作用有关[21],但大弹涂鱼中的机制尚不清楚。
铁蛋白是铁在生物体内的存储载体,在动物、植物和微生物体内均广泛存在,且保守性较高,具有调节铁代谢平衡、抗氧化胁迫、解毒等功能[23]。铁蛋白由外部的蛋白壳和内部的铁核组成,研究显示Cd2+和Fe2+竞争铁蛋白铁核上的同一位点,并且有一部分Cd2+可能结合于铁蛋白壳内表面[24],铁蛋白通过富集镉、铅等重金属可以对细胞起到保护作用[25-26]。虽然出现缺铁性贫血时通常铁蛋白会出现降低,但刘俊峰等[27]和赵花等[28]对肝炎、肝硬化病人的研究显示铁蛋白含量并不受体内铁贮存状态影响,与肝细胞损伤程度密切相关。本研究中,镉胁迫24 h期间大弹涂鱼血清铁蛋白含量逐渐升高,这有助于吸附镉;而同时血清铁含量则呈先降低后升高的变化,提示急性镉胁迫可能造成了肝脏的损伤。
在正常生理条件下,机体内铁的水平直接影响体内铁调节蛋白(IRP)的活性状态,继而影响转铁蛋白、铁蛋白、转铁蛋白受体等的合成,铁充足时,铁调节蛋白中的铁原子结合稳定,会增强铁蛋白mRNA表达、抑制转铁蛋白受体mRNA转录,结果是铁蛋白生成增加、转铁蛋白受体生成减少;而铁缺乏时则引起铁蛋白减少,而转铁蛋白受体和转铁蛋白则增多[29]。镉和铁均与转铁蛋白及其受体有很强的亲和力,我们推测大弹涂鱼受到镉胁迫时,镉竞争性的与转铁蛋白及其受体结合,导致机体出现铁充足的假象,激活了铁调节蛋白的作用,使铁蛋白mRNA表达增强,从而引起血清铁蛋白增高。同时,镉对大弹涂鱼正常铁代谢的干扰也与镉胁迫造成的肝脏损伤有关。
[1]冯 涛,郑微云,洪万树,等. 苯并(a)芘对大弹涂鱼肝脏抗氧化酶活性影响的初步研究[J]. 应用生态学报,2001,12(3):422-424.
[2]蔡福龙,陈 英,许丕安,等. 大弹涂鱼(Boleophthalmuspectinirostris)作为放射性核素指示物的研究[J]. 环境科学学报,1992,12(3):282-287.
[3]FENG T, GUO X Q, ZHENG W Y, et al. Detection of DNA strand breaks in the liver ofBoleophthalmuspectinirostristreated with benzo(a)pyrene[J]. Bulletin of Environmental Contamination and Toxicology, 2003, 71(2):263-269.
[4]上官旖旎,赵金龙,陈 婷,等. 对二甲苯对大弹涂鱼肝脏和白肌抗氧化酶活性的影响[J]. 水产科学, 2011,30(1):6-10.
[5]ANSARI T M, MARR I L, TARIQ N. Heavy metals in marine pollution perspective- a mini review[J]. Journal of Applied Sciences, 2004, 4(1):1-20.
[6]LUPARELLO C, LONGO A, VETRANO M. Exposure to cadmium chloride influencesastrocyte-elevatedgene-1 (AEG-1) expression in MDA-MB231 human breast cancer cells[J]. Biochimie, 2012, 94(1):207-213.
[7]叶帅东,李明云,章志盈. 镉离子对大弹涂鱼急性攻毒试验[J]. 宁波大学学报(理工版), 2007, 20(3):320-323.
[8]黄福勇,李明云,竺俊全,等. 急性镉中毒对大弹涂鱼血细胞同工酶表达的影响[J]. 上海水产大学学报, 2004,13(4):289-292.
[9]金春华,李明云,刘伟成,等. 镉胁迫对大弹涂鱼(Boleophthalmuspectinirostris)血细胞遗传损伤的研究[J]. 海洋与湖沼, 2010, 41(1): 80-83.
[10]张玉平,孙振中,郝永梅. 镉对大弹涂鱼肝脏超氧化物歧化酶活性的影响[J]. 水产科学, 2008,27(2):79-81.
[12]JIN Y H, CLARK A B, SLEBOS R J, et al. Cadmium is a mutagen that acts by inhibiting mismatch repair [J]. Nature Genetics, 2003, 34(3):326-329.
[13]MOULIS J M. Cellular mechanisms of cadmium toxicity related to the homeostasis of essential metals[J]. Biometals, 2010, 23(5): 877-896.
[14]KIM D W, KIM K Y, CHOI B S, et al. Regulation of metal transporters by dietary iron, and the relationship between body iron levels and cadmium uptake[J]. Arch Toxicol, 2007, 81(5): 327-334.
[15]陈 洁,熊邦喜,顾钱洪,等. 内源及外援因子对鱼类血液生理生化指标的影响[J]. 湖北农业科学,2011,50(9):1861-1865.
[16]弭希峰,黄子成,王木成,等. 非酒精性脂肪肝患者血清铁、转铁蛋白、血清铁蛋白水平测定[J]. 上海医药,2006,27(11):517-518.
[17]WLOSTOWSKI T, KRASOWSKA A, BONDA E. An iron-rich diet protects the liver and kindeys against cadmium-induced injury in the bank wole (Clethrionomysglareolus)[J]. Ecotoxicol Environ Sar, 2003, 54(2):194-198.
[18]黄 林.镉对南方鲇血液学指标和造血器官的影响[D].重庆:西南大学,2010.
[19]刘宗平,马 卓,李文范,等. 镉对绵羊的毒理学研究[J].畜牧兽医学报, 1996,27(6): 546-553.
[20]马振祥,姜声扬,张卫兵.实验性镉中毒致小鼠血液学指标改变及硫酸锌的保护作用[J].中国职业医学,2004,31(5):36-38.
[21]金慧英,胡惠民,周 雍,等. 急性镉中毒的肝脏损伤机制及金属硫蛋白的保护作用[J].中华劳动卫生职业病杂志, 1998,16(1):43-46.
[22]候 韬,徐燕平. 缺铁性贫血患者检测血清铁和转铁蛋白的临床意义[J].中国现代医生, 2010,48(29):155-156.
[23]陈 静, 赵永亮, 王 丹. 铁蛋白研究现状[J]. 河南师范大学学报(自然科学版), 2010,38(1):152-155.
[24]PEAD S, DURRANT E, WEBB B, et al. Metal ion binding to aop, holo, and reconstituted horse spleen ferritin[J]. Inorg Biochem, 1995,59(1):15-27.
[25]LI CH, LI Z, LI Y, et al. A ferritin fromDendrorhynchuszhejiangensiswith heavy metals detoxification activity[J]. PloS One, 2012,7(12):e51428.
[26]初双双,张云云,苏 倡,等. 可口革囊星虫(Phascolosomaesculenta)重组铁蛋白富集Pb2+等重金属特性和功能研究[J]. 海洋与湖沼,2015,46(6):1358-1364.
[27]刘俊峰, 谢 涛, 鞠 萍,等. 铁蛋白铁含量在肝脏疾病诊断中的临床意义[J]. 实用医技杂志, 2005,12(9):2340-2342.
[28]赵 花, 张 红. 肝炎患者血清铁蛋白测定的临床意义[J]. 中国误诊学杂志, 2008,8(28):6870.
[29]KLAUSNER R D, ROUAULT T A, HARFORD J B. Regulating the fate of mRNA: the control of cellular iron metabolism[J]. Cell, 1993,72(1):19-28.
EffectsofacutecadmiumstressonserumironmetabolismindicatorsofBoleophthalmuspectinirostris
DU Jing-ya, MIAO Liang, LI Ming-yun, MU Fang-shen, HOU Hong-hong, ZHAO Liang
(Key Laboratory of Applied Marine Biotechnology, Ministry of Education, Ningbo University, Ningbo 315211, China)
The effects of acute cadmium stress on iron metabolism were investigated inBoleophthalmuspectinirostris. Fish was exposed to different concentration Cd2+(0.05, 0.25, 0.5 and 5 mg/L) for 24 h, and the concentration of serum iron, total iron-binding capacity and serum ferritin were detected. The results showed that the concentration of serum iron increased at first and then descended (P<0.05), and there had a positive correlation between the variation range of serum iron and Cd2+concentration. In the four experimental groups, the minimal value of serum iron was all appeared at 6 h after Cd2+exposed, and the value at 24 h was all significantly higher than 0 h (P<0.05). The total iron binding capacity showed changes of decrease to increase, while the change extent had no significant (P>0.05) in 0.05 mg/L group. At 24 h, total iron binding capacities recovered to or exceed the normal levels (0 h) except 5 mg/L group. In 0.05 and 0.25 mg/L groups, the concentration of serum ferritin had no significant changes during experimental period. In 0.5 and 5 mg/L groups, the concentration of serum ferritin increased significantly after 12h (P<0.05), and the increased extent was positive correlation to Cd2+concentration. The results could provide reference for investigating the toxicity metabolism of cadmium toB.pectinirostristhrough interfering iron metabolism.
Boleophthalmuspectinirostris; cadmium stress; iron metabolism indicators
2016-10-14;
2016-10-24
浙江省自然科学基金(LY14C030002);长江学者和创新团队发展计划(IRT0734)
杜静雅,研究方向为鱼类遗传育种与资源保护,E-mail: 2548252250@qq.com
苗 亮,博士,硕士生导师,研究方向为水产经济动物遗传育种、增养殖及资源保护,E-mail:miaoliang@nbu.edu.cn;李明云,教授,博士生导师,研究方向为水产经济动物遗传育种、增养殖及资源保护,E-mail: limngyun@nbu.edu.cn
10.3969/j.issn.2095-1736.2017.06.037
Q945.78;Q89
A
2095-1736(2017)06-0037-05
