卡前列甲酯-羟丙基-β-环糊精包合物舌下片的制备及质量评价Δ
2017-12-19何瑶阮一李卓恒王丽娟李峥重庆市急救医疗中心药剂科重庆40004陆军军医大学第三附属医院药剂科重庆40000重庆医药高等专科学校药学院重庆40重庆市第五人民医院药剂科重庆40006
何瑶,阮一,李卓恒,王丽娟,李峥(.重庆市急救医疗中心药剂科,重庆40004;.陆军军医大学第三附属医院药剂科,重庆40000;.重庆医药高等专科学校药学院,重庆40;4.重庆市第五人民医院药剂科,重庆40006)
卡前列甲酯-羟丙基-β-环糊精包合物舌下片的制备及质量评价Δ
何瑶1*,阮一1,李卓恒2,王丽娟3,李峥4#(1.重庆市急救医疗中心药剂科,重庆400014;2.陆军军医大学第三附属医院药剂科,重庆400020;3.重庆医药高等专科学校药学院,重庆401331;4.重庆市第五人民医院药剂科,重庆400062)
目的:制备卡前列甲酯-羟丙基-β-环糊精(HP-β-CD)包合物舌下片,并进行质量评价。方法:采用湿法制粒法制备卡前列甲酯-HP-β-CD包合物舌下片,以片剂的外观、崩解时间、润湿时间、主药含量为考察指标,以处方中甘露醇-乳糖的质量比、聚维酮的体积分数、低取代羟丙纤维素(L-HPC)的用量为因素,采用正交试验筛选处方。评价最优处方所制舌下片的崩解时间、润湿时间、主药含量、含量均匀度及溶出度。结果:最优处方为卡前列甲酯-HP-β-CD包合物78.82 mg(含卡前列甲酯1 mg),甘露醇-乳糖(质量比9∶1)的混合粉末100 mg,2%的PVP溶液适量,L-HPC 30 mg,硬脂酸镁1 mg。所制3批舌下片的崩解时间为(25.30±3.21)~(26.53±2.69)s,润湿时间为(64.65±8.07)~(65.54±7.21)s,主药含量为(96.13±0.43)%~(97.06±0.82)%,含量均匀度为5.95~7.68,10 min内累积溶出度均超过50%,30 min内可完全溶出。结论:成功制得质量符合要求的卡前列甲酯-HP-β-CD包合物舌下片。
卡前列甲酯;羟丙基-β-环糊精;包合物;舌下片;正交试验;质量评价
卡前列甲酯为前列腺素F2α衍生物,具有多种生理生化功能,对血管、支气管、子宫和胃肠道平滑肌舒缩及胃酸分泌均有影响,还可以影响血小板和血管内皮细胞功能,被广泛用于防治产后出血[1]。卡前列甲酯水溶性小,对光、热、湿等外界因素敏感,性质不稳定。目前仅有卡前列甲酯的栓剂(商品名:卡孕)上市,其药品说明书给药途径为阴道给药,且需在-5℃条件下储存。较多临床研究和专家共识表明,将卡孕栓通过口腔黏膜给药用于产后出血,能迅速吸收并达到有效血药浓度而发挥效果[1-3]。在此基础上,本课题组希望将卡前列甲酯制成口服制剂,以增加临床应用时的选择剂型。
舌下黏膜给药系统将药物制备成适宜剂型通过黏膜吸收,避免了首关效应,能有效提高药物生物利用度。本课题组前期试验已经制备了卡前列甲酯-羟丙基-β-环糊精(HP-β-CD)包合物,已证实其可显著改善卡前列甲酯的溶解性能、提高药物稳定性、促进药物吸收。因此,本课题组拟通过处方筛选和制备工艺研究,将卡前列甲酯-HP-β-CD包合物制成舌下片,旨在为临床提供一种稳定性好,贮藏、使用方便,生物利用度高的卡前列甲酯新型给药制剂。
1 材料
1.1 仪器
LC-2010型高效液相色谱仪,包括2010型四元梯度泵和2010型紫外检测器(日本Shimadzu公司);PM300型分析电子天秤(瑞士Mettler-Toledo公司);TDP型单冲压片机(上海第一制药机械厂);ZB-IB型智能崩解仪(天津大学精密仪器厂);ZRS-8G智能溶出试验仪(天津大学无线电厂)。
1.2 药品与试剂
卡前列甲酯对照品(中国食品药品检定研究院,批号:100320-201302,纯度:99.2%,);HP-β-CD(山东新大精细化工有限公司,批号:20130622);卡前列甲酯-HP-β-CD包合物(重庆市急救医疗中心自制,批号:20151003,规格:79 mg含有卡前列甲酯1 mg);甘露醇(法国Roquette公司,批号:120594);乳糖(海拉尔乳糖厂,批号:15-8665);低取代羟丙纤维素(L-HPC,上海运宏化工有限公司,批号:20130911);聚维酮(PVP,上海维酮材料科技有限公司,批号:20141093);硬脂酸镁(淄博市鲁川化工有限公司,批号:20140725);甲醇为色谱纯,其余试剂均为分析纯。
2 方法
2.1 卡前列甲酯-HP-β-CD包合物舌下片的制备
2.1.1 处方卡前列甲酯-HP-β-CD包合物78.82 mg(含卡前列甲酯1 mg),甘露醇与乳糖的混合粉末100 mg,1%~3%(V/V)浓度的PVP溶液适量,L-HPC适量,硬脂酸镁1 mg。
2.1.2 制备工艺按“2.1.1”项下处方量称取卡前列甲酯-HP-β-CD包合物、甘露醇与乳糖的混合粉末,混匀,再加入L-HPC,过40目筛混匀后,再加入PVP溶液作为黏合剂制成软材;过20目筛制粒,50℃干燥2 h;过40目筛整粒,最后加入硬脂酸镁,混匀后压片机压制成片。
2.2 卡前列甲酯的含量测定方法
2.2.1 对照品溶液的制备取卡前列甲酯对照品100 mg,精密称定,置于10 mL棕色量瓶中,用流动相稀释并定容至刻度,制得质量浓度为10.0 mg/mL的对照品溶液,于4℃下保存,备用。
2.2.2 供试品溶液的制备取20片卡前列甲酯-HP-β-CD包合物舌下片,研细,取2.00 g粉末(相当于卡前列甲酯10 mg),置于50 mL棕色量瓶中,用流动相超声(功率200 W,间隔5 s)20 min溶解,静置至室温,用流动相定容。取约40 mL上述溶液,2 000 r/min(离心半径:3 cm)离心5 min,取上清液,经0.45 μm微孔滤膜过滤,制得供试品溶液,于4℃下保存,备用。
2.2.3 空白溶液的制备按照“2.1.1”项下处方中辅料配比制备不含卡前列甲酯-HP-β-CD包合物的空白片剂,
再按“2.2.2”项下方法制成空白溶液,于4℃下保存,备用。
2.2.4 色谱条件参考文献[4]色谱条件。色谱柱为Hypersil C18(250 mm×4.6 mm,5 μm);流动相为甲醇-水(70∶30,V/V);流速为1 mL/min;柱温为室温(25~30℃);检测波长为202 nm;进样量为20 μL。取对照品溶液、空白溶液和供试品溶液,进样测定。结果,在该色谱条件下,卡前列甲酯的保留时间约为12.2 min,理论板数以卡前列甲酯计大于8 000,空白溶液在对照品溶液色谱图中的相同保留时间处无吸收峰,表明辅料不干扰卡前列甲酯的测定。色谱图见图1。

图1 高效液相色谱图Fig 1HPLC chromatograms
2.2.5 线性关系考察分别移取对照品溶液0.05、0.1、0.2、0.4、0.6、0.8、1.0 mL,置于10 mL量瓶中,流动相定容至刻度,制得质量浓度分别为0.05、0.1、0.2、0.4、0.6、0.8、1.0 mg/mL的系列对照品溶液。按“2.2.4”项下色谱条件进样测定,记录峰面积,以卡前列甲酯质量浓度为横坐标(x)、峰面积为纵坐标(y)进行线性回归,得回归方程为y=0.257 8x+0.015 6(r=0.999 6,n=7)。结果表明,卡前列甲酯在0.05~1.0 mg/mL的质量浓度范围内与峰面积的线性关系良好。以3倍信噪比计算得检测限为0.4µg/mL;以10倍信噪比计算得定量限为1.0µg/mL。
2.2.6 精密度试验按“2.2.2”项下方法制备供试品溶液,按“2.2.4”项下色谱条件进样测定。同日内测定5次考察日内精密度;每日测定1次,连续测定5 d,考察日间精密度。结果,峰面积日内RSD为0.54%(n=5),日间RSD为0.88%(n=5),符合含量测定相关规定。
2.2.7 准确度考察按“2.1.1”项下处方量取各辅料,加入10 mL的流动相溶解,再分别加入1 mL的对照品溶液制备成低、中、高质量浓度(0.2、0.4、0.8 mg/mL)的样品溶液。按“2.2.2”项下方法处理后测定并计算回收率。结果,低、中、高质量浓度样品溶液的回收率分别为(99.96±0.98)%、(100.07±0.67)%、(100.12±0.55)%(n=3),符合含量测定相关规定。
2.2.8 稳定性试验取卡前列甲酯-HP-β-CD包合物舌下片适量,按“2.2.2”项下方法制成供试品溶液,分别放置于0、12、24、36、48、60、72 h时进样测定,记录峰面积。结果,峰面积的RSD为1.23%(n=7),表明供试品溶液在72 h内稳定。
2.2.9 重复性试验取卡前列甲酯-HP-β-CD包合物舌下片适量,按“2.2.2”项下方法制成供试品溶液,分别量取供试品溶液6份,进样测定,记录峰面积。结果,峰面积的RSD为0.55%(n=6),符合含量测定相关规定。
2.3 正交试验设计优选处方
2.3.1 因素与水平通过查阅文献[4-9],结合前期预试验,选择处方中填充剂甘露醇-矫味剂乳糖的质量比(A)、黏合剂PVP的体积分数(B,%)、崩解剂L-HPC的用量(C,mg)为因素,每个因素选择3个水平,因素与水平见表1。
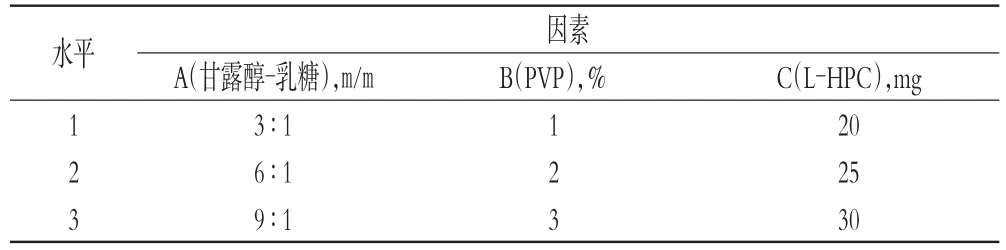
表1 因素与水平Tab 1Factors and levels
2.3.2 评价指标参考文献[5-8],以片剂的外观、崩解时间、润湿时间、主药含量为指标进行综合评分,设计正交试验优化卡前列甲酯-HP-β-CD包合物舌下片处方。综合评分总分为10分,其中外观1分(表面光滑,有亮泽,计1分;表面粗糙,有麻点、粉尘,计0分);崩解时间3分(30 s以内,计3分;30~60 s,计2分;大于60 s,计1分);润湿时间3分(50 s以内,计3分;50~90 s,计2分;大于90 s,计1分);主药含量3分(大于95%,计3分;90%~95%,计2分;小于90%,计1分)。正交试验设计与结果见表2,方差分析结果见表3。
由表2和表3结果可知,各因素对综合评分的影响大小顺序为C>A>B,其中A和C对综合评分有显著影响(P<0.05),B对综合评分无显著影响(P>0.05)。根据数据分析,确定最优处方为A3B2C3,即甘露醇-乳糖质量比为9∶1、PVP体积分数为2%、L-HPC用量为30 mg。
2.4 质量评价

表2 正交试验设计与结果Tab 2Design and results of orthogonal test
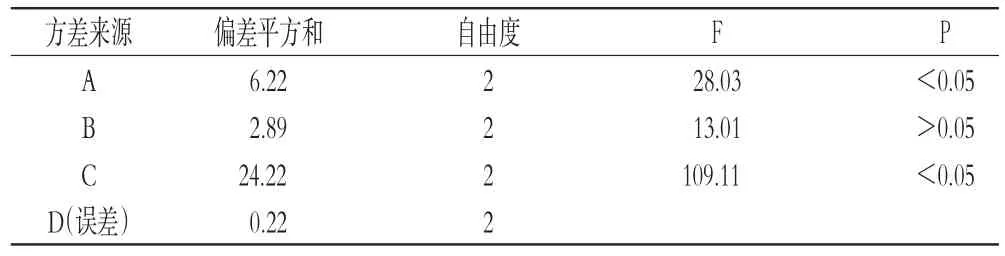
表3 方差分析结果Tab 3Results of variance analysis
以最优处方制备3批卡前列甲酯-HP-β-CD包合物舌下片,对其进行质量评价。
2.4.1 含量测定将3批样品按“2.2.2”项下方法制备供试品溶液,按“2.2.4”项下色谱条件进样测定,记录峰面积,代入回归方程计算卡前列甲酯的含量。结果,卡前列甲酯-HP-β-CD包合物舌下片中卡前列甲酯含量均在标示量的90.0%~110.0%范围内,结果见表4。
表4 3批卡前列甲酯-HP-β-CD包合物舌下片的质量评价结果(±s,n=9)Tab4Resultsofqualityevaluationof3batchesofCarboprostmethyl-HP-β-CD clathrate sublingual tablets(±s,n=9)

表4 3批卡前列甲酯-HP-β-CD包合物舌下片的质量评价结果(±s,n=9)Tab4Resultsofqualityevaluationof3batchesofCarboprostmethyl-HP-β-CD clathrate sublingual tablets(±s,n=9)
批号20160317 20160318 20160319含量,%96.13±0.43 97.06±0.82 96.77±0.96崩解时间,s 25.30±3.21 26.53±2.69 25.79±4.75润湿时间,s 65.54±7.21 64.65±8.07 65.54±5.76含量均匀度7.68 7.22 5.95 30 min累积溶出度,%101.76±1.35 99.97±1.65 101.70±1.79
2.4.2 崩解时限测定参照2015年版《中国药典》(四部)“崩解时限的测定方法”[10],分别取3批样品各6片,置于升降式崩解仪转篮中,测定其崩解时限。结果显示,3批样品的崩解时间均不超过35 s,见表4。
2.4.3 润湿时限测定参照文献[11]方法,取一张吸水纸(8 cm×4 cm),对折后放入pH 6.8的10 mL磷酸盐缓冲液(PBS)的培养皿(直径9.5 cm)中,待其完全吸收饱和时,倾出多余溶液。取3批样品,各6片,分别置于吸水纸中心,直到水分分散至整个片剂为止,记录时间。结果显示,3批样品的润湿时间均不超过80 s,具体见表4。
2.4.4含量均匀度参照2015年版《中国药典》(四部)“含量均匀度检查方法”[10],分别取3批样品各6片,以含量测定项下测定的结果计算含量均匀度(A+1.8S)。结果显示,3批样品的含量均匀度均小于8,具体见表4。
2.4.5 溶出度测定参照2015年版《中国药典》(四部)“溶出度的测定方法”[10],采用桨法测定3批样品的体外溶出度。设定转速为50 r/min,水温为(37±0.5)℃,溶出介质为pH 6.8的PBS 1 000 mL,取样时间为5、10、15、20、30、45、60 min,取样量为10 mL,取样同时补加等量同温介质。溶出液经0.45 μm微孔滤膜过滤,取续滤液作为供试品溶液。以PBS为空白,进样测定续滤液中卡前列甲酯的含量,计算累积溶出度。结果显示,3批样品在10 min时的累积溶出度均已超过50%,30 min内可完全溶出,见表4。3批样品的体外溶出曲线见图2。

图23 批卡前列甲酯-HP-β-CD包合物舌下片的体外溶出曲线Fig 2The in vitro dissolution curves of 3 batchesofCarboprostmethyl-HP-β-CD clathrate sublingual tablets
3 讨论
由于卡前列甲酯对光、热、湿等外界因素敏感,性质不稳定,因此其舌下片处方所用辅料应符合吸湿性小的条件。有研究针对常用辅料的吸湿性进行了对比[6,11-12],甘露醇、乳糖溶解性好又有甜味,几乎无吸湿性,且在已上市的舌下片制剂中广泛使用,因此为卡前列甲酯-HP-β-CD包合物舌下片的理想填充剂和矫味剂。本课题组前期试验比较了分别单用甘露醇和乳糖作为填充剂的情况,试验发现单用甘露醇时,流动性较乳糖差;单用乳糖时,制得的片剂易出现表面粗糙、有麻点等现象,因此本试验最终选择甘露醇和乳糖的混合粉末作为填充剂。
由于舌下片舌下含服仅依靠唾液润湿药片,使药片崩解,在服药时不得饮水,因此舌下片要求在少量水环境下即可达到快速崩解溶出。结合2015年版《中国药典》(四部)片剂质量要求,并参考文献[4-8,13-15],本研究选择了崩解时间、润湿时间、体外溶出度和含量均匀度为指标进行质量评价。其中,在2015年版《中国药典》(四部)中并没有明确规定润湿时间的测定方法和标准。因此,本试验参照文献方法进行润湿时限测定,试验结果表明,该方法适用于本研究中的舌下片,测定润湿时间较准确。通过对卡前列甲酯-HP-β-CD包合物舌下片质量评价,结果显示,该舌下片质量指标符合相关规定,制备工艺也较简单,适合于工业化生产。本文为卡前列甲酯新剂型的研究提供了试验依据,但有关其药动学试验还需进一步研究。
本研究首次将卡前列甲酯-HP-β-CD包合物制备成舌下片,具有较好的开发前景,对于临床产后出血防治的新剂型的研发具有很好的参考价值。
[1]林其德,杨孜,古航,等.卡前列甲酯临床应用专家共识:2013年版[J].中国实用妇科与产科杂志,2013,29(6):431-433.
[2]樊新星,李伦瑾,孙山.舌下含服卡前列甲酯栓预防产后出血疗效与安全性系统评价[J].中国药业,2016,25(15):19-23.
[3]嵇校琴,黄筱竑.舌下含服卡前列甲酯栓预防剖宫产妇产后出血疗效观察[J].药物流行病学杂志,2014,23(12):713-715.
[4]国家药典委员会.中华人民共和国药典:二部[S].2015年版.北京:中国医药科技出版社,2015:98-99.
[5]吴志恒,谢佳,卜婧,等.苯磺酸氨氯地平舌下片的制备及质量控制[J].武警后勤学院学报(医学版),2014,23(2):127-130.
[6]苏卫,董少华,胡晓,等.尼莫地平固体自微乳化舌下速溶片的制备及质量评价[J].中国医院药学杂志,2014,34(13):1079-1082.
[7]Aburahma MH,El-Laithy HM,Hamza ES.Preparation and in vitro/in vivo characterization of poroussublingualtabletscontainingternary kneaded solid system of vinpocetine with β-cyclodextrin and hydroxy acid[J].Sci Ph-arm,2010,78(2):363-379.
[8]Hosny KM,Mosli HA,Hassan AH.Soy polysaccharide as a novel superdisintegrant in sildenafilcitratesublingualtablets:preparation,characterization,andinvivoevaluation[J].Drug Des Devel Ther,2015,9:465-472.
[9]谷福根,高永良,崔福德.前列腺素E1-羟丙基-β-环糊精包合物舌下片的制备及其体外质量评价[J].中国新药杂志,2011,20(15):1463-1468.
[10]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:118-125.
[11]Rawas-Qalaji MM,Simons FE,Simons KJ.Fast-disintegrating sublingual tablets:effect of epinephrineloadontabletcharacteristics[J].AAPS Pharm Sci Tech,2006,7(2):72-78.
[12]范凌云,余琰,高建德,金辉.不同辅料对三黄粉吸湿性的影响[J].中成药,2015,37(12):2764-2766.
[13]刘志刚,李雪玲,李沙沙,等.常见药用辅料对毛冬青总黄酮吸湿性的影响[J].中国实验方剂学杂志,2014,20(1):24-27.
[14]WangXQ,XueKE,PingQN,etal.Formulation study for rotundine rapidly disintegrating tablet[J].J Chin Pharm Sci,2005,14(2):100-104.
[15]吴亚利,毛士龙.酒石酸唑吡坦舌下片的研制及质量评价[J].中国药业,2013,22(14):81-82.
Preparation and Quality Evaluation of Carboprost Methyl-hydroxypropyl-β-cyclodextrin Clathrate Sublingual Tablets
HE Yao1,RUAN Yi1,LI Zhuoheng2,WANG Lijuan3,LI Zheng4(1.Dept.of Pharmacy,Chongqing Emergency Medical Center,Chongqing 400014,China;2.Dept.of Pharmacy,the Third Affiliated Hospital of Army Medical University,Chongqing 400020,China;3.School of Pharmacy,Chongqing Medical and Pharmaceutical College,Chongqing 401331,China;4.Dept.of Pharmacy,the Fifth People’s Hospital of Chongqing,Chongqing 400062,China)
OBJECTIVE:To prepare the Carboprost methyl-hydroxypropyl-β-cyclodextrin(HP-β-CD)clathrate sublingual tablets,and conduct quality evaluation.METHODS:Wet granulation method was used to prepare Carboprost methyl-HP-β-CD clathrate sublingual tablets.Using the appearance,calving time,wetting time and main drug content as investigation indexes,mass ratio of mannitol-lactose,povidone volume fraction and amount of low-substituted hydroxypropylcellulose(L-HPC)as factors,orthogonal test was used to screen the formulation.The calving time,wetting time,main drug content,content uniformity,dissolution degree of sublingual tablets with optimal formulation were evaluated.RESULTS:The optimal formulation was as follow as 78.82 mg of carboprost methyl-HP-β-CD clathrate(containing carboprost methyl 1 mg),100 mg of mannitol-lactose(mass ratio of 9∶1)mixed powder,appropriate amount of 2%povidone solution,30 mg of L-HPC,and 1 mg of magnesium stearate.The calving time of prepared 3 batches of sublingual tablets was(25.30±3.21)-(26.53±2.69)s;wetting time was(64.65±8.07)-(65.54±7.21)s;main drug content was(96.13±0.43)%-(97.06±0.82)%;content uniformity was 5.95-7.68;the cumulative dissolution degree within 10 min was more than 50%,and it can completely dissolute within 30 min.CONCLUSIONS:Carboprost methyl-HP-β-CD clathrate sublingual tablets,which are up to requirements,are prepared successfully.
Carboprost methyl;Hydroxypropyl-β-cyclodextrin;Clathrate;Sublingual tablets;Orthogonal test;Quality evaluation
R943
A
1001-0408(2017)34-4860-04
DOI10.6039/j.issn.1001-0408.2017.34.28
重庆市卫生和计划生育委员会医学科研计划项目(No.20142078)
*主管药师,硕士。研究方向:医院药学、药剂学。电话:023-63692203。E-mail:27382552@qq.com
#通信作者:主管药师。研究方向:医院药事管理、临床药学、药剂学。电话:023-62875628。E-mail:597220337@qq.com
2017-06-03
2017-08-30)
(编辑:邹丽娟)
