鱼类miRNAs研究新进展
2017-12-18卢荣华王俊丽孙君君谢帝芝聂国兴
卢荣华,王俊丽,孙君君,杨 峰,谢帝芝,田 雪,聂国兴
( 1. 河南师范大学 水产学院,河南 新乡453007; 2. 河南省水产动物养殖工程技术研究中心,河南 新乡 453007; 3. 河南师范大学 生命科学学院,河南 新乡 453007 )
鱼类miRNAs研究新进展
卢荣华1,2,王俊丽3,孙君君3,杨 峰1,2,谢帝芝1,2,田 雪1,2,聂国兴1,2
( 1. 河南师范大学 水产学院,河南 新乡453007; 2. 河南省水产动物养殖工程技术研究中心,河南 新乡 453007; 3. 河南师范大学 生命科学学院,河南 新乡 453007 )
鱼类;miRNAs;功能;研究进展
MicroRNAs (miRNAs)是一类内生性的、进化上高度保守的单链成熟非编码RNA,长度约21~25个核苷酸,广泛存在植物、动物及微生物中[1-2],参与生物体的胚胎形成、个体生长发育、机体免疫、疾病防御以及繁殖和糖脂类代谢等生命过程[3-8]。目前,基于生物信息学预测,miRNAs约占整个基因组的2%~3%[9]。自Lee等[10]利用定位克隆法从秀丽隐杆线虫(Caenorhabditiselegans)中克隆到第1个miRNA lin-4基因以来,目前在果蝇(Drosophilamelanogaster)、人(Homosapiens)、家鼠(Musmusculus)、鸡(Gallusdomestiaus)、牛(Bovine)、斑马鱼(Daniorerio)以及植物的拟南芥(Arabidopsisthaliana)中均分离到了miRNAs。笔者就目前miRNAs在鱼类中的最新研究进展进行综述,以期为更多的了解其在鱼类中的作用提供基础资料。
1 鱼类miRNAs的克隆与鉴定
目前miRNAs在鱼类中的研究还处于对miRNAs的克隆、高通量测序筛选鉴定以及个别miRNAs的初步功能研究阶段,如虹鳟(Oncorhynchusmykiss)、斑马鱼、斑点绿河鲀(Tetraodonnigroviridis)和青鳉(Oryziaslatipes)等的多个miRNAs已被鉴定[11-13]。截至2016年2月24日,在http:∥www.mirbase.org/cgi-bin/browse.pl中收录的miRNAs数量已达28 645个miRNAs发夹前体序列,35 828个成熟miRNAs,覆盖223个物种。其中9种鱼类的miRNAs序列被收录的具体情况见表1。Yang等[14]采用比较基因组同源性的方法对虹鳟的miRNAs进行筛选鉴定,发现了196个潜在miRNAs,隶属于124个miRNAs家族,其中189个潜在miRNAs靶基因数目为2466个,GO富集和KEGG分析显示有2093、2107、2081个靶基因分别参与细胞组件、分子功能和生物过程,这些miRNAs靶基因可能调控105个代谢途径,包括嘌呤代谢、氮代谢和氧化磷酸化途径。硬骨鱼类是脊椎动物门中数量最大的一类,超过25 000个物种,但目前miRNAs仅在几个硬骨鱼类中被鉴定,这说明miRNAs在鱼类上的研究较为匮乏。
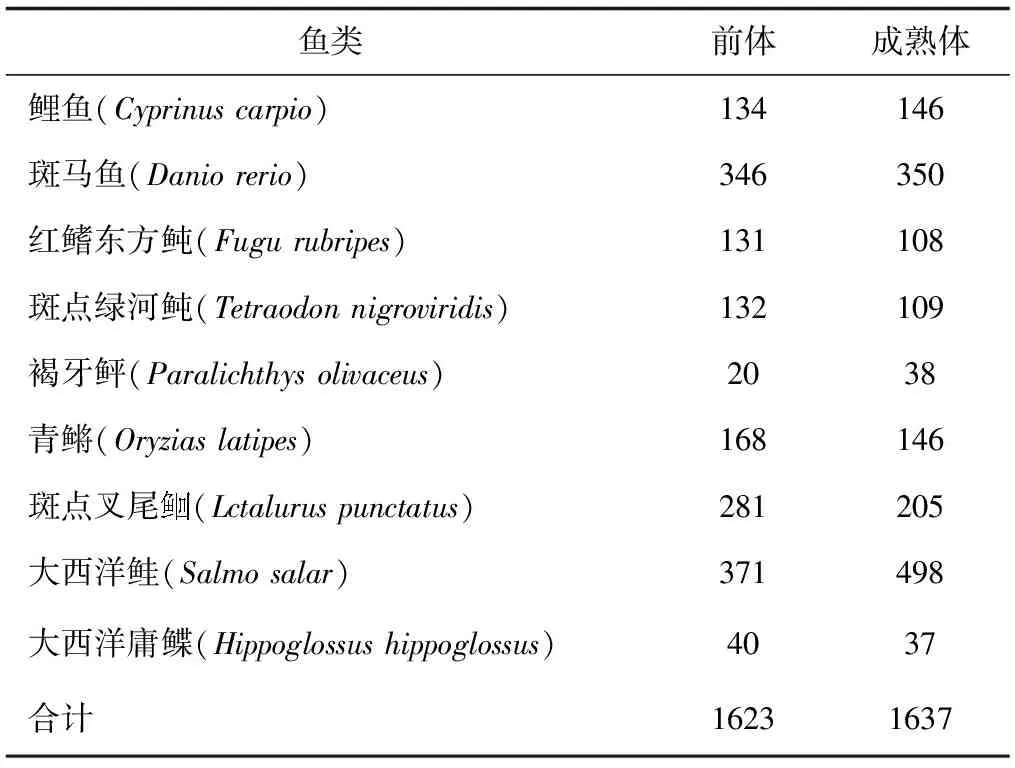
表1 硬骨鱼类前体和成熟miRNAs的数量(miRBase v.20)
2 miRNAs在鱼类中的作用研究
2.1 miRNAs调控鱼类糖脂代谢
与陆生动物相比,miRNAs在鱼类糖脂代谢中的相关功能及机制研究较少,仅见在斑马鱼、虹鳟、黄斑蓝子鱼(Siganusoramin)、草鱼(Ctenopharyngodonidella)和鲢鱼(Hypophthalmichthysmolitrix)等少数几种鱼类的研究中有涉及[8,13,15-16]。
2.1.1 miRNAs在鱼类脂代谢中的研究
Zhang等[8]在黄斑蓝子鱼肝脏中研究发现,miR-17能直接作用于Δ4脂酰去饱和酶的3′UTR区,且能特异性抑制Δ4脂酰去饱和酶mRNA的表达和蛋白质的合成,实现转录后水平对Δ4脂酰去饱和酶的负调控,从而参与长链多不饱和脂肪酸合成代谢的调节。孙君君等[15]在草鱼中的研究发现,SREBP-1的3′UTR区存在两种与脂代谢相关的miRNAs,即miR-33a和miR-16。在鳙鱼(Aristichthysnobilis)和鲢鱼中也鉴定出了miR-33[13]。Her等[16]在斑马鱼肝胰脏中转染癌性锚蛋白重复序列基因(gankyrin,GK)后,发现超过90%的癌性锚蛋白重复序列斑马鱼成鱼表现出肝脏脂质蓄积、肝细胞凋亡,大约10个月后会出现肝功能衰竭和肝坏死。进一步利用分子生物学手段分析,发现超表达癌性锚蛋白重复序列基因后不仅导致了脂肪肝,上调了22种脂代谢相关基因的表达,同时上调了miR-16、miR-126、miR-122及下调了miR-27b的表达,这与之前在人和鼠中的研究结果一致。从上文及后续的研究中还可以看出miRNAs可通过影响其靶基因,靶基因再进一步调节下游的脂代谢标志基因表达进而调控机体的脂代谢过程,而且在miRNAs作用的直接靶基因中,多为在机体中起关键作用的转录因子,如过氧化物酶体增殖物激活受体γ、SREBP-1c、CCAAT盒增强子结合蛋白等[17-20]。这在哺乳动物的研究中也有类似的发现,如PPARγ、C/EBPα是miR-27a/b的直接靶基因,miR-27a/b通过调节这些转录因子来参与调节哺乳动物脂肪细胞(肝脏)内的脂滴形成或代谢过程[21-22]。研究还发现miRNAs也可以调控它自身或者长链非编码RNA的表达[23-25],如在HepG2细胞系中miR-370可通过调节miR-122的表达,进一步提高肝脏内转录因子SREBP-1c、关键生脂酶基因如二酰甘油脂酰转移酶、脂肪酸合酶、乙酰辅酶A羧化酶1的表达,调控肝脏甘油三酯的合成过程[25]。 miRNAs还可以直接调节关键基因的表达,如在HepG2细胞系中miR-370可以通过直接下调肉毒碱棕榈酰转移酶1α表达,使肝脏中脂肪酸β氧化能力降低,造成脂质蓄积[25]。可见miRNAs通过和其靶分子形成一个精密、复杂的调控网络,在转录后水平实现对生物机体精细的调控。
2.1.2 miRNAs在鱼类糖代谢中的研究
Mennigen等[26]在虹鳟肝脏中预测了摄食后miRNAs调控胰岛素通路的作用机制,研究将试验鱼禁食48 h后,饲喂商品饲料,分别在饲喂0、2、4、8、12、16、24 h时取样,检测了相关miRNAs、胰岛素通路中关键分子、糖异生作用相关基因、生脂基因、脂肪分解基因的表达量,发现omy-miR-33和omy-miR-122b在饲喂4 h后表达量瞬时增加,肝脏胰岛素信号途径的关键分子和SREBP-1c、FAS等生脂基因在饲喂4 h后表达量也瞬时增加,但CPT1a和CPT1b等脂肪分解基因在饲喂4 h后表达量瞬时下降,推测这些miRNAs可能参与调节虹鳟摄食后胰岛素通路和糖脂类的代谢过程,有研究证明,omy-miR-33和omy-miR-122b的同源基因在哺乳动物脂代谢紊乱模型中具有潜在的生脂作用和激活胰岛素通路的作用[27-29],这也提示miR-33、miR-122b等miRNAs在糖脂代谢中的作用在一些鱼类和哺乳动物中可能是保守的。Mennigen等[30]在虹鳟中研究了胰岛素和营养素共同作用对肝脏omy-miR-122b和脂肪生成基因FAS的调控作用,发现体外胰岛素诱导肝细胞后omy-miR-122b和FAS表达量显著增高;体内腹腔注射胰岛素,omy-miR-122b和FAS表达量也显著增高。通过调节糖/蛋白质或脂肪/蛋白质的比率,发现对omy-miR-122b的表达无影响,但FAS在低糖/高蛋白质时表达增加;增加脂肪/蛋白质比率,omy-miR-122b、FAS表达均受到抑制。结果表明在体内外胰岛素诱导作用下,omy-miR-122b表达量均增高,证实了omy-miR-122b参与了胰岛素信号途径,omy-miR-122b的激活可能依赖于胰岛素,胰岛素信号通路也可能依赖于omy-miR-122b的调控。有研究指出,在哺乳动物中FAS是miR-122的间接靶基因[28],Mennigen等[31]在虹鳟中注射miR-122的抑制剂发现摄食后血糖含量显著增加,并且减少肝FAS蛋白质丰度,但miR-122与FAS究竟是如何相互作用从而调节代谢的作用机制尚不清楚。
2.2 miRNAs参与鱼类的生长发育
2.2.1 miRNAs参与鱼类生长
研究显示miRNAs参与了鱼类的肌肉生长过程。Huang等[32]报道,尼罗罗非鱼(Oreochromisniloticus)快速生长品系和慢速生长品系的骨骼肌中存在显著性差异表达的miRNAs,表明miRNAs可作为水产养殖业中选择性育种的分子标记。研究还表明,在尼罗罗非鱼骨骼肌发育的过程中4个miRNAs(miR-1、miR-133a、miR-27a和miR-206)存在差异表达,且可负调节各自靶基因HDAC4、SRF、Pax 3 和 Pax 7的表达变化[33]。Yan等[34]通过比较鲤不同发育阶段的骨骼肌,发现miR-1、miR-21、miR-133a-3p和miR-206的表达水平会随着年龄的增加而增加。Yi 等[35]在团头鲂(Megalobramaamblycephala)中鉴定了27种和生长相关的miRNA,包括miR-23b、miR-92和miR-462等,研究还显示miRNAs对组织的再生有作用。
2.2.2 miRNAs参与鱼类发育
Fu等[3]利用Solexa高通量测序技术对处于变态时期的褐牙鲆(Paralichthysolivaceus)miRNAs进行测序,在褐牙鲆的2个变态发育阶段(17 d和29 d孵化)鉴别出了66种差异表达的miRNAs,说明miRNAs在褐牙鲆的变态时期可能发挥着关键作用。江守文[36]构建了日本的文昌鱼(Branchiostomalanceolatum)miRNAs文库,并筛选出9个雌雄差异表达的miRNAs,利用原位杂交试验验证了miR-29等4个miRNAs在文昌鱼雌雄性腺中的差异表达,研究结果将有助于研究性腺发育的分子机制。miRNAs参与了大脑的发育和不同区域的功能发挥[4],有研究显示缺失miR-7能导致中脑大小减少但不影响端脑[37]。在尼罗罗非鱼中的研究发现miR-203b与成肌分化抗原呈负相关关系,抑制miR-203b可显著增加成肌分化抗原的表达从而激活成肌分化抗原的下游基因,调控肌肉的发育[38]。miR-218a与影响心内膜细胞分化和瓣膜组织形成的转录因子T-box转录因子-5相互作用调控斑马鱼的心脏发育,下调miR-218可以恢复由T-box转录因子-5过表达导致的心脏缺陷,进而证明了miR-218在心脏发育中是T-box转录因子-5的关键调节者[39];Lalwani等[40]采用敲除和超表达技术分析表明miR-142-3p和靶标钙黏蛋白5共同影响血管的完整性、重构和血管生成。miR-140在斑马鱼软骨组织中特异性表达,并可通过转录调节性别决定区Y框蛋白9在软骨发育中发挥重要作用[41]。Runt相关转录因子2是一个转录因子也可调节成骨细胞分化,Huang等[42]在成肌细胞系中的研究表明miR-204/miR-211可直接负调控Runt相关转录因子2的表达,进而抑制间充质干细胞和骨髓间充质干细胞向破骨细胞的生成和促进向脂肪细胞的生成,表明miRNAs参与骨骼和软骨的形成。
2.3 miRNAs参与鱼类免疫和疾病防御
miRNAs在鱼类免疫方面也有研究。Li等[43]采用Solexa高通量测序技术在鲤脾脏中鉴别出123个保守miRNAs和71个新miRNAs分子,并确定了其中12个新miRNAs在鲤脾脏中表达,进一步采用GO富集和KEGG pathway对56种高度保守的miRNAs进行了靶基因预测和潜在功能的分析,发现miRNAs与免疫调控和免疫应答之间存在密切关系。Tang等[5]在尼罗罗非鱼稚鱼的研究中发现,维生素E缺乏会降低超氧化物歧化酶的活性,并降低miR-223、miR-146a、miR-16和miR-122的表达;而过量的维生素E也会降低超氧化物歧化酶的活性,提高8个miRNAs (miR-21、miR-223、miR-146a、miR-125b、miR-181a、miR-16、miR-155、miR-122)的表达水平。Li等[44]发现微囊藻 (Microcystaceae) 毒素可以影响斑马鱼肝脏中4个miRNAs(dre-miR-21、dre-miR-122、dre-miR-27b、dre-miR-148)转录水平的表达,以及细胞色素P450 CYP1A1和CYP3A65和它们的受体芳香烃受体、孕烷X受体的表达。在草鱼CIK细胞中超表达cid-miRn-115或miR-142a-3发现,二者均可通过直接下调Toll样受体5进而抑制其下游靶基因白介素-1β, 白介素-8和肿瘤坏死因子α的表达,参与机体免疫活动[45]。综上所述,miRNAs在鱼类免疫和疾病防御方面具有重要作用。
2.4 miRNAs参与鱼类繁殖
研究显示,miRNAs参与鱼类卵子、精子的形成以及性成熟过程。在大西洋庸鲽(Hippoglossushippoglossus)成鱼精巢中let-7a、miR-143和miR-202-3p的表达量比成鱼卵巢的表达量显著升高[7]。Xiao等[46]采用Solexa小RNA深度测序技术发现尼罗罗非鱼性成熟雌鱼的miR-129-3p和miR-727-3p的表达量显著高于性成熟雄鱼,而miR-132a和miR-212的表达与之相反。Juanchich等[47]在虹鳟卵巢发育过程中确定了13个差异表达的miRNAs,并且观察到在卵子发生的各个阶段中至少有1种差异表达的miRNAs。Wang等[48]在尼罗罗非鱼中发现miR-17-5p和miR-20a可以通过抑制DM 结构域转录因子1表达,然后促进芳香化酶基因的转录诱导雌激素的产生;miR-138、miR-338和 miR-200a这3个miRNAs可以负调控细胞色素P450c17A2,而CYP17A2的表达产物P450C17-Ⅱ参与了17α,20β二羟基-4-pregnen-3-酮的生物合成,在罗非鱼精原细胞增殖和精子发生中是至关重要的[49]。
2.5 miRNAs与鱼类组织再生
在斑马鱼心脏摘除7 d后,发现心脏再生过程中有10个miRNAs上调,8个miRNAs下调;作者对其中的miR-133进一步研究发现它的靶标是单极纺锤体蛋白激酶1和连接蛋白43,它们对于心肌细胞的再生必不可少[50]。以往的研究已发现miR-133在骨骼肌增殖中也有调控作用[51],研究发现庆大霉素引起肾损伤后诱导了miR-21的表达上调,miR-21敲除后使鱼类肾脏的再生延迟,细胞死亡增加,其可能通过下游的候选基因如胰岛素样生长因子结合蛋白-3等介导细胞增殖和凋亡作用[52]。
2.6 miRNAs在鱼类内分泌中的作用
Plaisance等[53]报道了miR-9具有调控胰岛素分泌细胞的分泌功能,其试验显示转录因子oneout-2的靶基因为Granuphilin,沉默Onecut-2能增加Granuphilin的表达水平,Granuphilin的表达与胰岛素的分泌有关,并且它们受miR-9的调节以保持在适量的水平。
2.7 miRNAs与环境应激
研究显示,维生素E可以缓解由活性氧而引起的氧化应激反应,在尼罗罗非鱼的饲料中添加不同水平的维生素E (0、50、2500 mg/kg),结果显示,与对照组相比,维生素E缺乏组中miR-16、miR-122、miR-146a 和 miR-223 的表达减少;维生素E丰富组中miR-16、miR-21、miR-122、miR-125b、miR-146a、miR-155、miR-181a 和 miR-223 的表达增加[5];Yu 等[54]在miR-144/451缺失的红细胞中,氧化剂应激导致斑马鱼胚胎贫血症状增强,提示miR-451有抗氧化活性。真白鲑(Coregonuslavaretus)暴露于微囊藻毒素显著改变其肝脏中6种miRNA的表达,并表现出时间依赖性效应[55]。在斑马鱼发育过程中,暴露于其他化学物质如2,3,7,8-四氯二苯并-对-二噁英和全氟辛烷磺酰基化合物也可改变其miRNAs的表达。2,3,7,8-四氯二苯并-对-二噁英可调节 miR-451、miR-23a、miR-23b、miR-24和miR-27e的表达,而它们是对于造血和心血管发育至关重要的miRNAs[56-57]。上述研究表明miRNA的表达受到不同环境逆境因子的影响,但这种调节的机制和其带来的结果还有待进一步阐明。
3 展 望
目前,miRNAs在鱼类中的研究尚不够深入,在鱼类的生长、发育以及很多的生理活动中的具体功能还没有被阐释,其进一步的作用机理也没有阐明。但由于miRNAs自身的调节特点及其潜在的应用价值,miRNAs的功能研究必将成为鱼类很多领域的研究热点。如在鱼类营养学研究领域有很多亟待解决的问题:(1)鱼类miRNAs对糖脂代谢及其相关靶点的作用形式单一,是否与哺乳动物类似,是否存在其他的作用形式?(2)现发现的miRNAs对糖脂代谢的作用靶点也比较零散,miRNAs分子之间是否存在广泛作用?miRNAs对糖脂代谢的调控通路及作用靶点之间、miRNAs之间的关联尚待解决。(3)miRNAs在糖脂代谢的实际应用还有待于进一步拓展。随着研究的深入,全面了解和证明miRNAs在鱼类中的作用和分子机制将为重新认识鱼类miRNAs的功能研究提供新的视角。
[1] Bartel D P, Chen C Z. Micromanagers of gene expression: the potentially widespread influence of metazoan microRNAs [J]. Nature Reviews Genetics, 2004, 5(5):396-400.
[2] Carrington J C, Ambros V. Role of microRNAs in plant and animal development [J]. Science, 2003, 301(5631):336-338.
[3] Fu Y, Shi Z, Wu M, et al.Identification and differentia1 expression of microRNAs during metamorphosis of the Japanese flounder (Paralichthysolivaceus)[J]. PLos One, 2011, 6(7):e22957.
[4] Bizuayehu T T, Babiak I. MicroRNA in teleost fish [J]. Genome Biology and Evolution, 2014, 6(8):1911-1937.
[5] Tang X L, Xu M J, Li Z H, et al. Effects of vitamin E on expressions of eight microRNAs in the liver of Nile tilapia (Oreochromisniloticus)[J]. Fish & Shellfish Immunology, 2013, 34(6):1470-1475.
[6] 唐雪莲,李洪,付京花. 鱼类microRNAs研究进展[J]. 水产科学,2013,32(1):55-58.
[7] Bizuayehu T T, Babiak J, Norberg B, et al. Sex- biased miRNA expression in Atlantic halibut (Hippoglossushippoglossus) brain and gonads[J]. Sexual Development, 2012,6(5):257-266.
[8] Zhang Q H, Xie D Z, Wang S Q, et al. miR-17 is involved in the regulation of LC-PUFA biosynthesis in vertebrates:effects on liver expression of a fatty acyl desaturase in the marine teleostSiganuscanaliculatus[J]. Biochimica et Biophysica Acta, 2014, 1841(7):934-943.
[9] Berezikov E, Guryev V, van de Belt J, et al. Phylogenetic shadowing and computational identification of human microRNA genes[J]. Cell, 2005, 120(1):21-24.
[10] Lee R C, Feinbaum R L, Ambros V. TheC.elegansheterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14[J]. Cell, 1993, 75(5):843-854.
[11] Chen P Y, Manninga H, Slanchev K, et al. The developmental miRNA profiles of zebrafish as determined by small RNA cloning[J]. Genes Development, 2005, 19(11):1288-1293.
[12] Salem M, Xiao C, Womack J, et al. A microRNA repertoire for functional genome research in rainbow trout (Oncorhynchusmykiss)[J]. Mar Biotechnol (NY), 2010, 12(4):410-429.
[13] Chi W, Tong C, Gan X, et al. Characterization and comparative profiling of MiRNA transcriptomes in bighead carp and silver carp[J]. PLoS One, 2011, 6(8):e23549.
[14] Yang L D, He S P. A bioinformatics-based update on microRNAs and their targets in rainbow trout (Oncorhynchusmykiss)[J]. Gene, 2014, 533(1):261-269.
[15] 孙君君, 卢荣华, 杨峰,等. 草鱼SREBP-1基因的克隆及糖对其在肝脏中表达的影响[J]. 水产学报, 2014, 38(8):1057-1067.
[16] Her G M, Hsu C C, Hong J R, et al. Overexpression of gankyrin induces liver steatosis in zebrafish (Daniorerio)[J]. Biochimica et Biophysica Acta, 2011, 1811(9):536-548.
[17] Horton J D, Goldstein J L, Brown M S. SREBPs:Activators of the complete program cholesterol and fatty acid synthesis in the liver[J]. Journal of Clinical Investigation, 2002, 109(9):1125-1131.
[18] Shao W, Espenshade P J. Expanding roles for SREBP in metabolism [J]. Cell Metab, 2012, 16(4):414-419.
[19] Linhart H G, Ishimura-Oka K, Demayo F, et al. C/EBPα is required for differentiation of white, but not brown, adipose tissue [J]. Proc Natl Acad Sci U S A, 2001, 98(22):12532-12537.
[20] Tanaka T, Yoshida N, Kishimoto T, et al. Defective adipocyte differentiation in mice lacking the C/EBPbeta and/or C/EBPdelta gene[J]. EMBO J, 1997,16 (24):7432-7443.
[21] Wang T, Li M, Guan J, et al. MicroRNAs miR-27a and miR-143 regulate porcine adipocyte lipid metabolism[J]. International Journal of Molecular Sciences, 2011, 12(11):7950-7959.
[22] Kida K, Nakajima M, Mohri T, et al. PPARalpha is regulated by miR-21 and miR-27b in human liver[J]. Pharmaceutical Research, 2011, 28(10):2467-2476.
[23] Zisoulis D G, Kai Z S, Chang K R, et al. Autoregulation of microRNA biogenesis by let-7 and Argonaute[J]. Nature, 2012, 486(7404):541-544.
[24] Hansen T B, Wiklund E B, Bramsen J B, et al. miRNA-dependent gene silencing involving Ago2-mediated cleavage of a circular antisense RNA[J].EMBO Journal,2011,30(2):4414-4422.
[25] Iliopoulos D, Drosatos K, Hiyama Y, et al. MicroRNA-370 controls the expression of microRNA-122 and Cpt1alpha and affects lipid metabolism[J]. Journal of Lipid Research, 2010,51(6):1513-1523.
[26] Mennigen J A, Panserat S, Larquier M, et al. Postprandial regulation of hepatic MicroRNAs predicted to target the insulin pathway in rainbow trout[J]. PLoS One, 2012, 7(6):e38604.
[27] Davalos A, Goedeke L, Smibert P, et al. miR-33a/b contribute to the regulation of fatty acid metabolism and insulin signaling[J]. Proc Natl Acad Sci U S A, 2011, 108(22):9232-9237.
[28] Esau C, Davis S, Murray S F, et al. miR-122 regulation of lipid metabolism revealed by in vivo antisense targeting[J]. Cell Metabolism, 2006, 3(2):87-98.
[29] Rayner K J, Suarez Y, Davalos A, et al. MiR-33 contributes to the regulation of cholesterol homeostasis[J]. Science, 2011, 328(5985):1570-1573.
[30] Mennigen J A, Plagnes-juan E, Figueredo-silva C A, et al. Acute endocrine and nutritional co-regulation of the hepatic omy-miRNA-122b and the lipogenic gene fas in rainbow trout,Oncorhynchusmykiss[J]. Comp Biochem Physiol B Biochem Mol Biol, 2014, 169(3):16-24.
[31] Mennigen J A, Martyniuk C J, Seiliez I, et al. Metabolic consequences of microRNA-122 inhibition in rainbow trout,Oncorhynchusmykiss[J]. BMC Genomics,2014,15(1):70.
[32] Huang C W, Li Y H, Hu S Y, et al. Differential expression patterns of growth-related microRNAs in the skeletal muscle of Nile tilapia (Oreochromisniloticus)[J].Journal of Animal Science, 2012, 90(12):4266-4279.
[33] Yan B, Guo J T, Zhao L H, et al. microRNA expression signature in skeletal muscle of Nile tilapia[J]. Aquaculture, 2012(364/365):240-246.
[34] Yan X C, Ding L, Li Y C, et al. Identification and profiling of microRNAs from skeletal muscle of the common carp[J]. PLoS One, 2012, 7(1):e30925.
[35] Yi S, Gao Z X, Zhao H, et al. Identification and characterization of microRNAs involved in growth of blunt snout bream (Megalobramaamblycephala) by Solexa sequencing[J]. BMC Genomics, 2013, 14(1):754.
[36] 江守文. 日本文昌鱼性别差异miRNA的筛选与功能鉴定[D].上海:上海海洋大学,2012.
[37] Memczak S, Jens M, Elefsinioti A, et al. Circular RNAs are a large class of animal RNAs with regulatory potency[J]. Nature, 2013, 495 (7441):333-338.
[38] Yan B, Guo J T, Zhu C D, et al. miR-203b:a novel regulator of MyoD expression in tilapia skeletal muscle[J]. Journal of Experimental Biology, 2013, 216(3):447-451.
[39] Chiavacci E, Dolfi L, Verduci L, et al. MicroRNA-218 mediates the effects of Tbx5a over-expression on zebrafish heart development[J]. PLoS One, 2012, 7(11):e50536.
[40] Lalwani M K, Sharma M, Singh A R, et al. Reverse genetics screen in zebrafish identifies a role of miR-142a-3p in vascular development and integrity[J]. PLoS One, 2012, 7(12):e52588.
[41] Nakamura Y, He X, Kato H, et al. Sox9 is upstream of microRNA -140 in cartilage[J]. Applied Biochemistry and Biotechnology, 2012, 166(1):64-71.
[42] Huang J, Zhao L, Xing L, et al. MicroRNA-204 regulates Runx2 protein expression and mesenchymal progenitor cell differentiation[J]. Stem Cells, 2010, 28(2):357-364.
[43] Li G X, Zhao Y L, Wen L, et al. Identification and characterization of MicroRNAs in the spleen of common carp immune organ[J]. Journal of Cellular Biochemistry, 2014, 115(10):1768-1778.
[44] Li X Y, Ma J G, Fang Q, et al. Transcription alterations of microRNAs, cytochrome P4501A1 and 3A65, and AhR and PXR in the liver of zebrafish exposed to crude microcystins[J]. Toxicon, 2013(73):17-22.
[45] Xu X Y, Shen Y B, Fu J J, et al. MicroRNA-induced negative regulation of TLR-5 in grass carp,Ctenopharyngodonidella[J]. Sci Rep, 2016(6):18595.
[46] Xiao J, Zhong H, Zhou Y, et al. Identification and characterization of microRNAs in ovary and testis of Nile tilapia (Oreochromisniloticus) by using solexa sequencing technology[J]. PLoS One, 2014, 9(1):e86821.
[47] Juanchich A, Le C A, Montfort J, et al. Identification of differentially expressed miRNAs and their potential targets during fish ovarian development[J]. Biology of Reproduction, 2013, 88(5):1-11.
[48] Wang W, Liu W, Liu Q, et al. Coordinated microRNA and messenger RNA expression profiles for understanding sexual dimorphism of gonads and the potential roles of microRNA in the steroidogenesis pathway in Nile tilapia (Oreochromisniloticus)[J].Theriogenology,2016,85(5):970-978.
[49] Eshel O, Shirak A, Dor L, et al. Identification of male-specific amh duplication, sexually differentially expressed genes and microRNAs at early embryonic development of Nile tilapia (Oreochromisniloticus)[J]. BMC Genomics, 2014, 15(1):774.
[50] Yin V P, Lepilina A, Smith A, et al. Regulation of zebrafish heart regeneration by miR-133[J]. Developmental Biology, 2012, 365(2):319-327.
[51] Chen J F, Mandel E M, Thomson J M, et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nature Genetics, 2006, 38(2):228-233.
[52] Hoppe B, Pietsch S, Franke M, et al. MiR-21 is required for efficient kidney regeneration in fish[J]. BMC Dev Biol, 2015,15(1):1-10.
[53] Plaisance V, Abderrahmani A, Perret-Menoud V J, et al. MicroRNA-9 controls the expression of granuphilin/Slp4 and the secretory response of insulin-producing cells[J]. Journal of Biological Chemistry, 2006, 281(37):26932-26942.
[54] Yu D, Dos Santos C O, Zhao G, et al. miR-451 protects against erythroid oxidant stress by repressing 14-3-3 zeta [J]. Genes & Development, 2010, 24(15):1620-1633.
[55] Brzuzan P, Wožny M, Wolińska L, et al. Expression profiling in vivo demonstrates rapid changes in liver microRNA levels of whitefish (Coregonuslavaretus) following microcystin-LR exposure[J]. Aquatic Toxicology, 2012(122/123):188-196.
[56] Jenny M J, Aluru N, Hahn M E. Effects of short-term exposure to 2,3,7,8- tetrachlorodibenzo-p-dioxin on microRNA expression in zebrafish embryos[J]. Toxicology and Applied Pharmacology, 2012, 264(2):262-273.
[57] Zhang L, Li Y Y, Zeng H C, et al. MicroRNA expression changes during zebrafish development induced by perfluorooctane sulfonate[J]. Journal of Applied Toxicology, 2011,31(3):210-222.
CurrentResearchProgressinFishmiRNAs
LU Ronghua1,2, WANG Junli3, SUN Junjun3, YANG Feng1,2, XIE Dizhi1,2, TIAN Xue1,2, NIE Guoxing1,2
( 1.College of Fisheries, Henan Normal University, Xinxiang 453007, China; 2. Engineering Technology Research Center of Henan Province for Aquatic Animal Cultivation, Xinxiang 453007, China; 3. College of Life Sciences, Henan Normal University, Xinxiang 453007, China )
fish; miRNAs; function; research progress
10.16378/j.cnki.1003-1111.2017.02.022
2016-04-14;
2016-07-29.
国家自然科学基金资助项目(31372545, 31402311);河南省高校科技创新团队支持计划项目(14IRTSTHN013);河南省基础与前沿技术研究项目(142300410158);河南省高等学校重点科研项目(13A240548);河南省教育厅科学技术研究项目(14B24005).
卢荣华(1977-),女,副教授;研究方向:鱼类糖脂代谢调控机理.E-mail: laoaiyika@hotmail.com.通讯作者: 聂国兴(1971-),男,教授;研究方向:饲用酶制剂菌株选育及酶学性质、鱼类营养素转运生理学.E-mail: niegx@htu.cn.
S917
C
1003-1111(2017)02-0231-06
