某奶牛场乳房炎病原菌的分离鉴定及耐药性分析
2017-12-15李新圃罗金印刘龙海张亚茹李宏胜
王 丹,杨 峰,李新圃,罗金印,刘龙海,张 哲,2,张亚茹,2,李宏胜*
(1.中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃 兰州 730050;2.甘肃农业大学动物医学院,甘肃兰州 730070)
兽医临床
某奶牛场乳房炎病原菌的分离鉴定及耐药性分析
王 丹1,杨 峰1,李新圃1,罗金印1,刘龙海1,张 哲1,2,张亚茹1,2,李宏胜1*
(1.中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室,甘肃省新兽药工程重点实验室,甘肃 兰州 730050;2.甘肃农业大学动物医学院,甘肃兰州 730070)
为监测甘肃临洮某奶牛场奶牛乳房炎主要致病菌对临床常用治疗药物的耐药情况,指导临床合理用药。从奶牛场采集了45份临床型奶牛乳房炎病样,进行培养分离,并采用16S rDNA对分离纯化的细菌进行鉴定;对主要病原菌,采用牛津杯法测定其对乳房炎常用治疗药物的耐药情况。结果表明,从45份乳房炎奶样中,共分离出以大肠埃希菌和金黄色葡萄球菌为主的7种乳房炎致病菌。耐药性试验表明,金黄色葡萄球菌对无抗头孢、头孢力定、青霉素G钾、强力乳净、乳痈治、乳痈快克、炎乳康、乳肿康和硫酸庆大极其敏感;大肠埃希菌对头孢力定、青霉素G钾、强力乳净、乳痈快克、炎乳康、乳肿康和硫酸庆大极其敏感。金黄色葡萄球菌对强力乳康、无抗乳炎康、乳炎康、十味乳炎清、无抗乳肿消、获特键和强力宫康Ⅱ号耐药作用较强。大肠埃希菌对强力乳康、无抗乳肿消、乳房肿炎立消、获特键和强力宫康Ⅱ号耐药作用较强。研究结果为该奶牛场乳房炎的防治提供了参考。
奶牛乳房炎;金黄色葡萄球菌;大肠埃希菌;药物敏感性
奶牛乳房炎是奶牛乳房受到物理、化学、微生物等致病因子的刺激所发生的一种炎症,不仅可导致产奶量和乳品质的下降,严重时甚至可使奶牛泌乳机能丧失,使患牛淘汰,给奶牛养殖业造成巨大的经济损失[1]。经调查,目前全世界约有1/3的奶牛患有各种类型的乳房炎,每年造成的损失高达350亿美元,仅美国就高达30亿美元[2]。我国平均每年损失1.35亿人民币[3],日本平均每年每头患病奶牛损失5万日元,丹麦、美国和加拿大平均每年每头奶牛乳房炎奶牛损失200美元~300美元[4]。国内外研究学者表明,引起奶牛乳房炎的病因复杂,但主要是病原菌感染所引起,最常见的病原菌有20余种,其中以葡萄球菌和肠杆菌为主,葡萄球菌占7.87%~83.3%,其中金黄色葡萄球菌占2.24%~83.3%,肠杆菌占5.62%~32.14%,其中大肠埃希菌占2.25%~32.14%[5-6]。
目前,国内外治疗奶牛乳房炎的方法有多种,分为全身治疗、乳头灌注治疗和药膏直接涂抹乳房治疗等[7-8]。常用的药物有抗生素、中药等,或中西药结合来治疗奶牛乳房炎[9]。奶牛乳房炎的治疗最主要是使用抗生素,但大部分奶牛场都是在不明确病原菌及抗生素耐药性的情况下大量反复的使用,造成乳汁中抗生素的大量残留,不断出现耐药菌株,使治疗效果下降[10]。因此,为了准确选取敏感药物用于奶牛乳房炎的治疗,非常有必要对奶牛乳房炎主要致病菌金黄色葡萄球菌和大肠埃希菌进行药物敏感性的测定,为我国临床奶牛乳房炎提供治疗选择。
1 材料与方法
1.1 材料
1.1.1 主要仪器、药物和试剂 PCR扩增仪(SEDI-G)为Wealtec公司产品;凝胶成像仪(c150)为Azure Biosystems公司产品;显微镜(Nikon, E200)、电泳仪(DYY-6C)为北京六一仪器公司产品;培养箱( GHP-9050)为上海一恒科学仪器有限公司产品;16S rDNA PCR试剂盒DNA Marker DL 1 000为TaKaRa公司产品;细菌DNA提取试剂盒为OMEUA公司产品;营养肉汤和血琼脂营养基础为广东环凯生物科技有限公司产品;水解酪蛋白琼脂(MH)为杭州微生物试剂有限公司产品;血平板为广州市迪景微生物科技有限公司产品。
无抗头孢和抗乳必治为哈尔滨文明兽药厂产品;头孢力定为广州天王动物保健品有限公司产品;青霉素G钾为哈尔滨生物制品二厂有限责任公司产品;消炎无痕为四川维尔康动物药业有限公司产品;强力乳康和抗乳肿消为西乡长江动物药品有限责任公司产品;强力乳净、无抗乳炎康、乳痈、获特键为北京华盛药业有限公司产品;乳炎康为新乡市华畜商贸有限公司产品;十味乳炎清为江西一领药业有限公司产品;无乳痈快克为河南官渡兽药制造有限公司产品;炎乳康和硫酸庆大为黑龙江省北安市飞龙动物药厂产品;乳肿康为山西芮城亚宝兽药有限公司产品;乳房肿炎立消和宫乳霸为郑州黑白花生物科技有限公司产品;强力宫康Ⅱ号为北京华泰源动物药业有限公司产品。
1.2 方法
1.2.1 乳样采集 临床型乳房炎奶样采自临洮某奶牛场。用温水清洗患病乳区,酒精棉消毒乳头,弃去头2把乳,挤取适量乳汁在灭菌试管中,远途乳样挤在琼脂斜面上,并做好标记。采集乳样需冷藏保存,并尽快进行细菌分离。
1.2.2 细菌分离 挑取均匀乳样(或琼脂斜面上的菌落)划分在血平面上,同时接种增菌肉汤一管,37℃孵育18 h~20 h。从血平面上挑选单个菌落,接种到增菌肉汤中,37℃孵育18 h~20 h。进行载玻片涂片、革兰染色、显微镜观察,已分离纯化的细菌可进入细菌鉴定程序,未分离纯化的细菌需重新进行血平面划分,直至细菌分离纯化方可进入细菌鉴定程序。若血平面上未长菌,而相应的增菌肉汤管长菌,则挑取肉汤管中的细菌培养物进行血平面划分、纯化。分离纯化菌株可以加入到脱脂乳中冷冻保存。
1.2.3 16S rDNA鉴定 采用OMEGA提取试剂盒提取细菌DNA,并以此作为DNA模板,使用16S rDNA PCR试剂盒对DNA模板进行PCR扩增。对扩增产物进行10 g/L琼脂糖凝胶电泳和凝胶成像,将符合测序标准的PCR产物纯化,并送北京六合华大基因科技股份有限公司进行基因测序。使用PubMed数据库,对所测得序列片段进行在线Blast,搜索比对,确定细菌种属。
1.2.4 药敏试验 从血斜面分别挑取各试验菌株1~2铂耳圈接种于营养肉汤中,37℃培养18 h~20 h,经涂片镜检纯粹后,用生理盐水稀释1 000倍,用棉棒蘸取菌液均匀涂布到MH平板上,在平板中央放置一个牛津杯,周边等距离放置4个牛津杯,将药液(按照说明书推荐剂量配制)加到牛津杯中,每个加200 μL,然后置37℃温箱中培养18 h~20 h,用游标卡尺测量抑菌圈直径,每种药物平行测3次,取平均值。
1.2.5 判断标准 按药理试验方法学记载的牛津杯法检测计算37℃培养18 h的各药抑菌圈直径均值。抑菌效果判定标准按《中药药理学》标准:d≥20 mm为极其敏感;15 mm≤d<20 mm为高度敏感;10 mm≤d<15 mm为中度敏感;d<10 mm为耐药(不敏感)[11]。
2 结果
2.1 16S rDNA鉴定结果
使用试剂盒提供的forward primer/reverse primer引物,PCR扩增获得500 bp~ 600 bp之间的DNA片段(图1),测序结果通过BLAST搜索比对,序列对比结果见表1。
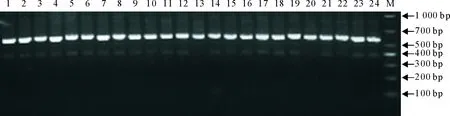
M.DNA标准DL1 000;1~24.待检菌株M.DNA Marker DL 2 000; 1-24.Strains to be tested
2.2 临床常用乳房炎治疗药物耐药性检测结果
从表2中可以看出,金黄色葡萄球菌对大部分临床常用的乳房炎药物比较敏感,对其有较强抑菌作用的药物主要有无抗头孢、头孢力定、青霉素G钾、强力乳净、乳痈治、乳痈快克、炎乳康、乳肿康和硫酸庆大。有较强耐药的药物主要有强力乳康、无抗乳炎康、乳炎康、十味乳炎清、无抗乳肿消、获特键和强力宫康Ⅱ号,表现为完全耐药。大肠埃希菌对临床常用的乳房炎药物的敏感性低于金黄色葡萄球菌,对其有较强抑菌作用的药物主要有头孢力定、青霉素G钾、强力乳净、乳痈快克、炎乳康、乳肿康和硫酸庆大。表现为完全耐药的药物主要有强力乳康、无抗乳肿消、乳房肿炎立消、获特键和强力宫康Ⅱ号。对无抗乳肿消、乳炎康、十味乳炎清和宫乳霸具有一定的耐药性。

表1 奶牛临床型乳房炎主要病原菌分离和鉴定结果
3 讨论
本试验采集的45份乳房炎奶牛乳样均分离出了病原菌,病原菌的检出率为100%。在采集的45份奶样中,混合感染的有7份,占所有奶样的15.56%。在分离出的52株病原菌中,有17株大肠埃希菌,占总分离株的32.69%,检出率明显高于其他多数报道[12-14]。这可能是由于大肠埃希菌为环境致病菌,该牛场饲养环境较差引起的。
金黄色葡萄球菌的检出率仅次于大肠埃希菌,占总分离株的23.08%,金黄色葡萄球菌属传染性细菌,主要在挤奶过程中传播,牛体遭其感染后即成为传染源,即使本身不发病也可病原菌传染给其他牛导致其他牛发病。本试验采集的奶样中还检出了益生菌乳酸乳球菌,检出率为7.96%,益生菌虽然能够抑制一些病原菌的生长,但是李新圃等[15]研究认为益生菌进入乳房成为条件性致病菌后能引起奶牛乳房炎。粪肠球菌和屎肠球菌的检出率分别为15.38%和13.46%,粪肠球菌和屎肠球菌属乳酸菌,常作为条件性致病菌进行研究[16]。本试验细菌分离结果提示该奶牛场需进一步加强饲养环境管理,挤奶过程中严把卫生关,彻底消毒,减少病原菌感染。

表2 病原菌对临床常用药物的耐药性
药敏试验结果发现,本试验分离的金黄色葡萄球菌和大肠埃希菌对临床常用药物头孢力定、青霉素G钾、强力乳净、乳痈快克、炎乳康、乳肿康和硫酸庆大都极其敏感,除此之外,金黄色葡萄球菌还对无抗头孢和乳痈治极其敏感性,这些药物可作为该牛场治疗金黄色葡萄球菌和大肠埃希菌性乳房炎的首选药物。但是金黄色葡萄球菌和大肠埃希菌也对临床常用药物产生了不同程度的耐药性,如对强力乳康、无抗乳肿消、获特键和强力宫康Ⅱ号均完全耐药;大肠埃希菌还对乳房肿炎立消也完全耐药,金黄色葡萄球菌对无抗乳炎康、乳炎康和十味乳炎消也完全耐药。如此高的多重耐药性与我国奶牛场长期反复大量不按规定使用这些药物有密切联系。有研究表明,细菌可通过质粒将耐药性从一种细菌传递给另一种细菌[17]。这些耐药菌株也可能在人与人之间传播,甚至可能出现“超级细菌”致使感染金黄色葡萄球菌和大肠埃希菌后无药治疗,给人类生命安全带来威胁。为了防止产生耐药菌株,应做到科学、规范、合理的选用临床药物来治疗奶牛乳房炎,并对使用药物进行定期的耐药性检测;交叉使用不同的药物,避免长期频繁的使用同一种药物;严格控制药物的剂量。
本试验选用的20种药物中,无抗头孢、头孢力定、抗乳必治、青霉素G钾和硫酸庆大属于西药抗生素;消炎无痕、强力乳康、无抗乳炎康、乳痈治、乳炎康、十味乳炎清、无抗乳肿消、乳痈治、炎立消、获特键和宫乳霸属于中药制剂;强力乳净、乳痈快克、乳肿康和强力宫康Ⅱ号属于中西药混合剂。从试验结果可看出,西药及中西药结合的药物敏感性试验结果优于纯中药制剂,但是,由于中药成分比较复杂,且对中药抑菌效果的研究多局限于体外,体内的研究较少,所以不能单纯的靠体外抑菌结果去评定中药在机体内抗感染能力。所以,奶牛乳房炎的治疗不能单一的依赖于抗生素等西药,有效的控制奶牛乳房炎的发生需要以预防为主,综合防治,且采用中药、生物制剂和疫苗结合的方案进行奶牛乳房炎有效防治[18]。
[1] 张立恩,王秀杰.奶牛乳房炎对奶牛养殖业的危害[J].农民致富之友,2016(6):258.
[2] 朱江巍,刘耀川,张雅为.奶牛乳房炎病原菌分离及药物敏感性试验[J].黑龙江畜牧兽医,2016 (4):111-113.
[3] 刘来钦.奶牛乳房炎及其防治[J].畜牧兽医科技信息,2016(9):67-68.
[4] 李宏胜,罗金印,王旭荣,等.我国奶牛乳房炎无乳链球菌抗生素耐药性研究[J].中兽医医药杂志,2012,31(6):5-7.
[5] 赵美盈.奶牛乳房炎致病菌的分离鉴定及药敏试验[J].养殖与饲料,2016(6):16-17.
[6] Osumi T,Kishimoto Y,Kano R,et al.Protothecazopfiigenotypes isolated from cow barns and bovine mastitis in Japan.[J].Vet Microbiol,2008,131(3-4):419-423.
[7] 刘志伟.乳房中药涂膜剂治疗奶牛乳房炎的效果试验[J].现代畜牧科技,2016(6):171-171.
[8] 张 颖,毛景东.奶牛乳房炎的治疗与预防[J].中国牛业科学,2016,42(2):88-90.
[9] 孔 娜.奶牛乳房炎的中西医结合治疗方法研究[J].河南农业科学,2015,44(3):144-147.
[10] 王海瑞,王旭荣,张景艳,等.甘肃省某奶牛场肠杆菌性乳房炎主要病原菌的分离鉴定与耐药性分析[J].动物医学进展,2016,37(5):63-68.
[11] 董淑珍,付志新,宋 瑜,等.六种中药提取物对金黄色葡萄球菌体外抑菌作用的比较[J] .动物医学进展,2010(8) :121-124.
[12] 王旭荣,李建喜,杨志强.2012年奶牛乳房炎防治技术研究进展[J].中国畜牧杂志,2013,49(24):35-40.
[13] 郭海军,周 斌.奶牛乳房炎病原菌的分离鉴定与主要致病菌耐药性分析[J].上海畜牧兽医通讯,2011(3):12-14.
[14] 王 娜,高学军.哈尔滨地区奶牛隐性乳房炎病原菌的分离鉴定[J].东北农业大学学报,2011,42(2):29-32.
[15] 李新圃,李宏胜,罗金印,等.奶牛乳房炎致病菌的分离鉴定及耐药性研究[J].动物医学进展,2015,36(11):36-39.
[16] 黄仁刚,杨兴祥,喻 华,等.肠球菌属血流感染92例临床及病原菌特点分析[J].中国感染与化疗杂志,2015,15(1):6-10.
[17] 赵红波,赵建宏,石 磊.质粒介导的耐药基因获得及转移研究进展[J].临床荟萃,2010,25 (11):1005-1007.
[18] 李宏胜,罗金印,李新圃,等.以疫苗预防为主的奶牛乳房炎综合防治措施应用效果观察[J].中国草食动物,2010,30(6):69-71.
Isolation,IdentificationandDrugResistanceAnalysisofPathogensfromaFarmofDairyCowwithMastitis
WANG Dan1,YANG Feng1,LI Xin-Pu1,LUO Jin-yin1,LIU Long-hai1,ZHANG Zhe1,2,ZHANG Ya-ru1,2, LI Hong-sheng1
(1.KeyLaboratoryofVeterinaryPharmaceuticalDiscovery,MinistryofAgriculture,KeyLaboratoryofNewAnimalDrugProjectofGansuProvince,LanzhouInstituteofAnimalHusbandryandPharmaceuticalSciences,ChineseAcademyofAgriculturalSciences,Lanzhou,Gansu,730050,China;2.CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou,Gansu,730070,China)
The aim of this study was to monitor the clinical drug resistance of the mastitis pathogens in Lintao,and to provide a foundation for clinical treatment.45 milk samples were collected from dairy cows with clinical mastitis for bacterial isolation and the main pathogens were identified using the method of 16S rDNA identification.The resistance of clinical drugs were detected by Oxford Cup method.The results showed that the main bacteria isolated from dairy cow mastitis cases wereE.coliandS.aureus.The drug sensitivity test indicated that theS.aureuswere extremely sensitive to ceftiofur,ampiallin sodium,benzylpenicillin potassium,Qianglirujing,Ruyongzhi,Ruyongkuaike,Yanrukang,gentamycin sulfate.E.coliwere extremely sensitive to ampiallin sodium,benzylpenicillin potassium,Qianglirujing,Ruyongkuaike,Yanrukang,gentamycin sulfate.S.aureuswere highly resistant to Qianglirukang,Wukangruyankang,Ruyankang,Shiweiruyanqing,Wukangruzhongxiao,Huotejian and QiangligongkangⅡ.E.coliwere highly resistant to Qianglirukang,Wukangruzhongxiao,Rufangzhongyanlixiao,Huotejian and QiangligongkangⅡ.The results were able to provide reliable foundation for prevention and control of dairy cow mastitis in Lintao.
dairy cow mastitis;S.aureus;E.coli; drug sensitivity
2017-03-08
“十三五”国家重点研发计划(2017YFD0502200);甘肃省科技支撑计划(144NKCA240);中国农业科学院基本科研业务费专项(Y2016PT43);中国农业科学院奶牛疾病研究创新工程项目(CAAS-ASTIP-2014-LIHPS-03)
王 丹(1991-),女,河南郑州人,硕士研究生,主要从事奶牛乳房炎诊断及防治工作。*
S857.26
B
1007-5038(2017)11-0117-05
