非洲猪瘟病毒非结构基因实时荧光LAMP检测方法的建立
2017-12-15田纯见杨舒展段喻燕刘志玲林志雄
田纯见,杨舒展,段喻燕,刘志玲,林志雄,罗 琼,陈 茹
(广东出入境检验检疫局检验检疫技术中心,广东广州 510623)
研究论文
非洲猪瘟病毒非结构基因实时荧光LAMP检测方法的建立
田纯见*,杨舒展,段喻燕,刘志玲,林志雄,罗 琼,陈 茹
(广东出入境检验检疫局检验检疫技术中心,广东广州 510623)
为建立非洲猪瘟病毒(ASFV)通用型高通量检测技术,利用高度保守的非结构DNA聚合酶G1211R基因,制备质粒标准品,建立实时荧光LAMP方法,出现典型的S形核酸扩增曲线,扩增产物具有特异的熔解曲线。G1211R基因质粒标准品在1.81×105拷贝数/μL~1.81×109拷贝数/μL对数值与Ct值之间的线性关系良好。以ASFV E70株病毒核酸为模板,LAMP检测灵敏度达到21 pg,优于荧光定量PCR方法。重复性试验LAMP检测批内和批间变异系数均小于5%。LAMP方法检测ASFV特异性良好,与猪圆环病毒2型、伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒及昆虫核酸无交叉反应。以ASFV Arm 07株制备各种临床模拟样品,检出阳性率达到17.31%。检测方法的建立,可为非洲猪瘟防控提供新的技术手段,有利于不同基因型毒株检测和出入境快速筛查。
非洲猪瘟病毒;DNA聚合酶;环介导恒温扩增;标准曲线;模拟样品
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的猪的烈性传染病,对生猪及猪肉产品国际贸易产生重要影响。该病是我国一类动物疫病,也是世界动物卫生组织(OIE)法定报告的动物疫病之一。目前,ASF疫情在欧洲由西向东扩散,波及俄罗斯、乌克兰及多个欧盟成员国。在我国“一带一路”建设中,中欧贸易日益频繁,对我国ASF防控提出新的严峻挑战。
ASFV基因组为线状双股DNA,全长170 kb~192 kb。在其结构基因中,编码主要衣壳蛋白p72的基因B646L及与编码形态发生有关蛋白p54的基因E183L,目前常用于ASFV分子生物学诊断[1-6]。但是,病毒分子流行病学研究表明ASFV 结构基因变异,存在22个不同的基因型,会影响分子生物学检测效果。一般认为,动物病毒非结构基因稳定性更高,在口蹄疫、禽流感等动物疫病诊断中发挥着重要作用。在ASFV非结构基因中,DNA聚合酶编码基因G1211R位于病毒基因组的中间保守区,是本研究ASFV检测的靶基因。
环介导等温扩增(loop-mediated isothermal amplifycation,LAMP)技术具有快速、敏感和特异的特点[7-9],在动物疫病诊断中具有重要作用,值得深入研究和推广应用。本研究基于ASFV非结构基因建立实时荧光LAMP检测方法,并与荧光定量PCR进行比较,现报告如下。
1 材料与方法
1.1 材料
1.1.1 病毒及昆虫 ASFV E70毒株(基因Ⅰ型)核酸和Arm 07毒株(基因Ⅱ型)灭活材料,均由ASF参考实验室CISA-INIA(西班牙)提供;猪圆环病毒2型、伪狂犬病病毒、猪瘟病毒及猪繁殖与呼吸综合征病毒由广东永顺生物制药股份有限公司惠赠;蜱虫由本实验室采集和保存。
1.1.2 主要试剂 Lyophilized general real-time LAMP Kit购自华峰生物科技公司;ExTaqTMVersion 2.0 plus dye购自宝生物工程(大连)有限公司;MagNA Pure核酸提取试剂购自罗氏公司;引物由宝生物(大连)有限公司合成。
1.2 方法
1.2.1 引物设计及序列 利用在线软件BLAST进行ASFV基因序列比对,在线软件primerexplorer设计LAMP引物(表1)。荧光PCR引物和探针按照文献方法[1],其序列为:(上游)5′-CTGCTCATGGTATCAATCTTATCGA-3′;(下游)5′-GATACCACAAGATCRGCCGT-3′;(探针)5′-FAM-CCACGGGAGGAATACCAACCCAGTG-TAMRA-3′。
1.2.2 重组质粒构建及鉴定 利用DNA Star软件进行ASFV E70株 G1211R基因克隆引物设计,序列为(上游)5′-CGGTGATTACCCAACGAG-3′;(下游)5′-AGAAAGAAGGGCGACAAA-3′。PCR反应体系为:PremixTaq(ExTaqversion 2.0 plus dye)12.5 μL,ASFV E70株DNA模板2 μL,上游引物(20 μmol/L)1 μL,下游引物(20 μmol/L)1 μL,DEPC蒸馏水8.5 μL。PCR反应条件为:98℃ 10 s,57℃30 s,72℃ 3 min,30个循环。取电泳条带大小正确的PCR产物用于克隆测序,由宝生物工程(大连)有限公司完成。测序结果正确的重组质粒命名为pMD-ASFV-G1211R(1.81×1011拷贝/μL),置-20℃保存备用。
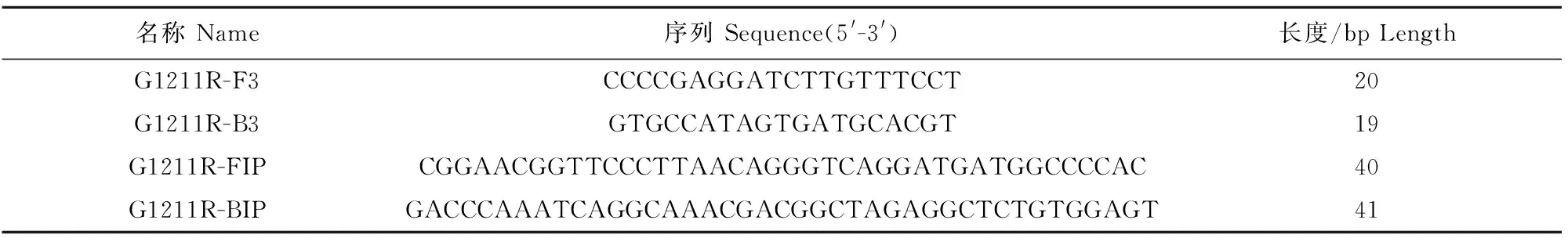
表1 ASFV荧光定量LAMP的引物
1.2.3 LAMP及荧光定量PCR反应 LAMP反应液组成为:冻干反应管(含Bst DNA polymerase、dNTP和荧光染料)1支,复溶液15 μL,待检模板2 μL,FIP引物(40 μmol/L)1 μL,BIP引物(40 μmol/L)1 μL,F3引物(5 μmol/L)1 μL,B3引物(5 μmol/L)1 μL,DEPC蒸馏水4 μL。60℃~65℃不同温度,每个温度反应10 s~30 s,65℃收集FAM荧光值,60个循环。荧光定量PCR反应参照文献[1]的方法进行。
1.2.4 绘制标准曲线和熔解曲线 将pMD-ASFV-G1211R质粒标准品进行10×连续稀释,应用LAMP反应体系按照上述条件进行检测,StepOne软件(v2.1)自动绘制标准曲线。
对ASFV荧光定量LAMP产物进行熔解曲线分析,确定引物特异性。熔解曲线反应程序为95℃ 15 s,60℃ 1 min,接着0.3℃/s升温到95℃ 15 s,在升温过程中收集SYBR荧光值,形成荧光值随温度变化的熔解曲线。
1.2.5 特异性、敏感性和重复性试验 提取猪圆环病毒2型、伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒和蜱虫的核酸作为模板,与ASFV核酸一起应用LAMP反应体系分别进行检测,观察检测方法的特异性。
将ASFV E70毒株核酸进行10×连续稀释,应用LAMP反应体系按照上述条件进行敏感性检测,并与荧光PCR进行比较。
应用pMD-ASFV-G1211R质粒标准品进行批内和批间重复性试验。以1.81×106、1.81×107、1.81×108拷贝/μL 3个滴度,均进行4个重复,评价批内变异情况。分别对每个稀释度连续进行4次试验,评价批间变异情况。获得数据在Excel软件计算平均Ct值、标准差(SD)和变异系数(CV)。
1.2.6 模拟样品检测应用 抽取实验室保存的进出境猪血清样品30份,猪鼻拭子样品15份,猪尿液2份,猪场昆虫3份,猪饲料2份,共计52份。应用ASFV Arm 07株模拟强弱阳性样品提取核酸,应用所建立的LAMP方法和荧光定量PCR进行检测,比较两个方法的检测实用性。
2 结果
2.1 LAMP反应条件优化
在线设计8组G1211R基因LAMP引物,利用序列保守性、结构特点和Ct值优选一组引物见表1。按照冻干通用型恒温实时荧光试剂建立反应体系,结果反应条件为60℃、61℃、62℃、63℃、64℃和65℃共6个温度各反应10 s,出现典型的S型核酸扩增曲线。
2.2 敏感性试验
标准曲线(图1)分析结果,直线方程为y=-3.232x+30.714,相关系数(R2)为0.999,扩增效率为0.934。结果表明,所建立的荧光定量LAMP检测方法的Ct值与质粒标准品拷贝数以10为底的对数之间的线性关系良好,所制备的质粒标准品合格。
荧光定量LAMP检测ASFV核酸(1 050 ng/μL)灵敏度达到10-5以上(图2),相当于每个反应体系可以检出21 pg病毒DNA,优于荧光定量PCR检测结果(10-3)。

(A)1.81×109;(B)1.81×108;(C)1.81×107;(D)1.81×106;(E)1.81×105,27.482(1);23.259(2);19.176(3);17.628(4);14.555(5)

A.10-3;B.10-4;C.10-5;D.10-6
2.3 特异性性试验
在ASFV实时荧光定量LAMP熔解曲线中,82.02℃(Tm)处出现单一特异峰(图3),无引物二聚体和非特异性产物。

图3 ASFV荧光定量LAMP熔解曲线
LAMP方法检测ASFV出现特异的S型扩增曲线,而猪圆环病毒2型、伪狂犬病病毒、猪瘟病毒、猪繁殖与呼吸综合征病毒和昆虫核酸均未出现特异扩增曲线(non-ASFV)(图4)。
图4 ASFV荧光定量LAMP特异性试验
2.4 重复性试验
3个滴度样品进行批内试验和批间试验(表2),结果变异系数均小于5%,具有良好的重复性。
2.5 临床样品检测
在进出境猪血清、鼻拭子、尿液、饲料和有关昆虫样品中(表3),LAMP 检测阳性率17.31%,比荧光定量PCR方法略高。
3 讨论
据OIE通报,2017年第一季度俄罗斯、波兰、立陶宛、乌克兰和南非等国家存在家猪和野猪持续感染非洲猪瘟的情况,其中俄罗斯自2014年起在伏尔加格勒州等30个地区发生163起野猪和281起家猪非洲猪瘟疫情,871头野猪和10 188头家猪感染。目前,对ASF不能进行预防接种和有效治疗,防控工作必须采取扑杀净化措施[10],严重干扰正常生产和生活秩序,造成重大经济损失,已经成为我国养猪业的巨大威胁,其研究结果具有重大政治经济意义。

表2 ASFV荧光定量LAMP重复性试验
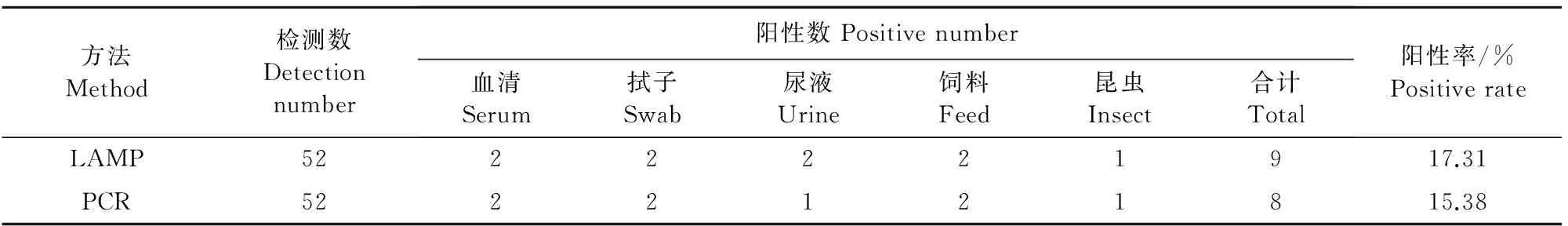
表3 ASFV荧光定量LAMP对模拟样品的检测结果
ASF与我国广泛流行的猪瘟、高致病性蓝耳病等出血性猪传染病具有相似的临床症状和病理变化,其鉴别诊断必须开展实验室检测[11]。ASFV特异性分子生物学方法是重要的鉴别诊断工具。与常规PCR方法比较,LAMP引物针对模板6~8个区段,其特异性更高;扩增过程无需变性与退火,所需时间更短;实时检测无需探针,成本更低。本研究建立的荧光定量LAMP方法与电泳、显色法[8]比较,适宜于高通量大规模筛查,可减少人工操作,结果判定准确可靠,其技术优势将在快速诊断和疫情防控工作中进一步发挥作用。
对ASFV结构蛋白p72基因的分子流行病学研究显示,世界各国流行毒株基因型不同,如俄罗斯为基因Ⅱ型(2007-2011)、坦桑利亚为基因Ⅹ型(2013)、乌干达为基因Ⅸ型(2013)等。这种结构基因分子结构差异和不同基因型出现,会影响不同地区ASFV毒株的分子诊断准确性,有必要在变异相对较少的非结构基因稳定区设计通用引物,保证针对不同基因型病毒具有较高的检出率。本研究为不同基因型非结构基因通用型检测方法打下基础。
在引物设计过程中对3个ASFV分子检测靶基因进行BLAST分析,结果全部毒株完整基因序列一致(100%)的比例是DNA聚合酶基因G1211R(3 636 bp)26.09%、结构蛋白p72基因B646L(1 940 bp)18.75%及E183L基因(5 526 bp)9.90%。说明非结构蛋白基因稳定性较高,有利于通用型扩增引物设计。
在制备非结构基因检测标准物质的基础上,本研究初步建立了针对非结构基因检测的LAMP方法,可以检测两种不同基因型病毒,其敏感性优于常规荧光定量PCR[12],特异性和重复性效果良好,成功用于多种模拟样品检测。进一步研究需要针对更多的不同基因型毒株进行临床验证[13],在实际防控工作中加以完善和推广应用。
[1] King D P,Reid S M,Hutchings G H,et al.Development of aTaqMan PCR assay with internal amplification control for the detection of African swine fever virus[J].J Virol Meth,2003,107(1):553-561.
[2] Agüero M,Fernández J,Romero L J,et al.A highly sensitive and specific gel-based multiplex RT-PCR assay for the simultaneous and differential diagnosis of African swine fever and classical swine fever in clinical samples[J].Vet Res,2004,35(5):551-563.
[3] Agüero M,Fernández J,Romero L,et al.Highly sensitive PCR assay for routine diagnosis of African swine fever virus in clinical samples[J].J Clin Microbiol,2003,41(9):4431-4434.
[4] Fernández-Pinero J,Gallardo C,Elizalde M,et al.Molecular diagnosis of African swine fever by a new real-time PCR using universal probe library[J].Transb Emerg Dis,2013,60(1):48-58.
[5] Haines F J,Hofmann M A,King D P,et al.Development and validation of a multiplex,real-time RT PCR assay for the simultaneous detection of classical and African swine fever viruses[J].PLoS One,2013,26;8(7):e71019.
[6] Steiger Y,Ackermann M,Mettraux C,et al.Rapid and biologically safe diagnosis of African swine fever virus infection by using polymerase chain reaction[J].J Clin Microbiol,1992,30(1):1-8.
[7] Qiao T M,Zhang J,Li S J,et al.Development of nested PCR,multiplex PCR,and loop-mediated isothermal amplification assays for rapid detection ofCylindrocladiumscopariumonEucalyptus[J].Plant Pathol J,2016,32(5):414-422.
[8] 王彩霞,刘 建,林祥梅,等.环介导恒温扩增技术快速检测非洲猪瘟病毒[J].动物医学进展,2010,31(2):15-19.
[9] 赵玲娜,金红岩,梁 琳,等.实时荧光定量RT-PCR检测小反刍兽疫病毒方法的建立[J].中国畜牧兽医,2016,43(11):2844-2851.
[10] Gallardo C,Nieto R,Soler A,et al.Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in eastern European union countries:how to improve surveillance and control programs[J].J Clin Microbiol,2015,53(8):2555-2565.
[11] Gallardo C,Soler A,Nieto R,et al.Experimental infection of domestic pigs with African swine fever virus Lithuania 2014 genotype II field isolate[J].Transb Emerg Dis,2017,64(1):300-304.
[12] Rodriguez-Sanchez B,Sanchez-Vizcaino J M,Uttenthal A,et al.Improved diagnosis for nine viral diseases considered as notifiable by the world organization for animal health[J].Transb Emerg Dis,2008,55(5-6):215-225.
[13] Guinat C,Gogin A,Blome S,et al.Transmission routes of African swine fever virus to domestic pigs:current knowledge and future research directions[J].Vet Rec,2016,178 (11):262-267.
EstablishmentofReal-timeFluorescenceLAMPAssayforDetectionofNon-structuralDNAPolymeraseGeneofAfricanSwineFeverVirus
TIAN Chun-jian,YANG Shu-zhan,DUAN Yu-yan,LIU Zhi-ling,LIN Zhi-xiong,LUO Qiong,CHEN Ru
(GuangdongInspectionandQuarantineTechnologyCenter,Guangzhou,Guangdong,510623,China)
A universal real-time fluorescence LAMP detection method was established by cloning the DNA polymerase gene G1211R of African swine fever virus strain E70.A specific amplification was obtained and verified by a melt curve analysis.There were good linear relationships between Ct values and logarithm of input copy numbers over a range from 1.81×105to 1.81×109copies/μL for G1211R gene.The sensitivity for detection of nucleic acid was greater than that of fluorescence PCR method.The coefficients of variation within a batch and between batches were both less than 5%.There was no cross-reactivity with a variety of clinical related viruses.The total positive rate of spiked samples with ASFV strain Arm 07 was up to 17.31%.This study can provide an important reference for the prevention and control of ASF,and needs for further verification and application with different genotypes.
African swine fever virus; DNA polymerase; loop-mediated isothermal amplification assay; standard curve; spiked sample
2017-05-10
出入境检验检疫科研项目(2016GDK02、2016IK046)
田纯见(1965-),男,湖北长阳人,博士,主要从事动物疫病检测技术研究。*
S852.659.3;S858.315.3
A
1007-5038(2017)11-0001-05
