络风宁1号方对心肌梗死大鼠血栓调节蛋白-活化蛋白C-内皮细胞蛋白C受体系统的调节作用
2017-12-15孙天王显
孙天,王显
络风宁1号方对心肌梗死大鼠血栓调节蛋白-活化蛋白C-内皮细胞蛋白C受体系统的调节作用
孙天1,王显2
目的探讨络风宁1号方对心肌梗死大鼠血栓调节素-活化蛋白C-内皮细胞蛋白C受体系统的调节作用。方法将SD大鼠随机分为假手术组(7只)、模型组(8只)、络风宁1号方组(7只)、联合用药组(8只)、卡托普利组(8只),心肌梗死造模后络风宁1号组及联合用药组予含生药量4.81 g/(kg·d)的络风宁1号方汤剂,卡托普利组及联合用药组予卡托普利片7.5 mg/(kg·d),假手术组及模型组予相同体积蒸馏水,2/d,连续4周。4周后测定各组大鼠心肌梗死边缘组织血栓调节蛋白(TM)、活化蛋白C(APC)、内皮细胞蛋白C受体(EPCR)基因及蛋白的表达。结果模型组大鼠EPCR、TM的mRNA、sEPCR、sTM含量较假手术组明显升高(P<0.05),EPCR、TM的蛋白表达及APC含量较假手术组下降(P<0.05);络风宁1号组、联合用药组EPCR、TM的mRNA以及含量较模型组降低,差异有统计学意义(P<0.05),EPCR蛋白表达较模型组增加,差异有统计学意义(P<0.05);络风宁1号组、联合用药组血清APC含量较模型组增加(P<0.05)。结论络风宁1号方能够减轻膜结合型EPCR、TM的损伤,抑制了TM、EPCR的mRNA代偿性增加,使sEPCR、sTM含量下降,APC含量增加。
心肌梗死;络风宁1号方;血栓调节蛋白;活化蛋白C;内皮细胞蛋白C受体;大鼠
急性心肌梗死是一种严重危害人类健康的心血管疾病,目前研究认为血管内皮功能障碍与冠心病进程密切相关[1]。改善内皮抗凝和抑制血栓功能在冠心病研究中已成为热点。血管内皮细胞通过其抗凝作用维持血液正常流动,其主要与血栓调节蛋白-活化蛋白C-内皮细胞蛋白C受体系统(TM-APC-EPCR)相关[2]。王显教授创新提出动脉粥样硬化“络风内动”学说,认为络风内动是冠心病发病的又一重要病机,前期研究表明络风宁1号具有抑制炎症因子、改善血管内皮功能等作用[3,4]。本研究观察急性心肌梗死大鼠心肌梗死边缘组织及血清中TM、EPCR、APC表达变化及络风宁1号方对此干预作用,进一步探讨络风宁1号方TM-APC-EPCR系统的作用机制,现报告如下。
1 材料与方法
1.1 实验动物
健康雄性SD大鼠50只,SPF级,体重(250±10)g,由北京维通利华实验动物中心提供,实验动物许可证编号:SCXK(京)2012-0001。
1.2 药物和主要试剂
络风宁1号方组成:徐长卿、地龙、三七、冰片组成(剂量保密),北京中医药大学东直门医院药房提供;卡托普利片(中美上海施贵宝制药有限公司,批号:1306032);注射用青霉素钠(华北制药股份有限公司,批号:F3056114);戊巴比妥钠(上海新亚药业有限公司,批号:H31021742);超纯RNA提取试剂盒(CW0581);HiFi-MMLV cDNA第一链合成试剂盒(CW0744);UltraSYBR Mixture(With ROX)( CW0956);DNase 1(CW2090);5x RNA Loading Buffer(CW0611A)均购自CWBIO公司;TM抗体(批号:G1607);EPCR(批号:A2714);均购自Santa Cruz公司;辣根酶标记兔抗山羊IgG(H+L)(北京中杉金桥生物技术有限公司,批号:ZB2306,);APC酶联免疫试剂盒(批号:148932);TM酶联免疫试剂盒(批号:162321);EPCR酶联免疫试剂盒(批号:162013),均购自北京尚柏生物工程有限公司;GAPDH单克隆抗体(美国Sigma公司,批号:051M5971)。
1.3 主要仪器
电子天平(上海精密科学仪器有限公司,JA1003N型);十二导心电图机(北京福田电子医疗仪器有限公司,FX-7202型);呼吸机(上海奥尔科特生物科技有限公司,ALC-V8型);4℃离心机(上海沪粤明科学仪器有限公司,TGL-16G型); 荧光定量PCR仪(Applied Biosystems公司,ABI7500型);电泳仪(北京市六一仪器厂,DYY-6C型);转膜仪(北京市六一仪器厂,DYCZ-40D型)。
1.4 模型制备
采用大鼠左冠状动脉前降支结扎的方法制备大鼠心肌梗死模型。用1%的戊巴比妥钠腹腔注射(0.5 ml/100 g)全身麻醉后,背部固定在手术板上,行经喉气管插管术,连接呼吸机,以80 次/min,吸呼比1:2,潮气量0.7~0.8 ml辅助呼吸。在左侧第三、四肋间切开皮肤,逐层钝性分离肌层,撕裂心包膜使心脏充分暴露,进针位置在主动脉根部约3 mm处,用5/0带线缝合针结扎左冠前降支,当心电图I导联显示ST段显著抬高后,肉眼观察结扎部位以下心肌变灰白,搏动减弱。彻底止血后逐层缝合关闭胸腔。假手术组手术过程相同,仅穿线不结扎。术后肌肉注射青霉素连续3 d。手术全部过程严格无菌操作。
1.5 动物分组与给药
38只SD大鼠称重并进行随机分为假手术组(7只)、模型组(8只)、络风宁1号组(7只)、联合用药组(8只)、卡托普利组(8只),造模后络风宁1号组及联合用药组给予含生药量4.81g/(kg·d)的络风宁1号方汤剂,卡托普利组及联合用药组予卡托普利片7.5 mg/(kg·d),假手术组及模型组予相同体积蒸馏水。各组均每天灌胃两次,连续给药4周。
1.6 观察指标及方法
1.6.1 实时荧光定量PCR法检测EPCR、TM mRNA的表达 采用超纯RNA提取试剂盒提取大鼠心肌梗死边缘区组织中总RNA。引物由上海生工设计并合成,TM引物序列(长度276bp),上游:TCATCCTGGACGAGGGTTC,下游:GTCGGATTGCTTGATGGGT;EPCR引物序列(长度217bp),上游:TCTACCTGTCCCAGTTCAA,下游:C A T A C C G A G T C C G A T T G T;G A P D H引物序列(长度1 3 8 b p),上游:TGGAGTCTACTGGCGTCTT,下游:TGTCATATTTCTCGTGGTTCA。用HiFi-MMLVcDNA第一链合成试剂盒进行反转录,以cDNA为模板进行PCR反应:2×UltraSYBR Mixture 10μl,上下游引物 各0.4 μl,cDNA 2 μl,加入灭菌蒸馏水至20μl。扩增程序为:95℃10 min,(95℃15sec,60℃60sec)×45个循环,进行实时荧光定量PCR,进行PCR溶解曲线分析,每个样品设立3个复孔,取平均值,CT值采用2-△△CT法进行数据的相对定量分析。
1.6.2 Western blot检测EPCR、TM蛋白的表达从液氮罐中取保存的大鼠心肌梗死边缘组织,用裂解液提取总蛋白,进行蛋白定量,静SDSPAGE电泳,转膜,封闭后,加入一抗(TM:1:200;EPCR:1:100;GAPDH:1:2000),与二抗孵育(1:2000),37℃孵育1 h,加ECL超敏发光液,暗室发光、显影、定影,将曝光后的X光片在扫描仪上进行扫描,得到的目的蛋白条带的图片用Image J软件进行灰度分析,以目标(EPCR、TM)灰度值与内参(GAPDH)灰度值的比值来表示。
1.6.3 酶联免疫法检测血清EPCR、TM、APC含量 大鼠于术后4周各组大鼠用1%戊巴比妥钠腹腔注射麻醉,腹主动脉取血,采用酶联免疫法对血清EPCR、TM、APC的含量进行测定,测定过程严格按照试剂盒说明进行。
1.7 统计学方法
采用SPSS 20.0统计分析软件,计量资料采用均数±标准差(±s)表示,两组间均数比较采用t检验,多组间均数的比较采用单因素方差分析,P<0.05为差异有统计学差异。
2 结果
2.1 各组大鼠心肌梗死边缘区组织EPCR、TM mRNA表达比较
与假手术相比,卡托普利组EPCR mRNA表达差异无统计学意义(P>0.05),而模型组、络风宁1号组及联合用药组较假手术组均升高(P<0.05);与模型组比较,假手术组、络风宁1号组、联合用药组、卡托普利组EPCR mRNA的表达量均下降(P<0.05);与卡托普利组比较,模型组、络风宁1号组EPCR mRNA的表达量均升高(P<0.05),假手术组EPCR mRNA表达量较低、联合用药组与卡托普利组近似,均无统计学意义(P>0.05),表1。
与假手术相比,联合用药组、卡托普利组TM mRNA差异无统计学意义(P>0.05),而模型组、络风宁1号组较假手术组均升高(P<0.05);与模型组相比,假手术组、络风宁1号组、联合用药组、卡托普利组TM mRNA的表达量均下降(P<0.05);与卡托普利组比较,模型组、络风宁1号组TM mRNA表达量均显著升高(P<0.05),而假手术组、联合用药组TM mRNA的表达量低且无统计学意义(P>0.05),表1。
2.2 各组大鼠心肌梗死边缘区组织EPCR、TM蛋白表达比较
与假手术相比,模型组EPCR蛋白表达量下降(P<0.05),络风宁1号方、联合用药组、卡托普利组EPCR蛋白表达量增加(P<0.05);与模型组相比,假手术组、络风宁1号组、联合用药组、卡托普利组EPCR蛋白表达量均增加(P<0.05);与卡托普利组比较,络风宁1号方EPCR的表达下降但无统计学意义(P>0.05),假手术组、模型组EPCR的表达下降(P<0.05),表2。
与假手术相比,络风宁1号组、卡托普利组TM蛋白表达量下降但无统计学差异(P>0.05),模型组TM蛋白表达量下降(P<0.05);与模型组相比,络风宁1号TM蛋白表达量均增加但无统计学差异(P>0.05),假手术组、联合用药组、卡托普利组TM蛋白表达量均增加(P<0.05);与卡托普利组比较,络风宁1号组TM蛋白表达量下降但无统计学差异(P>0.05),模型组TM蛋白表达量下降(P<0.05),假手术组、联合用药TM蛋白表达量增加但无统计学差异(P>0.05),表2。
2.3 各组大鼠血清sEPCR、sTM、APC含量比较
与假手术组相比,其余各组血清 sEPCR、sTM含量均增高(P<0.05);与模型组比较,其余各组血清sEPCR、sTM含量均降低(P<0.05);与卡托普利组比较,假手术组血清sEPCR、sTM含量降低(P<0.05),联合用药组血清sEPCR、sTM含量降低但无统计学意义(P>0.05),模型组、络风宁1号组血清sEPCR、sTM含量升高(P<0.05),表3。
表1 各组大鼠心肌梗死边缘区组织EPCR及TM的mRNA表达结果(±s)
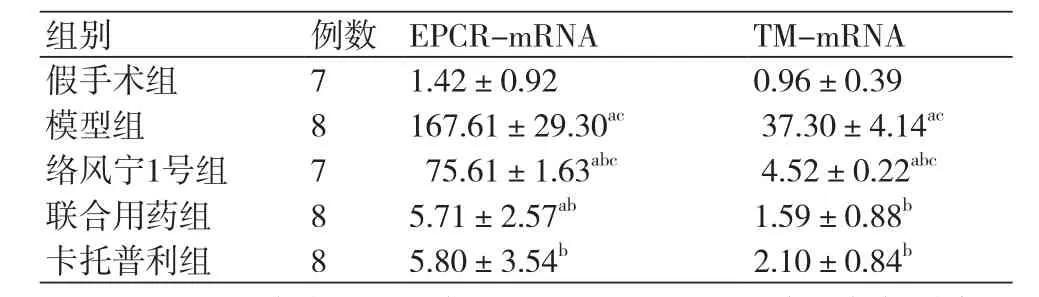
表1 各组大鼠心肌梗死边缘区组织EPCR及TM的mRNA表达结果(±s)
注:EPCR:内皮细胞蛋白C;TM:血栓调节蛋白;与假手术组相比,aP<0.05;与模型对照组相比,bP<0.05;与卡托普利组相比,cP<0.05
假手术组 7 1.4 2±0.9 2 0.9 6±0.3 9模型组 8 1 6 7.6 1±2 9.3 0 ac 3 7.3 0±4.1 4 ac络风宁1号组 7 7 5.6 1±1.6 3 abc 4.5 2±0.2 2 abc联合用药组 8 5.7 1±2.5 7 ab 1.5 9±0.8 8 b卡托普利组 8 5.8 0±3.5 4 b 2.1 0±0.8 4 b
表2 各组大鼠心肌组织EPCR、TM蛋白Western Blot条带灰度分析结果( ±s)
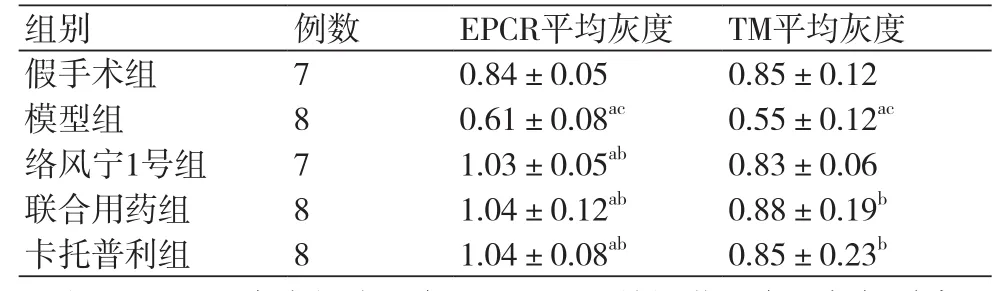
表2 各组大鼠心肌组织EPCR、TM蛋白Western Blot条带灰度分析结果( ±s)
注:EPCR:内皮细胞蛋白C;TM:血栓调节蛋白;与假手术组相比,aP<0.05,与模型对照组相比,bP<0.05;与卡托普利组相比,cP<0.05
组别 例数 EPCR平均灰度 TM平均灰度假手术组 7 0.84±0.05 0.85±0.12模型组 8 0.61±0.08ac 0.55±0.12ac络风宁1号组 7 1.03±0.05ab 0.83±0.06联合用药组 8 1.04±0.12ab 0.88±0.19b卡托普利组 8 1.04±0.08ab 0.85±0.23b
与假手术组比较,模型组血清APC含量降低(P<0.05),其余各组均降低但无统计学差异(P>0.05);与模型组相比,其余各组血清APC含量均升高(P<0.05);与卡托普利组比较,络风宁1号组血清APC含量降低但无统计学差异(P>0.05)、模型组血清APC含量降低(P<0.05),联合用药组、假手术组血清APC含量升高但无统计学意义(P>0.05),表3。
3 讨论
血栓调节素(TM)是血管内皮细胞表面的凝血酶受体之一,TM与凝血酶结合后引起凝血酶结构改变,形成的复合物可加速激活蛋白C形成活化蛋白C(APC),APC能够与纤维蛋白溶解酶原活化抑制剂1形成复合物,促进纤维蛋白溶解酶原活化,同时还可以通过刺激纤溶酶原释放而起到促纤溶活性的作用[5]。APC还可以直接抑制肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)及核转录因子kB(NF-kB)亚基p50和p52的表达,另有相关研究发现APC通过抑制Caspase-3的活性,抑制Ca2+超载引起的细胞及线粒体依赖的细胞凋亡间接发挥抗炎作用[6,7]。EPCR是I型血管内皮细胞跨膜糖蛋白,目前有研究证实EPCR可促进蛋白C呈递给TM-凝血酶复合物,使得APC在体内活化效率提高约数十倍[8],APC与EPCR结合后可以抑制中性粒细胞粘附分子CD11b/CD18的表达发挥抗炎作用[9],同时还可以在蛋白S辅助下灭活因子Va和因VⅢa,发挥抗凝作用[10]。
表3 各组大鼠血清EPCR、TM、APC含量结果( ±s,pg/ml)
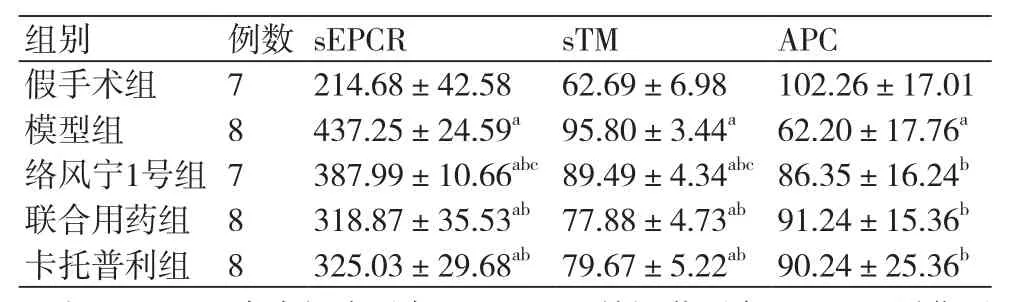
表3 各组大鼠血清EPCR、TM、APC含量结果( ±s,pg/ml)
注:EPCR:内皮细胞蛋白C;TM:血栓调节蛋白;APC:活化蛋白C;与假手术组相比,aP<0.05;与模型组相比,bP<0.05;与卡托普利组相比,cP<0.05
络风宁1号方中徐长卿、地龙为君药,共奏祛风通络之功;三七为臣药,散瘀止痛;冰片佐药,清热止痛、调和诸药;诸药相合以祛风通络为主,整体调节脏腑功能,标本兼顾。本研究结果显示络风宁1号方能够减轻膜结合型EPCR、TM的损伤,抑制了TM、EPCR的mRNA代偿性增加,使sEPCR、sTM含量下降,APC含量增加,上调心肌组织中EPCR、TM的蛋白表达,并且较模型组有统计学意义,说明络风宁1号方能够刺激TM、EPCR的合成,增加APC产生,逆转凝血酶活性,并减少sTM、sEPCR的产生,从而增加APC的有效作用,使TM-APC-EPCR系统良好的整合从而提高内皮细胞抗凝及抗炎作用,且络风宁1号方联合卡托普利具有协同增效的作用。后期课题组将进一步完善哪些信号通路参与TMAPC-EPCR系统作用调节,络风宁1号方治疗该系统在心肌梗死疾病中的变化仍需要进一步验证,从而为临床治疗和预后提供可靠依据。
[1]Lusis AJ. Atherosclerosis[J]. Nature,2000,407(6801):233-41.
[2]吴立岭,张幼怡. 心血管病理生理学[M]. 北京: 北京大学医学出版社,2009,129-32.
[3]杨然,朱海燕,赵明镜,等. 基于单核-巨噬细胞炎症模型的络风宁1号抗炎机制初探[J]. 中西医结合心脑血管病杂志,2014,10(12):1240-3.
[4]杨然,朱媛媛,朱海燕,等. 络风宁1号方治疗冠心病不稳定型心绞痛[J]. 中西医结合心脑血管病杂志,2013,11(9):1039-41.
[5]Bravo MC,Orfeo T,Mann KG,et al. Modeling of human factor Va inactivation by activated protein C[J]. BMC Syst Biol,2012,6(1):1-20.
[6]Ding JW,Tong XH,Yang J. Activated protein C protects myocardium via activation of anti-apoptotic pathways of survival in ischemiareperfuse rat heart[J]. J Korean Med Sci,2010,25(11):1609-15.
[7]Chen P,Huang L,Zhang Y,et al. Anti-apoptotic effect of activathe protein C on lipopolysaccharide-stimulated human umbilical vein endothelial cells is associated with the inhibition of the caspase-3 pathway[J]. Mol Med Rep,2010,3(6):991-997.
[8]Van de Wouwer M,Collen D,Conway EM. Thrombomodulin-Protein C-EPCR system: integrated to regulate coagulation and inflammation[J]. Arterioscler Thromb Vasc Biol,2004,24(8):1374-83.
[9]Bouwens EA,Stavenuiter F,Mosnier LO. Mechanisms of anticoagulant and cytoprotective actions of the protein C pathway[J]. J Thromb Haemost,2013,11(1 suppl):242-53.
[10]Navarro S,Bonet E,Estelles A,et al. The endothelial cell protein C receptor: its role in thrombosis[J]. Thromb Res,2011,128(5):410-6.
Regulative effect of Luofengning Fang I on system of thrombomoduline-activated protein C-endothelial protein C receptor in rats with myocardial infarction
Sun Tian*, Wang Xian.
*Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110032, China.
Corresponding author: Wang Xian, E-mail: wx650515@163.com
ObjectiveTo investigate the regulative effect of Luofengning Fang I on system of thrombomoduline
activated protein C-endothelial protein C receptor (TM-APC-EPCR) in rats with myocardial infarction (MI).MethodsSD rats were randomly divided into sham-operation group (n=7), model group (n=8), Luofengning Fang I group(n=7), combined therapy group (n=8) and captopril group (n=8). After modeling of MI, Luofengning Fang I group and combined therapy group were given decoction of Luofengning Fang I [contained 4.81 g/(kg. d) of crude medicinal],captopril group and combined therapy group were given captopril tablets [7.5 mg/(kg. d)], and sham-operation group and model group were the same volume of distilled water twice a day for 4 weeks. The gene and protein expressions of TM, APC and EPCR in peripheral tissue of MI were detected in all groups after 4 weeks.ResultsThe levels of EPCR-mRNA, TM-mRNA, serum EPCR (sEPCR) and serum TM (sTM) increased significantly (P<0.05), and protein expressions of EPCR and TM and APC level decreased (P<0.05) in model group compared with sham-operation group.The levels of EPCR-mRNA and TM-mRNA decreased (P<0.05), and protein expression of EPCR increased (P<0.05)in Luofengning Fang I group and combined therapy group compared with model group. The level of serum APC increased in Luofengning Fang I group and combined therapy group compared with model group (P<0.05).ConclusionLuofengning Fang I can relieve the injury of EPCR and TM, inhibit compensatory increases of TM-mRNA and EPCR-mRNA, reduce levels of sEPCR and sTM, and improve APC level.
Myocardial infarction; Luofengning Fang I; Thrombomoduline; Activated protein C; Endothelial protein C receptor; Rats
R542.22
A
1674-4055(2017)11-1342-04
北京中医药大学自主选题项目(2014-JYBZZ-XS-133)
1110032 沈阳,辽宁中医药大学附属医院;2100700北京,北京中医药大学东直门医院
王显,E-mail:wx650515@163.com
10.3969/j.issn.1674-4055.2017.11.14
杨新颖,姚雪莉
