麦考酚钠肠溶颗粒剂的研制
2017-12-14陈美红陈建华孙小梅
贾 可,陈美红,陈建华,孙小梅
麦考酚钠肠溶颗粒剂的研制
贾 可,陈美红,陈建华,孙小梅*
目的 采用挤出-滚圆法制备麦考酚钠肠溶颗粒剂。方法 以微晶纤维素KG802为填充剂,交联羧甲基纤维素钠为崩解剂,聚维酮K30为黏合剂,以丙烯酸树脂Ⅱ号、丙烯酸树脂Ⅲ号为肠溶衣膜材料,对不同配方组成进行湿法制粒、挤出、滚圆,制得肠溶颗粒。结果 所制麦考酚钠肠溶颗粒剂在pH2.0盐酸溶液中2 h内累积释放率<1%,在pH6.8磷酸盐缓冲液中30 min累积释放率≥95%。结论 以微晶纤维素KG802为填充剂、交联羧甲基纤维素钠为崩解剂、聚维酮K30为黏合剂,丙烯酸树脂Ⅱ号/丙烯酸树脂Ⅲ号(1∶1)混合物为肠溶材料,通过挤出-滚圆法能直接制得释放度符合要求的麦考酚钠肠溶颗粒剂。
麦考酚钠;肠溶颗粒剂;挤出-滚圆法
麦考酚钠(mycophenolate sodium,MPA)自 1896年被首次分离以后,通过研发发现其具有抗肿瘤、抗病毒、免疫抑制和抗炎活性,用于免疫抑制性病症,尤其是治疗或预防器官、组织或细胞在移植后的同种移植或异种移植排斥[1]。但MPA存在一个缺点,即生物利用度低,低生物利用度被认为是由未确定的因素如药物在胃肠腔中的络合,狭窄的吸收窗,吸收前的代谢等而引起的。国内外研究发现其制成肠溶制剂后,降低了胃肠道不良反应,提高了患者的耐受性和对药物的依从性。该课题将其制备成4 g/袋的麦考酚钠肠溶颗粒剂,属于多颗粒系统,为分散型制剂,活性成分被充分分散于辅料,有效避免肠溶片或胶囊在释放部位局部活性成分浓度过高,产生突释或受胃排空及食物影响,从而避免了起效不稳定现象口服后在胃肠道均匀分散成微粒,且有利于药物吸收,提高药物的生物利用度[2,3]。其次,肠溶颗粒剂便于灵活分剂量,而不会破坏肠溶衣层,影响肠溶效果。此外,制备肠溶颗粒,采用填充剂、崩解剂、黏合剂、肠溶材料直接混合制粒、挤出、滚圆的方法制得微丸颗粒剂,避免了颗粒包肠溶衣的步骤,大大简化了生产工艺,提高了生产效率。采用制粒、挤出、滚圆制得体外释放度符合要求的麦考酚钠肠溶颗粒剂,并对制剂处方及工艺进行优化。
1 仪器与试药
1.1 仪器 BFM6超微粉碎机(济南达微机械有限公司);HZ-12A湿法制粒机 (重庆南方制药机械厂);E50轴向单螺杆挤出机(重庆英格造粒包衣技术有限公司);YSEI电热鼓风干燥箱(重庆永生试验仪器厂);PL303电子天平 (瑞士梅特勒);RC-8D溶出度测定仪 (天津市天大天发科技有限公司);2487高效液相色谱仪(Waters)。
1.2 试药 麦考酚钠 (广州虎奥制药有限公司,批号:201604021, 纯度:99.0%); 微晶纤维素 KG802(旭化成株式会社);聚维酮K30(上海昌为医药辅料技术公司)、交联羧甲基纤维素钠(德国瑞登梅尔父子公司);丙烯酸树脂(Ⅱ号、Ⅲ号,德国Degussa公司);其他试剂均为分析纯。
2 方法与结果
2.1 制备方法 称取0.72 kg麦考酚钠、适量的丙烯酸树脂Ⅱ号与丙烯酸树脂Ⅲ号为肠溶材料;将原辅料混匀,粉碎,过100目;后将混合粉置于高效湿法制粒机中,加入适量95%乙醇溶液,低搅低切,再高搅高切适宜时间。后加入适量微晶纤维素KG802填充剂、交联羧甲基纤维素钠崩解剂,5%聚维酮K30水溶液黏合剂、再低搅低切,再高搅高切制粒,低速搅拌出料。
后将软材加于挤出机中,以35~40 rpm转速挤压成条状物,再将条状物转入滚圆机中,以1000~2000 rpm转速滚圆4~5 min,即得湿颗粒微丸;将湿颗粒微丸干燥,调节物料温度40~50℃,干燥30~45 min,控制干燥失重不大于1.5%,出料,装于铝袋中(4 g/袋),即得麦考酚钠颗粒剂成品。
2.2 试验结果
2.2.1 丸芯材料对挤出-滚圆工艺及释放度的影响[4,5]
试验表明,60%微晶纤维素KG802与4%交联羧甲基纤维素钠、3%聚维酮K30组合,制得微丸颗粒的圆整度优良,美观(详见处方A2)。此外,微丸颗粒崩解良好,在pH2.0盐酸溶液(SGF)中基本不释放(<1%),而在 pH6.8 磷酸盐缓冲液(SIF)中 30 min累积释放率高达95%以上(详见表1、表2及图1)。微晶纤维素KG802较其他型号微晶纤维素的弹性和黏性好,是一种优良的成球促进剂,其通常为挤出-滚圆制备微丸材料的首先。当其与吸水性能较好的交联羧甲基纤维素钠配合使用时,利于黏合剂聚维酮K30的充分润湿,故制得丸芯的圆整度良好,且因交联羧甲基纤维素钠为崩解剂,其利于丸芯的崩解,主药的释放。此外,辅料组合用量配比直接影响微丸颗粒的圆整度、硬度、粉末粒度及释放度;若配比不当,造成颗粒圆整度及硬度差、在胃酸中具有突释现象,影响产品临床肠溶效果。

表1 不同微丸颗粒配方对比结果
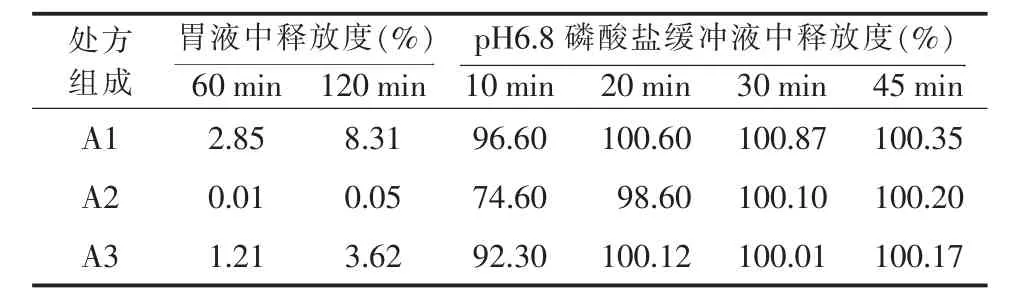
表2 不同配方微丸颗粒的释放度测定结果
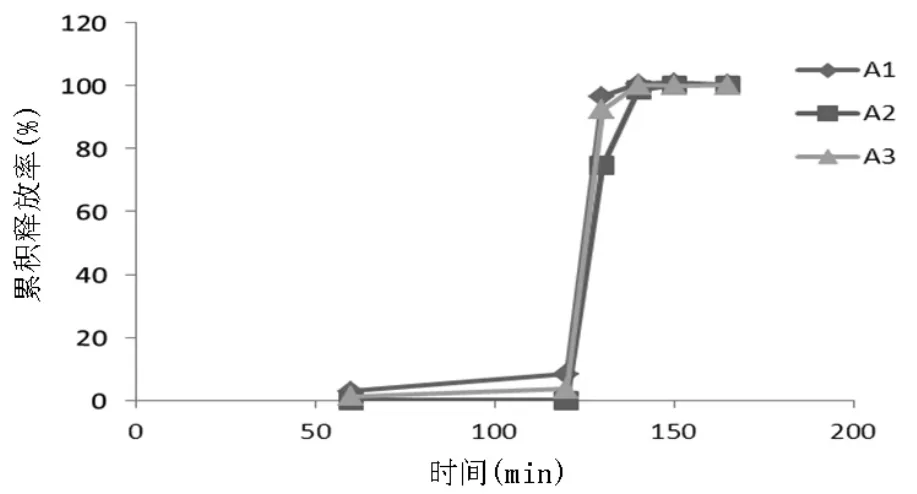
图1 不同微丸配方肠溶颗粒体外释放度对比
2.2.2 肠溶材料对挤出-滚圆工艺及释放度的影响
丙烯酸树脂系列是国内外常用的肠溶材料,型号较多,不同型号的肠溶特性不同,适合肠道pH释放环境不同,根据麦考酚钠肠道吸收pH值,本文采用对应pH值范围的丙烯酸树脂Ⅱ号、丙烯酸树脂Ⅲ号作为本品混合肠溶衣材料,以制备肠溶多颗粒微丸。结果以丙烯酸树脂Ⅱ号、丙烯酸树脂Ⅲ号(1∶1)的组合肠溶材料最佳,且二者在配方中用量各为10%(详见处方B1),制得微丸颗粒圆整度好,硬度高、不易碎,释放度符合要求(详见表3、表4及图2)。丙烯酸树脂Ⅱ号、丙烯酸树脂Ⅲ号延展系数高,塑性优良,最佳配比条件下能够有效包裹麦考酚钠,形成肠溶颗粒,且与外加辅料混合制粒后,衣膜未破损,在胃酸中衣膜能保持良好的完整性,基本无释放(2 h累积释放率<1%),而模拟肠液中能快速释放(30 min累积释放率≥95%)。
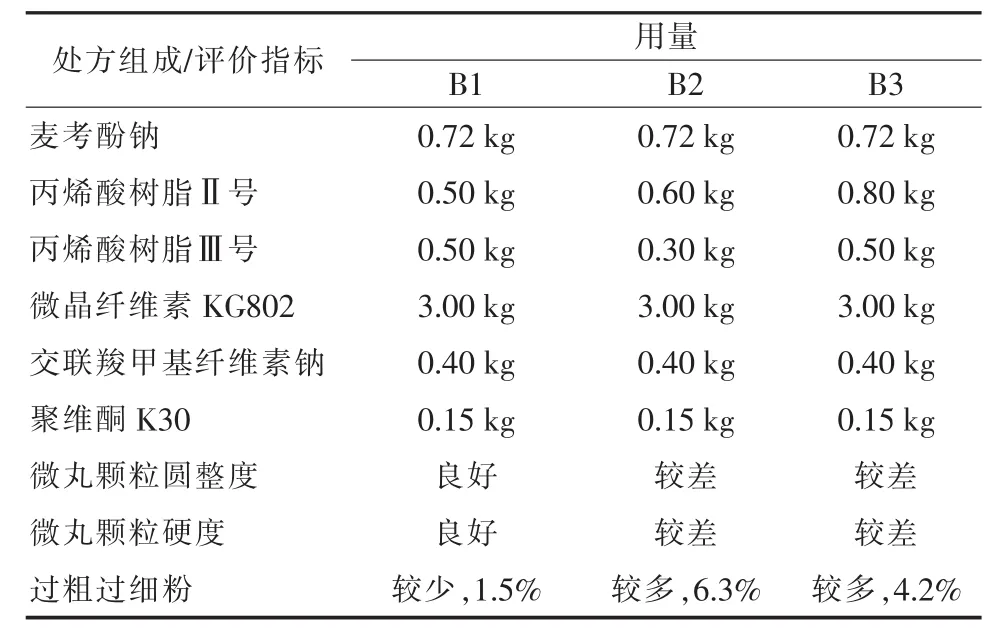
表3 不同肠溶材料配方对比结果

表4 不同肠溶材料配方微丸颗粒的释放度测定结果

图2 不同肠溶材料微丸颗粒体外释放度对比
2.2.3 制粒剪切强度对挤出-滚圆工艺及释放度的影响[5,6]该文制粒剪切包括两次,第一次为主药与肠溶材料的混合剪切,目的使麦考酚钠与肠溶材料充分接触包裹,此包裹是否完全受剪切速度及时间影响;第二次为包裹后麦考酚钠与微晶纤维素KG802、交联羧甲基纤维素钠、聚维酮k30混合剪切,此剪切强度影响微丸颗粒的圆整度、硬度及释放度。研究表明,剪切强度不能过弱,否则颗粒圆整度及硬度较差,酸性条件下肠溶衣容易破碎,导致微丸颗粒在胃中开始释放,影响在肠道释放吸收的效果;另外剪切强度也不能过强,虽然微丸颗粒圆整度及硬度较好,但在肠道中的释放较为缓慢。试验表明,该文两次剪切最佳强度为:第一次低搅低切1 min,再高搅高切3 min;第二次低搅低切2 min,高搅高切4 min(详见工艺C2)。此剪切工艺制得的微丸颗粒圆整度及硬度良好,释放度符合要求(详见表5、表6及图3)。
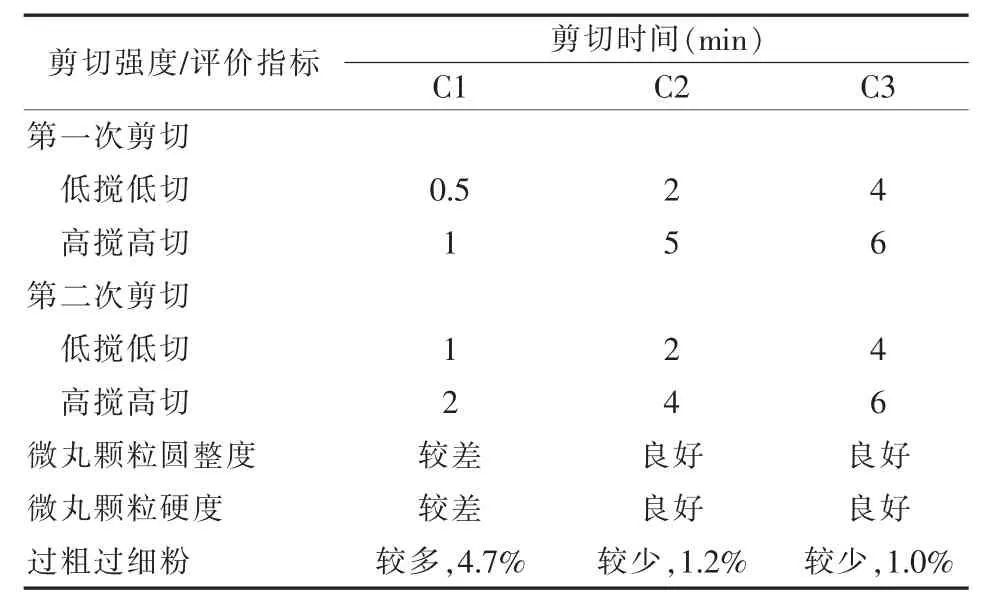
表5 不同剪切强度对比结果

图3 不同剪切强度微丸颗粒体外释放度对比

表6 不同剪切强度微丸颗粒的释放度测定结果
2.3 微丸颗粒剂体外释放度测定 取本品,照释放度测定法 (中国药典2015年版二部附录0931),采用溶出度测定法装置,以盐酸溶液(9→1000)1000 ml为释放介质,转速为100转/min,依法操作,经2 h,取溶液滤过,立即精密量取续滤液2 ml,置50 ml量瓶中,加磷酸盐缓冲液(取磷酸二氢钾6.81 g和氢氧化钠1.63 g,加水溶解并稀释到1000 ml,必要时用2 mol/L氢氧化钠溶液或2 mol/L盐酸溶液调节为pH7.5。以下磷酸盐缓冲液均为此溶液)至刻度,摇匀,作为供试品溶液Ⅰ。将搅拌桨升出液面,弃去各溶出杯中的酸液,并用约50 ml水洗去杯中样品表面残留的酸液,小心弃去洗液,加入温度为37℃磷酸盐缓冲液1000 ml,转速为100转/min,继续依法操作,再分别经 10、20、30、45 min,取溶液滤过,分别精密量取续滤液2 ml,分别置50 ml量瓶中,加磷酸盐缓冲液至刻度,摇匀,得稀释溶液,精密量取稀释溶液2 ml,置另一50 ml量瓶中,加磷酸盐缓冲液至刻度,摇匀,作为供试品溶液Ⅱ、Ⅲ、Ⅳ和Ⅵ。另取对麦考酚钠对照品适量,精密称定,加磷酸盐缓冲液适量,超声8 min使溶解,并用磷酸盐缓冲液稀释制成每1 ml约含对麦考酚钠5 μg的溶液,作为对照品溶液。取供试品溶液Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅵ和对照品溶液,照高相液相色谱测定,计算每个时间点的释放量。 色谱条件为[7,8]: 色谱柱 AgilentXDB-C8(4.6 mm×150 mm,5 μm),流动相乙腈-0.1%三氟醋酸溶液(三乙胺调节 pH 至 5.3)(35∶65),流速 1.0 ml/min,检测波长 250 nm,进样量 20 μl。 在盐酸溶液(9→1000)中释放量不得过1%;在磷酸盐缓冲液中10、20、30 min的释放量分别应为标示量的70%~80%、85%~95%、95%以上,均应符合规定。
3 讨论
以微晶纤维素KG802为填充剂,交联羧甲基纤维素纳为崩解剂,聚维酮k30为黏合剂,丙烯酸树脂Ⅱ号、丙烯酸树脂Ⅲ号为肠溶材料,提高了丸芯颗粒圆整度及硬度,充分保证制剂耐酸性及肠道中释放度符合要求。麦考酚钠肠溶片已有上市进口产品“米芙”,但其每次服用4片或2片,药片较大,服药片数较多,对片剂有吞咽困难的患者,顺应性较差,且不利于根据疗程分剂量,会破坏肠溶衣层。而制备的肠溶微丸颗粒可以分散于水中吞服,患者顺应性较好,且便于分剂量,不会破坏肠溶衣层。其次,制备肠溶微丸颗粒是多个小丸颗粒释药行为的总和,个别小丸颗粒制备上的缺陷不至于对整个制剂释药行为产生严重影响,从而保证了临床用药的安全性。此外,采用制备缓释骨架的方法制备肠溶颗粒,直接将肠溶材料与主药、辅料混合制粒、挤出、滚圆,即制得成品,避免了颗粒微丸包肠溶衣的常规工艺,节约了成本,提高了生产效率。该制备方法工艺简单、可行、重现性好;制得麦考酚钠在pH2.0盐酸溶液中2 h的释放度<1%,在pH6.8磷酸盐缓冲液中具有明显的肠溶释放特性,30 min内累积释放度高达95%以上,有效保证了麦考酚钠的生物利用度,可为免疫抑制性患者提供一种新的剂型选择。
[1]周 华,孙平平,贾志缃,等.麦考酚钠肠溶片在肾移植受者初始免疫抑制治疗的观察[J].中国药物与临床,2012,12(7):935-936.
[2] Beckert TE,Lehmann K,Schmidt PC.Compression of entericcoated pellets to disintegrating tablets [J].Int J Pharm,1996,143(7):13-23.
[3] Debunne A,Vervaet C,Mangelings D,et al.Compaction of enteric-coated pellets:influence of formulation and process parameters on tablet properties and in vivo evaluation[J].Eur J Pharm Sci,2004,22(3):305-314.
[4]王成永,时 军,王姝婧.奥美拉唑肠溶微丸制备及其质量影响因素探讨[J]. 安徽医药,2005,9(7):493-493.
[5]马 莉,赵汴霞.挤出滚圆法制备萘普生钠微丸效果分析[J].河南职工医学院学报,2012,24(4):425-427.
[6]包家汉,潘家祯.用局部因子法分析挤出-滚圆法制备的球形产品收得率[J]. 安徽工业大学学报,2002,19(3):244-247.
[7]陆春晓.吗替麦考酚酯胶囊含量和有关物质的测定[J].海峡药学,2010,22(2):48-50.
[8]张忠伟,陈一凡.吗替麦考酚酯干混悬剂的制备及含量测定[J].药学与临床研究,2011,19(1):85-86.
Development of enteric-coated mycophenolate sodium granules JIA Ke①,CHEN Mei-hong,CHEN Jian-
hua,et al.①Jinhua Pharmacy Factory of Jinhua Group Company Ltd,Xi'an,Shaanxi 710075,China
Objective Enteric -coated mycophenolate sodium granulesare prepared by extrusion -spheronization method.Methods Microcrystalline cellulose KG802 as filler, croscarmellose sodium as disintegrating agent,povidone K30 as adhesive,acrylic resinⅡand acrylic resinⅢfor enteric coated membrane materials of compositions were used to prepare enteric-coated mycophenolate sodium particles pellets by wet granulation,extrusion,spheronization.Results The drug release of the mycophenolate sodium enteric-coated granules containing these pellets would be lower than 1%in 2 h in pH2.0 HCL solution,but reach more than 95%in 30 min in pH6.8 PBS.Conclusion Microcrystalline cellulose KG802 as filler,croscarmellose sodium as disintegrating agent,povidone K30 as binder,acrylic resin Ⅱ -acrylic resin Ⅲ (1∶1) mixture as enteric material ofcomposition can be directly prepared to enteric-coated mycophenolate sodium granules by extrusion spheronization method,with release to meet the requirements.
Mycophenolate sodium;Enteric-coated granules;Extrusion-spheronization method
R943:TQ460.6
A
10.14172/j.issn1671-4008.2017.10.031
710075陕西西安,金花企业(集团)股份有限公司西安金花制药厂(贾可,陈美红,陈建华);西安和乐生物科技有限公司(孙小梅)
孙小梅,Email:1260087794@qq.com
[2017-02-15 收稿,2017-03-12 修回] [本文编辑:刘立平]
