miR-221在大鼠脑缺血再灌注神经损伤中的作用及其机制
2017-12-12孙瑛刘一民王玉丁静陈红兵
孙瑛,刘一民,王玉,丁静,陈红兵
(潍坊医学院附属益都中心医院,山东潍坊262500)
miR-221在大鼠脑缺血再灌注神经损伤中的作用及其机制
孙瑛,刘一民,王玉,丁静,陈红兵
(潍坊医学院附属益都中心医院,山东潍坊262500)
目的探讨miR-221在大鼠脑缺血再灌注神经损伤中的作用及其可能机制。方法选择SD大鼠60只,随机分为假手术组、模型组和agomiR-221组,每组20只。模型组、agomiR-221组建立局灶性脑缺血再灌注(MCAO)模型。假手术组仅手术,不阻断血流。成模后agomiR-221组尾静脉注射agomiR-221(miR-221激动剂)80 mg/kg,模型组尾静脉注射等量agomiR-NC,假手术组不予处理。再灌注24 h,各组随机取6只,留取脑组织,采用TTC染色法观察脑梗死体积;另取6只,采用干湿重法计算脑组织含水量;剩余大鼠采用原位末端标记法计算细胞凋亡指数(AI);Real-time PCR法检测脑组织miR-221 mRNA表达;Western blotting法检测脑组织炎症因子IL-1β、TNF-α及凋亡相关蛋白Caspase3表达。结果假手术组和agomiR-221组脑组织miR-211 mRNA相对表达量明显高于模型组,且agomiR-221组高于假手术组(P均<0.05)。与假手术组比较,模型组脑梗死体积、脑组织含水量及AI明显升高(P均<0.05),而agomiR-221组脑梗死体积、脑组织含水量及AI较模型组明显降低(P均<0.05)。与假手术组比较,模型组炎症因子IL-1β、TNF-α以及凋亡相关蛋白Caspse3表达明显升高(P均<0.05),而agomiR-221组炎症因子IL-1β、TNF-α以及凋亡相关蛋白Caspse3表达较模型组明显降低(P均<0.05)。结论过表达miR-221对大鼠脑缺血再灌注损伤具有神经保护作用,其机制可能与调控炎症反应和细胞凋亡有关。
脑缺血再灌注损伤;微小RNA-221;细胞凋亡;炎症因子;凋亡因子;大鼠
脑缺血再灌注损伤(CIR)是指各种原因导致脑组织血流中断,闭塞的脑血管再通后缺血性损伤却进一步加重的现象,是一个由多因素参与的复杂病理生理过程。目前CIR的发生机制主要包括细胞凋亡学说、炎症反应学说、兴奋性氨基酸学说以及自由基学说等[1]。炎症反应和细胞凋亡是诱导CIR后神经细胞损伤的主要因素。微小RNA(miRNA)是一组广泛存在于生物体中不编码蛋白质的短序列RNA,能与特定基因的mRNA 3′非编码区相结合,阻碍其翻译或直接使其降解,从而对目的基因进行调节[2]。大量研究证实,miRNAs与缺血性脑血管病关系密切[3,4]。miR-221是较早发现的miRNA家族成员之一,目前有关miR-221的研究主要集中在恶性肿瘤方面[5]。近期研究发现,缺血性脑卒中患者血清miR-221水平较健康者明显下降[3]。因此推测,miR-221在CIR的发生、发展过程中可能具有一定作用。2016年3~7月,我们观察了CIR大鼠脑组织miR-221表达变化,现分析结果并探讨其可能的作用机制。
1 材料与方法
1.1 材料 健康成年雄性SD大鼠60只,清洁级,3月龄,体质量280~300 g,由北京维通利华动物实验中心提供,合格证号:SCXK(京)2006-0009。所有大鼠标准饮食、自由摄水,湿度55%~60%,温度22~24 ℃,模拟正常昼夜交替的环境饲养。TRIzol试剂,美国Invitrogen公司;miR-221激动剂agomiR-221、阴性对照agomiR-NC,广州锐博生物科技有限公司;逆转录试剂盒(PrimeScript RT Reagent Kit with gDNA Eraser)及荧光定量PCR试剂盒(SYBR Premix Ex Taq TM),日本TaKaRa公司;所有引物由上海吉凯基因化学技术有限公司设计合成。IL-1β、TNF-α、Caspase3兔抗鼠多克隆抗体,美国Abcam公司;GAPDH兔抗鼠多克隆抗体、辣根过氧化物酶标记的羊抗兔IgG,武汉博士德生物工程有限公司;原位末端标记(TUNEL)检测试剂盒、Light Cycler PCR仪,美国罗氏公司。
1.2 模型制备及分组干预 所有大鼠适应性喂养1周,按随机数字表法分为假手术组、模型组、agomiR-221组,每组20只。模型组、agomiR-221组采用改良尼龙线栓法制作大鼠局灶性脑缺血再灌注(MCAO)模型[6]:10%水合氯醛腹腔注射麻醉,颈正中切口纵行剪开皮肤,分离皮下组织,结扎右侧颈总动脉近心段,于颈总动脉分叉处结扎颈外动脉,用微动脉夹暂时夹闭颈内动脉,在距离颈总动脉分叉部2 mm处,剪开一小口,将前端包裹石蜡的鱼线插入颈内动脉,插入深度从颈总动脉分叉部算起约18 mm,固定线栓,松开微动脉夹。假手术组基本操作同模型组和agomiR-221组,但不插入线栓,不阻断血流。模型组和agomiR-221组阻断血流120 min,将线栓拔除,恢复血流灌注。再灌注24 h,按Zea-Longa 5分制评分标准[7]评价神经功能,评分1~3分为模型制备成功。模型组和agomiR-221组各成模18只。成模后agomiR-221组阻断血流同时尾静脉注射agomiR-221 80 mg/kg,模型组阻断血流同时尾静脉注射等量agomiR-NC,假手术组不予处理。
1.3 相关指标观察
1.3.1 脑梗死体积及脑组织含水量 ①脑梗死体积:采用TTC染色法[8]。再灌注24 h,各组随机取6只,10%水合氯醛800 mg/kg麻醉后,断颈处死,完整取出脑组织,以视交叉前4 mm开始每间隔2 mm做连续冠状切片,每个脑组织切片5张,迅速浸入2% TTC染液,37 ℃恒温水浴中孵育30 min,4%多聚甲醛固定24 h,拍照,利用Image J图像分析软件测定脑梗死面积(红色区域为正常脑组织,苍白色区域为梗死区),脑梗死体积=各层梗死面积之和×层间隔。②脑组织含水量:采用干湿重法。各组随机另取6只,快速断颈处死,取大脑组织,沿脑中线切取缺血侧脑半球,用滤纸将脑组织表面的液体吸干,立即在电子分析天平上称湿重;置入110 ℃烤箱中烘烤24 h,称干重,计算脑组织含水量。脑组织含水量=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
1.3.2 大脑皮质神经细胞凋亡情况 采用TUNEL法。各组剩余大鼠10%水合氯醛800 mg/kg麻醉,断颈处死,取大脑组织常规制作石蜡切片,并按TUNEL试剂盒说明书操作进行染色。凋亡细胞TUNEL染色阳性,呈棕黄色,椭圆形或圆形,核固缩,偶见核碎裂。在光学显微镜下,选取不重复的5个400倍视野,应用显微图像分析系统计数每个视野中凋亡细胞数和细胞总数,计算细胞凋亡指数(AI)。AI=凋亡细胞数/细胞总数×100%。
1.3.3 脑组织miR-221 mRNA表达 采用Real-time PCR法。取各组剩余大鼠缺血侧大脑皮质100 mg,TRIzol法提取脑组织总RNA,紫外分光光度计检测RNA纯度和浓度,OD260/OD280为1.8~2.1。按逆转录试剂盒说明将总RNA逆转录为cDNA。以cDNA为模板进行PCR扩增。引物序列:miR-221上游引物:5′-CAGCATACATGATTCCTTGTGA-3′,下游引物:5′-CTTTGGTGTTTGAGATGTTTGG-3′。参照Real-time PCR试剂盒说明书配置PCR反应体系。PCR反应条件:95 ℃预变性3 min,95 ℃变性3 s,56 ℃退火34 s,72 ℃延伸10 s,共40个循环。以U6为内参,采用2-ΔΔCt法计算miR-221 mRNA相对表达量。实验重复3次,取平均值。
1.3.4 脑组织IL-1β、TNF-α、Caspase3蛋白表达 采用Western blotting法。取各组剩余大鼠缺血侧大脑皮质100 mg,加入裂解液,充分研磨裂解,12 000 r/min离心10 min,收集上清液,BCA法蛋白定量后加入上样缓冲液混匀,100 ℃水浴15 min,使蛋白充分变性。蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离,并转移至PVDF膜上,5%脱脂牛奶封闭2 h,一抗(IL-1β 1∶1 000,TNF-α 1∶1 000,Caspase3 1∶1 000,GAPDH 1∶2 000)4 ℃摇床孵育过夜,次日洗膜,加入HRP标记的二抗(1∶1 000),室温孵育1 h,洗膜,ECL发光,曝光显影。采用Image J软件分析各蛋白电泳条带灰度值。以目的蛋白电泳条带灰度值与内参GAPDH条带灰度值的比值作为目的蛋白的相对表达量。

2 结果
2.1 各组脑梗死体积、脑组织含水量比较 见表1。
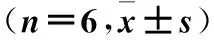
表1 各组脑梗死体积及脑组织含水量比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
2.2 各组大脑皮质神经细胞凋亡情况比较 假手术组脑组织切片偶见TUNEL染色阳性细胞,AI为(2.38±0.41)%;模型组可见大量TUNEL染色阳性细胞,AI为(38.46±5.89)%;agomiR-221组TUNEL染色阳性细胞较模型组明显减少,AI为(22.71±4.67)%。agomiR-221组和模型组AI均高于假手术组,且模型组高于agomiR-221组(P均<0.05)。
2.3 各组脑组织miR-221表达比较 假手术组、模型组和agomiR-221组脑组织miR-211 mRNA相对表达量分别为1.01±0.03、0.44±0.09、3.11±0.18。假手术组和agomiR-221组脑组织miR-211 mRNA相对表达量明显高于模型组,且agomiR-221组高于假手术组(P均<0.05)。
2.4 各组脑组织IL-1β、TNF-α、Caspase3蛋白表达比较 见表2。
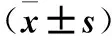
表2 各组脑组织IL-1β、TNF-α、Caspase3蛋白相对表达量比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
脑缺血可导致中枢神经系统大量神经细胞的缺失和神经网络受损,在短期内恢复血流灌注,神经系统损伤却进一步加重,这种现象被称为CIR。CIR对机体造成的损伤远远超过缺血损害,其作用机制尚不完全清楚。
近年研究发现,miRNA可能参与调控CIR的病理过程。有学者采用microarray方法对脑卒中患者和正常人的外周血检测发现,多种miRNA在脑卒中急性期出现变异[9,10];在缺血再灌注模型大鼠脑组织内也发现多种miRNA的变异[11]。Yin等[12]研究发现,MCAO模型大鼠脑组织miR-497表达升高,抑制miR-497表达可明显减少脑缺血再灌注大鼠脑梗死体积。Jeyaseelan等[13]利用基因芯片技术检测脑缺血再灌注大鼠脑组织miRNA表达,发现30余种miRNA表达发生明显变化,并认为这些miRNA可能参与了CIR过程。miR-221基因位于染色体Xp11.3附近,在血管生成过程中具有重要作用[14],且与恶性肿瘤的发生、发展有关[8]。目前,国内外关于miR-221与CIR关系的研究甚少。Tsai等[3]研究发现,缺血性脑卒中患者血清miR-221表达降低,提示miR-221可能与脑缺血性损伤有关。本研究结果显示,模型组脑组织miR-221表达明显低于假手术组,表明miR-221表达降低可能与CIR的发生有关。为进一步明确miR-221在CIR大鼠中的作用,本研究通过尾静脉注射miR-221激动剂agomiR-221,成功构建体内过表达miR-221的MCAO大鼠模型;结果发现,agomiR-221组CIR后AI、脑梗死区体积及脑组织含水量均明显低于模型组,表明过表达miR-221可显著改善CIR。
CIR的发生机制尚不完全明确,涉及氧自由基、钙超载、能量代谢异常、炎症反应及细胞凋亡等方面。炎症反应和细胞凋亡可能是CIR后神经细胞损伤的主要原因,其中关系最为密切的炎性因子有IL-1β、IL-6和TNF-α等。本研究结果显示,模型组脑组织IL-1β、TNF-α蛋白表达较假手术组明显升高,而agomiR-221组较模型组明显降低,表明miR-221可能通过调控炎性因子IL-1β、TNF-α表达,继而抑制CIR。Caspases是细胞凋亡的启动者和执行者,Caspase3是Caspases家族最关键的凋亡蛋白酶。本研究结果显示,模型组脑组织Caspase3蛋白表达较假手术组明显升高,而agomiR-221组Caspase3蛋白表达较模型组明显降低,表明miR-221可能通过调控Caspase3表达继而抑制CIR。以上结果表明,miR-221可能通过调控炎症反应和细胞凋亡参与抑制CIR进程。
综上所述,miR-221过表达对大鼠CIR具有神经保护作用;其机制可能与调控炎症反应和细胞凋亡有关。
[1] Carden DL, Granger DN. Pathophysiology of ischaemia-reperfusion injury[J]. J Pathol, 2000,190(3):255-266.
[2] Pasquinelli AE. MicroRNAs and their targets: recognition, regulation and an emerging reciprocal relationship[J]. Nat Rev Genet, 2012,13(4):271-282.
[3] Tsai PC, Liao YC, Wang YS, et al. Serum microRNA-21 and microRNA-221 as potential biomarkers for cerebrovascular disease[J]. J Vasc Res, 2013,50(4):346-354.
[4] Gan CS, Wang CW, Tan KS. Circulatory microRNA-145 expression is increased in cerebral ischemia[J]. Genet Mol Res, 2012,11(1):147-152.
[5] Wang YC, Liu JS, Tang HK, et al. miR-221 targets HMGA2 to inhibit bleomycin-induced pulmonary fibrosis by regulating TGF-β1/Smad3-induced EMT[J]. Int J Mol Med, 2016,38(4):1208-1216.
[6] 尉娜,李静,李娟,等.腺苷预处理对局灶性脑缺血再灌注损伤大鼠的脑保护作用及其机制[J].山东医药,2016,56(20):33-35.
[7] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989,20(1):84-91.
[8] Feng C, Fan X, Zhang C, et al. On the quantitative analysis of focal ischemic cerebral infarction by TTC staining[J]. Sheng Wu Yi Xue Gong Cheng Xue Za Zhi, 2009,26(6):1363-1366.
[9] Sørensen SS, Nygaard AB, Nielsen MY, et al. miRNA expression profiles in cerebrospinal fluid and blood of patients with acute ischemic stroke[J]. Transl Stroke Res, 2014,5(6):711-718.
[10] Liu DZ, Tian Y, Ander BP, et al. Brain and blood microRNA expression profiling of ischemic stroke, intracerebral hemorrhage, and kainate seizures[J]. J Cereb Blood Flow Metab, 2010,30(1):92-101.
[11] Lei P, Li Y, Chen X, et al. Microarray based analysis of microRNA expression in rat cerebral cortex after traumatic brain injury[J]. Brain Res, 2009(1284):191-201.
[12] Yin KJ, Deng Z, Huang H, et al. miR-497 regulates neuronal death in mouse brain after transient focal cerebral ischemia[J]. Neurobiol Dis, 2010,38(1):17-26.
[13] Jeyaseelan K, Lim KY, Armugam A. MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion[J]. Stroke, 2008,39(3):959-966.
[14] Meier P, Schirmer SH, Lansky AJ, et al. The collateral circulation of the heart[J]. BMC Med, 2013(11):143.
陈红兵(E-mail: chb0536@aliyun.com)
10.3969/j.issn.1002-266X.2017.40.012
R743
A
1002-266X(2017)40-0045-03
2016-12-16)
