基于尿苷二磷酸葡萄糖醛酸转移酶1解毒通路探讨枸杞汁对邻苯二甲酸二(2-乙基己基)酯代谢的干预作用
2017-12-11贺永健黄少文刘瑞菁万发达柳春红
贺永健,黄少文,刘瑞菁,万发达,杨 婕,刘 焕,柳春红,*
(1.华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642;2.青海大漠红枸杞有限公司,青海 西宁 810000)
基于尿苷二磷酸葡萄糖醛酸转移酶1解毒通路探讨枸杞汁对邻苯二甲酸二(2-乙基己基)酯代谢的干预作用
贺永健1,黄少文1,刘瑞菁1,万发达2,杨 婕1,刘 焕1,柳春红1,*
(1.华南农业大学食品学院,广东省食品质量安全重点实验室,广东 广州 510642;2.青海大漠红枸杞有限公司,青海 西宁 810000)
目的:通过大鼠毒性干预实验观察枸杞汁对邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl) phthalate,DEHP)染毒大鼠肝脏中尿苷二磷酸葡萄糖醛酸转移酶1(uridine diphosphate glucuronosyltransferase 1,UGT1)活性及代谢解毒的影响,探讨枸杞汁对DEHP代谢的干预效果。方法:60 只雄性大鼠随机分为对照组、DEHP组和枸杞汁干预组,每组20 只,DEHP组和干预组在DEHP一次染毒(3 000 mg/kg mb)后连续7 d分别灌胃生理盐水和枸杞汁,对照组则给予同等体积的芝麻油或生理盐水,期间每天收集大鼠24 h尿液。在染毒1、3、5、7 d后各组分别随机处死5 只。采用试剂盒检测肝脏UGT1的活力,高效液相色谱法检测血清中的邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethylhexyl) phthalate,MEHP)以及尿液MEHP和邻苯二甲酸(phthalic acid,PA)含量。结果:枸杞汁干预组大鼠第5天UGT1活性显著高于DEHP组和对照组(p<0.05),且相对于DEHP组血清中MEHP含量减少而尿液中MEHP和PA含量增加。结论:枸杞汁可能通过提高UGT1活力促进了DEHP的代谢与排泄,发挥了解毒效应,将来可能作为一种预防或对抗邻苯二甲酸酯类物质或其他有毒化学物潜在危害的保健药材或功能食品用于人群的健康防护。
邻苯二甲酸二(2-乙基己基)酯;尿苷二磷酸葡萄糖醛酸转移酶1;枸杞汁;干预
邻苯二甲酸酯类物质(phthalate esters,PAEs)又称酞酸酯,是生产塑料制品时广泛使用的一种化学添加剂,加入该类物质可增加塑料的可塑性和柔韧性,以此来增强塑料制品的强度。PAEs可通过呼吸道、消化道和皮肤等途径进入人体[1],目前,在人的尿液、乳汁、血液和精液等体液中都已检测出PAEs[2-5]。邻苯二甲酸二(2-乙基己基)酯(di-(2-ethylhexyl) phthalate,DEHP)是一种重要的PAEs化合物,由于其易从塑料制品中迁移出来,导致其在环境中浓度逐渐升高,污染日趋严重[6]。已有研究表明DEHP及其代谢产物邻苯二甲酸单(2-乙基己基)酯(mono-(2-ethylhexyl) phthalate,MEHP)的毒性作用具体表现为生殖内分泌毒性、胚胎发育毒性、免疫毒性、神经毒性以及血液和生化方面的改变等[7-9]。同时,也有研究认为DEHP的毒性作用可能为在体内的代谢产物MEHP所致[10]。在机体中,一部分DEHP直接以原型被吸收,另一部分受胰腺酶和肠道内一些酶的作用,迅速由双酯转化为单酯,主要代谢产物是MEHP,还有诸如邻苯二甲酸单(2-乙基-5-氢己基)酯、邻苯二甲酸单(2-乙基-5氧已基)酯等产物[11]。其产物的排出途径之一是在尿苷二磷酸葡萄糖醛酸转移酶(the uridine diphosphate glucuronosyltransferase,UGT)的催化下与葡萄糖醛酸结合,实现Ⅱ相生物转化,增强其水溶性、降低其生物活性从尿液中代谢排出[12-13]。部分DEHP会在24 h内经由尿液、粪便或者汗液排出体外,而MEHP则会在人体组织中长期蓄积,生物蓄积时间可长达6 个月[11,14]。UGT广泛存在于机体各种组织中,肝脏中UGT酶活力最高。其主要作用是与Ⅰ相反应后的功能基团发生葡萄糖醛酸结合反应使其水溶性增加而随胆汁或尿液排出体外。根据克隆的cDNA序列的相似性,Burchell等[15]建议将UGT分为UGT1和UGT2两个家族,分别参与外源化学物(如酚)和内源胆红素代谢和类固醇代谢,UGT1和UGT2两个家族又可分为许多亚族酶系统。广东省食品质量安全重点实验室前期PAEs暴露的尿液生物标志物研究表明:大鼠尿液中的所有PAEs代谢物的酸水解产物邻苯二甲酸(phthalic acid,PA)与PAEs暴露量有良好的相关性,即以尿液水解后的PA作为PAEs暴露的生物标志物,可很好地反映PAEs的外暴露水平[16]。
传统医学认为,枸杞的一个重要作用是养肝护肝,且多认为其作用机制可能与其抗氧化有关。枸杞中含有枸杞多糖、多酚类、类胡萝卜素、甾醇、各种蛋白质和游离氨基酸等成分,其药理作用除了保护肝脏以外,还具有抗衰老、抗肿瘤、抗辐射及增强机体免疫力等作用[17-19]。正是由于大家对枸杞功效的认可,几千年来枸杞一直被用作一种传统的中药和食品,广泛用于煲汤、泡茶等[20]。
由于环境和食品包装材料中的塑化剂普遍存在,导致人类无时无刻不在接触PAEs,这也使得广泛暴露而且对人体健康具有潜在威胁的PAEs得到特别的关注。本研究以大鼠为实验对象,根据预防为主的卫生策略,从UGT1解毒通路探讨枸杞汁对DEHP代谢的干预作用,以期为将来进一步挖掘枸杞的保健功能、开发解毒功能食品提供参考,同时也为揭示枸杞的养肝护肝机制提供依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级Sprague-Dawley(SD)雄性大鼠60 只,购自南方医科大学动物实验中心,实验动物合格证号SCXK(粤)2013-0002,体质量180~210 g。
DEHP、MEHP、β-葡糖苷酸酶 美国Sigma公司;邻苯二甲酸 德国Dr. Ehrenstorfer公司;枸杞汁 青海大漠红枸杞有限公司;UGT1试剂盒 上海江莱生物科技有限公司;食品级芝麻油 海天味业。
1.2 仪器与设备
LC-20A高效液相色谱仪(配SPD-20A及RF-20A检测器)日本岛津公司;5810R台式冷冻离心机 德国Eppendorf公司;EL204-IC电子天平 瑞士Mettler Toledo公司;FS 110超声波清洗机 美国Thermo Fisher公司;大鼠代谢笼配不锈钢支架 苏州市标正有限公司。
1.3 方法
1.3.1 实验设计
60 只大鼠放置于动物房代谢笼中饲养,自由摄食和饮水,光/暗周期12 h/12 h(光照时间7:00~19:00),室内温度为(22.0±0.5)℃,相对湿度为50%~60%。适应性饲养7 d后,按体质量采用随机区组设计分组法分为3 组(每组20 只):对照组、DEHP组和枸杞汁干预组。第1天上午9时,DEHP组和枸杞汁干预组以溶于芝麻油的DEHP溶液染毒,对照组则以等体积的芝麻油灌胃,1 h后枸杞汁干预组用枸杞汁灌胃,对照组和DEHP组则用等体积的生理盐水灌胃。第2天开始,一直到第7天,每天上午9时,枸杞汁干预组继续灌胃枸杞汁,对照组和DEHP组则灌胃等体积的生理盐水。DEHP染毒剂量为3 000 mg/kg mb。所用枸杞汁为枸杞原汁,主要活性成分为枸杞多糖[20],根据GB/T 18672—2014《枸杞》测得该枸杞汁中枸杞多糖质量浓度为10 mg/mL,结合Shan Xiaozhong等[21]研究中枸杞多糖的效应剂量和成年大鼠胃容量最大值,选择灌胃剂量为8 mL/kg mb,即枸杞多糖灌胃剂量为80 mg/kg mb,此时枸杞多糖剂量接近显著作用剂量,同时也避免了枸杞汁灌胃体积过大而造成损失。在灌胃1、3、5、7 d后的每个上午9时各组随机处死5 只。
1.3.2 样品采集
从首次灌胃开始,每天收集大鼠24 h尿液,测量体积并冻存于-80 ℃冰箱中。按实验既定时间,对隔天处死的动物则采集血样,离心后将血清-80 ℃冻存备测,同时在无菌操作台迅速分离肝脏并-80 ℃冷冻保存。
1.3.3 样品分析
1.3.3.1 肝微粒体UGT1活力测定
采用差速离心法制备大鼠肝微粒体。取适量肝脏剪碎,用0.05 mol/L pH 7.4 Tris-HCl缓冲液反复冲洗,按1∶4(m/V)加入0.05 mol/L pH 7.4 Tris-HCl缓冲液,用玻璃匀浆器制成肝匀浆。将制备好的肝匀浆在超速冷冻离心机上10 000×g离心20 min。取上清液100 000×g离心60 min,上清液为胞液,淡红色沉淀即为肝微粒体[22]。以上所有操作均在冰浴上进行。其UGT1活力参照试剂盒说明书测定。
1.3.3.2 样品中MEHP质量浓度测定
将冻存样品取出解冻后13 000 r/min离心5 min。移取适量样品(1 mL尿液或0.4 mL血清)上清液超声处理5 min,然后加入250 µL醋酸铵溶液(1 mol/L,pH 6.5)和20 μL β-葡糖苷酸酶,摇匀、密封放入37 ℃的水浴中酶解90 min。酶解处理后的样品中加入3 mL乙酸乙酯,涡旋振荡器上充分振荡5 min后,以4 000 r/min离心5 min。吸取上层乙酸乙酯相至10 mL离心管中,在氮吹仪上吹至近干。下层样品中再加入3 mL乙酸乙酯,重复以上步骤3 次。用500 μL乙腈溶解,经0.22 μm有机系微孔滤膜过滤后转移至液相进样瓶中,用于高效液相色谱分析[23]。
1.3.3.3 样品中PA质量浓度测定
将冻存样品取出解冻后12 000 r/min离心20 min,取1 mL上清液,加入20 μL β-葡糖苷酸酶、250 µL 1 mol/L醋酸铵缓冲液,37 ℃恒温振荡90 min。再加250 µL浓度为5 mol/L的NaOH溶液,于(95±5)℃水浴回流加热90 min,用体积分数50%盐酸水溶液将水解液pH值调为1~2,漩涡振荡3 min后,超声波振荡20 min。加入3 mL正己烷,漩涡振荡3 min,4 000 r/min离心5 min,弃去正己烷层,加入3 mL乙酸乙酯,漩涡振荡3 min,4 000 r/min离心5 min,取乙酸乙酯层,剩余液体中再加入3 mL乙酸乙酯,重复上述操作,将4 次萃取液合并,40 ℃氮气吹至近干。用1 mL色谱级甲醇复溶,超声5 min易于溶解,用0.22 μm有机滤膜过滤,用于高效液相色谱分析[16]。
1.3.3.4 MEHP和PA排泄率计算
分别根据式(1)、(2)计算MEHP和PA的排泄率。
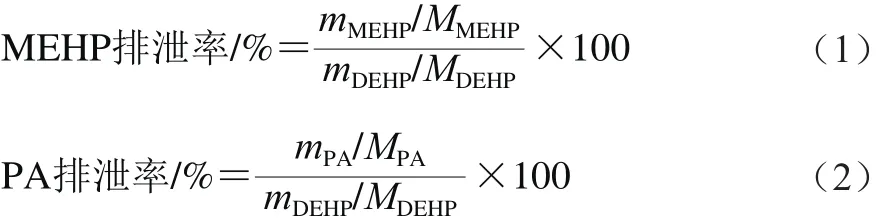
式中:mDEHP为DEHP实际摄入量/g;MDEHP为DEHP的相对分子质量(390.56);mMEHP为样品中MEHP的质量/g;MMEHP为MEHP的相对分子质量(278.34);mPA为样品中PA的质量/g;MPA为PA的相对分子质量(166.13)。
1.4 数据统计分析
采用Excel软件录入数据,使用SPSS 18.0软件进行统计学分析,实验数据用 ±s表示,多组间比较采用单因素方差分析。进一步进行组间两两比较,若方差齐时,采用LSD检验;若方差不齐,采用Tamhane’s检验,差异显著水平为p<0.05,极显著水平为p<0.01。
2 结果与分析
2.1 染毒及干预条件下大鼠肝脏UGT1活力的动态变化
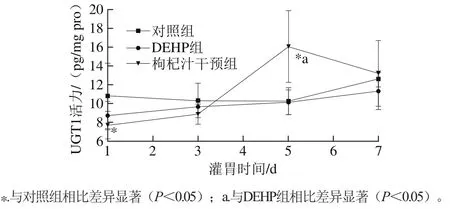
图1 肝脏UGT1活力的变化趋势Fig. 1 Variation in hepatic UGT1 activity during administration
大鼠肝脏UGT1活力的变化趋势如图1所示。对照组和DEHP组的UGT1活力变化趋势相对平稳;枸杞汁干预组呈现上升后下降的趋势,且在第5天的UGT1活力与对照组和DEHP组相比,差异都有显著性意义(p<0.05)。
2.2 染毒及干预条件下大鼠血清中MEHP检出量的变化

表1 大鼠血清MEHP检出量(n=5)Table 1 MEHP concentration in serum of rats at different administration times (n= 5)
由表1可知,对照组大鼠血清在实验期间未检测到MEHP;DEHP组大鼠血清的MEHP检出量随时间延长而下降,直到染毒后第7天才没有MEHP检出;枸杞汁干预组大鼠血清仅在染毒后第1天有MEHP检出,且检出量低于DEHP组,染毒后第3天已无MEHP检出。其中在第1天DEHP组血清的MEHP检出量与对照组相比差异极显著(p<0.01)。
2.3 染毒及干预对大鼠尿液MEHP检出量和排泄率的影响
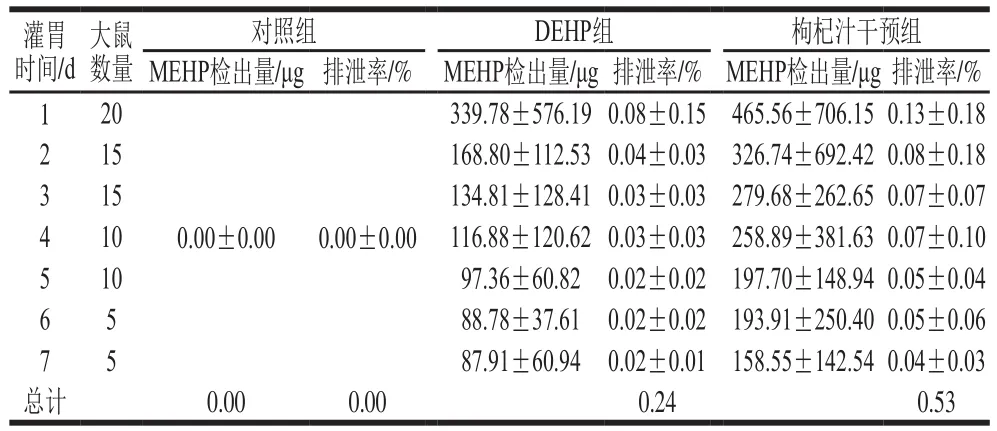
表2 大鼠尿液中MEHP检出量和排泄率Table 2 Urinary concentrations and excretion rates of MEHP in rats
由表2可知,对照组尿液在实验期间未有MEHP检出;DEHP组和枸杞汁干预组尿液MEHP的检出量都随时间延长而呈下降趋势;在相同时间点枸杞汁干预组尿液MEHP的检出量和排泄率都高于DEHP组。综合表1、2,枸杞汁干预组大鼠相对于DEHP组,其MEHP在血清中持续的时间短,被代谢和排出的速率快。
2.4 染毒及干预对大鼠尿液中PA的检出量和排泄率的影响
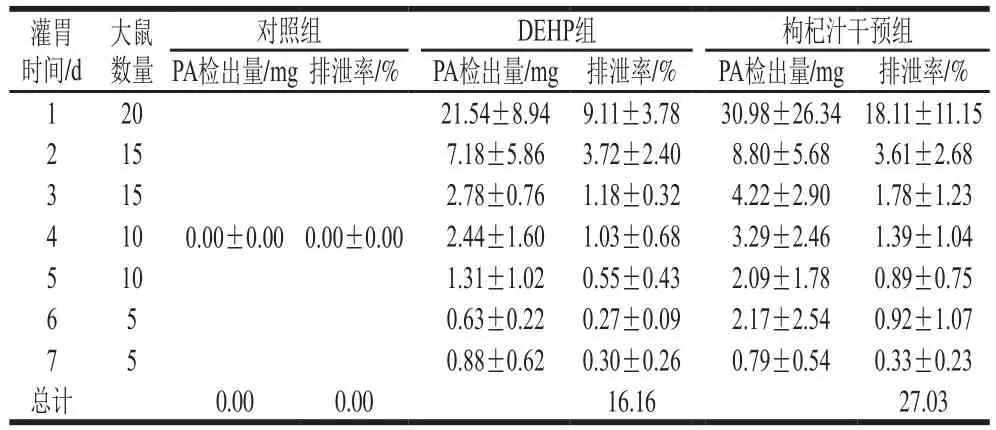
表3 大鼠尿液中PA的检出量和排泄率Table 3 Urinary concentrations and excretion rates of PA in rats
由表3可知,对照组尿液在实验期间未有PA检出;DEHP组和枸杞汁干预组尿液PA的检出量都随时间延长而呈下降趋势;在相同时间点枸杞汁干预组尿液PA的检出量和排泄率基本都高于DEHP组。
3 讨 论
葡萄糖醛酸结合反应是生物体内重要的Ⅱ相代谢途径,主要是由UGT催化完成的。肝脏是UGT含量最丰富也是葡萄糖醛酸结合代谢最活跃的器官,大量的葡萄糖醛酸化反应在此发生[24]。本研究发现,DEHP染毒之后采用枸杞汁干预,其肝脏UGT1活力在第5天上升至最高,且与对照组和DEHP组相比都有显著性差异(p<0.05);同时,枸杞汁干预组血清中MEHP检出量相对于DEHP组都减少而尿液中MEHP检出量都增加。相应的变化数据表明枸杞汁干预增加UGT1的活力,UGT1活力增加则促进了代谢产物MEHP的排泄,由此将减少有毒产物MEHP潴留对机体的影响。从UGT1变化趋势来看,UGT1活力在第5天升高后的第7天并没有持续上升,反而开始下降,这可能是因为本实验DEHP是一次性染毒,UGT1是促进DEHP排泄的,随着时间延长,动物体内的DEHP会逐渐排出。由于需要代谢排泄的DEHP减少,需要去与DEHP初级代谢物结合的UGT1也就会减少,所以UGT1不会一直升高。
大鼠尿液中PA是PAEs(本实验为DEHP)所有尿液代谢产物的共同酸水解产物,反映DEHP的总体排出量[16]。在本研究中大鼠尿液中PA检出量均随时间延长而逐渐降低,但枸杞汁干预组相对于DEHP组检出量更高,且排泄率也有不同程度增加,表明枸杞汁使DEHP的总代谢产物排出增加。大鼠血清MEHP检出量在枸杞汁干预后的第1天就低于DEHP组,第3天未检出,一方面可能是枸杞汁通过诱导UGT1来加速MEHP的排泄,另一方面可能也存在枸杞汁抑制DEHP吸收的作用,后者还有待于进一步探讨研究。PAEs为一类人工合成的内分泌干扰物,有学者研究指出,枸杞对同为内分泌干扰物的双酚A有缓解其所造成的生殖损伤毒性作用,是有效中药成分之一[25]。本研究则从枸杞汁对Ⅱ相解毒酶UGT1的诱导方面来探讨枸杞的解毒效应,从另一角度证实了枸杞对肝脏的保护作用及对外源有毒物质的干预效应。枸杞多糖是枸杞中主要的生物活性成分,具有广泛的药理作用,对机体的免疫功能和抗氧化能力有显著的增强作用[26-27],结合枸杞多糖对内分泌干扰物诱导的损伤起到的缓解作用[28],推测枸杞多糖可能是枸杞汁发挥解毒效应的一个重要成分。
UGT是Ⅱ相代谢中最重要的酶,与常见的Ⅰ相CYP450酶相比,研究相对滞后。本实验通过比较DEHP染毒后大鼠血清中MEHP检出量、尿液中MEHP和PA检出量与UGT1活力的实时变化,探讨了UGT1在DEHP代谢中发挥的作用和相关机制。实验结果显示大鼠体内DEHP的代谢与UGT1有着密切联系。Silva[13]和Koch[29]等研究报道,UGT在DEHP初级代谢物的Ⅱ相生物转化阶段中起到重要的催化作用,促进其进一步转化为亲水的葡糖苷酸结合物,其中的机制可能是UGT与DEHP代谢物结合而增强水溶性,同时减弱生物活性,并促进其排泄。从已有的文献来看,DEHP对代谢酶的影响可能有两条途径,一方面,DEHP或其代谢物对Ⅰ相代谢酶有直接的诱导作用[30],可能也对UGT1有同样的直接诱导效应;另一方面,DEHP可通过孕烷X受体途径引起Ⅰ相代谢酶活力增加[31],其进入机体后也可能激活孕烷X受体通路再进一步调节UGT1的表达。此外,UGT是组成型雄烷受体的下游效应靶基因之一[32],所以DEHP也可能通过诱导组成型雄烷受体而对UGT1的转录产生影响。
综上所述,大鼠肝脏中UGT1对DEHP代谢物的排出具有促进作用,枸杞汁能够显著上调UGT1活力,降低血清中MEHP含量,加速DEHP的清除,进而可以对抗因DEHP潴留造成的毒性作用。本研究初步证实了枸杞汁对DEHP暴露具有明显的干预效应,即枸杞将来可能作为一种预防或对抗PAEs或其他有毒化学物潜在危害的保健药材或功能食品。
[1] WORMUTH M, SCHERINGER M, VOLLENWEIDER M, et al.What are the sources of exposure to eight frequently used phthalic acid esters in Europeans?[J]. Risk Analysis, 2006, 26(3): 803-824.DOI:10.1111/j.1539-6924.2006.00770.x.
[2] PREUSS R, KOCH H M, ANGERER J. Biological monitoring of the five major metabolites of di-(2-ethylhexyl) phthalate (DEHP) in human urine using column-switching liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, 2005, 816(1/2):269-280. DOI:10.1016/j.jchromb.2004.11.048.
[3] CALAFAT A M, BROCK J W, SILVA M J, et al. Urinary and amniotic fl uid levels of phthalate monoesters in rats after the oral administration of di(2-ethylhexyl) phthalate and di-n-butyl phthalate[J]. Toxicology,2005, 217(1): 22-30. DOI:10.1016/j.tox.2005.08.013.
[4] MORTENSEN G K, MAIN K M, ANDERSSON A, et al.Determination of phthalate monoesters in human milk, consumer milk,and infant formula by tandem mass spectrometry (LC-MS-MS)[J].Analytical and Bioanalytical Chemistry, 2005, 382(4): 1084-1092.DOI:10.1007/s00216-005-3218-0.
[5] SILVA M J, SAMANDARAMANDAR E, PREAU J L, et al.Automated solid-phase extraction and quantitative analysis of 14 phthalate metabolites in human serum using isotope dilution-highperformance liquid chromatography-tandem mass spectrometry[J].Journal of Analytical Toxicology, 2005, 29(8): 819-824.
[6] 徐毅, 薛山, 贺稚非, 等. 食品包装中增塑剂DEHP毒性特点及迁移研究进展[J]. 食品工业科技, 2013, 34(21): 385-389. DOI:10.13386/j.issn1002-0306.2013.21.036.
[7] DO R P, STAHLHUT R W, PONZI D, et al. Non-monotonic dose effects of in utero exposure to di(2-ethylhexyl) phthalate (DEHP)on testicular and serum testosterone and anogenital distance in male mouse fetuses[J]. Reproductive Toxicology, 2012, 34(4): 614-621.
[8] LU Yali, ZHANG Peng, LI Chenghua, et al. Characterisation of immune-related gene expression in clam (Venerupis philippinarum)under exposure to di(2-ethylhexyl) phthalate[J]. Fish and Shellfish Immunology, 2013, 34(1): 142-146. DOI:10.1016/j.fsi.2012.10.015.
[9] BIEMANN R, SANTOS A N, SANTOS A N, et al. Endocrine disrupting chemicals affect the adipogenic differentiation of mesenchymal stem cells in distinct ontogenetic windows[J].Biochemical and Biophysical Research Communications, 2012,417(2): 747-752. DOI:10.1016/j.bbrc.2011.12.028.
[10] 杨文杰. DEHP和MEHP神经发育毒性的体外研究[D]. 武汉: 华中科技大学, 2010: 48-52. DOI:10.7666/d.d153151.
[11] 王丽, 袁晶, 张荣. 邻苯二甲酸二(2-乙基己基)酯环境暴露与人群健康研究进展[J]. 环境与健康杂志, 2009, 26(5): 465-467.
[12] ITO Y, YOKOTA H, WANG Ruisheng, et al. Species dif f erences in the metabolism of di(2-ethylhexyl) phthalate (DEHP) in several organs of mice, rats, and marmosets[J]. Archives of Toxicology, 2005, 79(3):147-154. DOI:10.1007/s00204-004-0615-7.
[13] SILVA M J, BARR D B, REIDY J A, et al. Glucuronidation patterns of common urinary and serum monoester phthalate metabolites[J].Archives of Toxicology, 2003, 77(10): 561-567. DOI:10.1007/s00204-003-0486-3.
[14] SCHETTLER T. Human exposure to phthalates via consumer products[J]. International Journal of Andrology, 2006, 29(1): 134-139.DOI:10.1111/j.1365-2605.2005.00567.x.
[15] BURCHELL B, NEBERT D W, NELSON D R, et al. The UDP glucuronosyltransferase gene superfamily: suggested nomenclature based on evolutionary divergence[J]. DNA and Cell Biology, 1991,10(7): 487-494. DOI:10.1089/dna.1991.10.487.
[16] 柳春红, 张明明, 赖玉婷, 等. 邻苯二甲酸酯暴露的大鼠尿液生物标志物研究[J]. 中国环境科学, 2015, 35(9): 2868-2873. DOI:10.3969/j.issn.1000-6923.2015.09.046.
[17] AMAGASE H, NANCE D M. A randomized, double-blind, placebocontrolled, clinical study of the general effects of a standardized Lycium barbarum (Goji) juice, GoChi[J]. The Journal of Alternative and Complementary Medicine, 2008, 14(4): 403-412. DOI:10.1089/acm.2008.0004.
[18] 朱彩平. 枸杞多糖的结构分析及生物活性评价[D]. 武汉: 华中农业大学, 2006: 11-19.
[19] 黄霞, 肖丙秀, 赵军伟, 等. 枸杞多糖对人肝癌细胞HepG2生长的影响及其分子机制[J]. 中草药, 2010, 41(9): 1501-1503.
[20] 如克亚·加帕尔, 孙玉敬, 钟烈州, 等. 枸杞植物化学成分及其生物活性的研究进展[J]. 中国食品学报, 2013, 13(8): 161-172.DOI:10.16429/j.1009-7848.2013.08.001.
[21] SHAN Xiaozhong, ZHOU Junlai, MA Tao, et al. Lycium barbarum polysaccharides reduce exercise-induced oxidative stress[J].International Journal of Molecular Sciences, 2011, 12(2): 1081-1088.DOI:10.3390/ijms12021081.
[22] 张盼盼. 乌头碱在大鼠体内和肝微粒体的代谢及其药物相互作用的研究[D]. 石家庄: 河北医科大学, 2016: 64-65.
[23] 王玮, 郭欣, 闻福, 等. 孕妇尿中五种邻苯二甲酸酯代谢产物的液-液萃取反相高效液相色谱测定法[J]. 环境与健康杂志, 2011, 28(8):711-713.
[24] 姜杉, 郝海平, 王广基. 肝损状态下尿苷二磷酸葡萄糖醛酸转移酶研究进展[J]. 中国临床药理学与治疗学, 2009, 14(12): 1321-1328.
[25] 李晓彩. 枸杞多糖对双酚A所致小鼠睾丸生精细胞凋亡的抑制作用研究[D]. 保定: 河北农业大学, 2012: 21-26.
[26] 蒋万志, 张洪泉. 枸杞多糖在免疫和抗衰老方面的研究进展[J].中国野生植物资源, 2010, 29(2): 5-7; 14. DOI:10.3969/j.issn.1006-9690.2010.02.002.
[27] XIN Yanfei, ZHOU Guoliang, DENG Zuyue, et al. Protective ef f ect of Lycium barbarum on doxorubicin-induced cardiotoxicity[J].Phytotherapy Research, 2007, 21(11): 1020-1024.
[28] 孙小娜. 枸杞多糖、槲皮素对双酚A致小鼠睾丸损伤的保护作用[D]. 保定: 河北农业大学, 2011: 22-24.
[29] KOCH H M, BOLT H M, PREUSS R, et al. New metabolites of di(2-ethylhexyl) phthalate (DEHP) in human urine and serum after single oral doses of deuterium-labelled DEHP[J]. Archives of Toxicology,2005, 79(7): 367-376. DOI:10.1007/s00204-004-0642-4.
[30] 葛建, 林芳, 邓同乐, 等. 塑料中PAEs环境污染物向食品模拟物中迁移及对CYP3A4和芳香化酶的影响[J]. 中国食品学报, 2014, 14(11):165-170. DOI:10.16429/j.1009-7848.2014.11.030.
[31] COOPER B W, CHO T M, THOMPSON P M, et al. Phthalate induction of CYP3A4 is dependent on glucocorticoid regulation of PXR expression[J]. Toxicological Sciences, 2008, 103(2): 268-277.DOI:10.1093/toxsci/kfn047.
[32] 周许年, 毕惠嫦, 金晶, 等. 白花前胡甲素及丙素经hCAR通路诱导UGT1A1的表达[J]. 药学学报, 2013, 48(5): 794-798. DOI:10.16438/j.0513-4870.2013.05.012.
Intervention Effect of Lycium barbarum Juice on the Metabolism of Di-(2-ethylhexyl) phthalate Based on the Uridine Diphosphate Glucuronosyltransferase 1 Detoxif i cation Pathway
HE Yongjian1, HUANG Shaowen1, LIU Ruijing1, WAN Fada2, YANG Jie1, LIU Huan1, LIU Chunhong1,*
(1. Key Laboratory of Food Quality and Safety in Guangdong Province, College of Food Science, South China Agricultural University,Guangzhou 510642, China; 2. Qinghai Red Magic Wolfberry Co. Ltd., Xining 810000, China)
Purpose: This study aimed to explore the intervention ef f ect of Lycium barbarum juice (LBJ) on the metabolism of di-(2-ethylhexyl) phthalate (DEHP) by analyzing the activity of uridine diphosphate glucuronosyltransferase 1 (UGT1)and metabolic detoxif i cation prof i le in the liver of rats exposed to DEHP. Methods: Sixty Sprague Dawley male rats were randomly divided into three groups (n = 20 each): control group, DEHP group and LBJ group. The DEHP and LBJ groups were administered with normal saline and LBJ respectively by gavage once daily for 7 consecutive days after receiving a single dose of 3 000 mg/kg mbDEHP dissolved in sesame oil. The control group was treated with normal saline for 7 days after receiving the same volume of sesame oil of. Urine samples were collected for 24 hours daily during the experimental period. Totally 5 rats were sacrif i ced randomly in each group after 1, 3, 5 and 7 days of exposure. The activity of UGT1 was determined by an enzyme linked immunosorbent assay kit while the contents of mono-(2-ethylhexyl) phthalate (MEHP) in serum and urine and phthalic acid (PA) in urine were detected by high performance liquid chromatography. Results: The activity of UGT1 in the LBJ group signif i cantly increased on the 5thday compared to the DEHP and control groups (P < 0.05).The content of serum MEHP in the LBJ group decreased signif i cantly, whereas the contents of urine MEHP and PA increased compared to DEHP group. Conclusion: LBJ can promote the metabolism and excretion of DEHP through improving the activity of UGT1, making it a healthcare product or functional food against the potential hazard of phthalate esters (PAEs) or other poisonous chemicals.
di-(2-ethylhexyl) phthalate (DEHP); uridine diphosphate glucuronosyltransferase 1(UGT1); Lycium barbarum juice (LBJ); intervention
2016-09-08
农业部农产品质量安全监管项目(GJFP201501202);广东省科技计划项目(2013B020204001)
贺永健(1993—),男,硕士,研究方向为营养与食品安全。E-mail:heyongjian93@126.com
*通信作者:柳春红(1968—),女,教授,博士,研究方向为营养与食品安全。E-mail:liuch@scau.edu.cn
10.7506/spkx1002-6630-201723031
R114;R151.41
A
1002-6630(2017)23-0196-05
贺永健, 黄少文, 刘瑞菁, 等. 基于尿苷二磷酸葡萄糖醛酸转移酶1解毒通路探讨枸杞汁对邻苯二甲酸二(2-乙基己基)酯代谢的干预作用[J]. 食品科学, 2017, 38(23): 196-200.
10.7506/spkx1002-6630-201723031. http://www.spkx.net.cn
HE Yongjian, HUANG Shaowen, LIU Ruijing, et al. Intervention effect of Lycium barbarum juice on the metabolism of di-(2-ethylhexyl) phthalate based on the uridine diphosphate glucuronosyltransferase 1 detoxif i cation pathway[J]. Food Science, 2017, 38(23):196-200. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723031. http://www.spkx.net.cn
