3 株益生菌体外降胆固醇能力及体内降血脂效果评价
2017-12-11韦云路孟祥飞李平兰
韦云路,刘 义,王 瑶,孟祥飞,李平兰*
(中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,教育部-北京市共建功能乳品重点实验室,北京 100083)
3 株益生菌体外降胆固醇能力及体内降血脂效果评价
韦云路,刘 义,王 瑶,孟祥飞,李平兰*
(中国农业大学食品科学与营养工程学院,北京食品营养与人类健康高精尖创新中心,教育部-北京市共建功能乳品重点实验室,北京 100083)
为探讨动物双歧杆菌LPL-RH、长双歧杆菌TTF及植物乳杆菌LPL-1作为降血脂益生菌的潜力,测定3 株益生菌的体外胆固醇脱除率和胆盐水解酶活力,同时以益生菌灌胃高脂饮食大鼠6 周后测定大鼠血脂含量变化。研究结果表明:菌株LPL-RH、TTF、LPL-1的体外胆固醇脱除率分别为23.8%、24.5%、20.9%,无显著差异(P>0.05);且3 株菌均有胆盐水解酶活性。菌株LPL-RH、TTF、LPL-1干预分别使高脂大鼠血清胆固醇含量分别降低17.3%、11.4%、10.1%;血清甘油三酯含量降低19.1%、16.8%、11.5%;血清低密度脂蛋白胆固醇含量降低24.0%、20.0%、10.0%;血清高密度脂蛋白胆固醇含量升高10.3%、5.2%和1.7%。综合而言,3 株益生菌在体内对高脂饮食大鼠血脂有调节作用,均有开发为降血脂益生菌的潜力,其中动物双歧杆菌LPL-RH的体内降脂能力最为突出。
益生菌;降胆固醇;降血脂
近年来,动脉粥样硬化、冠心病、脑卒中等心脑血管疾病的发病人群数量不断增加,已经成为严重威胁人类健康的一种常见疾病。据不完全统计,每年全球约有1 750万 人死于心脑血管疾病,约占死亡总人数的33%[1]。动脉粥样硬化是导致心脑血管疾病的重要原因,而高脂血症是导致动脉粥样硬化的重要危险因素之一。高脂血症是指血液中的一种或几种脂质水平异常。流行病学和临床研究表明,血清胆固醇水平和心脑血管疾病的发生呈明显正相关性,血清胆固醇水平每高出正常水平1 mmol,导致心血管疾病的风险便增加约35%[2];同时,血清甘油三酯、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平增高或高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平降低也会增加心血管疾病发生的风险[3]。目前,临床上常采用药物治疗和饮食干预的方法控制和降低血脂水平。但是药物治疗费用相对较高,且会存在不同程度的副作用[4]。饮食控制虽然能够在一定程度上起到调节机体内脂质代谢的作用,但长期往往控制效果欠佳。相比之下,食用降血脂功能性食品可能是长期控制血脂更理想的方法。
益生菌通常被定义为当机体从膳食中摄入一定量后,能够对宿主健康产生有益影响的一类具有活性的微生物[5]。目前,益生菌主要包括乳杆菌、链球菌和双歧杆菌等,这些益生菌不仅在人体肠道内起着营养、激活免疫及抗感染、调节肠道菌群平衡等作用[6-8],而且还具有抗过敏[9]、抗肿瘤[10]、治疗炎症性肠病[11]和改善酒精性脂肪肝[12]等多种益生功效。值得关注的是,研究表明一些益生菌如植物乳杆菌、嗜酸乳杆菌、双歧杆菌和鼠李糖乳杆菌等及含益生菌的发酵制品有降胆固醇和调节血脂作用[13-16]。适量摄入这些益生菌可有效调节体内血脂水平,对预防心血管疾病的发生很有意义[17]。益生菌作为药物辅助治疗剂,还具有安全性高、副作用小等优点,颇具市场开发潜力。
鉴于目前降血脂益生菌的报道有限,开发更多的降血脂益生菌并评价其体内外活性,将为降血脂益生菌的开发与应用奠定重要基础。本实验室经过筛选,获得了3 株有降血脂潜力的益生菌。本实验通过测定3 株菌体外降胆固醇能力和胆盐水解酶(bile salt hydrolase,BSH)活力,初步确定其降脂能力,进一步研究3 株菌对高脂饮食大鼠血脂的调节作用,为其作为降血脂益生菌的应用提供理论依据。
1 材料与方法
1.1 菌株、动物与试剂
动物双歧杆菌(Bifidobacterium animalis)LPL-RH、长双歧杆菌(B. longum)TTF、植物乳杆菌(Lactobacillus plantarum)LPL-1,由本课题组冻干保存并提供。
SD大鼠,45 只,SPF级,雄性,5 周龄,购于北京维通利华实验动物技术有限公司(合格证号:SCXK(京)2016-0011),饲养于中国农业大学实验动物平台(合格证号:SYXK(京)2015-0028)。
邻苯二甲醛、冰乙酸、浓硫酸、胆固醇、牛胆盐、巯基乙酸钠、氯化钙、氯化钠等 北京易秀博谷生物科技有限公司;胆固醇测定试剂盒、甘油三酯测定试剂盒、HDL-C测定试剂盒、LDL-C测定试剂盒 北京中生北控生物公司;基础饲料、高脂饲料 北京华阜康生物有限公司。
1.2 仪器与设备
3K15高速台式冷冻离心机 美国Sigma公司;AU480全自动生化分析仪 美国贝克曼公司;UV-1800紫外分光光度计 上海美谱达仪器有限公司;恒温培养箱 上海精宏实验公司。
1.3 方法
1.3.1 体外降胆固醇能力测定
改良MRS培养基配制:在MRS培养基中添加L-半胱氨酸盐酸盐,使终质量浓度为0.04 g/100 mL。根据文献[18]方法配制MRS高胆固醇培养基:在MRS培养基中添加胆盐(终质量浓度为3 mg/mL)和胆固醇(终质量浓度为0.1 mg/mL)。将活化好的菌株,接种于MRS高胆固醇液体培养基,37 ℃厌氧培养16 h,菌液于9 000 r/min离心10 min,收集上清液,采用邻苯二甲醛法测定胆固醇含量[19],并根据公式(1)计算胆固醇脱除率。
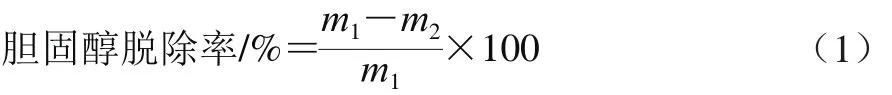
式中:m1、m2分别为发酵前、后上清液中的胆固醇质量/μg。
1.3.2 菌株BSH活力测定
菌株BSH活力根据文献[20]的方法测定。BSH筛选培养基配制:在MRS琼脂平板的基础上添加牛胆盐(终质量浓度为2 g/L)、巯基乙酸钠(终质量浓度为2 g/L)以及CaCl2(终质量浓度为0.37 g/L)。将灭菌的BSH筛选培养基倾入无菌的平板中,待培养基凝固后将无菌滤纸片均匀放在培养基上。吸取活化好的待测菌株菌液10 µL缓慢加在直径约3~4 mm的滤纸片上,待菌液不再流动后,于37 ℃厌氧条件下培养72 h,观察培养后滤纸片周围是否有白色沉淀物产生,若出现白色沉淀则可初步验证该菌含有BSH。
1.3.3 益生菌菌悬液的制备
取动物双歧杆菌LPL-RH、长双歧杆菌TTF和植物乳杆菌LPL-1冻干菌粉,用无菌生理盐水重悬使菌体浓度约为109CFU/mL,每只大鼠灌胃1 mL重悬菌液。为保证灌胃益生菌活性,需每天灌胃前用生理盐水制备灌胃菌液,现配现用。
1.3.4 实验动物分组及处理
实验用大鼠按照SPF级实验动物的要求在屏障环境中进行饲喂和管理。饲养条件:动物房温度为(22±2)℃,相对湿度为(50±10)%,严格按照12 h光照/黑暗循环,大鼠自由采食和进水。
大鼠适应性喂养1 周后,随机分为5 组,每组9 只,饲喂不同饮食,分别为正常对照(ND)组:给予基础饲料正常饮食;高脂(HFD)组:给予高脂饲料饮食;LPL-RH干预(HFD+RH)组:给予高脂饲料饮食+动物双歧杆菌LPL-RH;TTF干预(HFD+TTF)组:给予高脂饲料饮食+长双歧杆菌TTF;LPL-1干预(HFD+LPL-1)组:给予高脂饲料饮食+植物乳杆菌LPL-1(HFD+LPL-1)。干预组每天定时灌胃相应的益生菌悬液,连续灌胃6 周。
1.3.5 体质量增加量及摄食量的测定
实验开始和结束时称取各组大鼠体质量,计算大鼠体质量增加量;每2~3 d,记录一次大鼠的摄食量,并按照公式(2)计算食物利用率。

1.3.6 大鼠血脂水平检测
实验结束前,大鼠禁食不禁水12 h后,眼眶采血约1.5 mL,分离血清,-80 ℃保存,用于相关指标检测。参考胆固醇、甘油三酯、HDL-C、LDL-C测定试剂盒的说明书测定血清中胆固醇、甘油三酯、HDL-C、LDL-C含量。按公式(3)计算动脉硬化指数(atherogenic index,AI)。

式中:cTC为血清胆固醇浓度/(mmol/L);cHDL-C为血清HDL-C浓度/(mmol/L)。
1.4 数据统计分析
数据结果以 ±s表示,采用SPSS 17.0统计软件,对数据进行单因素方差分析,以p<0.05表示组间具有显著差异。
2 结果与分析
2.1 益生菌的体外胆固醇脱除率
体外降胆固醇实验是初步判定菌株是否具有潜在降脂能力的重要标准。由图1可知,在培养16 h后,动物双歧杆菌LPL-RH、长双歧杆菌TTF和植物乳杆菌LPL-1的体外胆固醇脱除率分别可达到(23.8±1.9)%、(24.5±1.9)%、(20.9±3.6)%,且统计学分析结果表明,菌株之间胆固醇脱除率无显著性差异(P>0.05)。
目前报道中,各菌株的体外胆固醇脱除率各异。刘丽莉等[21]报道了来源于发酵果蔬食品中的6 种乳酸菌的体外胆固醇脱除率,在18.5%~28%之间不等。林斌等[22]从自然发酵的酸乳中分离得到一株植物乳杆菌HLX37,在培养24 h后,其胆固醇脱除率可达(37.33±2.55)%。Dilmi-Bouras[23]报道的来源于酸奶的几株嗜热链球菌和保加利亚乳杆菌也具有降低培养基中总胆固醇的能力。相比之下,本研究所选取的3 株益生菌的体外降胆固醇能力处于一般水平。
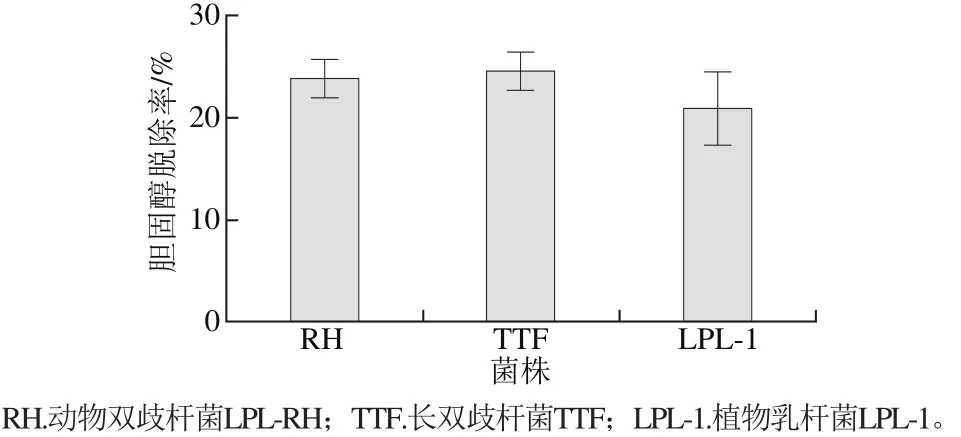
图1 菌株体外胆固醇脱除率Fig. 1 Cholesterol removal rates of the strains in vitro
2.2 益生菌的BSH活性
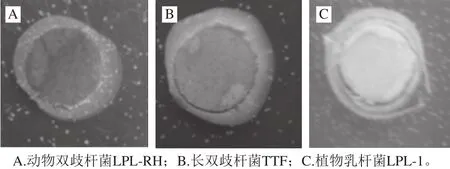
图2 菌株BSH平板检测结果Fig. 2 Determination of bile salt hydrolase activity
BSH能够将结合态的胆盐水解为非结合态的胆盐,而非结合态的胆盐在水中的溶解性较低,在酸性条件下能够与培养基中的Ca2+结合形成沉淀。因此,若菌株具有BSH活性,就能够在BSH筛选培养基中观察到沉淀[24]。从图2中结果可以观察到动物双歧杆菌LPL-RH、长双歧杆菌TTF和植物乳杆菌LPL-1周围都产生了白色沉淀,且菌落周围可以看到明显的颗粒状沉淀,说明所选取的这3 株益生菌都具有BSH活性。
有报道称,益生菌尤其是乳杆菌属和双歧杆菌属作为生物治疗剂,可以通过产生BSH来直接影响宿主胆盐代谢,从而调节血清胆固醇水平[25]。菌株所产生的BSH能够解离肠道中的胆汁盐,导致氨基酸残基的释放和解偶联的胆汁酸的形成。而解偶联的胆汁酸的溶解性较低,能够共沉淀胆固醇并与膳食纤维结合,随粪便排出体外,从而降低体内胆固醇水平[26]。同时,能够产生BSH的菌株具有存活和定植于肠道中的优势。因此,BSH活性也可以作为体外评价菌株降脂能力的一个重要指标。本研究中,3 株益生菌都具有BSH活性,具有调节血脂水平的潜力。
2.3 益生菌对高脂饮食大鼠体质量及摄食量的影响
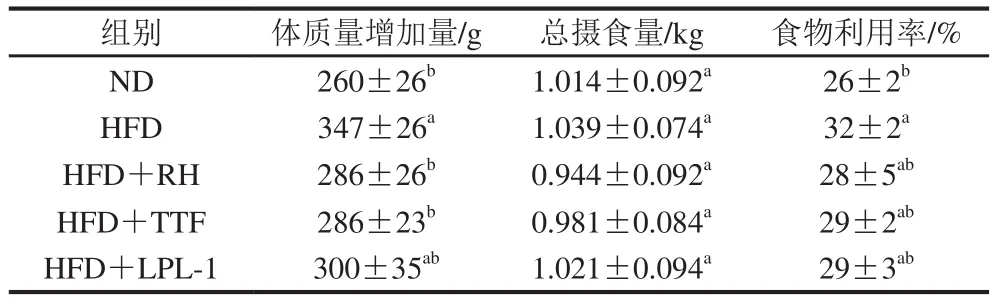
表1 各组大鼠体质量增加量、摄食量及食物利用率情况Table 1 Body weight gain, total food intake and eff i ciency of conversion of ingested food of rats in each group
由表1可知,与ND相比,HFD大鼠体质量显著增加(p<0.05);与HFD组相比,HFD+RH组、HFD+TTF组大鼠的最终体质量都明显降低(p<0.05),且与ND组(P>0.05)相当。各组的摄食量间没有显著性差异(P>0.05),说明益生菌干预不会影响大鼠的摄食量;与ND组相比,HFD组的食物利用率显著增加(p<0.05),HFD+RH组、HFD+TTF组和HFD+LPL-1组的食物利用率较HFD组低,接近ND组(P>0.05)。
2.4 益生菌对高脂饮食大鼠血脂的影响
2.4.1 益生菌对大鼠血清中胆固醇的影响
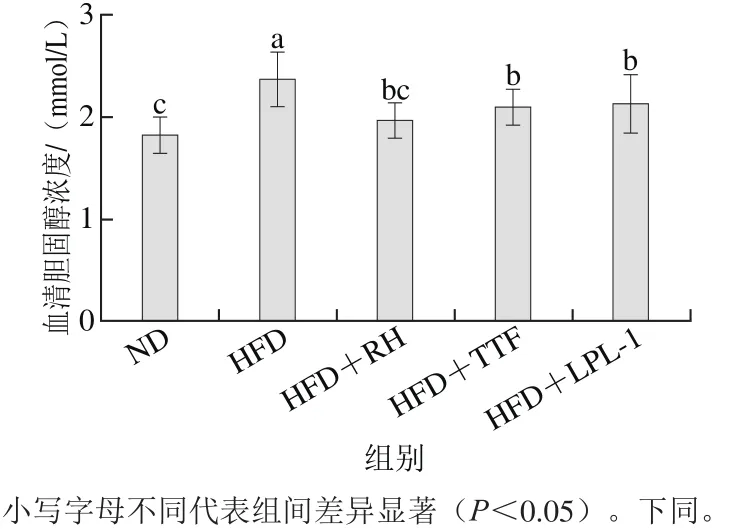
图3 各组大鼠血清胆固醇水平Fig. 3 Serum total cholesterol levels of rats in each group
如图3所示,高脂饮食诱导可以使血清胆固醇浓度显著升高(p<0.05),益生菌干预后,大鼠血清胆固醇浓度明显下降(p<0.05)。与HFD组相比,HFD+RH组、HFD+TTF组和HFD+LPL-1组的大鼠血清胆固醇浓度分别下降了17.3%、11.4%和10.1%,且均有显著性差异(p<0.05)。但是,HFD+RH组、HFD+TTF组和HFD+LPL-1组的大鼠血清胆固醇浓度仍然高于ND组。因此,3 种益生菌干预都能使高脂大鼠血清中胆固醇浓度降低,但无法降低至正常水平。
胆固醇为机体必需营养成分,不仅是细胞膜的组成部分,同时在体液免疫、神经传导及物质代谢中起着重要的生理作用。但当外源性胆固醇摄入过多时,易在血管壁上沉积,形成斑块使血管管腔狭窄,阻碍血液循环,心脑组织长期缺氧便可引发心脑血管疾病,因此,控制血清胆固醇含量在正常范围具有重要的意义。本研究中,3 株菌均有降低胆固醇的效果,同时体外结果表明3 株菌具有一定的胆固醇脱除率和BSH活性。因此,推测其降胆固醇的作用主要来源于两方面:一方面是益生菌能够吸收或同化去除胆固醇[27];另一方面,菌株通过产生BSH,将结合胆酸分解为游离胆酸,游离胆酸可与胆固醇结合形成复合物,沉淀下来,进而起到降低胆固醇含量的作用[28]。
2.4.2 益生菌对大鼠血清中甘油三酯的影响
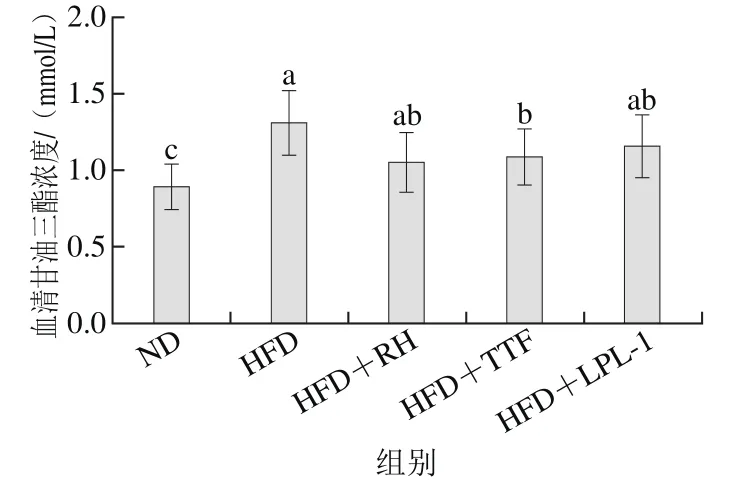
图 4 各组大鼠血清甘油三酯水平Fig. 4 Serum triglycerides levels of rats in each group
图4 结果表明,高脂饮食诱导可使大鼠血清甘油三酯浓度升高。与ND组相比,HFD组大鼠血清中甘油三酯浓度升高了45.6%,差异显著(p<0.05)。与HFD组相比,HFD+RH组、HFD+TTF组和HFD+LPL-1组大鼠血清甘油三酯浓度分别下降19.1%、16.8%和11.5%,其中HFD+TTF组与HFD组相比,差异显著(p<0.05)。但是各干预组大鼠血清甘油三酯浓度显著高于ND组(p<0.05),因此,3 株益生菌都具有降低血清甘油三酯浓度的效果,但无法降低至正常水平。甘油三酯主要存在于乳糜微粒和极低密度脂蛋白中,后者居多[29]。
研究发现,极低密度脂蛋白及乳糜微粒对血管内皮细胞具有细胞毒性作用、能够促进泡沫细胞的形成和诱发炎症反应,使甘油三酯沉积在血管壁中,促进动脉粥样硬化形成,进而引发心脑血管疾病。Al-Sheraji等[15]研究表明含有B. pseudocatenulatum G4和B. longum BB536的发酵乳能够有效降低高脂饮食大鼠血清甘油三酯含量。一些研究表明,益生菌可以利用碳水化合物生成短链脂肪酸及其盐类,如丙酸盐、醋酸盐等,起到抑制和降低脂肪酸合成的效果[30]。
2.4.3 益生菌对大鼠血清中LDL-C的影响
LDL被称为是动脉硬化因子,其作用是将肝脏内合成的胆固醇运送到肝脏外围细胞。LDL-C是临床检验的指标,它代表了血清中LDL的水平。益生菌干预6 周后,各组大鼠血清中LDL-C浓度变化情况如图5所示。与ND组相比,HFD组大鼠血清中LDL-C浓度显著性升高(p<0.05)。与HFD组相比,3 种益生菌干预使高血脂大鼠血清中LDL-C浓度降低,HFD+RH组、HFD+TTF组和HFD+LPL-1组大鼠血清LDL-C浓度分别下降24.0%、20.0%和10.0%,其中,HFD+RH组、HFD+TTF组与HFD组相比,差异显著(p<0.05)。
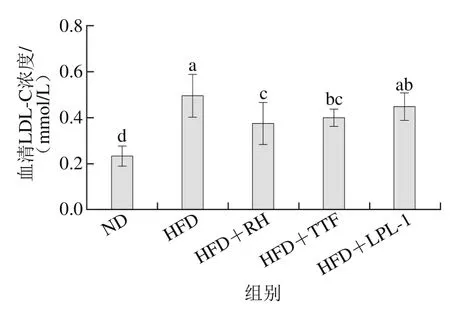
图5 各组大鼠血清LDL-C水平Fig. 5 Serum LDL-C levels of rats in each group
LDL为血清中胆固醇的主要携带者,可通过不同方式发生氧化修饰,转变为氧化低密度脂蛋白[31]。氧化低密度脂蛋白是诱导血管内皮细胞损伤及功能障碍的一个重要因素,可通过激活细胞特异受体、诱导相关基因和蛋白的表达,破坏内皮屏障作用和加重血管炎症反应[32],在动脉粥样硬化的发生发展过程中起着重要的作用。Shrivastava等[33]研究发现,嗜酸乳杆菌可显著降低血清中LDL-C含量;含有植物乳杆菌K12的发酵乳也能够显著降低高脂饮食小鼠的血清LDL-C含量[34],这与本研究结果一致。因此,3 株益生菌对大鼠血清LDL-C的升高具有缓解作用。
2.4.4 益生菌对大鼠血清中HDL-C的影响
HDL可介导胆固醇的逆转运,将血液中多余的胆固醇从周围组织转运至肝脏进行再循环,减少脂质在血管壁的沉积[35]。HDL还可调节内皮细胞NO的生成和活性,改善血管内皮功能[36];通过抗氧化、抗炎、抗血栓、促纤溶以及清除毒性磷脂等作用,起到保护血管功能的作用[37]。研究表明,HDL对动脉壁具有直接保护作用,并能使动脉粥样硬化病变消退,因此,HDL被称为“抗动脉硬化因子”。HDL-C是临床检验的指标,它代表了血清中HDL的水平[38]。
益生菌干预6 周后,各组大鼠血清中HDL-C浓度变化情况如图6所示。与ND组相比,HFD组大鼠血清中HDL-C浓度显著性降低(p<0.05)。与HFD组相比,3 种益生菌干预使高脂大鼠血清中HDL-C浓度有不同程度的升高,HFD+RH组、HFD+TTF组和HFD+LPL-1组大鼠血清HDL-C含量分别升高10.3%、5.2%和1.7%,其中,HFD+RH组与HFD组相比,差异显著(p<0.05)。因此,动物双歧杆菌LPL-RH能够使高血脂大鼠血清HDL-C浓度有一定程度升高,保护血管功能。
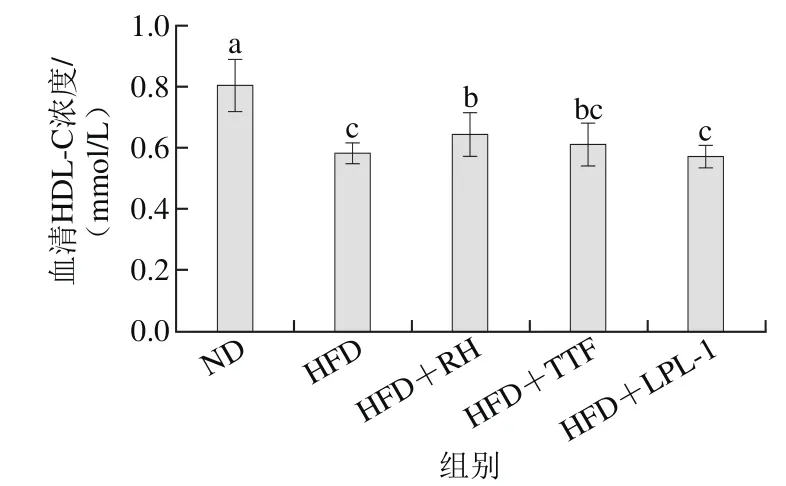
图6 各组大鼠血清HDL-C水平Fig. 6 Serum HDL-C levels of rats in each group
2.5 益生菌对高脂饮食大鼠AI的影响
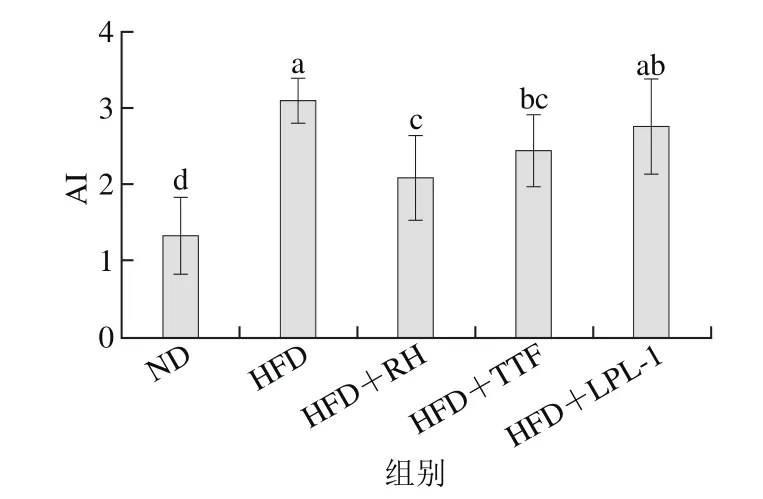
图7 益生菌对大鼠AI的影响Fig. 7 Effect of probiotics on AI of rats in each group
AI是国际医学界制定的一个衡量动脉粥样硬化程度的指标,AI数值越小动脉粥样硬化的程度就越轻,引发心脑血管病的危险性就越低[39]。由图7可知,高脂饮食可诱导AI升高,与ND组相比,HFD组大鼠AI显著升高(p<0.05),患心血管疾病的风险很高。与HFD组相比,HFD+RH组、HFD+TTF组和HFD+LPL-1组使大鼠AI分别降低了32.3%、19.4%和9.7%,其中HFD+RH组效果最明显(p<0.05)。张泽生等[16]采用4 种不同益生菌灌胃高脂饮食大鼠6 周后,发现益生菌干预能够显著降低大鼠AI,预防和减少动脉粥样硬化的发生。与本研究结果相似,说明益生菌干预可降低机体动脉粥样硬化的患病风险。
3 结 论
本研究选取的3 株益生菌,动物双歧杆菌LPL-RH、长双歧杆菌TTF和植物乳杆菌LPL-1的体外胆固醇脱除率分别为(23.8±1.9)%、(24.5±1.9)%、(20.9±3.6)%,都具有BSH活性。3 株菌在体内对高脂饮食大鼠血脂有调节作用,其中动物双歧杆菌LPL-RH调节大鼠血清脂质水平的效果好,能够使高脂大鼠血清胆固醇、甘油三酯和LDL-C分别降低17.3%、19.1%和24.0%,HDL-C升高10.3%。3 株益生菌均有作为功能性食品用益生菌,调节血脂和预防心血管疾病的潜力,值得进一步研究和开发。
[1] CLARK A M, DESMEULES M, LUO W, et al. Socioeconomic status and cardiovascular disease: risks and implications for care[J].Nature Reviews Cardiology, 2009, 6(11): 712-722. DOI:10.1038/nrcardio.2009.163.
[2] MANSON J E, TOSTESON H, RIDKER P M, et al. The primary prevention of myocardial infarction[J]. New England Journal of Medicine, 1992, 326(21): 1406-1416. DOI:10.1056/NEJM199205213262107.
[3] WILSON P W F. Assessing coronary heart disease risk with traditional and novel risk factors[J]. Clinical Cardiology, 2004, 27(Suppl 6): 7-11.DOI:10.1002/clc.4960271504.
[4] SCHUSTER H. Improving lipid management: to titrate, combine or switch[J]. International Journal of Clinical Practice, 2004, 58(7):689-694. DOI:10.1111/j.1368-5031.2004.00188.x.
[5] FULLER R. Probiotics in human medicine[J]. Gut, 1991, 32(4):439-442. DOI:10.1136/gut.32.4.439.
[6] RUSSELL D A, ROSS R P, FITZGERALD G F, et al. Metabolic activities and probiotic potential of bifidobacteria[J]. International Journal of Food Microbiology, 2011, 149(1): 88-105. DOI:10.1016/j.ijfoodmicro.2011.06.003.
[7] LIU Z, JIANG Z, ZHOU K, et al. Screening of bifidobacteria with acquired tolerance to human gastrointestinal tract[J]. Anaerobe, 2007,13(5/6): 215-219. DOI:10.1016/j.anaerobe.2007.05.002.
[8] 李俊洁, 陈庆森. 双歧杆菌调理和改善肠道相关疾病作用的研究进展[J]. 食品科学, 2011, 32(23): 326-332.
[9] ISOLAURI E, RAUTAVA S, KALLIOMӒKI M, et al. Role of probiotics in food hypersensitivity[J]. Current Opinion in Allergy and Clinical Immunology, 2002, 2(3): 263-271. DOI:10.1097/00130832-200206000-00018.
[10] HIRAYAMA K, RAFTER J. The role of probiotic bacteria in cancer prevention[J]. Microbes and Infection, 2000, 2(6): 681-686.DOI:10.1016/S1286-4579(00)00357-9.
[11] DAMMAN C J, MILLER S I, SURAWICZ C M, et al. The microbiome and inflammatory bowel disease: is there a therapeutic role for fecal microbiota transplantation?[J]. American Journal of Gastroenterology, 2012, 107(10): 1452-1459. DOI:10.1038/ajg.2012.93.
[12] KIRPICH I A, MCCLAIN J C. Probiotics in the treatment of the liver diseases[J]. Journal of the American College of Nutrition, 2012, 31(1):14-23. DOI:10.1080/07315724.2012.10720004.
[13] 王俊国, 孟和毕力格, 包秋华, 等. 植物乳杆菌LIP-1对高脂血症大鼠血脂的调节作用[J]. 中国食品学报, 2013, 13(2): 6-12.DOI:10.16429/j.1009-7848.2013.02.002.
[14] MORADI S M, JAVIDAN A, ISFAHANI H N. Effects of probiotic ultra-f i ltered feta cheese and raw chicory root extract on lipid prof i le in healthy adult volunteers: a triple-blinded randomized controlled trial[J]. Mediterranean Journal of Nutrition and Metabolism, 2013,6(3): 199-206. DOI:10.1007/s12349-013-0130-6.
[15] AL-SHERAJI S H, ISMAIL A, MANAP M Y, et al.Hypocholesterolaemic effect of yoghurt containing Bifidobacterium pseudocatenulatum G4 or Bifidobacterium longum BB536[J].Food Chemistry, 2012, 135(2): 356-361. DOI:10.1016/j.foodchem.2012.04.120.
[16] 张泽生, 王俊辉, 李健, 等. 四株益生菌对高脂血症仓鼠降血脂作用的研究[J]. 食品工业科技, 2012, 33(12): 365-367. DOI:10.13386/j.issn1002-0306.2012.12.011.
[17] PARK Y H, KIM J G, SHIN Y W, et al. Effects of Lactobacillus acidophilus 43121 and a mixture of Lactobacillus casei and Bifidobacterium longum on the serum cholesterol level and fecal sterol excretion in hypercholesterolemia-induced pigs[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(2): 595-600. DOI:10.1271/bbb.70581.
[18] 王正根. 两株乳杆菌体内外降胆固醇的筛选及相关机制的研究[D].长沙: 中南大学, 2010: 9-12.
[19] 张晓磊, 武岩峰, 朴春红, 等. 益生菌发酵豆乳对高脂血症小鼠降血脂及肝损伤缓解的作用[J]. 现代食品科技, 2016, 32(5): 1-8.DOI:10.13982/j.mfst.1673-9078.2016.5.01.
[20] DU TOITA M, FRANZ C M A P, DICKS L M T, et al.Characterisation and selection of probiotic lactobacilli for a preliminary minipig feeding trial and their effect on serum cholesterol levels, faeces pH and faeces moisture content[J]. International Journal of Food Microbiology, 1998, 40(1/2): 93-104. DOI:10.1016/S0168-1605(98)00024-5.
[21] 刘丽莉, 董铁有, 杨协立. 6 种乳酸菌降解胆固醇的体外试验[J]. 河南科技大学学报(自然科学版), 2005, 26(6): 85-88.
[22] 林斌, 黄菊青, 官雪芳, 等. 植物乳杆菌HLX37降胆固醇活性研究[J]. 食品工业科技, 2016, 37(20): 179-182; 188. DOI:10.13386/j.issn1002-0306.2016.20.027.
[23] DILMI-BOURAS A. Assimilation (in vitro) of cholesterol by yogurt bacteria[J]. Annals of Agricultural and Environmental Medicine, 2006,13(1): 49-53.
[24] 王玉文, 刘慧, 李平兰, 等. 产胆盐水解酶乳酸菌的分离、鉴定及降解胆固醇机理的初步研究[J]. 食品科学, 2006, 27(10): 215-218.
[25] KLAVER F A, VAN DER MEER R. The assumed assimilation of cholesterol by Lactobacilli and Bifidobacterium bifidum is due to their bile salt-deconjugating activity[J]. Applied and Environmental Microbiology, 1993, 59(4): 1120-1124.
[26] 靳志强, 王延祥, 李平兰, 等. 植物乳杆菌耐酸耐胆盐的体外试验及其降胆固醇作用[J]. 中国食品学报, 2009, 9(5): 24-28.DOI:10.16429/j.1009-7848.2009.05.029.
[27] MIREMADI F, AYYASH M, SHERKAT F, et al. Cholesterol reduction mechanisms and fatty acid composition of cellular membranes of probiotic Lactobacilli and Bifidobacteria[J].Journal of Functional Foods, 2014, 9(7): 295-305. DOI:10.1016/j.jff.2014.05.002.
[28] LIONG M T, SHAH N P. Bile salt deconjugation ability, bile salt hydrolase activity and cholesterol co-precipitation ability of lactobacilli strains[J]. International Dairy Journal, 2005, 15(4): 391-398. DOI:10.1016/j.idairyj.2004.08.007.
[29] HASSING H C, SURENDRAN R P, MOOIJ H L, et al.Pathophysiology of hypertriglyceridemia[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2012, 1821(5):826-832. DOI:10.1016/j.bbalip.2011.11.010.
[30] WRIGHT R S, ANDERSON J W, BRIDGES S R. Propionate inhibits hepatocyte lipid synthesis[J]. Experimental Biology and Medicine,1990, 195(1): 26-29. DOI:10.3181/00379727-195-43113.
[31] LUSIS A J. Atherosclerosis. nature[J]. Nature, 2000, 407(6801):233-241. DOI:10.1038/35025203.
[32] SAKURAI K, SAWAMURA T. Stress and vascular responses:endothelial dysfunction via lectin-like oxidized low-density lipoprotein receptor-1: close relationships with oxidative stress[J]. Journal of Pharmacological Sciences, 2003, 91(3): 182-186. DOI:10.1254/jphs.91.182.
[33] SHRIVASTAVA A, CHATURVEDI U, BHATIA G. Hypolipidemic and antioxidative effect of Lactobacillus acidophilus bacteria in hyperlipidemic rats[J]. Asian Journal of Pharmaceutical and Clinical Research, 2013, 6: 84-87.
[34] 王辑, 张雪, 李盛钰, 等. 植物乳杆菌K25发酵乳降低小鼠血清胆固醇的作用研究[J]. 食品科学, 2012, 33(7): 256-260.
[35] CAO A, WANG G, TANG Y, et al. Linear correlation between thermal stability and folding kinetics of lysozyme[J]. Biochemical and Biophysical Research Communications, 2002, 291(4): 795-757.DOI:10.1006/bbrc.2002.6526.
[36] IGNARRO L J, NAPOLI C. Novel features of nitric oxide, endothelial nitric oxide synthase, and atherosclerosis[J]. Current Atheroslerosis Reports, 2004, 6(4): 281-287. DOI:10.1007/s11892-005-0062-8.
[37] PARK S H, PARK J H, KANG J S, et al. Involvement of transcription factors in plasma HDL protection against TNF-alpha-induced vascular cell adhesion molecule-1 expression[J]. International Journal of Biochemistry & Cell Biology, 2003, 35(2): 168-182. DOI:10.1016/S1357-2725(02)00173-5.
[38] 王晓娜, 叶平. 高密度脂蛋白胆固醇与动脉粥样硬化研究进展[J].中华保健医学杂志, 2015(6): 516-517. DOI:10.3969/.issn.1674-3245.2015.06.030.
[39] GUO C F, LI J Y. Hypocholesterolaemic action of Lactobacillus casei F0822 in rats fed acholesterol-enriched diet[J]. International Dairy Journal, 2013, 32(2): 144-149. DOI:10.1016/j.idairyj.2013.04.001.
Cholesterol-Lowering Ability in Vitro and Hypolipidemic Effect in Vivo of Three Probiotic Strains
WEI Yunlu, LIU Yi, WANG Yao, MENG Xiangfei, LI Pinglan*
(Key Laboratory of Functional Dairy, Co-Constructed by Ministry of Education and Beijing Government, Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering,China Agricultural University, Beijing 100083, China)
This study aimed to investigate the hypolipidemic potential of Bifidobacterium animalis LPL-RH, B. longum TTF and Lactobacillus plantarum LPL-1. The cholesterol-lowering ability and bile salt hydrolase activity were determined.Then, the effect of probiotic intervention on blood lipids in high-fat diet fed SD rats was examined. The results showed that the cholesterol removal rates of B. animalis LPL-RH, B. longum TTF and L. plantarum LPL-1 were 23.8%, 24.5% and 20.9%, respectively, with no signif i cant differences among them. All three probiotics had bile salt hydrolase activity. The assays in vivo showed that intervention with LPL-RH, TTF and LPL-1 decreased serum cholesterol by 17.3%, 11.4% and 10.1%, triglycerides by 19.1%, 16.8% and 11.5%, and low-density lipoprotein cholesterol by 24.0%, 20.0% and 10.0%, and increased high-density lipoprotein cholesterol by 10.3%, 5.2% and 1.7% in hyperlipidemia rats, respectively. In summary,the three strains have the potential to be developed as lipid-lowering probiotics, with B. animalis LPL-RH having the best lipid-lowering ability.
probiotics; cholesterol-lowering; hypolipidemic
10.7506/spkx1002-6630-201723021
TS201.3
A
1002-6630(2017)23-0129-06
韦云路, 刘义, 王瑶, 等. 3 株益生菌体外降胆固醇能力及体内降血脂效果评价[J]. 食品科学, 2017, 38(23): 129-134.
DOI:10.7506/spkx1002-6630-201723021. http://www.spkx.net.cn
WEI Yunlu, LIU Yi, WANG Yao, et al. Cholesterol-lowering ability in vitro and hypolipidemic effect in vivo of three probiotic strains[J]. Food Science, 2017, 38(23): 129-134. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723021. http://www.spkx.net.cn
2017-04-14
国家自然科学基金面上项目(31271827;31671831)
韦云路(1991—),女,硕士研究生,研究方向为食品微生物。E-mail:495680187@qq.com
*通信作者:李平兰(1964—),女,教授,博士,研究方向为食品微生物。E-mail:lipinglan@cau.edu.cn
