改性苹果果胶性质及抗氧化活性
2017-12-11马丽苹焦昆鹏向进乐党筱筱朱文学
马丽苹,焦昆鹏,罗 磊,向进乐,党筱筱,朱文学,*
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省食品原料工程技术研究中心,河南 洛阳 471023)
改性苹果果胶性质及抗氧化活性
马丽苹1,2,焦昆鹏1,2,罗 磊1,2,向进乐1,2,党筱筱1,朱文学1,2,*
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省食品原料工程技术研究中心,河南 洛阳 471023)
以苹果果胶为原料,采用酸碱修饰和高压蒸汽法2 种方法分别制备酸碱改性和热改性苹果果胶,并在分析苹果果胶改性前后理化性质的基础上,进一步研究了其体外抗氧化活性。结果表明:酸碱改性和热改性后的苹果果胶与未改性果胶相比:半乳糖醛酸含量由(683.92±4.51)mg/g分别增加到(910.61±1.08)mg/g和(780.19±5.68)mg/g,酯化度由(77.26±1.20)%分别降低到(35.48±1.90)%和(33.67±1.28)%。改性后果胶分子质量降低,多酚和蛋白质含量均较低(分别小于3 mg/g和7 mg/g)。改性前后苹果果胶的1,1-二苯基-2-三硝基苯肼自由基清除率、羟自由基清除率、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基清除率和超氧阴离子自由基清除率均随果胶质量浓度的增大而增强,而且酸碱改性更有助于其抗氧化活性的提高,这可能与其半乳糖醛酸含量增加有关。
改性;苹果果胶;果胶性质;抗氧化活性
果胶是一种天然的酸性多糖物质,主要存在于高等植物的细胞壁和细胞内层,具有黏合细胞的作用[1]。天然果胶是由a-D-(1-4)-半乳糖醛酸重复片段组成的平滑区和带有大量中性糖侧链的a-D-(1-4)-半乳糖醛酸和a-L-(1-2)-鼠李糖交替连接的毛发区组成[2]。果胶具有良好的增稠性、稳定性、凝胶性、吸附性和成膜性等特性,因此可作为一种高档的天然食品添加剂和保健品,广泛用于食品、医药保健品和日化等行业[3]。
苹果果胶是仅次于柑橘果胶的第二大商品果胶来源,有研究表明其具有降血脂[4]、清除机体内放射性元素[5]、抗肥胖[6]和一定的抗肿瘤作用[7-8]。但是苹果果胶分子质量大、水溶性差的特点有可能会阻碍或者限制其功能的发挥。而果胶改性可以使果胶生成较短、分支较少的糖链,以降低其分子质量和酯化度,增加其水溶性,并提高其半乳糖醛酸含量,从而更好地发挥其生物活性和功能[9-14]。然而,改性果胶的研究主要集中在柑橘果胶方面[15-21],对苹果果胶改性以及改性果胶的生物活性方面的研究报道较少。目前,果胶改性方法有化学改性法(如碱法脱酯、酰胺化脱酯)、生物改性法(如酶法改性)和物理改性法(如高温、高压处理),其中碱法脱酯和高温高压改性的工艺简便易操作、安全性高且成本低,易于工业化推广[22]。因此,本研究采用酸碱修饰和高温蒸汽处理2 种方法对苹果果胶进行改性,并在分析改性果胶理化性质的基础上,进一步研究其抗氧化活性,本研究不仅能拓宽苹果果胶的应用范围,还为今后利用苹果果胶开发保健食品和药品提供理论依据。
1 材料与方法
1.1 材料与试剂
苹果果胶 上海凯洋生物工程有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、半乳糖醛酸、间羟联苯 美国Sigma公司;2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、吩嗪硫酸甲酯(phenazine methosulfate,PMS)、四唑氮蓝(nitro-blue tetrazolium,NBT)、还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)阿拉丁(上海)试剂公司;牛血清白蛋白(bovine serum albumin,BSA) 成都西亚试剂有限公司;考马斯亮蓝G-250 上海吉生物科技发展有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;UV1800型紫外-可见分光光度计 日本岛津公司;TDZ5-WS型多管架自动平衡离心机 湖南湘仪实验室仪器开发有限公司;高压蒸汽灭菌锅 上海申安医疗器械厂;精密电子天平 上海菁海仪器系统有限公司;101型电热鼓风干燥箱 北京市永光明医疗仪器有限公司;FA1004型电子天平 上海上平仪器公司;Vertex70/80型傅里叶变换红外光谱仪 日本SANYO公司;600型高效液相色谱仪 美国Waters公司;DAWN8型多角度激光光散射仪、OpticlabrEX型示差折光仪美国Wyatt公司;L-2400型紫外检测仪 日本日立公司;QUANTA200扫描电子显微镜 美国FEI公司;FE20-K plus型酸度计 瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 苹果果胶的改性
酸碱改性果胶制备[23]:称取3 g苹果果胶于250 mL锥形瓶中,加入200 mL、55 ℃蒸馏水配制成质量浓度为15 mg/mL的溶液。待果胶全部溶解后,缓慢加入3 mol/L的NaOH溶液至pH值变化到10.0,在55 ℃水浴中维持45 min不变,冷却至室温,再加3 mol/L的盐酸调节pH值至3.0后维持一段时间不变,在室温下静置过夜。然后加入3 倍体积的95%乙醇搅拌产生大量的白色絮状沉淀,50 ℃烘干得到酸碱改性苹果果胶,酸碱改性果胶得率按式(1)计算。
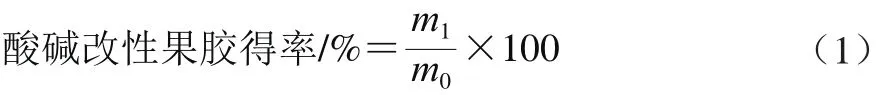
式中:m1为酸碱改性果胶的干质量/g;m0为苹果果胶的质量/g。
热改性果胶制备[24]:称取3 g苹果果胶溶于100 mL、55 ℃蒸馏水中,配制成30 mg/mL的溶液,完全溶解后,调节pH值至4.0,置于蒸汽灭菌锅中,在123.2 ℃高温条件下维持30 min,取出冷却至室温,50 ℃下旋转蒸发至原液体积的1/3,向浓缩液中加入3 倍体积无水乙醇搅拌产生白色沉淀,50 ℃烘干得到热改性苹果果胶,热改性果胶得率按式(2)计算。
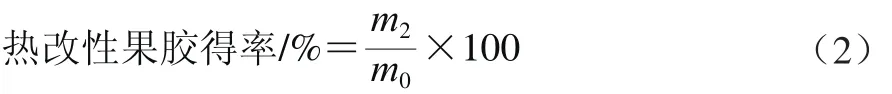
式中:m2为热改性果胶的干质量/g;m0为苹果果胶的质量/g。
1.3.2 半乳糖醛酸含量的测定
采用Blumenkrantz等[25]的间羟联苯法测定果胶样品中半乳糖醛酸含量。分别吸取60 μg/mL半乳糖醛酸标准溶液0.00、0.05、0.10、0.15、0.20 mL和0.25 mL于6 个10 mL离心管中,并标号为0、1、2、3、4和5。用蒸馏水补加各管至0.25 mL。冰水浴中预冷后,加入0.012 5 mol/L四硼酸钠-硫酸溶液1.5 mL,并振荡混匀,沸水浴加热5 min后冰浴至室温,加入1.5 mg/mL间羟联苯25 μL并摇匀。以0号管为空白对照,在520 nm波长处测定吸光度。以反应体系中半乳糖醛酸的质量浓度为纵坐标,吸光度为横坐标绘制标准曲线,得线性回归方程为:y=0.218 8x-0.001 1,R2=0.995 8。配制适当质量浓度的样品果胶溶液,按上述操作测定520 nm波长处吸光度,将吸光度代入线性回归方程计算半乳糖醛酸质量浓度,再计算其含量。
1.3.3 酯化度的测定
称取0.05 g果胶溶于50 mL蒸馏水中,使其充分溶解。加入3 滴酚酞,用0.1 mol/L的氢氧化钠溶液进行标定,出现粉红色并维持1 min不变色时记录所消耗的氢氧化钠溶液体积(V1),即为初始滴定度。再加入3 mol/L的氢氧化钠溶液2.5 mL,并振荡摇匀,5 min后加入3 mol/L的盐酸2.5 mL;并振荡至粉红色消失。然后再加入2 滴酚酞指示剂,用0.1 mol/L氢氧化钠溶液滴定至再次呈粉红色并维持1 min不变色,记录这次氢氧化钠溶液的消耗体积(V2)。酯化度按式(3)进行计算。
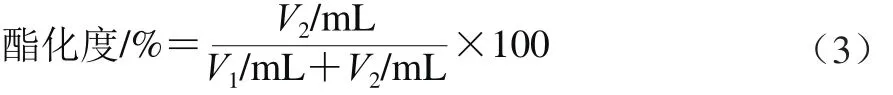
1.3.4 蛋白质含量的测定
取100 μg/mL BSA标准溶液0.0、0.1、0.2、0.4、0.6 mL和0.8 mL分别加入到编号为0、1、2、3、4、5的10 mL刻度试管中,用蒸馏水将各管补至1.0 mL。再加入5 mL考马斯亮蓝G-250溶液,混匀后静置5 min,以0号管为空白对照,在595 nm波长处测定吸光度。以反应体系中BSA质量浓度为纵坐标,吸光度为横坐标绘制标准曲线,得线性回归方程为:y=0.259 2x-0.001 2,R2=0.995 6。将3 种果胶配制成适当质量浓度的溶液,按上述操作,测定595 nm波长处吸光度。将吸光度代入BSA标准曲线的线性回归方程中计算得蛋白质量浓度,进一步计算其含量。1.3.5 多酚含量的测定
准确移取0.1 mg/mL的没食子酸标准溶液0.0、0.2、0.4、0.6、0.8、1.0 mL和1.2 mL分别加入到10 mL的容量瓶中,再分别加入6 mL的蒸馏水与0.5 mL的福林-酚试剂,摇匀,1 min后再分别加入1.5 mL 0.2 g/L碳酸钠溶液,定容至10 mL后置于室温下反应30 min,于765 nm波长处测定吸光度。以吸光度为横坐标,没食子酸质量浓度为纵坐标绘制标准曲线,得线性回归方程为:y=0.135 5x-0.004 3。将3 种果胶配制成适当质量浓度溶液,按上述操作,测定765 nm波长处吸光度。将吸光度代入线性回归方程中计算得多酚质量浓度(以没食子酸当量计),进一步计算得样品中多酚含量。
1.3.6 分子质量的测定
分子质量和分子质量的分布采用使用高效体积排阻色谱联用多角度激光散射(high performance size exclusion chromatography multiangle laser light scattering,H P SEC-MALLS)法测定,实验条件:TOSOH TSKG4000PWXL凝胶柱(300 mm×7.8 mm,10 μm);果胶溶液2 mg/mL;进样量100 μL;洗脱液为含有0.2 mg/mL叠氮钠的0.1 mol/L硝酸钠溶液(pH 7.0);洗脱速率0.5 mL/min。由Astra 4.73.04软件分析得出重均分子质量(mW)、数均分子质量(mn)和多分散性指数(mW/mn)。
1.3.7 微观结构的观察
果胶样品经过粘台、喷金等步骤后,在加速电压为10 kV的条件下采用扫描电子显微镜进行观察。
1.3.8 DPPH自由基清除率测定
将2.0 mL新鲜配制的DPPH溶液(0.2 mmol/L,95%甲醇溶液配制)分别与2.0 mL不同质量浓度的果胶样品(0.062 5~4.000 0 mg/mL)充分混匀,室温避光反应20 min后,在517 nm波长处测定吸光度,记为A1,以95%甲醇溶液代替上述体系中的DPPH溶液,在517 nm波长处测定吸光度,记为A2,以蒸馏水代替上述体系中果胶样品溶液,在517 nm波长处测定吸光度,记为A0。DPPH自由基清除率按式(4)进行计算。
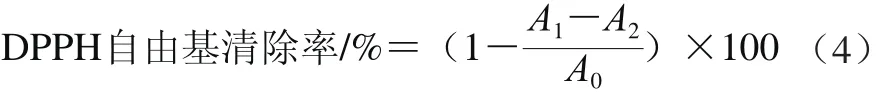
1.3.9 ·OH清除率测定
将0.6 mL 6 mmol/L FeSO4溶液与2.0 mL果胶样品溶液(0.062 5~4.000 0 mg/mL)分别混匀后,加入0.6 mL 6 mmol/L的H2O2溶液,充分混匀后反应10 min,再向各管加入6 mmol/L水杨酸0.6 mL,充分混合后反应10 min,最后在510 nm波长处测得吸光度为A1。在上述反应体系中,以无水乙醇代替水杨酸,测定吸光度为A2,以蒸馏水代替样品溶液,测定吸光度为A0。·OH清除率按式(5)进行计算。
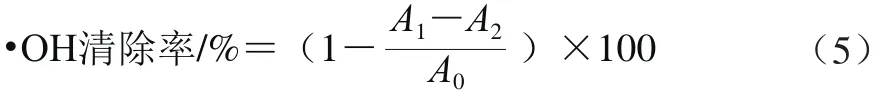
1.3.10 ABTS+·清除率测定
用磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4、0.2 mol/L)配制7.4 mmol/L的ABTS溶液(其中过硫酸钾浓度为2.6 mmol/L),然后避光置于室温下16 h,使用之前用PBS稀释至其在734 nm波长处的吸光度(A0)为(0.70±0.02)。将3 种果胶样品用PBS配制成0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 mg/mL和4.000 0 mg/mL的溶液,分别取0.2 mL各质量浓度样品溶液与2.0 mL ABTS稀释液混合,室温避光反应20 min后,立即在734 nm波长处测定吸光度(A1);同时将0.2 mL不同质量浓度的样品溶液与2 mL PBS混合,并室温避光反应20 min后,在734 nm波长处测定吸光度(A2)。按式(6)计算ABTS+·清除率。
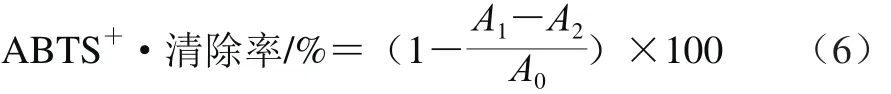
1.3.11 O2-·清除率测定
配制16 mmol/L pH 8.0的Tris-HCl缓冲液,并用该缓冲液配制果胶样品溶液(0.062 5、0.125 0、0.250 0、0.500 0、1.000 0、2.000 0 mg/mL和4.000 0 mg/mL)、468 μmol/L NADH、108 μmol/L NBT和60 μmol/L PMS。将1.0 mL样品溶液、1.0 mL NBT和1.0 mL NADH溶液混合,混合均匀后加入1.0 mL PMS溶液,室温下静置5 min,测定混合液在560 nm波长处的吸光度。按式(7)计算超氧阴离子自由基()清除率。
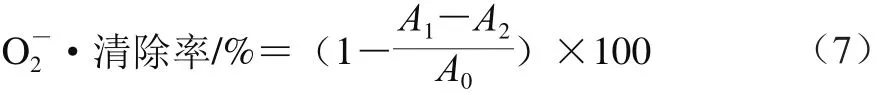
式中:A0为缓冲液代替样品的吸光度;A1为样品溶液与显色体系的吸光度;A2为样品溶液的吸光度。
1.4 数据统计分析
半抑制浓度(half maximal inhibitory concentration,IC50)采用SPSS 22.0软件中Probit回归分析求得,实验结果利用SPSS 22.0软件进行数据统计分析,所得数据采用±s表示,数据显著性差异检验采用单因素方差分析并用LSD法进行多重比较,p<0.05表示差异显著。
2 结果与分析
2.1 改性苹果果胶的化学性质
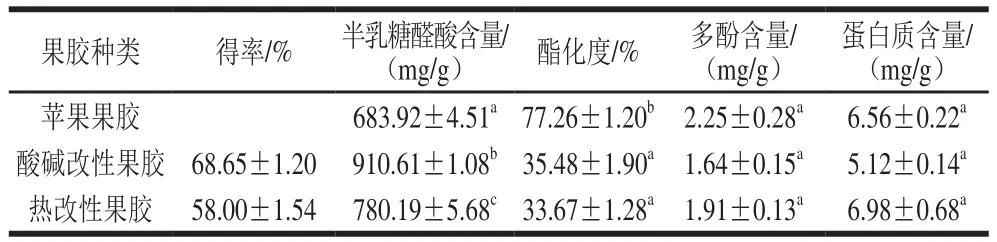
表1 改性前后苹果果胶的化学性质Table 1 Chemical properties of native and modif i ed apple pectin
采用酸碱修饰和高压蒸汽处理2 种手段分别获得酸碱改性苹果果胶和热改性苹果果胶,3 种果胶的化学性质见表1。酸碱改性果胶和热改性果胶的得率分别为(68.65±1.20)%和(58.00±1.54)%;未改性果胶、酸碱改性果胶和热改性果胶的半乳糖醛酸含量分别为(683.92±4.51)、(910.61±1.08)mg/g和(780.19±5.68)mg/g,与改性前相比,改性后果胶半乳糖醛酸含量显著提高(p<0.05)。改性前果胶的酯化度为(77.26±1.20)%,而改性后果胶酯化度显著下降(p<0.05),其中酸碱改性果胶和热改性果胶酯化度分别为(35.48±1.90)%和(33.67±1.28)%。酸碱改性时,碱处理引起β-消除反应,使得同聚半乳糖醛酸骨架解聚,同时也使酯化度降低;酸处理则优先脱下侧链上的中性糖[26],因此,果胶经酸碱改性后其半乳糖醛酸含量增加,酯化度下降;果胶经高温高压处理,可引起β-消除反应和脱甲酯基作用[27],因此半乳糖醛酸含量增加,酯化度下降。尹颖等[24]在121 ℃温度条件下处理30 min制备柑橘皮渣改性果胶,发现改性后果胶的半乳糖醛酸含量比处理前上升了6%~14%,酯化度比处理前下降了8%~21%,与本研究高温高压改性结果的趋势一致。3 种果胶多酚含量均较低(<3 mg/g)且差异不显著(P>0.05),说明其抗氧化活性主要由多糖引起。而改性前后蛋白质含量变化不显著(P>0.05)。
2.2 改性苹果果胶的分子质量及其分布
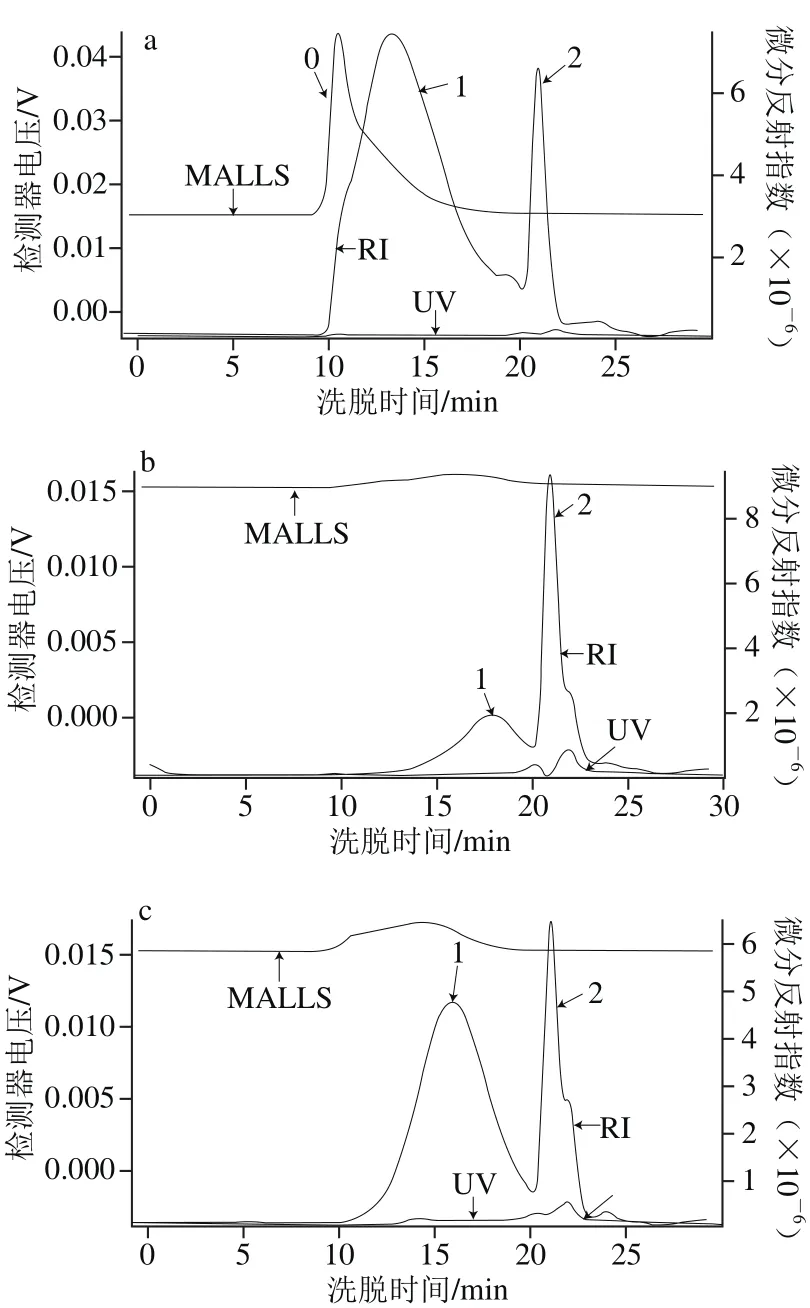
图1 苹果果胶(a)、酸碱改性果胶(b)和热改性果胶(c)的HPSEC-MALLS图Fig. 1 HPSEC-MALLS chromatograms of unmodi fi ed pectin (a),pH-modi fi ed pectin (b), and heat-modi fi ed pectin (c)
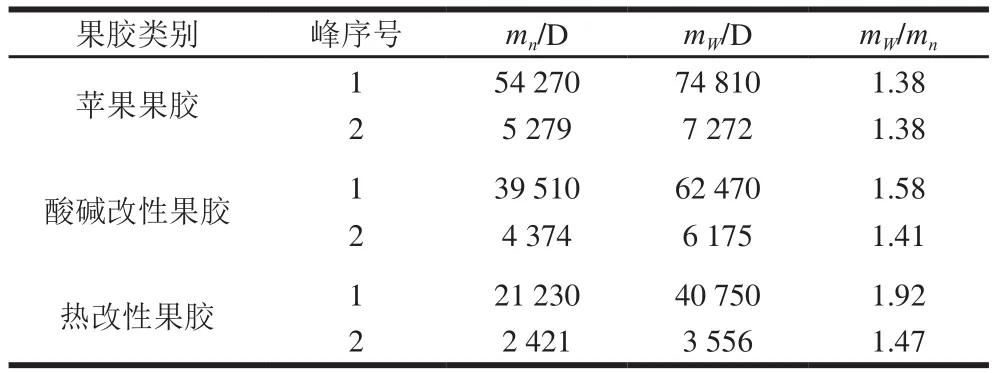
表2 苹果果胶的分子质量及其分布Table 2 Molecular weight distribution of native and modif i ed apple pectin
由图1、表2可知,苹果果胶主要由2 个片段组成(峰0为光散射大分子特征峰),其中片段1(图1a,峰1)的mW和mn分别为7.481×104D和和5.427×104D,片段2(图1a,峰2)的mW和mn分别为7.272×103D和5.279×103D。酸碱改性苹果果胶亦由2 个片段组成,其中片段1(图1b,峰1)的mW和mn分别为6.247×104D和3.951×104D,另一个片段(图1b,峰2)的mW和mn分别为6.175×103D和4.374×103D;热改性苹果果胶也由两个片段组成,其中片段1(图1c,峰1)的mW和mn分别为4.075×104D和2.123×104D,片段2(图1c,峰2)的mW和mn分别为3.556×103D和2.421×103D。苹果果胶经改性后,mW和mn均明显下降,其中热改性果胶的mW和mn的下降幅度最大。改性后果胶的mW/mn都高于未改性果胶,说明苹果果胶经酸碱修饰或高压蒸汽处理后,分子片段被随机打断,不均一片段增多,分子质量分布变宽。
2.3 改性苹果果胶的扫描电子显微镜结果

图2 苹果果胶(a)、酸碱改性果胶(b)和热改性果胶(c)的扫描电子显微镜图Fig. 2 Scanning electron microscopic images of unmodif i ed pectin (a),pH-modif i ed pectin (b) and heat-modif i ed pectin (c)
未改性果胶表面凹凸不平,质地紧密,且有许多大小不等的碎片散落(图2a)。酸碱改性果胶质地较疏松,且表面有丝状或颗粒状堆积(图2b)。热改性果胶与前两种果胶相比,质地更加疏松,具有空腔结构,且呈现瓣膜状皱褶,隐约可见片层结构(图2c)。果胶经改性后,其分子质量、半乳糖醛酸含量和酯化度发生了不同程度变化,引起了多糖分子间相互作用力的改变,从而导致结构的差异。
2.4 苹果果胶对DPPH自由基的清除率
DPPH自由基是一种合成的以氮为中心的亲脂自由基,其甲醇溶液呈紫色,且在517 nm波长处有特征吸收峰。当它从氢供体(如抗氧化剂)获得氢时生成黄色的DPPH-H,并伴随着在517 nm波长处吸光度的降低[28],这种现象可以用来评价抗氧化剂的自由基清除能力。
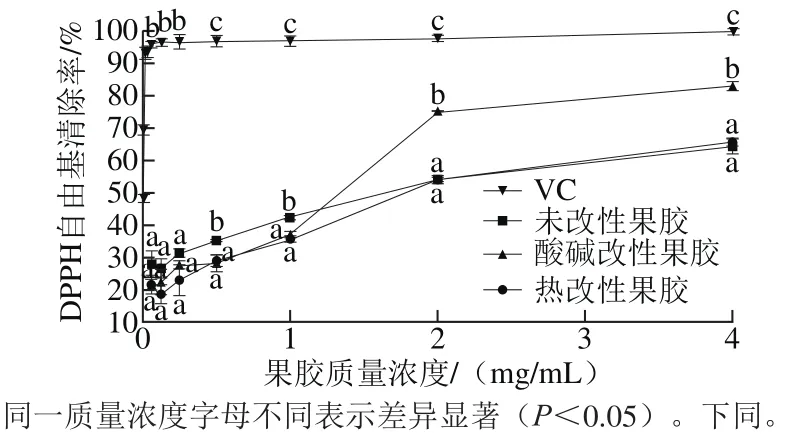
图3 不同苹果果胶对DPPH自由基的清除率Fig. 3 Scavenging capacity of different apple pectins against DPPH radical
由图3可知,3 种果胶对DPPH自由基的清除作用存在着剂量依赖效应,即随着果胶质量浓度的增加其DPPH自由基清除率亦不同程度增加。当果胶质量浓度低于0.5 mg/mL时,三者清除率差异不显著(P>0.05),当质量浓度超过1.0 mg/mL时,酸碱改性果胶的DPPH自由基清除率远高于未改性果胶和热改性果胶(p<0.05),而热改性果胶的DPPH自由基清除率与未改性果胶差异不大(P>0.05)。当果胶质量浓度为4.0 mg/mL时,未改性果胶、酸碱改性果胶和热改性果胶的DPPH自由基清除率分别达到(64.32±2.25)%、(82.95±1.45)%和(65.68±0.32)%,由回归分析可知三者IC50值分别为(1.40±0.07)、(0.87±0.26)、(1.83±0.01)mg/mL。由此可见,酸碱改性果胶对DPPH自由基的清除能力最强。
多糖中的羟基和羧基均可以作为氢的供体,相比较之下,羧基更容易解离氢原子,就更容易使DPPH自由基还原成DPPH-H,因此半乳糖醛酸含量高且酯化度低的酸碱改性果胶清除DPPH自由基的能力最强。
2.5 苹果果胶对·OH的清除活性
本实验利用Fe2+和H2O2混合产生·OH。若在反应体系中加入水杨酸,能有效地与·OH发生反应并生成2,3-二羟基苯甲酸,其在510 nm波长处有最大吸收峰[29]。在反应体系中加入果胶溶液,若其能抑制·OH的产生,便能与水杨酸竞争·OH从而使有色产物的产量减少,利用此原理便可测定果胶清除·OH的能力。
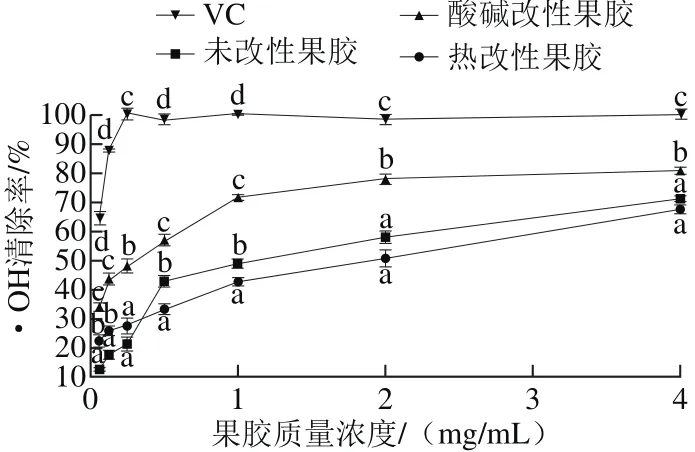
图 4 不同苹果果胶对·OH的清除率Fig. 4 Scavenging capacity of different apple pectins against hydroxyl radical
由图4可知,3 种果胶均具有·OH的清除能力,且随着果胶质量浓度的增加,其清除能力也逐渐增强。当果胶质量浓度为0.062 5 mg/mL时,3 种果胶的清除能力差异显著(p<0.05),酸碱改性果胶的·OH清除率最高,可达到(33.90±1.32)%,且果胶质量浓度在0~4 mg/L范围内,酸碱改性果胶的·OH清除能力都显著高于未改性果胶和热改性果胶(p<0.05)。而热改性果胶仅在质量浓度低于0.5 mg/mL时,其·OH清除率大于未改性果胶,当质量浓度高于2.0 mg/mL时,热改性果胶与未改性果胶的·OH清除能力差异不显著(P>0.05)。当果胶质量浓度为4.0 mg/mL时,未改性果胶、酸碱改性果胶和热改性果胶的·OH清除率分别达到(71.00±0.99)%、(80.63±1.32)%和(67.41±1.58)%,由回归分析可知三者IC50值分别为(1.10±0.17)、(0.23±0.05)mg/mL和(1.5 2±0.3 9)m g/m L,V C的I C50值为(0.04±0.01)mg/mL,3 种果胶的清除能力均低于VC。3 种果胶对·OH清除能力由高到低依次为:酸碱改性果胶>未改性果胶>热改性果胶。研究表明,·OH的清除机制主要表现在两个方面:抑制·OH的产生和清除已经产生的·OH。多糖中的羧基还能够络合金属离子如Fe2+和Cu2+等,从而抑制它们与H2O2进一步反应生成·OH,而多糖中的羟基和羧基可作为氢供体(提供氢原子与·OH反应)清除·OH[30-33]。因此,半乳糖醛酸含量较高的酸碱改性苹果果胶对·OH的清除能力较强。
2.6 苹果果胶对ABTS+·的清除活性
作为稳定的以氮为中心的水溶性自由基,ABTS+·常用于评价天然产物的抗氧化活性。ABTS和过硫酸钾反应可以产生蓝绿色ABTS+发色团,多糖可以提供氢或电子灭活ABTS+发色团,使其蓝绿色消失[34-35]。因此推测供氢能力越强的多糖,其清除ABTS+·的能力就愈强。
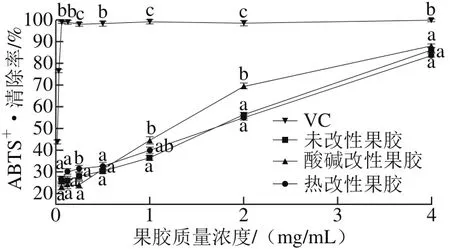
图5 不同苹果果胶对ABTS+·的清除率Fig. 5 Scavenging capacity of different apple pectins against ABTS radical
由图5可知,所有样品对ABTS+·的清除率随果胶质量浓度的增加而升高。当果胶质量浓度低于0.25 mg/mL时,3 种果胶的ABTS+·的清除率差异不显著(P>0.05),当果胶质量浓度为1.0 mg/mL时,酸碱改性果胶的清除率显著高于未改性果胶(p<0.05),果胶质量浓度增加至2.0 mg/mL时,酸碱改性果胶的清除率显著高于未改性果胶和热改性果胶(p<0.05)。当果胶质量浓度为4.0 mg/mL时,未改性果胶、酸碱改性果胶和热改性果胶的ABTS+·的清除率分别为(86.46±1.20)%、(88.21±0.90)%和(83.83±0.97)%,可见3 种果胶清除率差异不显著(P>0.05)。由回归分析可知3 种果胶的IC50值分别是(1.01±0.15)、(0.78±0.10)mg/mL和(0.9 4±0.1 5)m g/m L,V C的I C50值为(0.015±0.003)mg/mL,远高于3 种果胶的清除能力。苹果果胶经酸碱改性后,其对ABTS+·的清除能力最强,这可能与羧基比羟基更容易解离出氢,从而更容易淬灭ABTS+发色团有关。
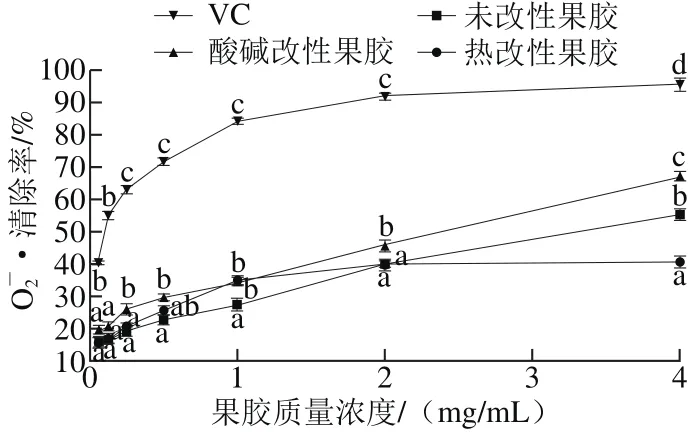
图6 不同苹果果胶对O-2·的清除率Fig. 6 Scavenging capacity of different apple pectins against superoxide anion radical
由以上结果可知,半乳糖醛酸含量提高有助于果胶抗氧化活性的增强,而半乳糖醛酸含量较高的热改性果胶对自由基的清除能力却较低,这可能与其分子质量、单糖组成和构象等多种因素有关,具体原因需要进一步分析。
3 结 论
采用酸碱修饰和高压蒸汽2 种方法对苹果果胶进行改性,分别得到酸碱改性果胶和热改性果胶。与未改性果胶相比,酸碱改性和热改性果胶的半乳糖醛酸含量提高,酯化度和分子质量下降,多酚及蛋白质含量差异不明显(P>0.05)。扫描电子显微镜结果表明,改性后果胶质地更加疏松,可能与其分子质量、酯化度和半乳糖醛酸含量改变有关。酸碱改性和热改性果胶的·OH清除率、ABTS+·清除率和的清除率呈质量浓度依赖效应,当果胶质量浓度为4.0 mg/mL时,未改性果胶、酸碱改性果胶和热改性果胶对DPPH自由基的清除率分别为(64.32±2.25)%、(8 2.9 5±1.4 5)%和(6 5.6 8±0.3 2)%,对·O H的清除率分别达到(71.00±0.99)%、(80.63±1.32)%和(67.41±1.58)%,对ABTS自由基的清除率分别达到(8 6.4 6±1.2 0)%、(88.21±0.90)%和(83.83±0.97)%,对的清除率分别达到(55.14±1.73)%、(66.98±1.51)%和(40.50±2.01)%。由此可见,酸碱改性更有助于果胶抗氧化活性的提高,这可能与其半乳糖醛酸含量提高有关。
[1] HOFF J E, CASTRO M D. Chemical composition of potato cell wall[J]. Journal of Agricultural and Food Chemistry, 1969, 17(6):1328-1331. DOI:10.1021/jf60166a058.
[2] 彭小燕, 木泰华, 孙红男, 等. 甜菜果胶的结构、提取及乳化特性研究进展[J]. 核农学报, 2014, 28(6): 1070-1075. DOI:10.11869/j.issn.100-8551.2014.06.1070.
[3] 孙绪兵, 廖立敏, 付孝锦. 果胶改性及应用研究进展[J]. 食品工业科技, 2015, 36(20): 384-391. DOI:10.13386/j.issn1002-0306.2015.20.070.
[4] GROUDEVA J,KRATCHANOVA M G, PANCHEV I N, et al. Application of granulated apple pectin in the treatment of hyperlipoproteinaemia I. Deriving the regression equation to describe the changes[J]. European Food Reseach and Technology, 1997,204(5): 374-378. DOI:10.1007/s002170050093.
[5] NESTERENKO V B, NESTERENKO A V, BABENKO V I, et al.Reducing the137Cs-load in the organism of “Chernobyl” children with apple-pectin[J]. Swiss Medical Weekly, 2004, 134(12): 24-27.
[6] KUMAR A , CHAUHAN G S. Extraction and characterization of pectin from apple pomace and its evaluation as lipase (steapsin)inhibitor[J]. Carbohydrate Polymers, 2010, 82(2): 454-459.DOI:10.1016/j.carbpol.2010.05.001.
[7] WALDECKER M, KAUTENBURGER T, DAUMANN H, et al.Histone-deacetylase inhibition and butyrate formation: fecal slurry incubations with apple pectin and apple juice extracts[J]. Nutrition,2008, 24(4): 366-374. DOI:10.1016/j.nut.2007.12.013.
[8] DELPHI L, SEPEHRI H. Apple pectin: a natural source for cancer suppression in 4T1 breast cancer cells in vitro and express p53 in mouse bearing 4T1 cancer tumors, in vivo[J].Biomedicine & Pharmacotherapy, 2016, 84: 637-644. DOI:10.1016/j.biopha.2016.09.080.
[9] MARÍN A P, ORTUŇO J, AGUILAR M, et al. Use of chemical modif i cation to determine the binding of Cd (Ⅱ), Zn(Ⅱ) and Cr(Ⅲ)ions by orange waste[J]. Biochemical Engineering Journal, 2010,53(1): 2-6. DOI:10.1016/j.bej.2008.12.010.
[10] RAMACHANDRAN C, WILK B J, HOTCHKISS A, et al. Activation of human T-helper/inducer cell, T-Cytotoxic cell, B-cell, and natural killer (NK)-cells and induction of natural killer cell activity against K562 chronic myeloid leukemia cells with modif i ed citrus pectin[J].BMC Complementary and Alternative Medicine, 2011, 11(1): 59.DOI:10.1186/1472-6882-11-59.
[11] HUANG P H, LU H T, WANG Y T, et al. Antioxidant activity and emulsion -stabilizing effect of pectic enzyme treated pectin in soy protein isolate-stabilized oil/water emulsion[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17): 9623-9628. DOI:10.1021/jf202020t.
[12] 张燕燕, 木泰华, 张苗. 改性甘薯果胶对癌细胞增殖的影响[J]. 中国农业科学, 2012, 45(9): 1798-1806. DOI:10.3864/j.issn.0578-1752.2012.09.015.
[13] LECLERE L, VAN CUTSEM P, MICHIELS C. Anti-cancer activities of pH-or heat-modif i ed pectin[J]. Frontiers in Pharmcacology, 2013, 4:1-8. DOI:10.3389/fphar.2013.00128.
[14] KIM Y, KIM Y S,YOO S H, et al. Molecular structural differences between low methoxy pectins induced by pectin methyl esterase II:effects on texture, release and perception of aroma in gels of similar modulus of elasticity[J]. Food Chemistry, 2014, 145(1): 950-955.DOI:10.1016/j.foodchem.2013.09.003.
[15] NANGIA-MAKKER P, HOGAN V, HONJO Y, et al. Inhibition of human cancer cell growth and metastasis in nude mice by oral intake of modif i ed citrus pectin[J]. Journal of the National Cancer Institute,2002, 94(24): 1854-1862. DOI:10.1093/jnci/94.24.1854.
[16] YAN J, KATZ A. PectaSol-C modif i ed citrus pectin induces apoptosis and inhibition of proliferation in human and mouse androgendependent and–independent prostate cancer cells[J]. Integrative Cancer Therapies, 2010, 9(2): 197-203. DOI:10.1177/1534735410369672.
[17] 张文博, 刘长忠, 高林. 改性柑橘果胶的制备、表征及抗癌活性[J].高等学校化学学报, 2010, 31(5): 964-969. DOI:10.1063/1.2432408.
[18] 戴少庆, 李高阳, 苏东林, 等. 柑橘果胶的提取及其改性方法的研究进展[J]. 食品工业科技, 2013, 34(16): 376-379.
[19] 苏东林, 戴少庆, 李高阳, 等. 柑橘果胶磷酸化制备工艺优化及其改性品质分析[J]. 中国食品学报, 2015, 15(8): 127-135. DOI:10.16429/j.1009-7848.2015.08.019.
[20] ZHANG T, LAN Y, ZHENG Y, et al. Identif i cation of the bioactive components from pH-modif i ed citrus pectin and their inhibitory effects on galectin-3 function[J]. Food Hydrocolloids, 2016, 58: 113-119.DOI:10.1016/j.foodhyd.2016.02.020.
[21] LECLERE L, FRANSOLET M, CAMBIER P, et al. Identif i cation of a cytotoxic molecule in heat-modif i ed citrus pectin[J]. Carbohydrate Polymers, 2016, 137: 39-51. DOI:10.1016/j.carbpol.2015.10.055.
[22] 魏子淏, 杨伟, 刘夫国, 等. 改性柑橘果胶研究进展[J].中国食品添加剂, 2014(3): 194-200. DOI:10.3969/j.issn.1006-2513.2014.03.025.
[23] PIENTA K J, NAILK H, AKHTAR A, et al. Inhibition of spontaneous metastasis in a rat prostate cancer model by oral administration of modified citrus pectin[J]. Journal of the National Cancer Institute,1995, 87(5): 348-353. DOI:10.1093/jnci/87.5.348.
[24] 尹颖, 陆胜民, 陈剑兵, 等. 柑橘皮渣制备低分子果胶及其抗癌活性的评价[J]. 浙江农业学报, 2013, 25(3): 614-618. DOI:10.3969/j.issn.1004-1524.2013.03.35.
[25] BLUMENKRANTZ N, ASBOE-HANSEN G. New method for quantitative determination of uronic acids[J]. Analytical Biochemistry,1973, 54(2): 484-489. DOI:10.1016/0003-2697(73)90377-1.
[26] 叶兴乾, 陈健乐, 金妙仁, 等. 果胶改性方法及生物学作用机理研究进展[J]. 中国食品学报, 2015, 15(7): 1-9. DOI:10.16429/j.1009-7848.2015.07.001.
[27] FRAEYE I, DE ROECK A, DUVETTER T, et al. Influence of pectin properties and processing conditions on thermal pectin degradation[J]. Food Chemistry, 2007, 105(2): 555-563. DOI:10.1016/j.foodchem.2007.04.009.
[28] XU Y F, SONG S, WEI Y X, et al. Sulfated modification of the polysaccharide from Sphallerocarpus gracilis and its antioxidant activities[J]. International Journal of Biological Macromolecules,2016, 87: 180-190. DOI:10.1016/j.ijbiomac.2016.02.037.
[29] 李侠, 徐博, 孙江, 等. 糙米黄酮的提取及对羟自由基的清除作用[J]. 吉林农业大学学报, 2014, 36(3): 347-351. DOI:10.13327/j.jjlau.2014.2141.
[30] 项惠丹, 许时婴, 王璋等. 蛋白质与还原糖美拉德反应产物的抗氧化活性[J]. 食品科学, 2008, 29(7): 52-57. DOI:10.3321/j.issn:1002-6630.2008.07.005.
[31] LI B, LIU S, XING R, et al. Degradation of sulfated polysaccharides from Enteromorpha prolifera and their antioxidant activities[J].Carbohydrate Polymers, 2013, 92(2): 1991-1996. DOI:10.1016/j.carbpol.2012.11.088.
[32] SHI M J, WEI X Y, XU J, et al. Carboxymethylated degraded polysaccharides from Enteromorpha prolifera: preparation and in vitro antioxidant activity[J]. Food Chemistry, 2017, 215: 76-83.DOI:10.1016/j.foodchem.2016.07.151.
[33] ZHANG H, LI J, XIA J, et al. Antioxidant activity and physicochemical properties of an acidic polysaccharide from Morinda officinalis[J]. International Journal of Biological Macromolecules,2013, 58: 7-12. DOI:10.1016/j.ijbiomac.2013.03.031.
[34] LI X Y, WANG L, WANG Y, et al. Effect of drying method on physicochemical properties and antioxidant activities of Hohenbuehelia serotina polysaccharides[J]. Process Biochemistry, 2016, 51(8): 1100-1108. DOI:10.1016/j.procbio.2016.05.006.
[35] VAN DER WERF R, MARCIC C, KHALIL A, et al. ABTS radical scavenging capacity in green and roasted coffee extracts[J]. LWTFood Science and Technology, 2014, 58(1): 77-85. DOI:10.1016/j.lwt.2014.02.053.
[36] YUAN Q X, XIE Y F, WANG W, et al. Extraction optimization,characterization and antioxidant activity in vitro of polysaccharides from mulberry (Morus alba L.) leaves[J]. Carbohydrate Polymers,2015, 128: 52-62. DOI:10.1016/j.carbpol.2015.04.028.
[37] PLANO D, BAQUEDANO Y, IBÁÑEZ E, et al. Antioxidantprooxidant properties of a new organoselenium compound library[J]. Molecules, 2010, 15(10): 7292-7312. DOI:10.3390/molecules15107292.
[38] JIN L, GUAN X, LIU W, et al. Characterization and antioxidant activity of a polysaccharide extracted from Sarcandra glabra[J].Carbohydrate Polymers, 2012, 90(1): 524-532. DOI:10.1016/j.carbpol.2012.05.074.
Characterization and Antioxidant Activity of Modif i ed Apple Pectin
MA Liping1,2, JIAO Kunpeng1,2, LUO Lei1,2, XIANG Jinle1,2, DANG Xiaoxiao1,ZHU Wenxue1,2,*
(1. College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471023, China;2. Henan Engineering Research Center of Food Material, Luoyang 471023, China)
From commercially available apple pectin, pH-modified and heat-modified pectin were prepared through pH modif i cation and high-pressure steam treatment, respectively. The physical and chemical properties of native and modif i ed apple pectin were investigated, and further, their antioxidant activity was examined. The results showed that galacturonic acid contents of pH-modified and heat-modified pectin increased from (683.92 ± 4.51) mg/g to (910.61 ± 1.08) and(780.19 ± 5.68) mg/g, respectively, and the degree of esterif i cation was reduced from (77.26 ± 1.20)% to (35.48 ± 1.90)%and (33.67 ± 1.28)%, respectively as compared to the native one. The molecular weight of pectin reduced and the contents of polyphenol and protein were reduced (to less than 3 and 7 mg/g, respectively) after modification. The scavenging activity of all three apple pectins against 1,1-diphenyl-2-picrylhydrazyl, hydroxyl, 2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt and superoxide anion free radicals was enhanced with their increasing concentration,and pH modif i cation could contribute to improving the antioxidant activity of pectin, which may be related to its increased galacturonic acid content.
modif i cation; apple pectin; pectin characterization; antioxidant activity
10.7506/spkx1002-6630-201723020
TS255.4
A
1002-6630(2017)23-0121-08
马丽苹, 焦昆鹏, 罗磊, 等. 改性苹果果胶性质及抗氧化活性[J]. 食品科学, 2017, 38(23): 121-128.
10.7506/spkx1002-6630-201723020. http://www.spkx.net.cn
MA Liping, JIAO Kunpeng, LUO Lei, et al. Characterization and antioxidant activity of modif i ed apple pectin[J]. Food Science,2017, 38(23): 121-128. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723020. http://www.spkx.net.cn
2016-09-16
河南省高等学校重点科研项目(16A550002);河南科技大学博士启动基金项目(13480047)
马丽苹(1979—),女,副教授,博士,研究方向为功能食品研究与开发。E-mail:maliping226@163.com
*通信作者:朱文学(1967—),男,教授,博士,研究方向为食品加工与功能食品。E-mail:zwx@haust.edu.cn
