甘薯膳食纤维的物化性质及其对体内外铅离子清除能力的影响
2017-12-08王洪云钮福祥岳瑞雪张文婷
张 毅,王洪云,钮福祥,孙 健,徐 飞,朱 红,岳瑞雪,张文婷
(江苏徐淮地区徐州农业科学研究所/中国农业科学院 甘薯研究所,江苏 徐州 221131)
甘薯膳食纤维的物化性质及其对体内外铅离子清除能力的影响
张 毅,王洪云,钮福祥*,孙 健,徐 飞,朱 红,岳瑞雪,张文婷
(江苏徐淮地区徐州农业科学研究所/中国农业科学院 甘薯研究所,江苏 徐州 221131)
以徐薯32号和徐紫薯8号为材料,采用超声辅助酶解法提取甘薯膳食纤,比较其组分、物化性质及铅离子清除能力,为预防铅中毒提供理论基础和生物学证据。结果表明:徐紫薯8号膳食纤维样品中总膳食纤维含量明显高于徐薯32号,而前者可溶膳食纤维和不溶膳食纤维比值明显低于后者。徐薯32号膳食纤维的持水性、持油性、膨胀性和葡萄糖吸收能力显著高于徐紫薯8号膳食纤维。2种甘薯膳食纤维均具有较强的铅吸收能力,并且中性条件下对铅离子的吸附能力强于酸性条件下。徐薯32号膳食纤维具有较强的体外铅离子的清除能力,而徐紫薯8号膳食纤维则对铅中毒小鼠具有更强的体内铅离子清除能力。
甘薯;膳食纤维;物化性质;铅离子清除能力
甘薯(IpomoeabatatasLam)属于旋花科甘薯属,为一年生或多年生草本植物,具有高产、适应性广、保健功能强等优点,是农业产业转型升级、结构调整的优势作物[1]。据联合国粮农组织统计,我国甘薯总产量为0.71亿吨,是全球最大的甘薯生产和消费国。随着人们生活水平的不断提高,食物摄入越来越精细化,导致肥胖症、高血脂和糖尿病等慢性病发病率呈快速上升趋势,其中膳食纤维的摄入量减少而导致的膳食营养不平衡是诱发这些现代文明病的主要原因[2]。甘薯营养成分丰富,薯块一般含有8%的膳食纤维[3],属于高膳食纤维食物,被视为营养平衡的优质食物资源。
膳食纤维(DF)是指具有3个或以上单体链节的碳水化合物,主要由果胶类物质、纤维素、半纤维素和木质素组成,不能够被人体小肠内源酶水解,但大肠中寄生的各种微生物可对其进行程度不同的分解发酵作用。DF具有多种重要的物化性质,如持水性、持油性、膨胀性、吸附性和阳离子交换能力等,此外还有诸多生理功能,如抑制肥胖、降血糖、降血脂和改善肠道菌群等,可用于预防和治疗肥胖症、糖尿病、心脑血管疾病以及肠道疾病等[4-6],被营养学界补充认定为第七类营养素。
目前,人们的生活环境和部分食物已受到不同程度的铅污染,铅中毒已成为世界范围内公害,特种行业(采矿、冶炼、蓄电池、金属热处理、焊接等)工作人员更是受到铅中毒的严重威胁,以致成为铅中毒职业病[7]。目前,排铅药物虽能起到一定治疗作用,但效果不稳定、副作用明显。DF能通过螯合、络合或吸附作用在体内与铅产生很强结合力,有效地阻止铅在胃肠道的吸收,随排泄物排出体外[8]。本研究拓宽了甘薯DF的应用范围,为甘薯DF排铅功能提供了一个新的试验证据。
1 材料与方法
1.1试验材料
以江苏徐淮地区徐州农业科学研究所的2个甘薯品种(徐薯32号和徐紫薯8号)为试验材料,试验场地为江苏徐淮地区徐州农业科学研究所试验田(117°17.48′ E, 34°16.95′ N)。收获后的甘薯储存于12~14 ℃的甘薯库,1周内所有样品同时进行DF提取。
1.2试验动物
ICR小鼠,8周龄,每组7只,全部雄性,由徐州医科大学实验动物中心提供。
1.3主要试剂与仪器
α-淀粉酶购自诺维信公司,酶活90 KNU/g;纤维素酶为无锡杰能科,酶活82 GCU/g;铅标准溶液购自国家环境标准物质中心,浓度为500 mg/L;其他试剂均为国产分析纯。
UV-2450紫外分光光度计,由日本岛津公司生产;Spectr AA220原子吸收光谱仪,由美国瓦里安公司生产;BSA323S电子天平,由赛多利斯科学仪器有限公司生产;Milli-Q Advantage A10超纯水系统,由默克化工技术有限公司生产。
1.4甘薯DF的提取
甘薯DF的提取参考孙健等[9]的方法进行,新鲜甘薯切块打浆,洗去淀粉后的薯渣烘干备用。薯渣按料液比1∶50加入蒸馏水,85 ℃水浴,加入α-淀粉酶去除薯渣中残留的淀粉,酶解30 min至碘液滴定不变蓝。冷却,调pH值至4.8,按每克薯渣加入3 μL纤维素酶,于65 ℃和超声功率400 W条件下酶解10 min。收集处理液,加入4倍体积95%乙醇,醇沉过夜,3000 r/min离心15 min,沉淀物经干燥粉碎后过200目,即为甘薯DF。
1.5甘薯DF成分的测定
蛋白质含量的测定参考AOAC 955.04;脂肪含量的测定参考AOAC 920.39;灰分含量的测定参考AOAC 942.05;总膳食纤维(TDF)、可溶性膳食纤维(SDF)、不溶性膳食纤维(IDF)含量的测定参考AOAC 991.43。
纤维素、半纤维素、木质素和果胶含量的测定参考Claye等[10]的方法改进,取纯化后的徐薯32号和徐紫薯8号DF 1.0 g,与10 mL 0.25%的EDTA溶液混合,90 ℃下浸提2 h,残渣分别用蒸馏水、甲醇和丙酮洗涤后烘干称重,提取液经透析后冻干,称重即为果胶含量(P1);烘干的残渣与20 mL含0.1%硼氢化钠的5%氢氧化钾溶液混合,室温下浸提18 h,提取液经透析后冻干,称重即为半纤维素含量(P2);残渣分别用蒸馏水、甲醇和丙酮洗涤后烘干得P3;P3与72%的硫酸混合,4 ℃下浸提30 h,过滤烘干得P4;其中灰分含量为P5;木质素含量为P4与P5之和;纤维素含量为P3、P4与P5之和。
1.6DF物化性质的测定
DF物化性质的测定参考梅新等[11]的方法改进,取1.0 g DF样品,加入20 mL蒸馏水,室温下搅打30 min后静置24 h,5000 r/min离心10 min,弃去上清液并用滤纸吸干离心管残留水分,称重后计算持水性(WHC,g/g):
WHC=(W2-W1)/W1
(1)
式(1)中:W1为样品的干重(g);W2为样品的湿重(g)。
取1.0 g DF样品,加入10 mL植物油,室温下搅打10 min后静置1 h,5000 r/min离心20 min,弃去上清液,称重后计算持油性(OHC,g/g):
OHC=(W2-W1)/W1
(2)
式(2)中:W1为样品的干重(g);W2为样品的湿重(g)。
取1.0 g DF样品,置于直径为1.5 cm带刻度的试管中,记录干基样品的体积,加入20 mL去离子水,充分混匀,平衡后于室温下放置16 h,记录吸水后饱胀的体积,计算膨胀性(SWC,mL/g):
SWC=(V2-V1)/W
(3)
式(3)中:V1为吸水前样品体积(mL);V2为吸水后样品体积(mL);W为样品的质量(g)。
取1.0 g经过醇洗的DF样品与100 mL的200 mmol/L葡萄糖溶液充分混合后,于室温下放置6 h,4000 r/min离心20 min,上清液中葡萄糖含量测定采用葡萄糖氧化酶-过氧化物酶(GOD-POD)法,540 nm下测定上清的吸光值,计算葡萄糖吸收能力(GAC,mmol/g):
GAC=(C0-Ct)/W×V
(4)
式(4)中:C0为初始葡萄糖溶液的浓度(mmol/L);Ct为吸附后葡萄糖溶液的浓度(mmol/L);W为样品的质量(g);V为葡萄糖溶液的体积(mL)。
1.7DF对体外铅离子清除能力的测定
阳离子交换容量的测定参考欧仕益等[12]的方法进行,取1.0 g DF样品于锥形瓶中,加入30 mL去离子水,搅拌均匀后加入酚酞指示剂,用0.105 mol/L NaOH溶液滴定,当溶液变微红立即停止滴定,振荡褪色后再滴定,振荡5 min仍不褪色时视为滴定终点。根据消耗的NaOH溶液计算出阳离子交换容量(CCEC,mmol/g):
CCEC=(C×V)/W
(5)
式(5)中:CCEC为阳离子交换容量(mmol/g);C为NaOH溶液的浓度(mol/L);V为消耗NaOH溶液的体积(mL);W为样品的质量(g)。
DF对铅离子的清除能力以BCmax和Cmin两个吸附值来衡量。BCmax为铅离子最大吸附量,Cmin为铅离子最小吸附浓度。
BCmax的测定参考Hu等[13]的方法改进,取0.2 g DF样品于锥形瓶中,加入20 mL的10 mmol/L的硝酸铅溶液[Pb(NO3)2]。设置pH=2.0和pH=7.0,分别模拟胃和肠道环境,室温振荡3 h,取上清液1 mL,加入无水乙醇使酒精浓度达到80%,4000 r/min离心20 min,去上清液,用原子吸收分光光度计测定溶液中铅离子含量,根据反应前后的浓度差计算铅离子最大吸附量(BCmax,μmol/g):
BCmax=V×(C0-Ct)/W
(6)
其中:V为上清液的体积(mL);C0为初始铅离子的浓度(μmol/mL);Ct为吸附后铅离子的浓度(μmol/mL);W为样品的质量(g)。
Cmin的测定参考Zhang等[14]的方法改进,取0.5 g DF样品于锥形瓶中,加入20 mL的500 μmol/L的硝酸铅溶液[Pb(NO3)2]。设置pH=2.0和pH=7.0,室温振荡4 h,取上清液1 mL,加入无水乙醇使酒精浓度达到80%,4000 r/min离心20 min,去上清液,测定所得的上清液浓度表示铅离子最小吸附浓度(Cmin,μmol/L)。
1.8DF对体内铅离子清除能力的测定
铅中毒小鼠模型参考Liu等[15]的方法进行建模,正常对照组小鼠给予普通饮用水和饲料;模型对照组小鼠给予含500 mg/L醋酸铅的饮用水和普通饲料;徐薯32号DF组给予含500 mg/L醋酸铅的饮用水和含30%徐薯32号DF的饲料;徐紫薯8号DF组给予含500 mg/L醋酸铅的饮用水和含30%徐紫薯8号DF的饲料。试验持续60 d,取血和肾脏消化后直接用于石墨炉原子吸收光谱测定铅含量[16]。
1.9统计分析
采用SPSS 18.0软件处理数据,以平均值±标准误差表示。采用LSD法进行多重比较和描述性统计;相关性检验采用皮尔森相关系数。
2 结果与分析
2.1甘薯DF的基本成分和化学成分
由表1可知,徐薯32号DF和徐紫薯8号DF的基本成分中蛋白、脂肪和灰分的含量都很低且无显著差异。徐紫薯8号DF的TDF含量(81.27±0.77) g/100 g DM显著高于徐薯32号DF的TDF含量(80.44±0.55) g/100 g DM(Plt;0.05)。徐薯32号DF的SDF含量极显著高于徐紫薯8号DF(Plt;0.01),SDF/IDF比值为0.70;而徐紫薯8号DF的IDF含量极显著高于徐薯32号DF(Plt;0.01),SDF/IDF比值为0.56。
注:同列数据后不同大、小写字母分别表示在0.01、0.05水平上的差异显著性。下同。
由表2可以看出,DF的化学成分主要包括果胶、纤维素、半纤维素和木质素,徐薯32号DF和徐紫薯8号DF各化学组分间存在极显著差异(Plt;0.01)。徐薯32号DF中果胶含量较高,达到(40.19±0.33) g/100 g DM;而徐紫薯8号DF中纤维素、半纤维素和木质素含量较高,分别达到(32.01±0.56) g/100 g DM、(15.81±0.32) g/100 g DM和(11.19±0.25) g/100 g DM。

表2 甘薯DF的化学成分 g/100 g DM
2.2甘薯DF的物化性质
表3为不同品种甘薯DF的基本物化性质,徐薯32号DF的持水性达到(10.01±0.09) g/g;而徐紫薯8号DF的持水性为(9.38±0.23) g/g,两者差异极显著(Plt;0.01)。徐薯32号DF的持油性和膨胀性分别为(4.26±0.22) g/g和(6.09±0.16) mL/g,均显著高于徐紫薯8号DF的持油性和膨胀性(3.81±0.13) g/g和(5.77±0.32) mL/g(Plt;0.05)。在200 mmol/L葡萄糖溶液中,每克徐薯32号DF能有效结合20.00 mmol的葡萄糖;而每克徐紫薯8号DF只能吸附(19.08±0.26) mmol的葡萄糖,徐薯32号DF的葡萄糖吸收能力极显著高于徐紫薯8号DF(Plt;0.01)。

表3 甘薯DF的物化性质
2.3甘薯DF对体外铅离子的清除能力
甘薯DF的结构中含有很多的羟基、羧基及酚羟基等基团[17],这些基团具有较强的阳离子交换能力。如表4所示,徐薯32号DF和徐紫薯8号DF的阳离子交换容量分别为0.61 mmol/g和0.55 mmol/g,徐薯32号DF的阳离子交换容量显著高于徐紫薯8号DF(Plt;0.05)。
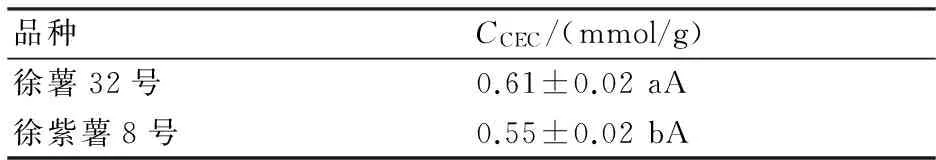
表4 甘薯DF的阳离子交换容量
不同pH值条件下分别模拟胃和肠道环境,甘薯DF对体外铅离子的吸附能力如表5所示。2种甘薯DF在中性pH条件下比酸性pH条件下具有更强的吸附能力,徐薯32号DF在胃中(pH=2.0)对铅离子的最大吸附能力为(52.95±0.66) μmol/g,远小于在肠道中(pH=7.0)对铅离子的最小吸附能力(320.22±0.97) μmol/g,这说明DF对铅离子的吸附作用主要发生在肠道内。徐紫薯8号DF在胃和肠道中对铅离子的最大吸附能力分别为(49.68±0.51) μmol/g和(302.10±1.30) μmol/g,极显著低于徐薯32号DF(Plt;0.01)。在评价DF吸附铅离子的能力时,不仅要确定铅离子的最大吸附量,还要检测铅离子的最小吸附浓度。徐薯32号DF在胃中(pH=2.0)Cmin值高达(188.27±1.03) μmol/L,说明DF在胃中对铅离子清除很不彻底,徐紫薯8号DF在胃道中Cmin值为(194.68±2.20) μmol/L,两者差异极显著(Plt;0.01)。在肠道中(pH=7.0)徐薯32号DF能将铅离子浓度降低到(18.30±0.43) μmol/L,而徐紫薯8号DF在肠道中Cmin值为(20.74±0.50) μmol/L,两者差异显著(Plt;0.05)。

表5 不同pH值条件下甘薯DF对体外铅离子的吸附能力
2.4甘薯DF对体内铅离子的清除能力
由表6可知,正常对照组与模型对照组相比较,全血和肾脏组织的铅含量均呈极显著差异 (Plt;0.01),模型对照组小鼠血铅和肾脏铅含量分别达到(6.67±0.99) μg/cL和(7.77±1.12) μg/g。徐薯32号DF组和徐紫薯8号DF组与模型对照组相比,两项指标均有所下降,其中血铅含量依次下降了35.08%和38.83%,肾脏铅含量下降了41.31%和44.27%,且两组小鼠上述组织的铅含量与模型对照组相比具有极显著差异 (Plt;0.01),徐紫薯8号DF组清除铅离子效果略好于徐薯32号DF组。
3 结论与讨论
徐薯32号DF和徐紫薯8号DF中TDF的含量分别达到80.44%和81.27%,说明超声辅助酶解法可以获得纯度较高的DF。2种甘薯DF中SDF含量均在10%以上,属于优质的DF[18]。SDF和IDF的物化性质和生理功能不尽相同,徐薯32号DF的SDF/IDF比值0.70高于徐紫薯8号DF的SDF/IDF比值0.56,暗示2种甘薯DF将具有不同的物化性质和清除铅离子的能力。

表6 甘薯DF对体内铅离子的清除能力
持水性、持油性和膨胀性的大小是衡量DF品质的重要指标。持水性、持油性和膨胀性越大,则表示DF的吸水、吸油能力越大,这与SDF/IDF比值、纤维颗粒度和密度、比表面积、电荷密度及疏水性能等都有关[19]。徐薯32号DF的持水性、持油性和膨胀性均优于徐紫薯8号DF,说明SDF/IDF比值的增高,可以提高甘薯DF的理化性质。DF的葡萄糖吸收能力是考察肠道消化过程中DF对葡萄糖抑制和转运能力的重要指标[20]。徐薯32号DF的葡萄糖吸收能力优于徐紫薯8号DF,这可能是由于徐薯32号DF的SDF含量较多,从而网状结构更为均匀,比表面积较大,易于对葡萄糖分子的截留,并减缓了葡萄糖分子扩散的速率[21]。
甘薯DF在pH值为7.0的条件下对铅离子的吸附能力较pH值为2.0的条件下显著增强,说明甘薯DF对铅离子的吸附作用主要依靠化学吸附,因为根据物质的表明特性,pH值对物理吸附的影响不大,而化学吸附主要依靠DF中的羧基基团,当pH值升高,羧基上的质子解离增多,铅离子吸附量增多,当pH值下降,羧基的解离减少,吸附量减少。徐薯32号DF和徐紫薯8号DF的CCEC分别为0.61 mmol/g和0.55 mmol/g,而BCmax的最大值分别为320.22 μmol/g和(302.10±1.30) μmol/g,根据化学计量,2个羧基才能吸附1个二价铅离子,2种DF上的羧基均被铅离子过饱和,说明甘薯DF对铅离子的吸附作用也存在物理吸附。徐薯32号DF的阳离子交换容量和吸附能力均大于徐紫薯8号DF,可能是因为徐薯32号DF中的SDF含量较多,这与前人的研究结果相一致,一般认为SDF比IDF具有更强的物化性和功能性[22]。
血液是铅进入机体的门户,肾脏是铅的主要靶器官之一[23],因此本研究选择血铅和肾脏铅含量作为考察指标。结果表明:2种甘薯DF均可以有效降低小鼠血液和肾脏的铅含量,血铅对甘薯DF的影响更敏感,进一步说明甘薯DF具有很强的阳离子交换作用,可以减少机体对肠道铅的吸收,进而减少铅在组织中的分布。而徐紫薯8号DF的效果要略好于徐薯32号DF,这可能也是徐薯32号DF中的SDF含量较多的原因。因为肠道是盐和水分吸收的重要部位,也是DF分解的场所,因此,不能完全凭肠道pH值的条件下铅离子被吸附量来判断体内清除铅离子的情况,要考虑DF被分解后会释放部分铅离子。本研究表明,SDF/IDF比值低的徐薯32号DF对体内铅离子的清除能力要优于SDF/IDF比值低高的徐紫薯8号DF,说明SDF释放出的铅离子要多于IDF。
综上所述,徐薯32号DF的SDF含量高于徐紫薯8号DF,具有较强的体外铅离子的清除能力,而徐紫薯8号DF则具有更强的体内铅离子的清除能力。徐薯32号DF具有更好的持水性等物化性质、更大的阳离子交换能力和更强的铅离子吸附能力,但同时在肠道中易分解,会释放更多的铅离子,所以在研制甘薯DF功能食品时,应根据不同需求适当调节SDF和IDF的比例。
[1] 蒋玉峰,马代夫.国家甘薯产业技术体系建设推动甘薯产业和学科发展[J].江苏师范大学学报:自然科学版,2016,34(3):23-27.
[2] Cyrilwc K, Amin E, Davidja J. The link between dietary fibre and human health[J]. Food Hydrocolloids, 2010, 24(1): 42-48.
[3] 王洪云,孙健,钮福祥,等.甘薯的功能成分及其药用价值[J].中国食物与营养,2013,19(12):59-62.
[4] Mann J I, Cummings J H. Possible implications for health of the different definitions of dietary fibre[J]. Nutrition Metabolism amp; Cardiovascular Diseases, 2009, 19(3): 226-229.
[5] Anderson J W, Baird P, Davis Jr R H, et al. Health benefits of dietary fiber[J]. Nutrition Reviews, 2009, 67(4): 188-205.
[6] Kaczmarczyk M M, Miller M J, Freund G G. The health benefits of dietary fibre: beyond theusual suspects of type 2 diabetes mellitus, cardiovascular disease and colon cancer[J]. Metabolism: Clinical and Experimental, 2012, 61(8): 1058-1066.
[7] 陈炳卿,孙长颢.食品污染与健康[M].北京:化学工业出版社,2002:154-158.
[8] 陈洪雨,马蕾,杨建乔,等.山楂膳食纤维改善功能性便秘及预防铅中毒作用[J].食品科学,2013,34(15):232-235.
[9] 孙健,钮福祥,岳瑞雪,等.超声波辅助酶法提取甘薯渣膳食纤维的研究[J].核农学报,2014,28(7):1261-1266.
[10] Claye S S, Idouraine A, Weber C W. Extraction and fractionation of insoluble fiber from five fiber sources[J]. Food Chemistry, 1996, 57(2): 303-310.
[11] 梅新,木泰华,陈学玲,等.超微粉碎对甘薯膳食纤维成分及物化特性影响[J].中国粮油学报,2014,29(2):76-81.
[12] 欧仕益,高孔荣,吴晖.麦麸膳食纤维清除重金属离子的研究[J].食品科学,1998,19(5):7-10.
[13] Hu G H, Huang S H, Chen H, et al. Binding of four heavy metals to hemicelluloses from rice bran[J]. Food Research International, 2010, 43(1): 203-206.
[14] Zhang N, Huang C, Ou S. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J]. Journal of hazardous materials, 2011, 186(1): 236-239.
[15] Liu C M, Ma J Q, Liu S S, et al. Proanthocyanidins improves lead-induced cognitive impairments by blocking endoplasmic reticulum stress and nuclear factor-jB-mediated inflammatory pathways in rats[J]. Food and Chemical Toxicology, 2014, 72(3): 295-302.
[16] 顾文龙,郝书林,王静,等.石墨炉原子吸收光谱法快速测定小白鼠全血中铅残留量[J].中国畜牧兽医文摘,2015(11):55-56.
[17] Sangnark A, Noomhorm A. Effect of particle sizes on functional properties of dietary fibre prepared from sugarcane bagasse[J]. Food Chemistry, 2003, 80(2): 221-229.
[18] 郑建仙.功能性食品[M].第二卷.北京:中国轻工业出版社,1999:50-56.
[19] Gomez-Ordonez E, Jimenez-Escrig A, Ruperez P. Dietary fibre and physicochemical properties of several edible seaweeds from the northwestern Spanish coast[J]. Food Research International, 2010, 43(9): 2289-2294.
[20] Chau C F, Wen Y L, Wang Y T. Improvement of the functionality of a potential fruit insoluble fibre by micron technology[J]. International Journal of Food Science amp; Technology, 2006, 41(9): 1054-1060.
[21] Lopez G, Ros G, Rincon F, et al. Relationship between physical and hydration properties of soluble and insoluble fiber of artichoke[J]. Journal of Agricultural amp; Food Chemistry, 1996, 44(9): 2773-2778.
[22] Schneeman B O. Dietary fiber: Physical and chemical properties, methods of analysis, and physiological effects[J]. Food Technology, 1986, 40(2): 104-110.
[23] Osterloh J D, Selby J V, Bernard B P, et al. Body burdens of lead in hypertensive nephropathy[J]. Arch Environ Health, 1989, 44(5): 304-310.
(责任编辑:曾小军)
StudyonPhysico-chemicalPropertiesofDietaryFiberinSweetPotatoandItsCapacityofScavengingLeadIoninvitroandvivo
ZHANG Yi, WANG Hong-yun, NIU Fu-xiang*, SUN Jian, XU Fei,ZHU Hong, YUE Rui-xue, ZHANG Wen-ting
(Xuzhou Institute of Agricultural Sciences in Xuhuai Region of Jiangsu / Sweet Potato Research Institute,Chinese Academy of Agricultural Sciences, Xuzhou 221131, China)
Dietary fiber (DF) was extracted from two sweet potato varieties by the ultrasonic-assisted enzymatic hydrolysis method. The compositions, physico-chemical properties and lead-scavenging capacities of DF from two sweet potato varieties were compared, in order to provide theoretical basis and biological evidence for the prevention of lead poisoning. The results indicated that: the content of total dietary fiber in Xuzishu No. 8 DF sample was obviously higher than that in Xushu No. 32 DF sample; however, the ratio of soluble dietary fiber to insoluble dietary fiber in Xuzishu No. 8 DF sample was evidently lower than that in Xushu No. 32 DF sample. Furthermore, the water-holding capacity, oil-holding capacity, swelling capacity and glucose-absorbing ability of Xushu No. 32 DF were significantly higher than those of Xuzishu No. 8 DF. These two kinds of sweet potato DF had a strong capacity of absorbing lead ion, and this capacity under neutral condition was stronger than that under acidic condition. Xushu No. 32 DF had a stronger capacity of scavenging lead ion in vitro, while Xuzishu No. 8 DF had a stronger capacity of scavenging lead ion in lead-poison mice.
Sweet potato; Dietary fiber; Physico-chemical property; Lead-scavenging capacity
S531
A
1001-8581(2017)12-0087-06
2017-08-31
国家现代农业产业技术体系建设专项资金(CARS-10-B20);江苏省徐州市农业科学院科研基金(2015001);江苏省苏北计划专项项目(SZ-XZ2017034)。
张毅(1987─),男,江苏徐州人,助理研究员,从事甘薯功能食品研究。*通讯作者:钮福祥。
