腹腔镜低位直肠癌手术的临床治疗价值及其对血浆miR-21水平的影响*
2017-12-07胡连智刘海山张士丰韩武军
胡连智,李 伟,刘海山,张士丰,韩武军
(昌黎县人民医院,河北 秦皇岛,066600)
腹腔镜低位直肠癌手术的临床治疗价值及其对血浆miR-21水平的影响*
胡连智,李 伟,刘海山,张士丰,韩武军
(昌黎县人民医院,河北 秦皇岛,066600)
目的比较腹腔镜与开腹手术治疗低位直肠癌的疗效及对血浆水平的影响。方法回顾分析2011年10月至2014年10月收治的80例低位直肠癌患者的临床资料,将患者分为对照组(行开腹手术)与观察组(行腹腔镜手术),比较两组患者术中、术后相关情况及血浆miR-21水平的变化。结果观察组术中出血量、切口长度、术后排气时间、进食时间、排尿时间、住院时间均优于对照组(P<0.05),手术时间、淋巴结清扫数量两组差异无统计学意义(P>0.05)。治疗后,两组miR-21水平均低于治疗前(P<0.05),其中观察组术后miR-21水平降低更为显著。观察组术后并发症总发生率(5.0%)低于对照组(27.5%),差异有统计学意义(P<0.05)。术后1年随访,两组手术相关指标差异无统计学意义(P>0.05)。结论腹腔镜手术治疗低位直肠癌的肿瘤根治效果与开腹手术相当,腹腔镜手术安全、可靠,微创优势更明显,康复更快。
低位直肠肿瘤;腹腔镜检查;剖腹术;对比研究
低位直肠癌是指发生于腹膜返折线以下的直肠癌变,属于直肠癌常见类型之一,患病率及致死率均较高[1]。手术是治疗低位直肠癌最有效的治疗手段,主要包括传统开腹手术及腹腔镜手术两种。传统开腹手术切口大,创伤明显,术后康复慢,并发症较多[2]。随着腹腔镜技术水平的不断提高与完善,腹腔镜直肠癌手术在临床上已被广泛采用,并具有切口小、创伤少、康复快、并发症少等优势,更容易受到患者的青睐[3]。目前关于腹腔镜直肠癌手术的安全性、可行性基本得到国内外专家的肯定,但仍有学者认为腹腔镜术后的肿瘤复发率、远端转移率、生存率、肿瘤学安全性等尚需进一步证实,因此关于低位直肠癌手术方式的选择仍存有争议[4]。miR-21属于内源性致癌小RNA,常在多种肿瘤中表达,在肿瘤的发生、发展中起重要作用,在部分患者中与临床分期、淋巴结转移、远处转移密切相关。笔者结合我院近年收治的低位直肠癌患者进行观察,比较腹腔镜与开腹低位直肠癌手术的临床疗效。现将结果报道如下。
1 资料与方法
1.1 临床资料 选取2011年10月至2014年10月我院手术治疗的80例直肠癌患者作为观察对象,按手术方式分为对照组(行开腹手术)与观察组(行腹腔镜手术),每组40例。两组患者性别、年龄、病程(出现临床症状时间)、肿瘤直径、肿瘤分期、肿瘤分化程度等基本资料差异无统计学意义(P>0.05),具有可比性,见表1。纳入标准[5]:(1)术前肠镜活检、术后病理均证实为直肠癌,且肿瘤直径≤5.0 cm,肿瘤下缘距肛缘3.0~7.0 cm;(2)全腹部B超、CT等检查均排除远处转移;(3)年龄>18岁;(4)无严重基础疾病,可耐受手术;(5)能主动积极的配合治疗,自愿签署知情同意书;(6)本研究经过我院医学伦理委员会的批准。排除标准[6]:(1)难以耐受手术;(2)合并严重心肺、肝肾功能不全;(3)合并精神、意识障碍;(4)伴有肠梗阻或恶性肿瘤远处转移;(5)术前曾行放化疗;(6)中途退出治疗,更改术式。
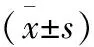
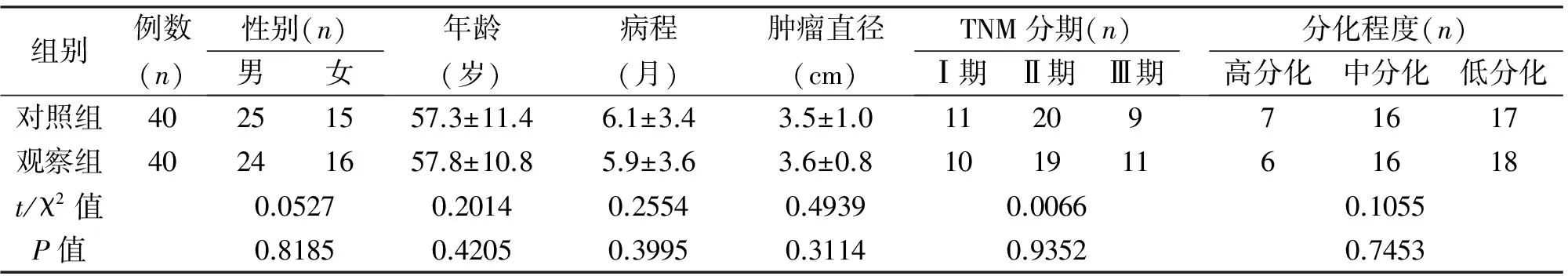
组别例数(n)性别(n)男女年龄(岁)病程(月)肿瘤直径(cm)TNM分期(n)Ⅰ期Ⅱ期Ⅲ期分化程度(n)高分化中分化低分化对照组40251557.3±11.46.1±3.43.5±1.01120971617观察组40241657.8±10.85.9±3.63.6±0.810191161618t/χ2值0.05270.20140.25540.49390.00660.1055P值0.81850.42050.39950.31140.93520.7453
1.2 手术方法 两组患者围手术期准备相同,手术均由同一组治疗小组完成,均遵循直肠全系膜切除原则。本研究中Ⅱ~Ⅲ期直肠癌患者术前未行新辅助化疗,尽管通过新辅助放化疗手段可取得较低的局部复发率,但却会延迟最佳的化疗治疗,同时采取新辅助化疗对本研究结果的影响难以评估。观察组:采取腹腔镜手术治疗,建立CO2气腹,压力控制在13 mmHg,脐孔附近穿刺10 mm Trocar,置入观察镜,分别于右侧腹部、左侧腹部根据情况选择操作孔,置入超声刀、分离钳等器械。游离乙状结肠系膜(图1),处理肠系膜下血管并清扫周围脂肪、淋巴结,暴露肠系膜下动脉并用血管夹夹闭、离断(图2),继续分离至腹膜返折线后,结合超声刀向下分离,切开直肠前间隙,分离直肠后间隙并沿系膜两侧壁入路继续分离,确保直肠系膜及周围脂肪结缔组织的完全游离(图3)。保肛方式包括:拖出式切除吻合手术与腔镜辅助法。肿瘤侵犯肛门括约肌或肛提肌者,行Miles术;肿瘤侵犯会阴部的患者,常规切除直肠及肿瘤,不做保肛处理。仔细冲洗盆腔,放置引流管,逐层缝合。对照组:采取传统开腹手术治疗,行Miles术与Dixon术。患者取膀胱截石位,于肠系膜下动脉根部离断并清除周围组织及淋巴结,电刀锐性分离直肠及其周围系膜,分离至肿瘤远切缘2 cm处。打开直肠返折腹膜,并向下游离切断直肠侧韧带,至肛尾韧带、肛提肌,注意保护腹膜后直肠两旁的输尿管。切除肿瘤,并行肠管吻合。肿瘤侵犯会阴部的患者,常规切除直肠及肿瘤,不做保肛处理。仔细冲洗盆腔,放置引流管,逐层缝合。两组患者术后均根据疾病分期及美国国立综合癌症网络直肠癌指南相关标准行放化疗。
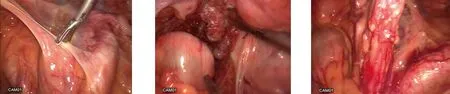
图1 游离乙状结肠图2 血管夹夹闭结直肠动脉 图3 游离直肠右侧壁
1.3 观察指标 比较两组患者手术相关情况(手术时间、术中出血量、切口长度、淋巴结清扫数量、术后排气时间、术后进食时间、术后排尿时间、术后住院时间)、治疗前后血浆miR-21水平、术后并发症(切口感染、肠梗阻、尿潴留、吻合口瘘)及术后随访结果(局部复发、远处转移、切口种植、切口疝及术后1年生存率、无瘤生存率)。miR-21水平测定[7]:分别于治疗前后采集两组患者5 ml血浆,并提取总RNA,使用QIAamp Viral RNA Mini Kits 试剂盒进行提取,按说明书操作。
1.4 随访方法 通过门诊、电话及调查等方式随访,门诊及电话每3个月随访一次,主要询问患者术后恢复情况、体格检查及癌胚抗原的测定,平均随访(16.5±5.5)个月。
2 结 果
2.1 两组患者手术相关情况 观察组术中出血量、切口长度、术后排气时间、术后进食时间、术后排尿时间、术后住院时间均优于对照组,差异有统计学意义(P<0.05);两组手术时间、淋巴结清扫数量差异无统计学意义(P>0.05),见表2。
2.2 两组患者治疗前后血浆miR-21水平 两组患者治疗前miR-21水平无明显差异,治疗后两组患者miR-21水平均显著降低,较治疗前差异有统计学意义(P<0.05),其中观察组患者治疗后miR-21水平较对照组降低更为显著,差异有统计学意义(P<0.05),见表3。
2.3 两组患者术后并发症 两组患者术后均发生不同程度并发症,主要包括:切口感染、肠梗阻、尿潴留、吻合口瘘,观察组并发症总发生率为5.0%,低于对照组的27.5%,差异有统计学意义(P<0.05),见表4。
2.4 两组患者术后随访结果 两组患者术后均获随访,术后1年内两组均有局部复发、远处转移、切口种植、切口疝发生,两组术后1年并发症发生率、生存率及无瘤生存率差异无统计学意义(P>0.05),见表5。术后2年随访,对照组34例生存,生存率85.0%,观察组36例生存,生存率90.0%。
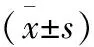
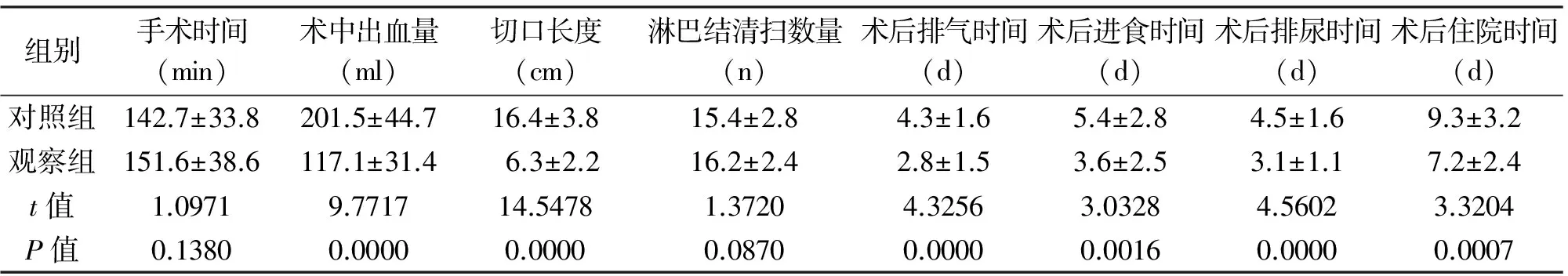
组别手术时间(min)术中出血量(ml)切口长度(cm)淋巴结清扫数量(n)术后排气时间(d)术后进食时间(d)术后排尿时间(d)术后住院时间(d)对照组142.7±33.8201.5±44.716.4±3.815.4±2.84.3±1.65.4±2.84.5±1.69.3±3.2观察组151.6±38.6117.1±31.46.3±2.216.2±2.42.8±1.53.6±2.53.1±1.17.2±2.4t值1.09719.771714.54781.37204.32563.03284.56023.3204P值0.13800.00000.00000.08700.00000.00160.00000.0007
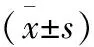
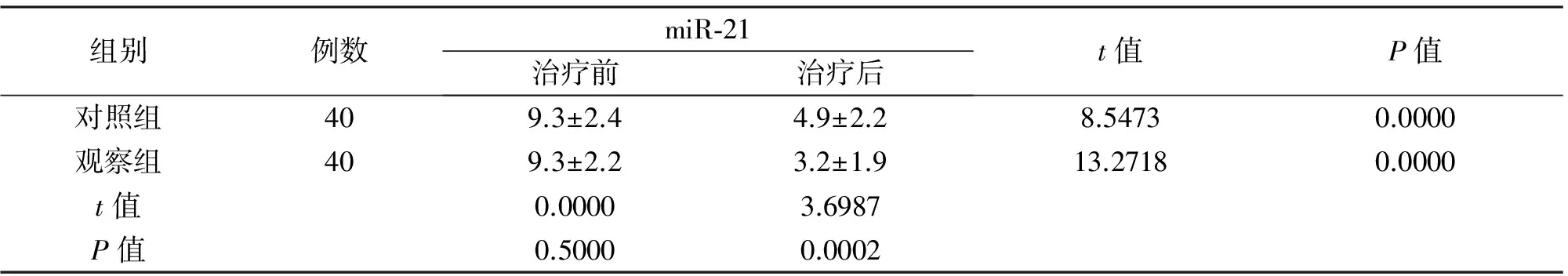
组别例数miR⁃21治疗前治疗后t值P值对照组409.3±2.44.9±2.28.54730.0000观察组409.3±2.23.2±1.913.27180.0000t值0.00003.6987P值0.50000.0002
表4 两组患者术后并发症的比较[n(%)]
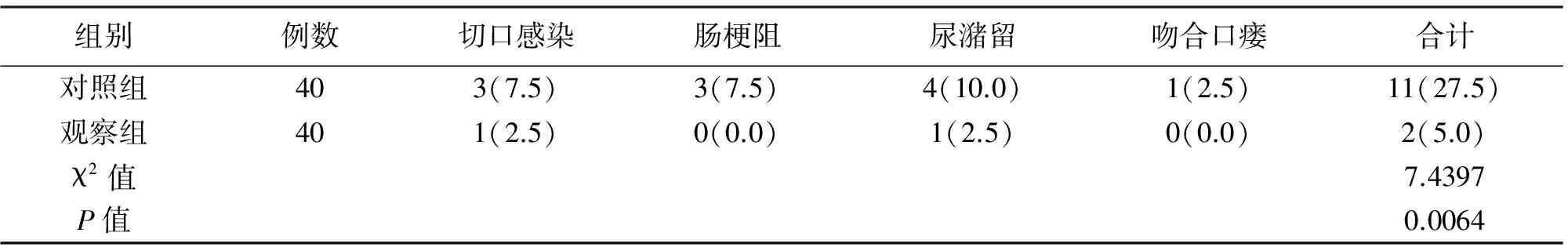
组别例数切口感染肠梗阻尿潴留吻合口瘘合计对照组403(7.5)3(7.5)4(10.0)1(2.5)11(27.5)观察组401(2.5)0(0.0)1(2.5)0(0.0)2(5.0)χ2值7.4397P值0.0064
表5 两组患者术后1年随访结果的比较[n(%)]
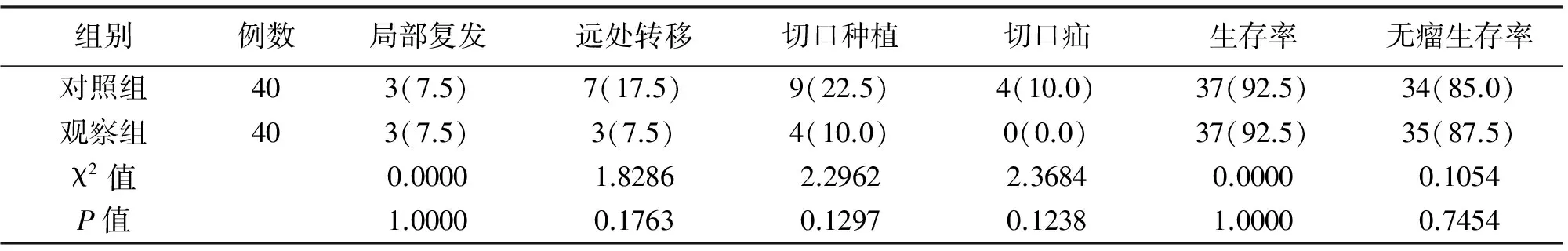
组别例数局部复发远处转移切口种植切口疝生存率无瘤生存率对照组403(7.5)7(17.5)9(22.5)4(10.0)37(92.5)34(85.0)观察组403(7.5)3(7.5)4(10.0)0(0.0)37(92.5)35(87.5)χ2值0.00001.82862.29622.36840.00000.1054P值1.00000.17630.12970.12381.00000.7454
3 讨 论
低位直肠癌是常见的消化道恶性肿瘤之一,在腹膜返折线以下,位置较特殊,手术方式的选择涉及保肛问题,操作难度较高[8]。目前手术方式主要包括传统开腹手术及腹腔镜手术。不论选择何种手术方式,目的都是提高直肠癌根治性切除的效果,因此术中必须达到完整切除肿瘤及周围组织、直肠系膜的完整切除、彻底清扫淋巴结,在保护盆腔自主神经的同时尽可能达到直肠远端切缘阴性[9]。
传统开腹手术切口较大,手术创伤大,出血量多,术后并发症较多,术后康复慢,给患者生理、心理均带来极大影响[3]。随着腹腔镜技术水平的提高、完善,腹腔镜直肠癌手术逐渐得到应用。与开腹手术相比,腹腔镜手术创伤小、术后应激反应轻、恢复快、术后并发症少,更有助于术后恢复及改善生活质量[10]。腹腔镜手术切口小,操作局限在相对密闭的环境,与外界空气不接触,减少了空气中的颗粒物质、细菌的进入,降低了腹腔内异物污染的概率,同时还能避免长时间与空气接触的肠管变得干燥、粗糙,术中减少对脏器的牵拉、腹膜的损伤,这些均利于减少术后炎症反应程度。本研究结果显示,观察组术中出血量、切口长度、术后排气时间、术后进食时间、术后排尿时间、术后住院时间均优于对照组,手术时间、淋巴结清扫数量两组差异无统计学意义。表明腹腔镜手术的创伤更小,更利于术后康复。徐洪彪[11]指出,腹腔镜直肠癌根治术操作难度较大,初学者学习周期较长,加之腔镜操作缺少触觉等缺点,使其在临床应用中遇到一定阻力。因此术者需具备丰富的临床经验,才能保障腹腔镜下低位直肠癌切除术的手术质量。本研究结果显示,两组术后均有并发症发生,观察组总并发症发生率为5.0%,低于对照组的27.5%,差异有统计学意义(P<0.05);而术后局部复发、远处转移、切口疝、切口种植、1年生存率及无瘤生存率两组相比差异无统计学意义(P>0.05);表明两组术后1年生存率及无瘤生存率基本接近,疗效相当,但腹腔镜直肠癌手术的切口更小、创伤更小、康复更快、并发症更少,能有效改善术后患者生存质量[12]。
与传统开腹直肠癌手术相比,腹腔镜直肠癌手术具有以下优势:(1)腔镜下操作手术视野更宽广、更清晰,可局部放大,术中几乎不存在视野盲区,对于Toldt间隙、手术入路的选择更精细,术中操作时能清晰辨认盆腔自主神经、血管、输尿管等组织,有效减少意外情况的发生[13]。(2)微创优势更明显,手术切口更小,愈合快,有效改善了患者的预后生活质量,更易被接受[14]。(3)术中操作更精细,对病灶周边组织的损伤更小,减少了术中副损伤及术后应激反应,减轻了术后患者的疼痛感,利于术后快速恢复[15]。(4)术中使用超声刀较电刀止血效果更确切,有效降低了血液、淋巴液内肿瘤细胞播散的概率[16]。陈振伟等[17]指出,miR-21属于致癌小RNA,在肿瘤的发生与发展中起着重要作用,miR-21表达水平与结直肠癌患者临床分期、淋巴结转移及远处转移相关。作为一类非编码小RNA,能调控基因蛋白的表达,在肿瘤细胞增殖、分化、侵袭与转移中起重要作用。目前在肝癌、肺癌、结肠癌、胃癌等肿瘤中均可见miR-21表达水平过高。本研究结果显示,两组患者治疗后miR-21水平均显著降低,较治疗前差异有统计学意义(P<0.05),其中观察组较对照组降低更为显著。表明直肠癌患者miR-21表达水平可能与直肠癌的发生、发展存在某种内在的联系,有希望作为直肠癌诊断与预后判断的辅助诊断指标。临床上为提高腹腔镜直肠癌根治术的疗效,还应严格掌握手术适应证,肿瘤直径>4.0 cm的患者,腔镜手术需要扩大切口,失去了微创的意义,同时术中小切口会造成肿瘤挤压、破裂,增加了切口种植转移的几率[18]。
综上所述,低位直肠癌患者行腹腔镜手术可取得与开腹手术相当的根治效果,但腹腔镜手术微创优势更明显,更利于提高患者的术后生存质量[19]。同时监测术前、术后miR-21水平也能潜在的预测腔镜手术后的疗效。
[1] 梁锋.低位直肠癌应用腹腔镜与开腹手术治疗的效果对比分析[J].中国医药指南,2017,15(1):59-60.
[2] 钱友庆.低位直肠癌腹腔镜与开腹根治术近期效果比较[J].腹腔镜外科杂志,2016,21(3):173-176.
[3] 耿焕菊.腹腔镜低位直肠癌保肛手术的临床观察[J].中国医药指南,2016,14(27):42.
[4] 蔡栋臣,徐栋,柳旦.腹腔镜与开腹全直肠系膜切除术治疗中低位直肠癌的对比研究[J].腹腔镜外科杂志,2016,21(10):750-754.
[5] 陆昌运,李裕永,卢挺斌,等.腹腔镜与开腹手术治疗低位直肠癌的效果对比[J].中国微创外科杂志,2016,16(5):465-467.
[6] 刘鸣伟.腹腔镜与开放手术治疗直肠癌的临床疗效分析[J].中国实用医药,2016,11(31):48-49.
[7] 阚炳华,燕归如,申武峰,等.腹腔镜下低位直肠癌超低位保肛术的疗效及分析[J].结直肠肛门外科,2016,22(4):409-412.
[8] 吴庆平.腹腔镜与开腹手术治疗低位直肠癌临床效果的比较[J].中国内镜杂志,2014,20(7):752-754.
[9] 陈文,吴雄辉.手助腹腔镜与开腹低位直肠癌切除术疗效分析[J].中外医疗,2016,35(14):26-28.
[10] 邱进.腹腔镜下全直肠系膜切除低位直肠癌保肛手术的临床研究[J].中国实用医药,2015,10(30):80-81.
[11] 徐洪彪.腹腔镜与开腹直肠全系膜切除术治疗低位直肠癌的临床对比探讨[J].中国医药指南,2016,14(5):69-70.
[12] 代国龙,刘阳文,李庭军.腹腔镜与开腹直肠全系膜切除术治疗低位直肠癌的临床对比研究[J/CD].世界最新医学信息文摘:连续型电子期刊,2016,16(24):45-46.
[13] 钱卫锋.腹腔镜与开腹手术在中低位直肠癌治疗中的疗效比较[J/CD].世界最新医学信息文摘:连续型电子期刊,2015,15(4):97-98.
[14] 宋明东,周活动,谢伟,等.腹腔镜全直肠系膜切除术治疗低位直肠癌的疗效观察[J].结直肠肛门外科,2014,20(2):107-110.
[15] 黄峰,应敏刚,杨春康,等.腹腔镜与开腹腹会阴联合切除术治疗低位直肠癌的临床对照研究[J].中国微创外科杂志,2014,14(8):692-694.
[16] 熊懿.腹腔镜直肠全系膜切除术治疗中、低位直肠癌的临床疗效分析[J].中国普通外科杂志,2015,24(4):616-618.
[17] 陈振伟,黄卫华,徐勇,等.腹腔镜和开腹手术方式治疗低位直肠癌的疗效对比及对血浆miR-21表达水平的影响[J].临床和实验医学杂志,2017,16(6):580-583.
[18] 万伯顺,陈跃宇,史佩东,等.腹腔镜与开腹低位直肠癌根治术的疗效对比[J].结直肠肛门外科,2015,21(1):24-28.
[19] 黄庆录,李鸿飞.腹腔镜低位直肠癌保肛手术的研究进展[J].中国微创外科杂志,2015,15(1):80-82.
(英文编辑:程玉刚)
ClinicalvalueoflaparoscopyinlowrectalcancersurgeryanditseffectonplasmamiR-21levels
HULian-zhi,LIWei,LIUHai-shan,etal.
DepartmentofGeneralSurgery,ChangliPeople’sHospitalinQinhuangdao,Qinhuangdao066600,China
Objective:To compare the difference of laparoscopic and open surgery in the treatment of low rectal cancer and the effect on plasma level.MethodsClinical data of patients with low rectal cancer from Oct.2011 to Oct.2014 were retrospectively analyzed.The patients were divided into observation group (laparoscopic surgery) and control group (open surgery).The changes of intraoperative and postoperative conditions and plasma miR-21 were compared.ResultsThe intraoperative blood loss,incision length,postoperative exhaust time,postoperative feeding time,postoperative urination time and postoperative hospital stay in the observation group were better than those in the control group (P<0.05).The operation time and lymph node dissection were not significantly different between the 2 groups (P>0.05).The postoperative levels of miR-21 in the two groups were lower than those before treatment (P<0.05),and the decrease of miR-21 in the observation group was more significant.The overall incidence of postoperative complications in the observation group was 5.0%,which was lower than 27.5% in the control group (P<0.05).There was no significant difference between the two groups in 1 year follow-up after surgery (P>0.05).ConclusionsLaparoscopic surgery is effective in the treatment of low rectal cancer.The effect of laparoscopic radical resection for low rectal neoplasm is similar to that of open surgery.However,laparoscopic surgery is safe,reliable and minimally invasive with faster postoperative recovery.
Low rectal neoplasms;Laparoscopy;Laparotomy;Comparative study
1009-6612(2017)10-0738-05
10.13499/j.cnki.fqjwkzz.2017.10.738
秦皇岛市科学技术研究与发展计划项目(编号:201602A250)
李 伟,E-mail:604957652@qq.com
胡连智(1982—)男,河北省秦皇岛市昌黎县人民医院普通外科主治医师,主要从事腹腔镜外科及直肠癌治疗方面的研究。
R735.3+7
A
2017-05-11)
