两种手术方案治疗进展期胃中上部癌的临床对比研究
2017-12-07郭永锋张洪伟李祎龙罗孔亮
郭永锋,张洪伟,李祎龙,乔 伟,罗孔亮,韩 冰
(1.西安市第九医院,陕西 西安,710054;2.第四军医大学西京医院)
两种手术方案治疗进展期胃中上部癌的临床对比研究
郭永锋1,张洪伟2,李祎龙1,乔 伟1,罗孔亮1,韩 冰1
(1.西安市第九医院,陕西 西安,710054;2.第四军医大学西京医院)
目的探讨D2淋巴结清扫术与全系膜切除术治疗进展期胃中上部癌的临床疗效及安全性。方法选取2011年5月至2014年1月收治的100例进展期胃中上部癌患者,分为对照组(n=50)与观察组(n=50),分别采用D2淋巴结清扫术与全系膜切除术,比较两组患者手术相关临床指标、术后并发症发生率、随访复发率及生存率。结果观察组手术时间、术中出血量均优于对照组(P<0.05),两组淋巴结清扫数量、首次排气时间、首次下床活动时间、住院时间、术后并发症发生率及随访复发率差异无统计学意义(P>0.05),观察组随访生存率高于对照组(P<0.05)。结论全系膜切除术治疗进展期胃中上部癌可有效缩短手术时间,减少医源性创伤,并有助于提高远期生存率,优于D2淋巴结清扫术。
进展期胃癌;D2淋巴结清扫术;全系膜切除术;腹腔镜检查;对比研究
目前对于胃癌患者,外科手术切除仍是推荐的治疗手段,大量临床研究证实,外科手术方式与患者临床预后密切相关[1]。D2淋巴结清扫术是胃癌临床治疗最主要、最成熟的术式之一,但已被证实术后远期复发风险较高[2]。近年,全结肠系膜切除术在肠癌临床治疗中获得广泛应用及良好的临床收益,因此国外学者在此基础上提出全胃系膜切除的理念,并经相关研究证实在根治效果方面与D2淋巴结清扫术基本一致[3],但国内尚缺乏相关随机对照研究证实[3]。本研究以2011年5月至2014年1月西安市第九医院收治的100例进展期胃中上部癌患者作为研究对象,分别采用D2淋巴结清扫术、全系膜切除术,探讨两种术式治疗进展期胃中上部癌的相关临床指标、生存率及术后并发症,将结果报道如下。
1 资料与方法
1.1 临床资料 选取2011年5月至2014年1月西安市第九医院收治的100例进展期胃中上部癌患者,根据手术方案分为对照组与观察组,每组50例;两组患者一般资料差异无统计学意义(P>0.05);见表1。
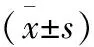
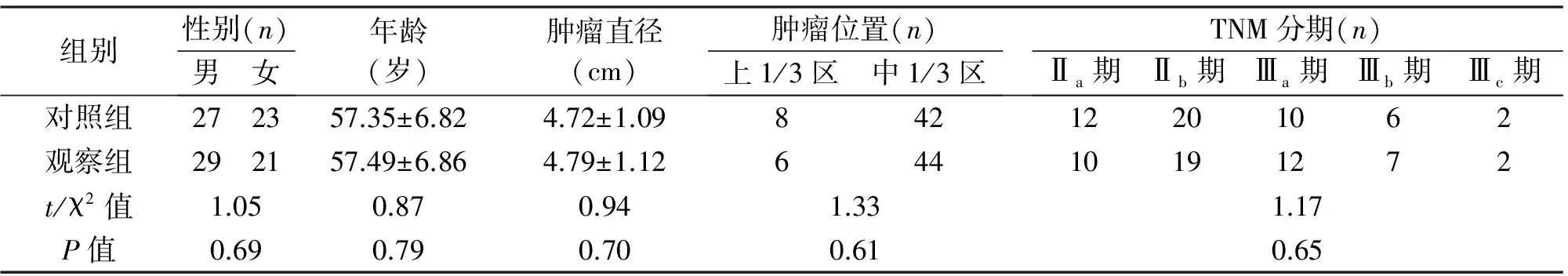
组别性别(n)男女年龄(岁)肿瘤直径(cm)肿瘤位置(n)上1/3区中1/3区TNM分期(n)Ⅱa期Ⅱb期Ⅲa期Ⅲb期Ⅲc期对照组272357.35±6.824.72±1.0984212201062观察组292157.49±6.864.79±1.1264410191272t/χ2值1.050.870.941.331.17P值0.690.790.700.610.65
1.1.1 纳入标准 (1)经消化内镜病理活检确诊胃癌;(2)影像学提示无远处转移;(3)病灶位于胃中上部;(4)TNM分期为Ⅱ~Ⅲ期[4];(5)行全胃切除术,且符合R0切除;(6)45~75岁;(7)患者或家属知情同意。
1.1.2 排除标准 (1)腹腔镜手术禁忌;(2)有上腹部手术史;(3)周围淋巴结肿大融合;(4)术前行辅助化疗;(5)合并其他系统恶性肿瘤;(6)精神系统疾病;(7)免疫系统疾病;(8)凝血功能障碍;(9)心脑肝肾功能障碍;(10)临床资料不全。
1.2 手术方法 对照组行D2淋巴结清扫术,即依据日本《胃癌处理规约》(15版)[5]操作规范进行淋巴结分区及清扫,消化道重建方式为食管空肠Roux-en-Y吻合术,采用常规弧形五孔法置入腹腔镜器械。观察孔置入腹腔镜,全面探查腹腔,确定肿瘤位置。离断大网膜抬起胃部头侧,游离切断胃网膜左动静脉,清扫第4组淋巴结;剥离暴露胃网膜右动静脉,清扫第6组淋巴结。剥离胰腺被膜,切断胃左动静脉,清扫第7、8a及9组淋巴结。游离解剖肝胃韧带、胃右动静脉,清扫第5、10组淋巴结;离断肝胃韧带,清扫第1、3组淋巴结。以上操作完成后游离幽门下方,完成胃十二指肠吻合,最后做上腹部正中切口,切口长度4~5 cm,并于切口外切除胃部组织;观察组行全系膜切除术,即首先游离横结肠与大网膜连接处,经横结肠系膜进入融合间隙;自右侧胃结肠静脉干根部行网膜右静脉离断,清扫第4d、6组淋巴结;分离网膜左动静脉后离断网膜左血管,清扫第4sb组淋巴结;再离断十二指肠并翻转胃体向上。经胰腺背膜于Toldt间隙向各方向分离,切断胃左动静脉、后动静脉等相应走行血管,清扫第2、3、5、9、10、11d、11p、12a及7、8a淋巴结,清扫范围至食管裂孔处;最后向下翻转胃体,于肝下缘处切断肝胃韧带、小网膜前叶,并彻底切除胃相关系膜。手术见图1~图4。
1.3 观察指标 (1)记录手术时间、术中出血量、淋巴结清扫数量、首次排气时间、首次下床活动时间及住院时间,计算平均值;(2)记录术后并发症发生例数,包括肺部感染、肠梗阻、胃瘫及淋巴瘘,计算百分比;(3)随访3年,记录患者复发与生存例数,计算百分比。
2 结 果
观察组手术时间、术中出血量均显著优于对照组(P<0.05),两组淋巴结清扫数量、首次排气时间、首次下床活动时间及住院时间差异无统计学意义(P>0.05);两组术后并发症发生率、随访复发率差异无统计学意义(P>0.05),观察组随访生存率显著高于对照组(P<0.05)。见表2、表3。
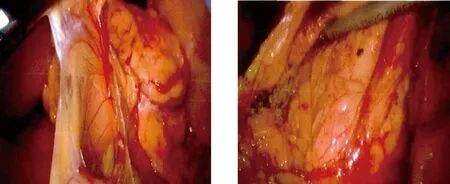
图1 胃网膜左系膜分离 图2 胃网膜右系膜分离
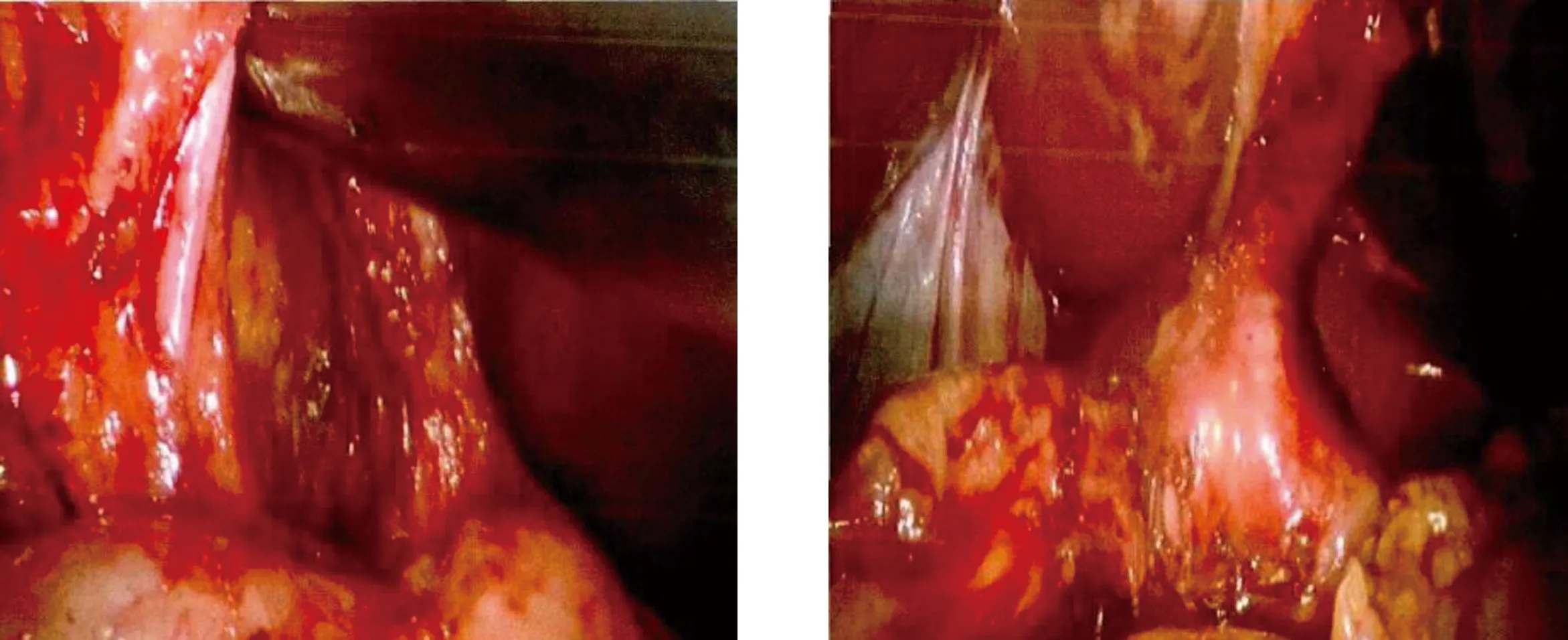
图3 胃左系膜分离 图4 胃右系膜分离
表3 两组患者术后并发症发生率、复发率、生存率的比较[n(%)]
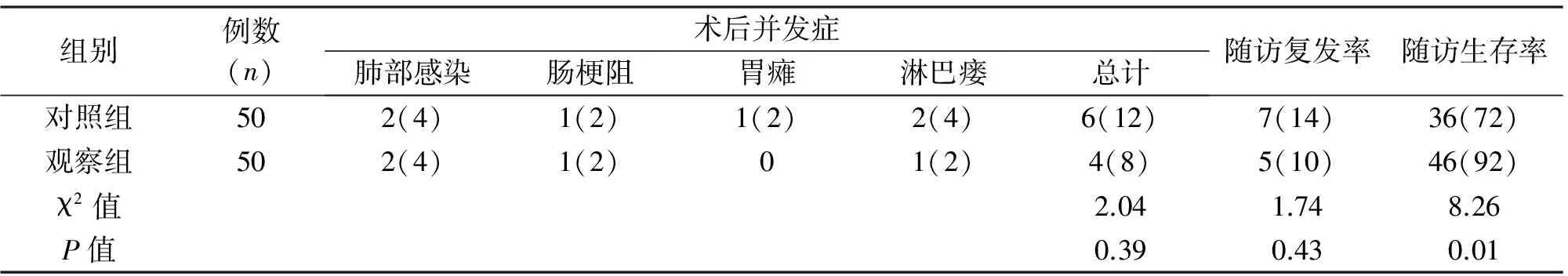
组别例数(n)术后并发症肺部感染肠梗阻胃瘫淋巴瘘总计随访复发率随访生存率对照组502(4)1(2)1(2)2(4)6(12)7(14)36(72)观察组502(4)1(2)01(2)4(8)5(10)46(92)χ2值2.041.748.26P值0.390.430.01
3 讨 论
解剖学研究显示[6],背侧胃系膜被脾脏分割为胃脾韧带、脾肾韧带两部分,其中一部分与邻近组织融合后往往难以识别;而全胃系膜切除概念认为应将既往指南认为可切除与不易识别系膜同时切除,即将系膜包绕淋巴脂肪及周围血管组织作为整体,要求切除胃及部分胃周组织,彻底清除可能存在残留转移灶脂肪结缔组织,达到近似全肠系膜切除的效果[7]。
近年大量研究证实[8],全肠系膜切除术治疗结直肠癌患者较传统术式临床受益显著增加,为全胃系膜切除术式的应用奠定了良好基础。在解剖学上胃系膜与肠系膜具有一定的相似性与对称性,国外学者通过分析消化功能、系膜血管淋巴走行及淋巴结分区进一步证实了全胃系膜切除术的可操作性[9]。已有研究显示[10],全胃系膜切除操作基础为胚胎解剖学,较常规D2淋巴结清扫术切除系膜范围明显增加,更为强调手术切除系膜完整性,有助于预防肿瘤细胞因术中操作导致的腹腔种植转移,实现真正的无瘤操作。
本研究中,观察组手术时间、术中出血量显著优于对照组(P<0.05),证实全系膜切除方案用于进展期中上部胃癌患者有助于降低操作难度,减少手术时间与术中出血量;胃系膜血管、神经及淋巴管均走行其内,而发育过程中系膜不断融合使得筋膜间容易存在间隙形成疏松结缔组织,而全系膜切除术的操作主要循筋膜走行完成分离,解剖结构更为清晰,减少血管找寻的盲目性及医源性血管损伤,而组织疏松亦降低了剥离难度,这是手术时间、术中出血量减少的主要原因[11-12]。
本研究中,两组淋巴结清扫数量、首次排气时间、首次下床活动时间及住院时间差异无统计学意义(P>0.05),表明两种手术治疗进展期中上部胃癌在淋巴结清扫、术后恢复方面效果相当;以往报道显示[13],全系膜切除术胃周淋巴结清扫数量应多于D2淋巴结清扫术,笔者认为造成这一差异的原因可能与入选样本量少、术者操作熟练程度有关,因此需要进一步研究证实。目前医学界将全系膜切除术清扫淋巴结划分为胃周、胃中间及胃中央,与结直肠淋巴分区基本一致,且与D2淋巴结清扫范围相吻合;而通过对系膜划分、淋巴结分群,结合常规自下而上系膜间隙操作方式有效降低了全胃系膜切除术的难度[14-15]。
本研究中,两组患者术后并发症发生率、随访复发率差异无统计学意义(P>0.05);观察组随访生存率显著高于对照组(P<0.05),提示进展期胃癌患者行全系膜切除术可有效提高远期生存率,而术后并发症发生率、复发率两种手术较为一致。以往报道显示[16],全系膜切除术与D2淋巴结清扫术应用后进展期胃癌患者随访生存时间并无差异,笔者认为这可能与本研究纳入人群多为Ⅲ~Ⅳ期有关。
综上所述,全系膜切除术治疗进展期胃中上部癌可有效缩短手术时间,减少医源性创伤,并有助于提高远期生存率,价值优于D2淋巴结清扫术。
[1] 田贵,王方平,孙作成.腹腔镜D2根治术治疗进展期胃癌的近期疗效分析[J].腹腔镜外科杂志,2017,22(1):39-41.
[2] Lin JX,Huang CM,Zheng CH,et al.Laparoscopy-assisted gastrectomy with D2 lymph node dissection for advanced gastric cancer without serosa invasion:a matched cohort study from South China[J].World J Surg Oncol,2013,11:4.
[3] Kim KH,Kim MC,Jung GJ.Is the rate of postoperative complications following laparoscopy-assisted gastrectomy higher in elderly patients than in younger patients?[J].World J Surg Oncol,2014,12:97.
[4] Ajani JA,Bentrem DJ,Besh S,et al.Gastric cancer,version 2.2013:featured updates to the NCCN Guidelines[J].J Natl Compr Canc Netw,2013,11(5):531-546.
[5] 胡祥.日本第15版《胃癌处理规约》及第5版《胃癌治疗指南》更新内容解读[J].中国实用外科杂志,2017,37(4):394-398.
[6] 汪雪,王梦桥,汪树林.腹腔镜胃癌根治术治疗老年进展期胃癌的临床疗效分析[J].腹腔镜外科杂志,2016,21(10):733-736.
[7] Gordon AC,Kojima K,Inokuchi M,et al.Long-term comparison of laparoscopy-assisted distal gastrectomy and open distal gastrectomy in advanced gastric cancer[J].Surg Endosc,2013,27(2):462-470.
[8] Takeuchi Y,Iishi H,Tanaka S,et al.Factors associated with technical difficulties and adverse events of colorectal endoscopic submucosal dissection:retrospective exploratory factor analysis of a multicenter prospective cohort[J].Int J Colorectal Dis,2014,29(10):1275-1284.
[10] Liang YX,Guo HH,Deng JY,et al.Impact of intraoperative blood loss on survival after curative resection for gastric cancer[J].World J Gastroenterol,2013,19(33):5542-5550.
[11] Chen K,Xu XW,Mou YP,el al.Systematic review and meta-analysis of laparoscopic and open gastrectomy for advanced gastric cancer[J].World J Surg Oncol,2013,11:182.
[12] Hu Y,Ying M,Huang C,et al.Oncologic outcomes of laparoscopy-assisted gastrectomy for advanced gastric cancer:a large-scale multicenter retrospective cohort study from China[J].Surg Endosc,2014,28(7):2048-2056.
[13] Li GC,Zhang YC,Xu Y,et al.Single-layer continuous suture contributes to the reduction of surgical complications in digestive tract anastomosis involving special anatomical locations[J].Mol Clin Oncol,2014,2(1):159-165.
[14] Kimura Y,Morita M,Saeki H,et al.Minimally invasive total pharyng-laryngo-esophagectomy and reconstruction with gastric tube:report of three cases[J].Fukuoka Igaku Zasshi,2013,104(11):442-448.
[15] Kim CH,Song KY,Park CH,et al.A comparison of outcomes of three reconstruction methods after laparoscopic distal gastrectomy[J].J Gastric Cancer,2015,15(1):46-52.
[16] Inokuchi M,Kojima K,Yamada H,et al.Long-term outcomes of Roux-en-Y and Billroth-I reconstruction after laparoscopic distal gastrectomy[J].Gastric Cancer,2013,16(1):67-73.
(英文编辑:夏平钿)
Comparativestudyoftotalmesenteryexcisionandtraditionalradicalgastrectomyforproximalgastriccancer
GUOYong-feng1,ZHANGHong-wei2,LIYi-long1,etal.
1.DepartmentofGeneralSurgery,the9thPeople’sHospitalofXi’anCity,Xi’an710054,China;2.XijingHospitaloftheFourthMilitaryMedicalUniversity
Objective:To investigate the clinical effects and safety of D2 lymph node dissection and total mesentery excision (TME) in the treatment of patients with advanced gastric cancer in middle and upper part.MethodsOne hundred patients with advanced gastric cancer in middle and upper part were chosen in the period from May 2011 to Jan.2014 in the 9th People’s Hospital of Xi’an City and divided into control group (50 patients) for D2 lymph node dissection and observation group (50 patients) for TME operation.The operation-related clinical index,the postoperative complications incidence,the survival rate and the recurrence rate of the two groups were compared.ResultsThe operation time and the intraoperative blood loss of observation group were significantly better than those of control group (P<0.05).There were no significant differences in the lymph nodes dissection number,the first exhaust time,the first ambulation time,the hospital stay,postoperative complications incidence and recurrence rate during follow-up between the 2 groups (P>0.05).During follow-up the survival rate of observation group was significantly better than that of control group (P<0.05).ConclusionsCompared with D2 lymph node dissection,TME in the treatment of patients with advanced gastric cancer in middle and upper part can efficiently shorten the operation time,reduce the iatrogenic trauma and is helpful to improve the long-term survival rate.
Advanced gastric cancer;D2 lymph node dissection;Total mesentery excision;Laparoscopy;Comparative study
1009-6612(2017)10-0730-04
10.13499/j.cnki.fqjwkzz.2017.10.730
韩 冰,E-mail:gotohb@163.com
郭永锋(1975—)男,陕西省西安市第九医院普通外科副主任医师,主要从事胃肠外科及急腹症方面的研究。
R735.2
A
2017-05-02)
