典型多环麝香在土壤-小麦系统的对映体选择性环境行为研究
2017-12-07徐慧琳陈翠红曾文炉
徐慧琳,陈翠红,曾文炉,卢 媛
典型多环麝香在土壤-小麦系统的对映体选择性环境行为研究
徐慧琳,陈翠红*,曾文炉,卢 媛
(南开大学环境科学与工程学院,教育部环境污染过程与基准重点实验室,天津 300071)
佳乐麝香(HHCB)和吐纳麝香(AHTN)是多环麝香中使用最广泛的两种手性化合物,采用Agilent Cyclosil-B和HP-5MS毛细管柱串联,在气质联用仪上对两种多环麝香的对映体进行了同时拆分;采用盆栽实验,以HHCB和AHTN商业标准外消旋品中的对映体比率(ERs)作为参照,对小麦幼苗及根际土中HHCB和AHTN的ERs进行分析。结果表明:根际土中HHCB的ERtrans和ERcis值分别为 1.13 和 1.09;小麦体内 HHCB 的 ERtrans和 ERcis值分别为 1.32~1.50 和 1.17~1.57,且茎和叶中的对映体比率显著高于外消旋品。根际土中AHTN的ERs值为1.06;小麦体内AHTN的ERs值为1.46~1.68,与外消旋品有显著差异。上述研究结果说明HHCB和AHTN在根际土中发生对映体选择性降解的能力很低,但易于在小麦体内发生对映体选择性吸收,且(4S,7R)-HHCB、(4S,7S)-HHCB和3R-AHTN是小麦体内容易吸收累积的类型。
多环麝香;气质联用法;手性拆分;对映体组成
佳乐麝香(1,3,4,6,7,8-六氢-4,6,6,7,8,8-六甲基-环戊并[G]-2-苯并呋喃,HHCB)和吐纳麝香(6-乙酰基-1,1,2,4,4,7-六甲基四氢化萘,AHTN)作为多环麝香的代表,被广泛应用于各种化妆品和日用品中[1-2]。随着日化产品持续不断的使用,目前已在水体、土壤和生物等多种环境介质中检出合成麝香。据文献报道,地表水、沉积物和土壤中HHCB浓度分别为3.5~678.0、1.5~388.0 ng·g-1干重和 0.96~16.98 ng·g-1干重[3-5]。Hu等[3]调查了流经天津的最大的河流——海河中7种典型麝香的含量,发现在海河水体、底泥和鱼体样品中均检出HHCB。水体中HHCB的浓度为3.5~32.0 ng·L-1,与水中持久性有机污染物如双酚、4-叔辛基酚等浓度相当;底泥中浓度为1.5~32.3 ng·g-1干重,高于底泥中多溴联苯醚、多氯联苯的浓度。与多环芳烃和多氯联苯相似,合成麝香具有半挥发性、较高的正辛醇/水分配系数,易在生物体内累积。Hu等[3]发现HHCB和AHTN可在鱼体内累积,并具有生物放大效应。另外,Litz等[6]发现HHCB在土壤表面的吸附作用很强,Koc值高达7900。据推算,HHCB在土壤/污泥混合物中的半衰期为10~17个月[6-7]。因此,随着污水与污泥反复施用于农田,土壤中HHCB浓度将逐渐升高,其对农产品和生态安全的影响也将逐渐增大。喻月等[5]测定了长江三角洲农田土壤中合成麝香的含量,发现所有样品中均检出HHCB,其浓度为0.96~16.98 ng·g-1干重。Litz等[6]发现多环麝香可在陆生植物莴苣和胡萝卜中累积。综上所述,合成麝香易吸附于土壤颗粒上,并由植物根系吸收进入植株,在植物体内发生迁移进入植物茎和叶,从而通过食物链危及人类的健康。因此,研究HHCB和AHTN在植物体内的迁移转化对农产品安全和生态风险预警具有重大意义。
HHCB和AHTN是手性物质,具体结构见图1,市面上销售和使用的都是外消旋混合物[8]。迄今为止,世界各国开展了大量针对多环麝香外消旋混合物潜在的毒性效应的急性毒性、亚慢性毒性等实验,发现多环麝香具有环境激素效应、生态毒性效应等[9]。此外,HHCB和AHTN能够损伤加州贻贝机体复合型异生物抗性,影响外排机制的正常运行,从而导致其他污染物在生物体内的累积[10]。由于生物体的立体选择性高,对于生物体而言,一对对映异构体的作用会有所不同,甚至相反[11]。尽管国内外对HHCB和AHTN手性分离及各对映体环境行为的研究已有报道,但对各对映体的毒性效应的研究尚未见报道。Wong[12]的研究表明对映体比率(ERs)这一指标可以用来区分环境中非生物和生物的降解和转化过程。Berset等[13]和Bester等[14]研究过HHCB和AHTN在污水处理厂中的对映体降解过程。Franke等[15]和Gatermann等[16]的研究表明鲫鱼体内的HHCB对映体组成和鲤鱼体内的AHTN对映体组成与其对应的外消旋体之间具有显著性差异。Song等[1]的研究结果显示,珠江三角洲中HHCB的ERcis为1.09~1.53,与外消旋体之间具有显著性差异,ERtrans为 0.98~1.10;AHTN的 ERAHTN则为1.10~1.34。这说明沉积物中HHCB和AHTN都发生了一定程度的对映体选择性生物降解。综上所述,目前的研究大多集中在水体、沉积物及水生生物上,而对土壤生态系统中动植物对HHCB和AHTN的立体选择性行为方面尚未开展相应的研究。
本研究对小麦及其根际土中HHCB和AHTN的对映体比率(ERs)进行研究,并与标准外消旋体的ERs进行比较,旨在研究土壤-小麦系统中典型多环麝香的对映体选择性环境行为,力求从对映体水平上阐明HHCB和AHTN在环境中的迁移转化规律,为准确评价其对人类健康和生态环境风险提供基础数据。
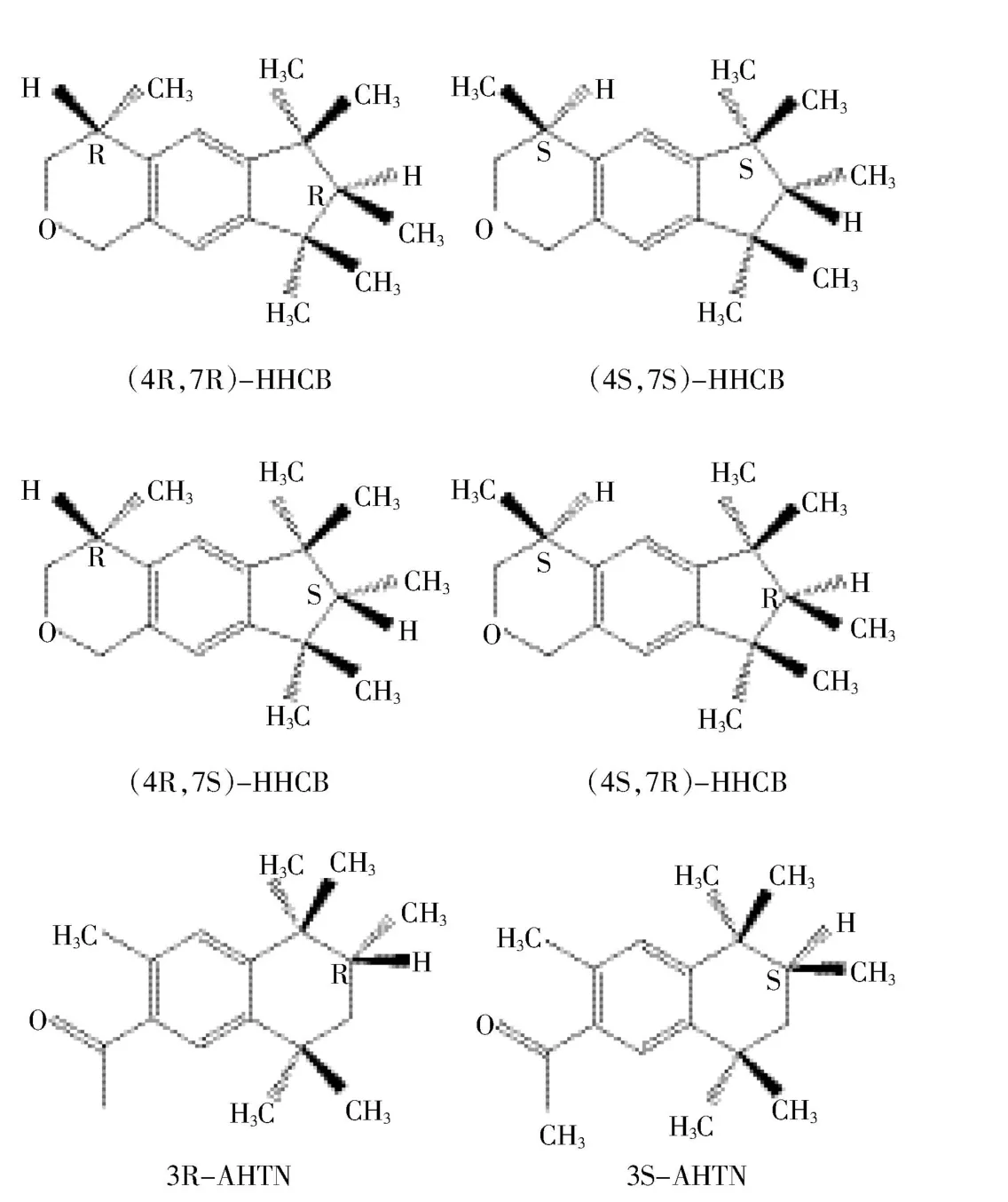
图1 HHCB和AHTN的手性结构图Figure 1 The structure of the chiral HHCB and AHTN
1 材料与方法
1.1 材料和试剂
HHCB纯度为99.5%,AHTN纯度为98%,购自Sigma公司。实验中使用的二氯甲烷、正己烷为色谱纯。硅胶(100~200目)、无水硫酸钠和玻璃棉使用前均用二氯甲烷超声清洗以去除杂质。硅胶在180℃活化12 h,用3%的超纯水脱活后存于正己烷中备用。无水硫酸钠在450℃下干燥6 h。供试土壤样品采自山东,其理化性质如表1所示。小麦种子(Triticum aestivum)购自天津农业科学院。
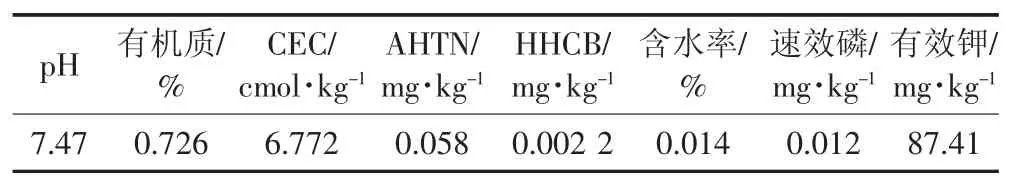
表1 土壤的基本理化性质Table 1 Basic physiochemical properties of the soil
1.2 实验方法
称量土壤样品,在通风橱中配置AHTN和HHCB的丙酮溶液,用移液管将其均匀地滴至土壤表面,搅拌均匀后放通风橱过夜,使丙酮挥发干净。染毒土壤中HHCB和AHTN的表观浓度为20 mg·kg-1,然后放于阴凉通风处一年备用。选出籽粒饱满的小麦种子,用10%的双氧水灭菌10 min,用蒸馏水反复冲洗数次后,恒温催芽48 h,然后转移至备用土壤中,置于恒温培养箱(上海博讯,SPX-400IC)中培养,每处理组3个重复。培养温度为25±2℃,12 h光照,12 h黑暗,每日适量补充水分。小麦培养1个月后收获,根、茎、叶分别存放,冷冻干燥后称重,待测。
样品经冷冻干燥后,进行研磨粉碎,样品前处理方法参照Chen等[17]。称取适量样品用索氏萃取装置萃取24 h,利用二氯甲烷和正己烷混合溶液为萃取剂。萃取液用旋转蒸发仪(Heidolph,LABORTA4000)浓缩至1~2 mL,再用自制的固相萃取小柱净化,洗脱液经氮吹(天津奥特赛恩斯,MTN-28WW)至近干后,用正己烷定容,待测。实验中所用玻璃器皿用铬酸洗液浸泡后,用清水洗净。实验中所有操作都要带手套进行,以防实验样品的污染。样品前处理的加标回收率为68.91%~93.53%。
1.3 对映体分析
HHCB和AHTN对映体的定性和定量分析采用安捷伦气相-质谱联用仪(Agilent 7890A GC-5975C MS)。利用 HP-5MS(30 m×0.25 mm×0.25 μm)和 Cyclosil-B(30 m×0.25 mm×0.25 μm)毛细管柱串联的方法分离HHCB和AHTN的各个对映体[18]。升温程序:80℃保留2 min;以10℃·min-1的速率升至120℃;以2℃·min-1的速率升至140℃;以0.3℃·min-1的速率升至164℃,保留35 min(总运行时间131 min)。定量离子和定性离子为243和258,离子源为电子轰击离子化源,离子源电压为70 eV,离子源温度为230℃,进样口温度为270℃,载气(氦气)流速为2 mL·min-1。HHCB 各对映体的出峰顺序为(4S,7S)-HHCB、(4S,7R)-HHCB、(4R,7S)-HHCB 和 (4R,7R)-HHCB;AHTN各对映体的出峰顺序为3R-AHTN和3S-AHTN。色谱图如图2所示。
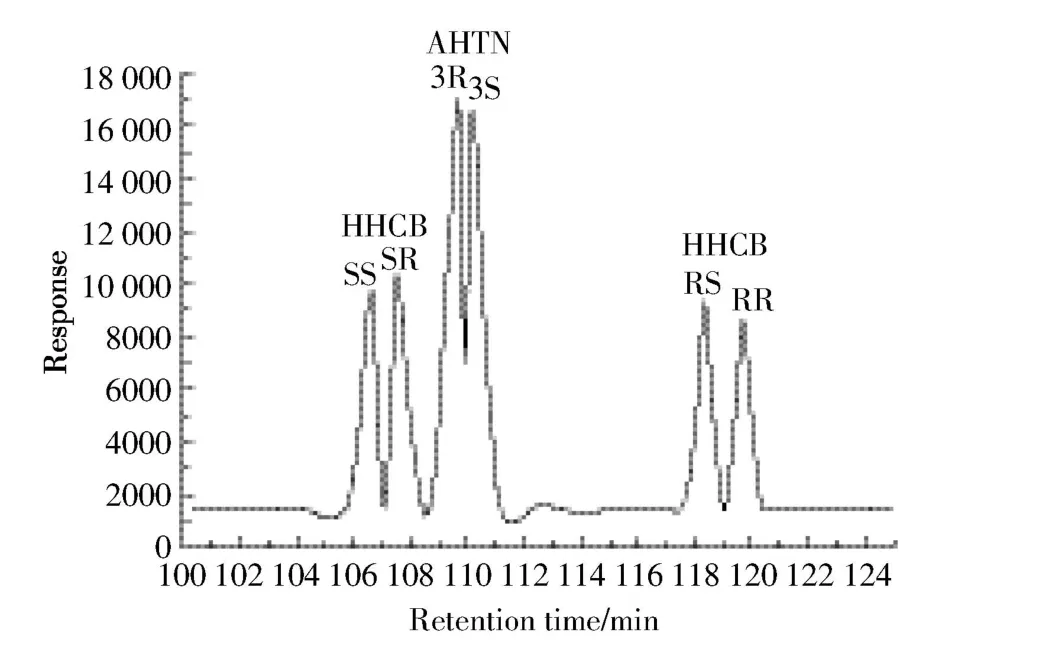
图2 500 μg·L-1的标品在Cyclosil-B和HP-5MS色谱柱串联时的优化离子色谱图Figure 2 Optimised MRM chromatogram of 500 μg·L-1standard from Cyclosil-B column with HP-5MS column
1.4 数据处理与统计
由于AHTN只有一个手性中心,3R-AHTN和3S-AHTN的对映体比率可以表示为 ERAHTN;而HHCB含有两个手性中心,(4S,7R)-HHCB和(4R,7S)-HHCB 的对映体比率表示为 ERcis,(4S,7S)-HHCB 和(4R,7R)-HHCB的对映体比率表示为ERtrans。运用SPSS软件对数据进行处理和统计,对映体比率ERs之间的显著性差异(P<0.05)进行T检验。
2 结果与讨论
2.1 HHCB和AHTN标准品中的对映体比率
手性物质的ERs可以用来表征其在环境中的降解和转化程度,为了便于与生物样品中的ERs比较,实验中测定了HHCB和AHTN商业标准品的ERs作为参照。测定结果表明HHCB的标准品中ERcis为0.992,而ERtrans为 0.993;AHTN 的标准品中 ERAHTN为1.016。这与前人的研究结果一致,Bester等[14]的研究表明,HHCB的ERcis和ERtrans,以及AHTN的ERAHTN都近似等于1。
2.2 小麦及土壤中HHCB的对映体比率及潜在的生物降解
小麦植株及根际土中HHCB浓度如表2所示。由表中结果可以看出,HHCB在植物根、茎和叶中的累积量顺序为根>茎>叶,与之前的研究结果一致[19]。小麦植株及根际土中HHCB的对映体比率ERtrans和ERcis之间的关系如图3所示。Berset等[13]的研究指出:当对映体比率(ERs)的值接近于商业外消旋品(ERs≈1)时,则表明这个系统的对映体选择性代谢转化潜力很低;而当对映体比率(ERs)的值与1差距较大时,则证明系统的转化具有选择性差异。根际土中HHCB的ERtrans值为1.13,ERcis的值为1.09,在一定程度上说明土壤中的HHCB发生了代谢转化且降解具有一定的选择性。这可能是由于小麦根际微生物对HHCB的降解产生了一定的影响。Song等[1]的研究表明,苏州河沉积物中HHCB的ERtrans为0.98~1.05,ERcis为1.40~1.48,珠江沉积物中HHCB的ERtrans为0.99~1.04,ERcis为 1.09~1.52;Berset等[13]的研究表明污水处理厂的污泥中HHCB的ERtrans为0.98,ERcis为0.99。ERtrans值之所以与本研究土壤中的值有较大差异,可能是因为土壤基质比较复杂,含水量相对较低,微生物种类与沉积物差异较大,从而导致降解的选择性差异。律泽等[20]的研究表明HHCB会提高土壤微生物的种群丰富度,增加优势种群。具体原因还有待进一步证明。
小麦样品的对映体比率与标准外消旋品差异较大,根的ERtrans值为1.32,茎的ERtrans值为1.41,叶的ERtrans值为1.50;小麦根、茎和叶中ERcis的值分别为1.17、1.57和1.41。根、茎和叶的对映体比率均大于土壤,且茎和叶的对映体比率与标准外消旋品之间有显著差异。这说明HHCB在小麦体内发生了对映体选择性吸收,且HHCB在小麦地上部对映体选择性较大,其中(4S,7R)-HHCB 和(4S,7S)-HHCB 是小麦体内最容易被累积吸收的。许宏宇[21]在研究手性多氯联苯在小麦不同部位的对映体选择性分布和累积时发现,手性多氯联苯在小麦地上部分的外消旋偏离度大于根部,认为手性PCBs在小麦根中的生物转化过程存在对映体选择性,这种转化过程可能是发生了酶促反应将某一对映体组分优先降解,或某一对映体因酶促络合作用与细胞物质结合(例如,与还原型谷胱甘肽络合),亦或是两种过程均发生。由于禾本植物小麦的茎主要为木质,脂含量较小,主要起水分及营养物质输导的作用,茎不具备从外界环境吸收PCBs等污染物的能力,茎中的PCBs主要来自根或/和叶的传输,茎与根和叶中对映体组成的差异性则一定程度上表明手性PCBs在小麦茎中具有对映体选择性。目前,国内外对陆生生物体内HHCB的对映体研究鲜有报道,本实验的研究结果显示小麦体内的ERs值大于外消旋化合物的ERs值,与水生生物体内的ERs值相比具有较大差异。

图3 小麦体内HHCB的对映体比率ERsFigure 3 The enantiomeric ratio(ERs)of HHCB in the wheat seedlings
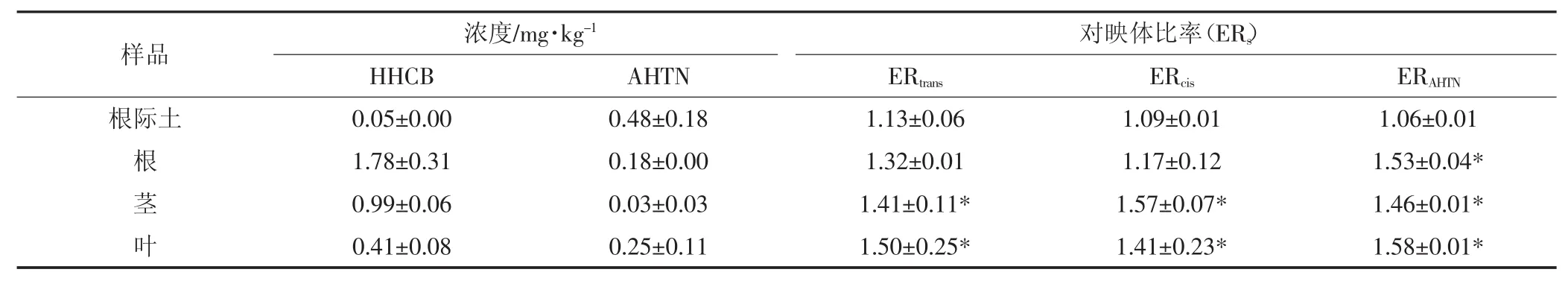
表2 小麦体内HHCB和AHTN的浓度及对映体比率ERsTable 2 Concentrations of HHCB and AHTN as well as ERsof HHCB and AHTN in the wheat seedlings
Gatermann等[16]对淡水鱼体内的研究结果表明:鲤鱼不同组织中的ERtrans值为0.88~1.10,ERcis值为0.95~1.00;鲫鱼组织中的ERtrans值为0.10~0.19,ERcis值为0.41~0.54;大部分鱼体内ERtrans和ERcis的值小于1,这可能与鱼体和植物体的组织差异或新陈代谢能力不同有关,其差异和原因值得进一步探究。
2.3 小麦及土壤中AHTN的对映体比率及潜在的生物降解
土壤中AHTN的ERs值为1.06,根、茎和叶中ERs值分别为1.53、1.46和1.58(表2)。根际土中的ERs值略高于AHTN的标准外消旋品,说明在根际土中AHTN的对映体选择性降解能力很低,几乎没有[22]。但小麦体内的ERs值却与外消旋品之间具有显著差异,说明AHTN在小麦体内发生了对映体选择性生物吸收,其中3R-AHTN容易发生吸收累积。
科学家们对AHTN在活性污泥、沉积物以及水体生物中降解转化的研究比较多。Martin等[23]发现寄居在沉积物上层的特定真菌使AHTN发生了生物降解。Gatermann等[14]通过对淡水鱼的研究发现,鲤鱼组织中的ERs值为1.65~1.98,鲫鱼组织中的ERs值为1.05~1.29,鳗鱼体内的 ERs值为 0.87;Franke 等[15]的研究则为鲤鱼组织中的ERs值为1.67~2.00,鲫鱼组织中的ERs值为1.11~1.43,鳗鱼体内的ERs值为0.77,贻贝体内的ERs值为0.91。这说明淡水鱼对AHTN具有强烈的对映体选择性代谢作用,而且不同水生生物对AHTN的对映体选择性代谢是不同的。鉴于目前有关麝香对映体的研究还比较少,且多集中于水体及水生生物的研究,关于陆地生物及人体的研究甚少,尤其是对映体选择性代谢的研究,所以需要通过更深入的研究来阐明其生物降解和转化机制,为AHTN的生态风险评价提供依据。
3 结论
手性污染物的不同对映体,由于其结构的差异,通常会展现出不同的生物学特征,经历不同微生物的代谢和转化,从而导致对映体比率(ERs)的差异。本研究中小麦及根际土中HHCB和AHTN的对映体比率(ERs)分析结果表明,HHCB和AHTN在小麦体内发生了对映体选择性降解转化,其中(4S,7R)-HHCB、(4S,7S)-HHCB 和 3R-AHTN 易于被小麦植株吸收累积。鉴于目前的研究大多集中于水体及水生生物,故急需开展多环麝香类物质在陆生生物体内的对映体选择性行为研究,以期为多环麝香类物质的环境风险评价提供数据支持。
[1]Song H,Zeng X Y,Yu Z Q,et al.Enantiomeric composition of polycyclic musks in sediments from the Pearl River and Suzhou Creek[J].Environmental Science and Pollution Research International,2015,22(3):1679-1686.
[2]Wang L L,McDonald J A,Khan S J.Enantiomeric analysis of polycyclic musks in water by chiral gas chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2013,1303(6):66-75.
[3]Hu Z J,Shi Y L,Cai Y Q.Concentrations,distribution,and bioaccumulation of synthetic musks in the Haihe River of China[J].Chemosphere,2011,84:1630-1635.
[4]马 莉,敬 烨,周 静,等.太湖梅梁湾水体合成麝香的分布特征[J].环境化学,2014,33(4):630-635.
MA Li,JING Ye,ZHOU Jing,et al.Distribution of sunthetic musk in surface water and sediments from Meiliang Bay,Taihu Lake[J].Environmental Chemistry,2014,33(4):630-635.
[5]喻 月,王 玲,赵全升,等.气相色谱-质谱联用测定长江三角洲农田土壤中的合成麝香[J].环境化学.2015,34(11):2046-2052.
YU Yue,WANG Ling,ZHAO Quan-sheng,et al.Determination of synthetic musks in farmland soil from Yangtze River Delta by gas chromatography-mass spectrometry[J].Environmental Chemistry,2015,34(11):2046-2052.
[6]Litz N,Müller J,Bohmer W.Occurrence of polycyclic musks in sewage sludge and their behaviour in soil and plants.Part 2:Investigation of polycyclic musks in soils and plants[J].Journal of Soils and Sediments,2007,7(1):36-44.
[7]Müller J,Boehmer W,Litz N T.Occurrence of polycyclic musks in sewage sludge and their behaviour in soils and plants.Part 1:Behaviour of polycyclic musks in sewage sludge of different treatment plants in summer and winter[J].Journal of Soils and Sediments,2006,6(4):231-235.
[8]Vetter W,Bester K.Gas chromatographic enantioseparation of chiral pollutants-techniques and results[M].Amreica:Elsevier Science,2006:131-213.
[9]周启星,王美娥,范 飞,等.人工合成麝香的环境污染、生态行为与毒理效应研究进展[J].环境科学学报,2008,28(1):1-11.
ZHOU Qi-xing,WANG Mei-e,FAN Fei,et al.Research progress in environmental pollution,ecological behavior and toxicological effects of synthetic musks[J].Acta Scientiae Circumstantiae,2008,28(1):1-11.
[10]Luckenbach T,Corsi I,Epel D.Fatal attraction:Synthetic musk fragrances comprise multixenobiotic defense systems in mussels[J].Marine Environmental Research,2004,58:215-219.
[11]曾国平.手性及手性物质的应用[J].湖北第二师范学院学报,2013,30(8):28-31.
ZENG Guo-ping.The application of chirality and chiral substances[J].Journal of Hubei University of Education,2013,30(8):28-31.
[12]Wong C S.Environmental fate processes and biochemical transformations of chiral emerging organic pollutants[J].Analytical and Bioanalytical Chemistry,2006,386(3):544-558.
[13]Berset J D,Kupper T,Etter R,et al.Considerations about the enantios-elective transformation of polycyclic musks in wastewater,treated wastewater and sewage sludge and analysis of their fate in a sequencing batch reactor plant[J].Chemosphere,2004,57(8):987-996.
[14]Bester K J.Polycyclic musks in the Ruhr catchment area--transport,discharges of waste water,and transformations of HHCB,AHTN and HHCB-lactone[J].Environmental Monitoring,2005,7(1):43-51.
[15]Franke S,Meyer C,Heinzel N,et al.Enantiomeric composition of the polycyclic musks HHCB and AHTN in different aquatic species[J].Chirality,1999,11(10):795-801.
[16]Gatermann R,Biselli S,Huhnerfuss H,et al.Synthetic musks in the environment.Part 2:Enantioselective transformation of the polycyclic musk fragrances HHCB,AHTN,AHDI,and ATII in freshwater fish[J].Archives of Environmental Contamination and Toxicology,2002,42(4):447-453.
[17]Chen C H,Zhou Q X,Cai Z.Effect of soil HHCB on cadmium accumulation and phytotoxicity in wheat seedlings[J].Ecotoxicology,2014,23(10):1996-2004.
[18]Wang L L,McDonald J A,Khan S J.Enantiomeric analysis of polycyclic musks in water by chiral gas chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2013,1303(6):66-75.
[19]陈翠红,周启星,张志能,等.土壤中佳乐麝香和镉污染对小麦生长及其污染物累积的影响[J].环境科学,2011,32(3):199-205.
CHEN Cui-hong,ZHOU Qi-xing,ZHANG Zhi-neng,et al.Effect of soil HHCB and Cd contamination on the growth of wheat seedlings(Triticum aestivum)and the pollutants accumulation in plants[J].Environmental Science,2011,32(3):199-205.
[20]律 泽,胡筱敏,安 婧,等.佳乐麝香与镉复合污染对土壤微生物群落功能和丰度的影响[J].农业环境科学学报,2017,36(1):66-75.
L譈Ze,HU Xiao-min,AN Jing,et al.Joint effects of galaxolide and cadmium on soil microbial community function and abundance[J].Journal of Agro-Environment Science,2017,36(1):66-75.
[21]许宏宇.典型手性多氯联苯(PCBs)分析方法及其在环镜介质中的分布和对映体特征[D].济南:山东大学,2011.
XU Hong-yu.Enantioselective analysis of typical chiral PCBs and their distributions and enantiomeric signatures in environmental medium[D].Jinan:Shandong University,2011.
[22]Valdersnes S,Kallenborn R,Sydnes L K.Identification of several Tonalide(R)transformation products in the environment[J].International Journal of Environmental Analytical Chemistry,2006,86(7):461-471.
[23]Martin C,Moeder M,Daniel X,et al.Biotransformation of the polycyclic musks HHCB and AHTN and metabolite formation by fungi occurring in freshwater environments[J].Environmental Science and Technology,2007,41(15):5395-5402.
Enantioselective behavior of typical polycyclic musks in soil-wheat systems
XU Hui-lin,CHEN Cui-hong*,ZENG Wen-lu,LU Yuan
(Key Laboratory of Pollution Processes and Environmental Criteria,Ministry of Education,College of Environmental Science and Engineering,Nankai University,Tianjin 300071,China)
Galaxolide(HHCB)and tonalide(AHTN)are common polycyclic chiral synthetic musks.The enantiomers/diastereomers of HHCB and AHTN were separated by gas chromatography-mass spectrometry(GC-MS)by connecting a HP-5MS column to the outlet of a Cyclosil-B column.Using an indoor pot-culture experiment,the enantiomeric compositions of racemic HHCB and racemic AHTN were determined as a reference.The enantiomeric compositions of HHCB and AHTN in the rhizosphere soil and wheat seedlings were also studied.The ERtransand ERcisvalues(ER=enantiomeric ratio)of HHCB in the rhizosphere soil were 1.13 and 1.09,respectively,and those in the wheat seedlings were 1.32~1.50 and 1.17~1.57,which were significantly higher than the ER of racemic HHCB.The ER of AHTN in the rhizosphere soil was 1.07,and the ERsof AHTN in wheat seedlings were 1.46~1.58 which were significantly higher than the ER of racemic AHTN.The results showed that there was little enantioselective degradation of HHCB and AHTN in the rhizosphere soil,but there was considerable enantioselective accumulation in the wheat seedlings,and(4S,7R)-HHCB,(4S,7S)-HHCB,and 3R-AHTN were more prone to biological absorption in the wheat seedlings.
polycyclic musks;GC-MS;enantiomeric separation;enantiomeric composition
X53
A
1672-2043(2017)11-2171-06
10.11654/jaes.2017-0677
徐慧琳,陈翠红,曾文炉,等.典型多环麝香在土壤-小麦系统的对映体选择性环境行为研究[J].农业环境科学学报,2017,36(11):2171-2176.
XU Hui-lin,CHEN Cui-hong,ZENG Wen-lu,et al.Enantioselective behavior of typical polycyclic musks in soil-wheat systems[J].Journal of Agro-Environment Science,2017,36(11):2171-2176.
2017-05-09 录用日期:2017-07-14
徐慧琳(1991—),女,硕士研究生。E-mail:szxhliner@163.com
*通信作者:陈翠红 E-mail:chencuih@nankai.edu.cn
国家自然科学基金项目(21207068,21037002,U1133006);天津市自然科学基金项目(17JCQNJC08400)
Project supported:The National Natural Science Foundation of China(21207068,21037002,U1133006);The Natural Science Foundation of Tianjin,China(17JCQNJC08400)
