响应面法优化藜麦总皂苷提取工艺研究
2017-12-07周柏玲江永清
梁 霞 周柏玲 刘 森 刘 超 江永清
(山西省农业科学院农产品加工研究所1,太原 030031) (静乐县田园农业综合开发有限公司2,忻州 035107)
响应面法优化藜麦总皂苷提取工艺研究
梁 霞1周柏玲1刘 森1刘 超1江永清2
(山西省农业科学院农产品加工研究所1,太原 030031) (静乐县田园农业综合开发有限公司2,忻州 035107)
采用响应面法优化乙醇回流法提取藜麦总皂苷条件。在单因素试验基础上,选择提取溶剂乙醇体积分数、液固比、提取温度和提取时间为自变量,进行四因素三水平Box-Behnken中心组合设计,以总皂苷含量为指标,采用响应面法(RSM)分析4个因素对响应值的影响。方差分析结果表明:回归模型较好地反映藜麦总皂苷含量与乙醇体积分数、液固比、提取温度和提取时间之间的关系。试验结果表明,最优提取条件为乙醇体积分数90%,液固比78:1,提取温度72.0 ℃,提取时间125 min,回归模型预测值与实际值之间有较好的拟合度(R2=0.973 9)。在此提取条件下藜麦总皂苷含量为1.580 g/100 g,与预测值的相对误差为0.57%,精密度RSD为0.279%,回收率96.0%~105.0%,相对标准偏差为4.05%,总皂苷含量响应模型的回归分析、验证试验、精密度和准确性试验证明本方法合理可行。
藜麦 总皂苷 提取 响应面法
藜麦(Chenopodium quinoa willd)原产于南美洲,被古印加人称为“粮食之母”[1-2]。藜麦具有极高且全面的营养价值,其蛋白质、矿物质、氨基酸、纤维素、维生素等含量都高于普通谷物[3],联合国粮农组织推荐藜麦为最适宜人类的完美“全营养食品”[4]。我国于1987年开始引种藜麦[5],目前藜麦总种植面积约3 333 hm2,总产量约7 500 t。我国食用藜麦的历史不长,加工技术有限,产品结构简单,附加值低。随着藜麦种植面积和产量的增加,对藜麦进行综合开发、精深加工成为当务之急[6]。
藜麦表皮中有一层含量很高的皂苷,是藜麦中的主要抗营养物质[7]。Burnouf-Radosevich等[8]利用气相色谱-质谱联用(GC-MS)技术,通过衍生手段测定了藜麦中7种齐墩果酸和2种乌索烷型三萜皂苷,确定齐墩果酸为藜麦籽粒中主要的三萜皂苷。
目前国内企业在加工藜麦时大多用水洗或碾磨法去除苦味物质皂苷,并未对其进一步加工利用。藜麦皂苷有很重要的工业用途,由于其杀血吸虫性和起泡性,可用于生产安全的杀虫剂、肥皂、洗涤剂、灭火材料等[9]。藜麦皂苷具有广泛的生理活性,如抗炎、抗氧化、促进药物吸收、溶血和增强免疫、保护神经、降低脂肪吸收等[10];经碱处理的皂苷有很强的抗灰霉菌真菌活性[11],因此又可作为制药工业原料。从藜麦中提取皂苷应用于工业、制药业具有较好的前景。
文献报道中有关藜麦皂苷提取的方法有超声法和溶剂回流提取法。超声法由于噪声污染等问题使应用受到限制,回流提取在目前工业化生产中应用较为广泛[12]。本研究采用响应面法优化乙醇回流法提取藜麦皂苷工艺条件,利用紫外可见分光光度法测定藜麦总皂苷的含量(以齐墩果酸计),同时进行精密度、准确性加标回收试验,目的在于为藜麦皂苷类物质的开发利用、提升藜麦附加值提供借鉴。
1 材料与方法
1.1 原料和试剂
黄藜麦,种植于山西静乐藜麦种植基地,2015年10月收获,由静乐县田园农业综合开发有限公司提供。将藜麦置于烘箱中60 ℃烘干,粉碎过40目筛,密封、备用。
齐墩果酸对照品:中国药品研究院,国产,分子式C30H48O3。
1.2 仪器与设备
SHA-C水浴恒温振荡器:常州润华电器有限公司;756紫外可见分光光度计:上海光谱仪器有限公司;BSA224S-CW分析天平:赛多利斯科学仪器(北京)有限公司;01-0A电热鼓风干燥箱:天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 试剂的配制
齐墩果酸标准溶液[13]:称取在105 ℃干燥至恒重的齐墩果酸标准品10 mg,用甲醇溶解定容到10 mL刻度管中,摇匀,得到浓度为1 mg/mL的齐墩果酸标准溶液。
5%香草醛-冰醋酸溶液:准确称取5.0 g香草醛,用冰乙酸溶剂并定容至100 mL容量瓶中,现用现配。
1.3.2 齐墩果酸标准曲线的绘制
准确移取齐墩果酸标准溶液0、30、60、90、120、150 μL于10 mL具塞试管中,每组2个平行,置于60 ℃水浴挥干溶剂。依次加入0.20 mL 5%香草醛-冰醋酸溶液和0.8 mL高氯酸溶液,加塞摇匀,于60 ℃水浴显色15 min,取出后立即用冷水冷却至室温,加入5.0 mL冰乙酸,摇匀,空白溶液做参比,测定吸光值。以测得的吸光度为纵坐标,以齐墩果酸的浓度为横坐标绘制标准曲线。
准确移取100 μL标准溶液于10 mL具塞试管中,前处理如标准曲线,以空白溶液做参比,在可见光分光光度计400~700 nm处扫描波长,选择最大吸收波长测定各标准溶液[14]。
1.3.3 总皂苷含量的测定
采用香草醛-高氯酸法[15]:准确量取0.20 mL提取液,置于10 mL具塞试管中,按1.3.2试验方法在最大吸收波长处测定样品吸光值,计算总皂苷含量。
1.3.4 藜麦样品待测液的制备及总皂苷含量的测定
测定方法参照陆敏佳等[16]的方法,并略有改动。称取0.65 g的藜麦样品于50 mL容量瓶中,加入一定体积分数的乙醇溶液作为提取剂,在一定条件下回流浸提,冷却后定容至50 mL,过滤。准确吸取滤液0.20 mL于10 mL具塞试管中,按1.3.3测定方法测其总皂苷含量,根据公式计算总皂苷含量(所有试验做3组平行,取平均值):
式中:C为依据标准曲线计算出被测液中的总皂苷质量浓度/mg/mL;V为待测液的总体积/mL;M为称取的藜麦粉质量/g。
1.3.5 单因素试验
1.3.5.1 不同浸提溶剂在不同体积分数条件下对总皂苷含量的影响
选用甲醇、乙醇为浸提溶剂。称取0.65 g藜麦样品7份,分别加入50 mL体积分数为40%、50%、60%、70%、80%、90%、100%甲醇溶液;称取0.65 g藜麦样品7份,分别加入50 mL体积分数为40%、50%、60%、70%、80%、90%、100%乙醇溶液,以上样品于70 ℃水浴振荡提取180 min,定容,过滤,测其吸光度,计算总皂苷含量。
1.3.5.2 液固比对总皂苷含量的影响
按液固比25:1、50:1、75:1、100:1、125:1、150:1分别称取藜麦样品6份,置于50 mL容量瓶中,加入50 mL体积分数为90%的乙醇溶液,于70 ℃水浴振荡提取180 min,定容,过滤,测其吸光度,计算总皂苷含量。
1.3.5.3 提取温度对总皂苷含量的影响
称取0.65 g藜麦样品6份,分别加入50 mL体积分数为90%的乙醇溶液,在40、50、60、70、80、90 ℃条件下水浴振荡提取180 min,定容,过滤,测其吸光度,计算总皂苷含量。
1.3.5.4 提取时间对总皂苷含量的影响
称取0.65 g藜麦样品5份,分别加入50 mL体积分数为90%的乙醇溶液,70 ℃水浴振荡提取60、120、180、240、300 min,定容,过滤,测其吸光度,计算总皂苷含量。
1.3.6 响应面法优化藜麦总皂苷含量的提取条件
在单因素试验结果的基础上,采用响应面法进行Box-Behnken中心组合设计,进而优化藜麦总皂苷的提取工艺,本试验共重复3次。
2 结果与分析
2.1 检测波长的扫描
表1为100 μL齐墩果酸标液(0.1 mg/mL)在400~700 nm处的吸光值,545 nm处吸光值最大,因此选择545 nm为测定波长。
2.2 齐墩果酸标准曲线的绘制
以齐墩果酸浓度为横坐标,吸光值为纵坐标绘制标准曲线。通过趋势线拟合求得标准方程为Y=7.315 2X-0.017 1,相关系数R2=0.999 2。

表1 不同波长扫描齐墩果酸标品的吸光度值
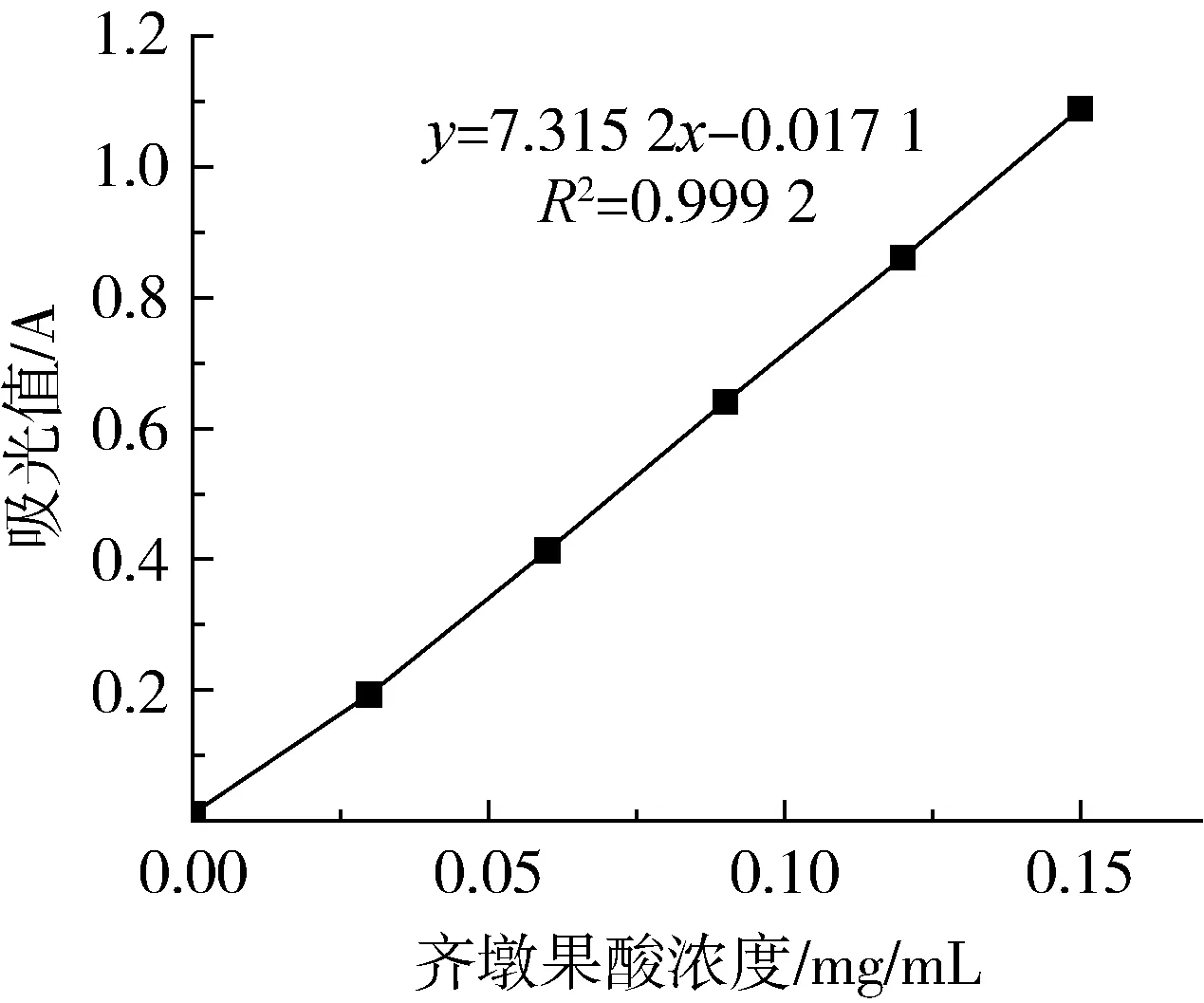
图1 齐墩果酸标准曲线
2.3 不同因素对总皂苷含量的影响
由图2可知,随着乙醇体积分数的增加,总皂苷含量在90%时有一个显著升高,之后略有下降;而随着甲醇体积分数的增加,总皂苷含量呈一个逐渐上升的趋势,在100%体积分数时达到最大,但数值仍低于90%乙醇提取液所得总皂苷含量,这可能是由于100%甲醇溶液极性与被提取溶质极性接近程度仍低于90%乙醇溶液。对2种浸提剂试验结果进行多变量组间(双侧)方差分析,得出2组间总皂苷含量差异极其显著(P<0.01),说明甲醇、乙醇作为浸提剂的提取效率有极显著差别。随着液固比的增加,总皂苷含量增长较快,当液固比达到75:1时,总皂苷含量达到最大,可能是由于水溶液的增加可以加大质量浓度差及固液接触面积,有利于提高分子扩散速度,当液固比过大时,分子扩散速度几乎不会发生明显变化。提取温度在50~70 ℃范围内,总皂苷含量有一个线性的增长,在70 ℃呈现最大值。继续升高温度,总皂苷含量呈下降的趋势,这可能与温度过高,溶剂挥发加大,杂质溶出多有关。随着提取时间的增长,总皂苷含量显著增高,当时间达到120 min后,总皂苷含量基本稳定,说明皂苷已完全溶解于浸提剂中,再延长提取时间只能增大能耗。
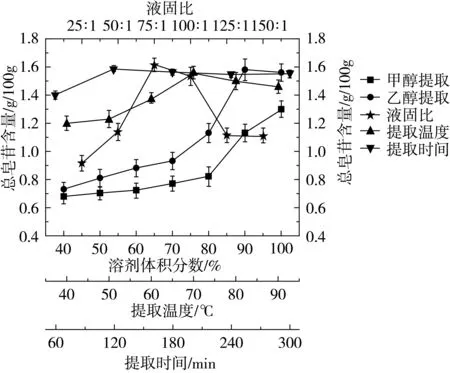
图2 不同因素对总皂苷含量的影响
2.4 响应面法优化总皂苷含量的提取条件
2.4.1 试验设计方案与结果
采用统计软件Design Expert(Static Made Easy,Minneapolis,MN,USA.version 6.0.5,2001)进行四因素三水平的试验设计以及数据分析,分析4个随机因子(乙醇体积分数、液固比、提取温度、提取时间)对响应值(总皂苷含量)的影响,试验因素及水平安排见表2,试验结果见表3,重复3次。
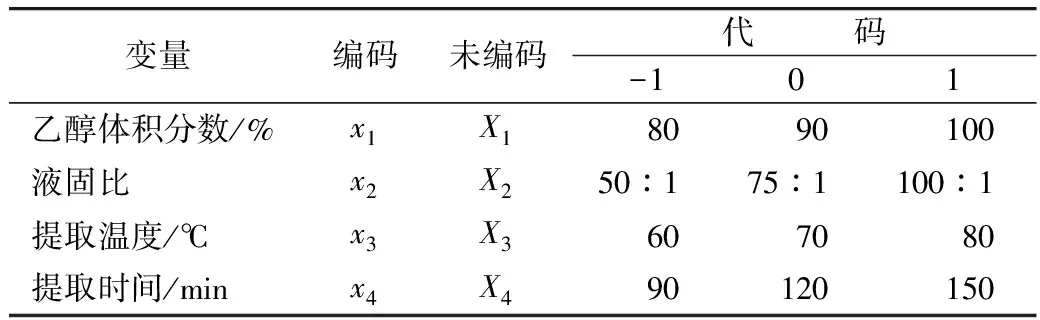
表2 Box-Behnken中心组合因素水平表
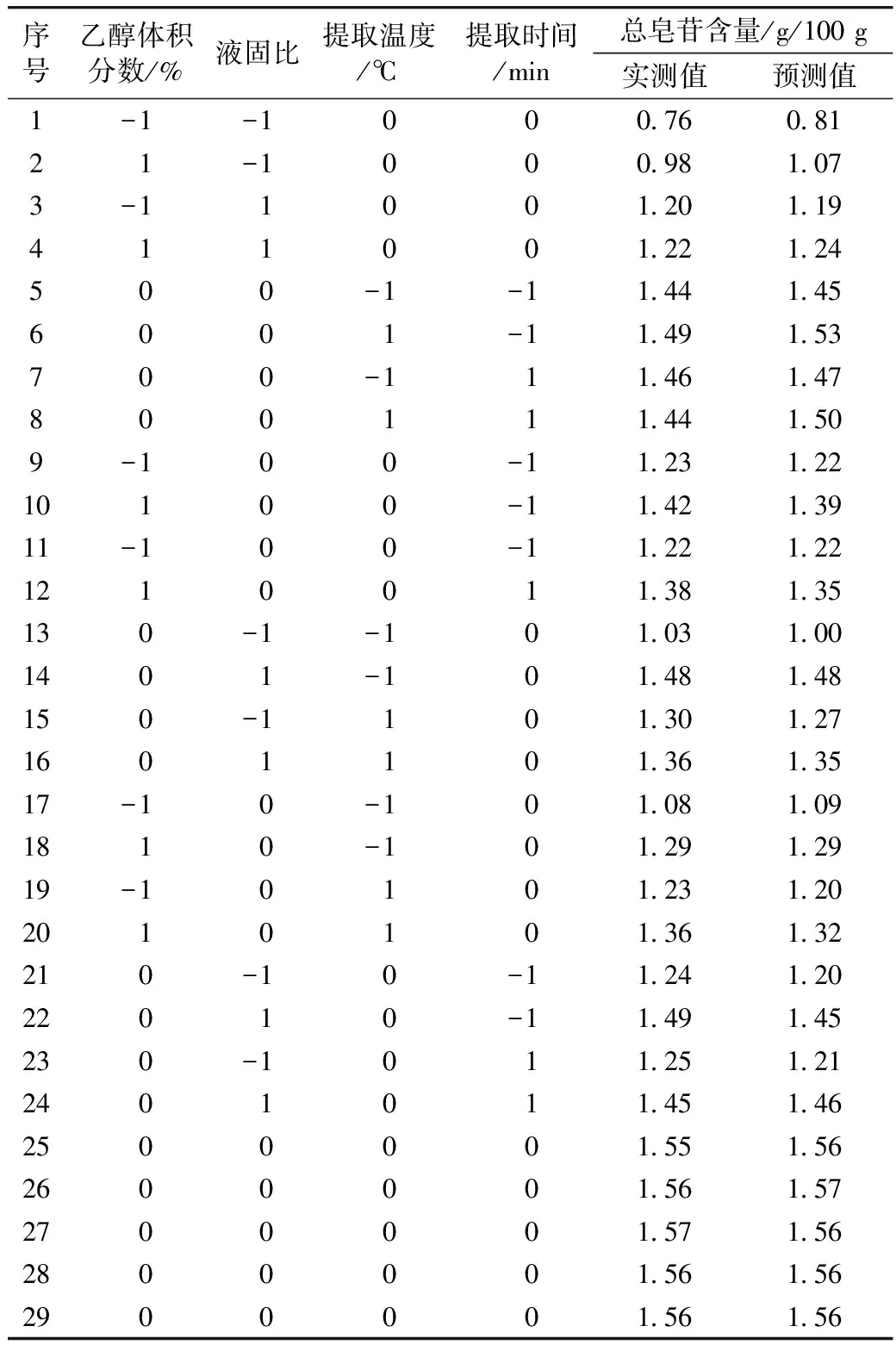
表3 Box-Behnken试验设计及结果
对实测值和预测值进行比较,如图3,二者非常接近(R2=0.973 9),说明该模型是可靠、有效的。
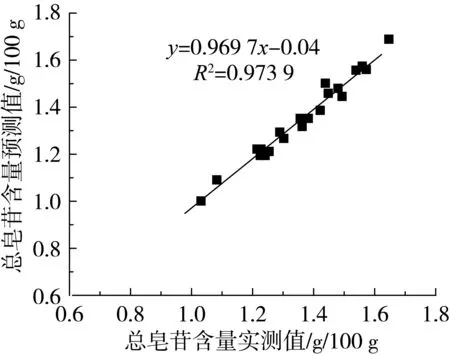
图3 总皂苷含量实测值与预测值之间的相关关系
2.4.2 方差分析
对表3数据进行响应面分析,所得回归方程为(去掉影响不显著的因素):
Y=1.56+0.077X1+0.14X2+0.033X3-0.050X1X2-0.098X2X3-0.27X12-0.22X22-0.068X32
采用SAS软件对所得数据进行回归模型方差分析,结果见表4。
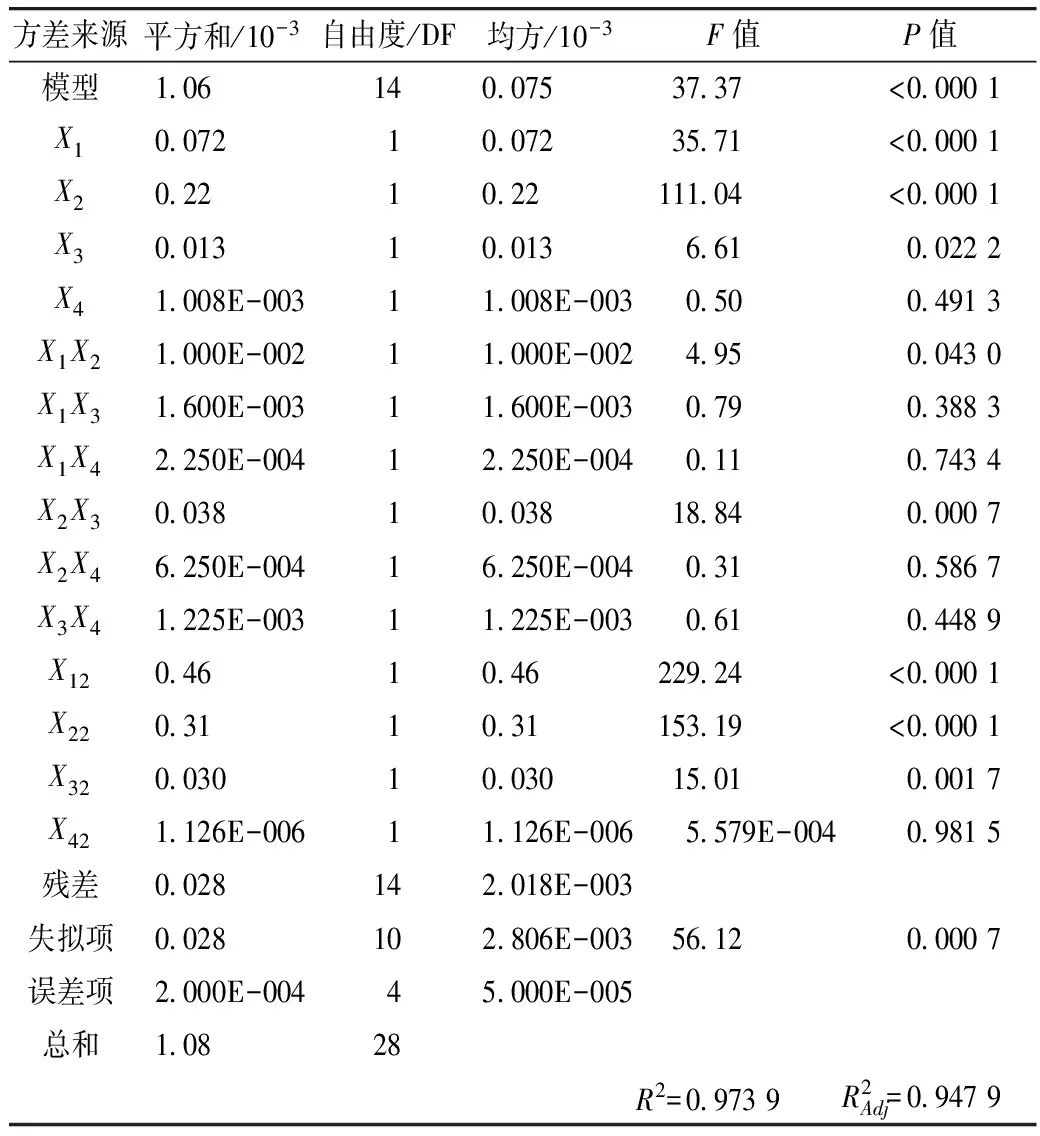
表4 RSM试验的方差分析结果
2.4.3 响应面分析
根据回归模型做出响应面图。
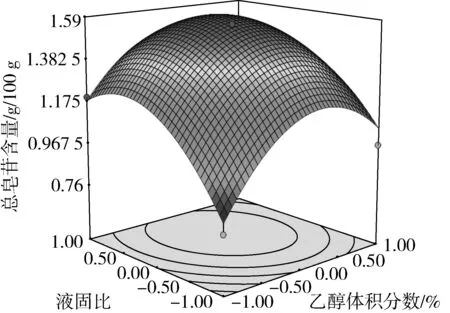
图4 乙醇体积分数与液固比对总皂苷含量的影响
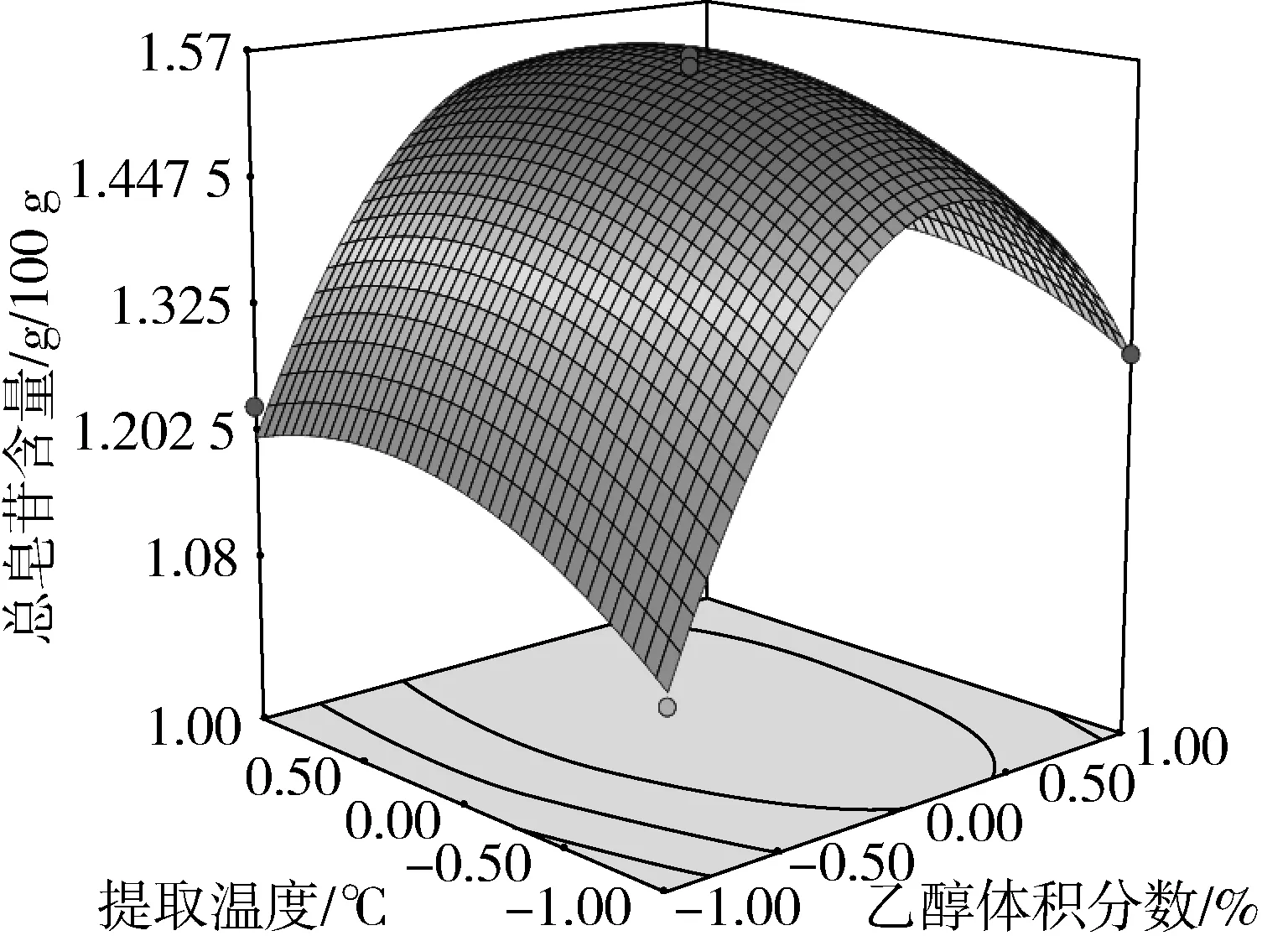
图5 乙醇体积分数与提取温度对总皂苷含量的影响
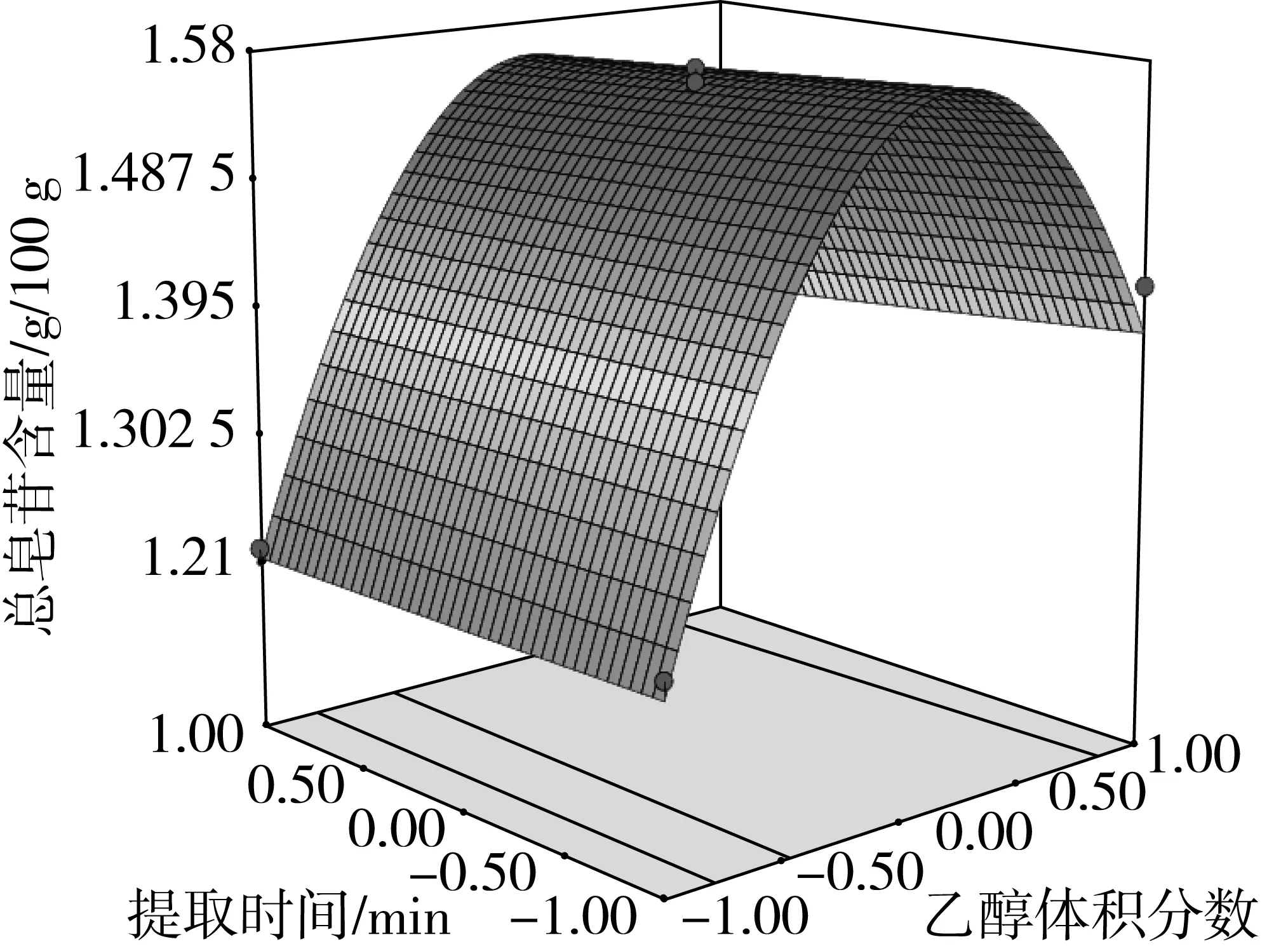
图6 乙醇体积分数与提取时间对总皂苷含量的影响
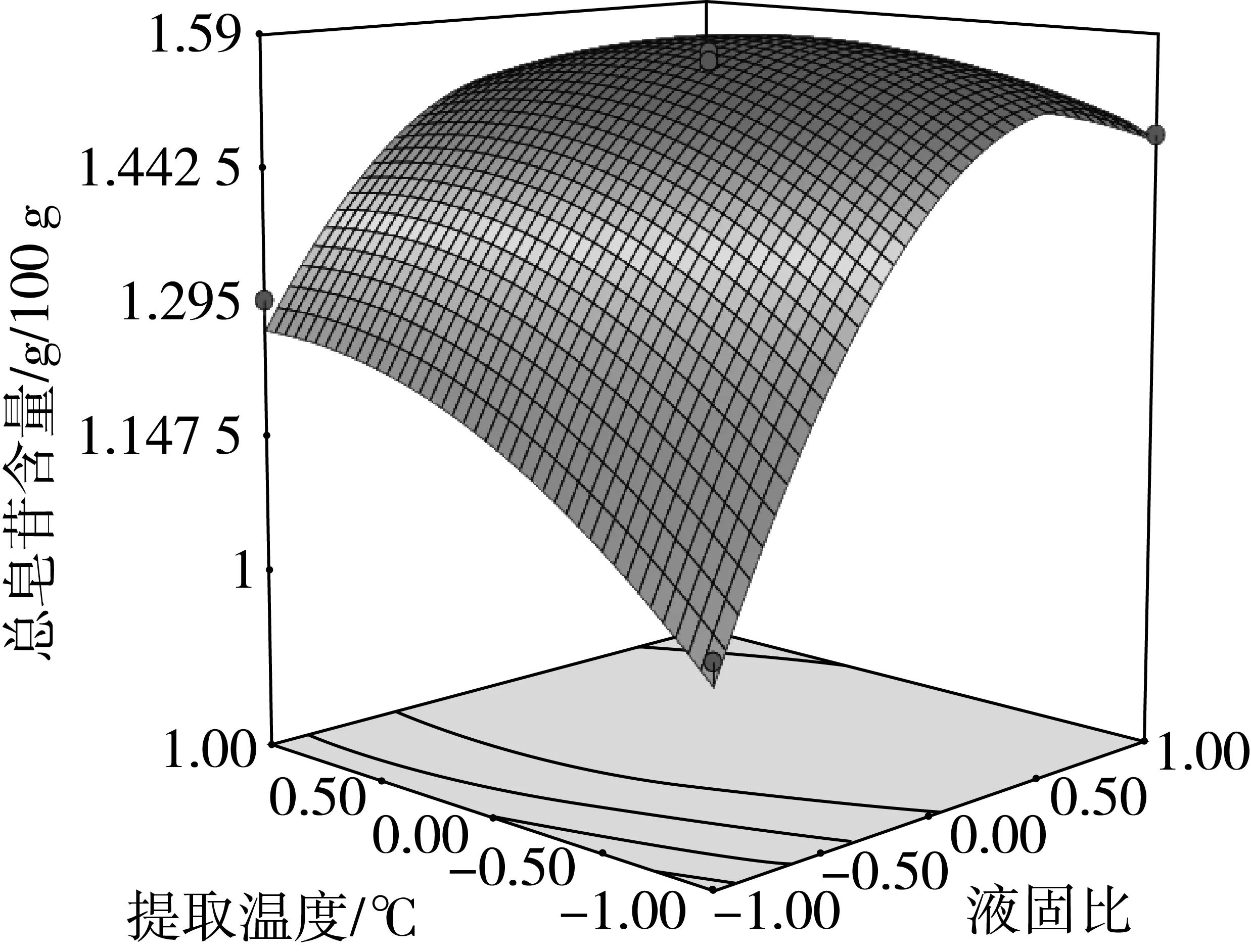
图7 液固比与提取温度对总皂苷含量的影响
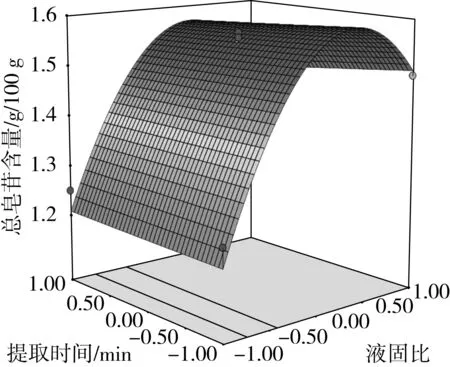
图8 液固比与提取时间对总皂苷含量的影响
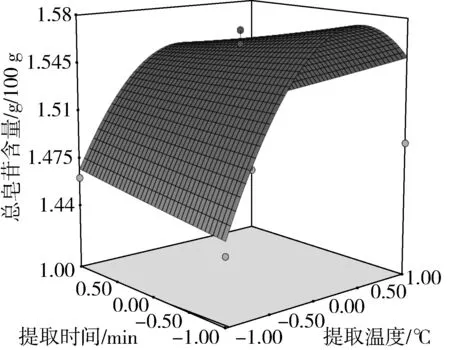
图9 提取温度与提取时间对总皂苷含量的影响
由方差分析可知,单因素X1、X2对藜麦总皂苷含量的影响极显著(P<0.01),X3对总皂苷含量的影响显著(P<0.05)。交互项X2X3对总皂苷含量的影响极显著(P<0.01),交互项X1X2对总皂苷含量的影响显著(P<0.05)。由交互项X1X2、X2X3的响应面图4、图7可以看出,其等高线为椭圆形,响应面高度卷曲,说明提取温度(乙醇体积分数)一定时,存在最适的液固比;液固比一定时,存在最适的提取温度(乙醇体积分数),两因素之间存在相互促进作用[17]。由图6、图8、图9可知,在乙醇体积分数、液固比及提取温度对应总皂苷含量逐渐增大又减少的过程中,提取时间曲线变化较为平缓,说明提取时间对总皂苷含量影响不显著,即在提取时间比较充分的情况下,即使提高乙醇体积分数、液固比及提取温度,总皂苷含量得不到提高,提取时间与其他因素互相抑制,这与模型方差分析结果一致。
通过响应面优化试验得出,影响藜麦总麦皂苷得率的主次因素为乙醇体积分数>液固比>提取温度>提取时间。
2.4.4 模型验证试验
使用SAS 8.0软件的优化功能,验证藜麦总皂苷含量测定模型方程的适宜性和有效性,得到提取液的乙醇体积分数为90.5%,液固比为77.8:1,提取温度72.3 ℃,提取时间126 min。考虑实际操作等因素,将其结果修正为:乙醇体积份数为90%,液固比为78:1,提取温度72.0 ℃,提取时间125 min,并进行验证试验,重复3次,结果见表5。试验证明此模型是有效适用的,并具有一定的实践指导意义。
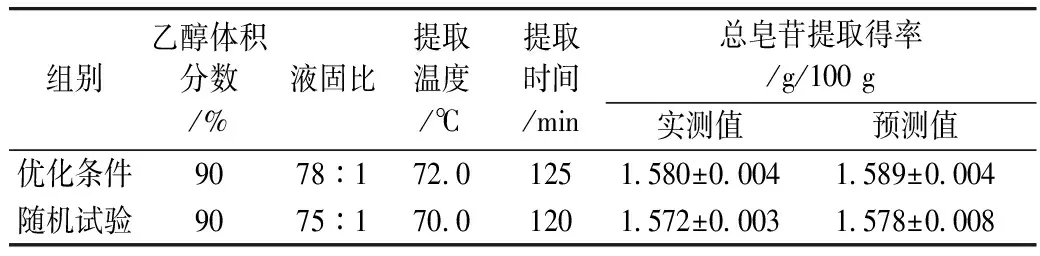
表5 模型验证
2.4.5 精密度试验
在优化提取条件下,称取藜麦样品6份,测定其总皂苷含量,计算得出相对标准偏差为0.279%,结果证明本方法具有良好的精密度。

表6 精密度与稳定性试验
2.4.6 加标回收率试验
在优化提取条件下,称取0.3 g藜麦样品6份,分别加入1 mg/mL齐墩果酸标准品0、0.02、0.03、0.04、0.05、0.06 mL,测定其总皂苷含量,见表7。试验结果显示,回收率在96.0%~105.0%之间,相对标准偏差为4.05%,表明本方法的准确度较好。
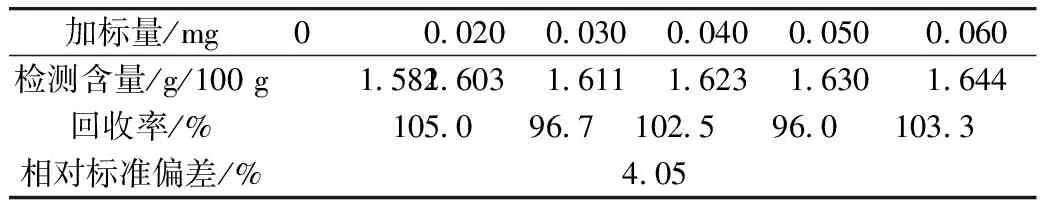
表7 加标回收率试验
3 结论
本研究利用Box-Behnken统计学试验设计方法建立提取藜麦皂苷含量的二次多项数学模型。通过对模型方程的响应面分析,获得了提取藜麦皂苷含量的最佳工艺条件。优化后试验结果为:乙醇体积分数为90%,液固比为78:1,提取温度72.0 ℃,提取时间125 min,总皂苷含量预测值为1.589 g/100 g,实测值为1.580 g/100 g,与预测值的相对误差为0.57%;精密度RSD为0.279%,回收率在96.0%~105.0%之间,相对标准偏差为4.05%。方差分析结果表明,乙醇体积分数、液固比、液固比与提取温度的交互作用对总皂苷含量的影响极为显著,提取温度、乙醇体积分数与液固比的交互作用对总皂苷含量的影响显著。本研究所提供的藜麦总皂苷提取工艺在藜麦的综合利用及皂苷类化合物的产业化开发中有实际用途。
[1]Jacobsen S E.The worldwide potential for quinoa(chenopodium quinoa willd)[J].Food Reviews Intenational,2003,19:167-177
[2]Repo-Carrasco R,Espinoza C,Jacobsen S E.Nutritional value and use of the andean crops quinoa(Chenopodium quinoa)and kafliwa(Chenopodium pallidicaule)[J].Food Reviews International,2003,19(1):179-189
[3]NG S C,Anderson A,Coker J.Characterization of lipid oxidation products in quinoa(chenopodium quinoa)[J].Food Chemistry,2007,101(1):185-192
[4]Abugoch James L E.Quinoa(chenopodium quinoa willd):composition,chemistry,nutritional,and functional properties[J].Advances in Food Nutrition Research,2009,58:1-31
[5]王晨静,赵习武,陆国权,等.藜麦特性及开发利用研究进展[J].浙江农林大学学报,2014,31(2):296-301
Wang Chenjing,Zhao Xiwu,Lu Guoquan,et al.A review of characteristics and utilization of chenopodium quinoa[J].Journal of Zhejiang A & F University,2014,31(2):296-301
[6]任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015,(5):1-5
Ren Guixin,Yang Xiushi,Yao Yang.Current situation of quinoa industry in china[J].Crops,2015,(5):1-5
[7]Kuljanabhagaved T,Thongphasuk P,Chamulitrat W,et al.Triterpense saponins from chenopodium quinoa willd[J].Phytochemistry,2008,69:919-1926
[8]Burnouf-Radosevich M,Delfel N E,England R.Gas chromatography-mass spectrometry of oleanane-and ursane-type triterpense-applicatiion to chenopodium quinoa triterpenes[J].Phytochemistry,1985,24:2063-2066
[9]刘美正,郭忠武,惠永正.皂甙研究新进展[J].天然产物研究与开发,1997,9(2):81-85
Liu Meizheng,Guo Zhongwu,Hui Yongzheng.Recent progress of saponins research[J].Nature Product Research and Development,1997,9(2):81-85
[10]Guclu-ustundag,Mazza,G.Saponius:protertie,Applications and processing[J].Critical Reviews in Food Science and Nutrition,2007,47:231-258
[11]San Martin R,Ndjoko K,hosterttmann K.Novel molluscicide aganist pomacea canaliculata based on quinoa saponins[J].Crop Protection,2008,27:310-319
[12]许晖,孙兰萍,张斌,等.响应面法优化花生壳黄酮提取工艺的研究[J].中国粮油学报,2009,24(1):107-111.
Xu Hui,Sun Lanping,Zhang Bin,et al.Optimization of extraction technique of flavonoids from peanut hull using response surface metholoyg[J].Journal of the Chinese Cereals and Oils Association,2009,24(1):107-111
[13]高丽萍,刘华,封云芳.人参总皂苷的含量测定[J].浙江工程学院学报,2002,19(3):171-173
Gao Liping,Liu Hua,Feng Yunfang.Determination of total saponins in panax ginseng[J].Journal of Zhejiang Institute of Science and Technology,2002,19(3):171-173
[14]任卓伟,倪文杰,刘森.藜麦皂苷的测定研究[J].山西农业科学,2015,43(8):932-935
Ren Zhuowei,Ni Wenjie,Liu Sen.Determination of quinoa saponins[J].Journal of Shanxi Agricultural Sciences,2015,43(8):932-935
[15]赵文婷.藜麦麸皮总皂苷的提取纯化及其抗氧化和免疫增强作用[D].晋中:山西农业大学,2015
Zhao Wenting.The extractiion,purification,antioxidant and immunoenhancement in chenopodium quinoa willd bran total saponins[D].Jinzhong:Shanxi Agricultural University,2015
[16]陆敏佳,蒋玉蓉,袁俊杰,等.藜麦叶片多酚最佳提取工艺及其抗氧化性研究[J].中国粮油学报,2016,31(1):101-106
Lu Minjia,Jiang Yurong,Yuan Junjie,et al.Optimum extraction of quinoa leaf polyphenols and its antioxidant activity[J].Journal of the Chinese Cereals and Oils Association,2016,31(1):101-106
[17]逯家辉,姜鑫,李昊龙,等.应用响应面法优化超声波法提取甘草中总黄酮的工艺[J].吉林大学学报(工学版),2008,38(2):293-298
Lu Jiahui,Jiang Xin,Li Haolong,et.al.Optimization of ultrasonic-assisted extraction of general flavonoids in glycyrrhiza uralensis using the response surface method[J].Journal of Jilin University(Engineering and Technology Edition),2008,38(2):293-298.
Extraction of Total Saponins of Quinoa by Response Surface Methodology
Liang Xia1Zhou Bailing1Liu Sen1Liu Chao1Jiang Yongqing2
(Institute of Agro-Food Science and Technology,Shanxi Academy of Agricultural Sciences1,Taiyuan 030031) (The Comprehensive Development Limited Company of Countryside Agriculture of Jinle County2,Xinzhou 035107)
We used response surface analysis methodology(RSM)to optimize the ethanol reflux extraction conditions of total saponins in quinoa.Based on single factor experiments,the concentrations of ethanol in solvent,ratio of liquid to solid,extraction temperature and extraction time were chosen as causal factors,four-factors-three-levels Box-Behnken central composition experiments design were applied.With the aim of the content of total saponins,RSM was employed to study the effect of these factors on the content of total saponins in quinoa.Variance analysis showed that the regression model fits the relationship of total saponins content to the four process parameters well.The test results showed that the obtained optimum extraction parameters are concentration of ethanol 90%(V/V),ratio of solvent to raw material 78:1,extraction temperature 72.0 ℃,extraction time 125 min.The experimental values agree with those predicted from the regression model indicated a good fitness(R2=0.973 9).The total saponins content was 1.580 g/100 g,the relative error to the predicted yield was 0.57%,the RSD of precision is 0.279%,the recovery rate between 96.0%~105.0%,relative standard deviations was 4.05%.It was proved that the method was reasonable and feasible by the regression equation of total saponin content response model,verification test,precision and accuracy test.
quinoa,total saponins,extraction technology,response surface methodology
TS225.1
A
1003-0174(2017)11-0040-07
2016-11-03
梁霞,女,1970年出生,副研究员,农产品加工及杂粮主食化
