基于Miseq法纳豆冻干粉对小鼠肠道菌群影响的研究
2017-12-07黄占旺王素贞吴高峰吴少福黄永平陈佳妮
黄占旺 王素贞 吴高峰 吴少福 黄永平 陈佳妮
(江西农业大学食品科学与工程学院;江西省天然产物与功能食品重点实验室,南昌 330045)
基于Miseq法纳豆冻干粉对小鼠肠道菌群影响的研究
黄占旺 王素贞 吴高峰 吴少福 黄永平 陈佳妮
(江西农业大学食品科学与工程学院;江西省天然产物与功能食品重点实验室,南昌 330045)
抗生素近年来被滥用,它抑制或杀死微生物使得机体菌群失调。因此找出一种抗生素的安全有效替代物非常有必要,而益生菌是一种有效的替代物。本研究以纳豆冻干粉为原料,正常小鼠和肠道菌群失衡小鼠为动物试验模型,采用体内灌胃试验和Miseq方法研究纳豆冻干粉对小鼠肠道菌群的影响并进行生物信息分析。分析多样本间的肠道菌群多样性和单样本属水平上的分类情况;分析纳豆芽孢杆菌及益生菌、致病菌的菌数变化情况。预期的研究结果为揭示纳豆芽孢杆菌的肠道菌群调节机理提供科学依据,对人类健康和传统发酵食品微生物的开发具有十分重要的意义。
纳豆冻干粉 肠道菌群 Miseq法 多样性
抗生素近年来被广泛滥用[1],正常肠道菌群被杀灭,导致有害菌繁殖并引起菌群失调,激起机体免疫反应[2]。抗生素在杀死细菌的同时会筛选耐药细菌,使得抗生素失去治疗效果。因此寻找一种安全并且对机体肠道有益的抗生素替代物非常有必要。
纳豆是由纳豆芽孢杆菌发酵大豆制成的,不仅保有大豆的营养价值,而且还富含维生素K2等活性成分[3-4],能有效提高蛋白质的消化吸收率[5],具有溶解体内纤维蛋白[6]、防治“三高”、溶血栓、醒酒等功能[7]。近年来,研究者对于纳豆芽孢杆菌的研究越来越多,包括纳豆菌的选育以及纳豆菌与其他功能成分复合研究、纳豆激酶的研究及产品开发等。然而,纳豆的研究还存在不足,纳豆中的一些功能性物质未探究清楚,纳豆冻干粉对肠道菌群的影响缺乏全面分析。高通量测序方法(Miseq方法)是最近10年新兴发展起来的免培养分子生物学技术,又称新一代测序技术。目前,高通量测序技术已被广泛应用于动物肠道、食品、土壤、根际、植物内部、水体等多种微生态的研究中[8],有助于全面了解食品中微生物群落动态和生理活性,以便提高食品质量和控制其微生物安全[9]。因此,本研究以纳豆冻干粉为原料,正常小鼠和抗生素建立肠道菌群失衡小鼠为动物模型,采用体内试验和Miseq方法研究纳豆冻干粉对小鼠肠道菌群的影响并进行生物信息分析。
1 材料与方法
1.1 材料与试剂
纳豆冻干粉(NLP):实验室自制;KM小鼠:雌性SPF级,湖南斯莱克景达实验动物有限公司,动物质量合格证号:SCXK(湘)2011-0003,饲料质量合格证号:SCXK(湘)2014-0002;盐酸林可霉素(批号:20130902)、氨苄青霉素(批号:104D038):Solarbio公司;头孢唑啉钠:梯希爱TCI(上海)化成工业发展有限公司;FastDNA Soil Kit:美国MP Biomedicals公司。
1.2 主要仪器设备
TDL-5-A低速离心机:上海安亭科学仪器厂;凝胶电泳成像系统:美国Kodak公司;PCR反应仪:美国BioRad公司;高通量测序仪:中国Illumina公司;生物分析仪:美国Agilent technologies公司;NanoDrop©ND~1000:美国NanoDrop Technologies公司。
1.3 方法
1.3.1 纳豆冻干粉的制备:
取300 g左右大豆,洗净浸泡20 h并不断换水,在121 ℃下蒸煮30 min,用手捏碎即可,在温度降到不烫手时,加入10%的纳豆芽孢杆菌菌液于大豆表面,充分搅拌均匀,在37 ℃生化培养箱中固态发酵24 h,然后等其降到室温时放入4 ℃冰箱中后熟12 h,加入15%脱脂奶粉,真空冷冻干燥后,用高速粉碎机粉碎,即制成纳豆冻干粉。
1.3.2 样品采集
KM雌性小鼠128只,18~22 g,在SPF小鼠生长环境下饲养。小鼠适应性饲养5 d,随机分为8个组,每组16只,组间体重差异不大于0.5 g。把NLP配制成10、100、400 mg/mL的溶液。选取1组为空白对照组A,灌胃生理盐水;其余组灌胃抗生素混合溶液(盐酸林可霉素、头孢唑林钠、氨苄青霉素,浓度均为100 mg/mL)建模3 d后,随机选取4组作为调节组,B组灌胃生理盐水,F~H灌胃3个剂量的NLP;L组作为模型组,灌胃抗生素溶液。试验期为30 d,灌胃量均为0.5 mL/只。每天16点无菌收集小鼠粪便,置于标记好的EP管中,-80 ℃下保存。取0、3、18、33、48 d 5时间点(5个时间点之间的时间段分别称为Ⅰ,Ⅱ,Ⅲ,Ⅳ期)的小鼠粪便样品进行后续DNA提取。
1.3.3 DNA提取
每个样品分别称取约500 mg后利用FastDNA Soil Kit提取各样品的总DNA,使用NanoDrop®ND~1000对提取的总DNA样品进行浓度和纯度检测。
1.3.4 PCR扩增及纯化
参照文献[10]方法进行操作。
1.3.5 建库及Miseq测序
参照文献[11]方法进行操作。
1.3.6 数据分析
参照Pala-Ozkok等[12]的方法,进行序列筛选,数据降噪分析,获得样品中微生物群落结构信息。
1.3.7 生物信息分析(DNA STAR)
进行序列分析,得出物种分类;分析多样本间的多样性;另外对单样本属水平上的分类情况进行分析;对纳豆芽孢杆菌、益生菌、致病菌菌数的变化进行分析。
2 结果与分析
2.1 PCR结果分析
经过PCR,样品浓度均大于20 mg/mL,A260/A280均在1.80~2.00之间,说明DNA提取的质量高,可用于后续试验。
2.2 序列信息和多样性指数
由表1可见,操作分类单元系数AL、BL、HL差异极显著;菌种丰富度系数AL、BL差异极显著,HL差异显著;香农系数除了BG、BL、FH、GL差异不显著,其余各组间均差异极显著;辛普森系数AF、AH、BF、BH、FG、FH、FL、GH、HL差异极显著,其余各组差异不显著;测序深度系数AB、AF、AG、AH、AL差异极显著,BF差异显著。本试验研究表明,在建模前群落中物种以乳酸杆菌最多,达到63.08%,其次是拟杆菌属为12.89%,革兰氏阳性菌较革兰氏阴性菌多,益生菌多于致病菌,说明建模前肠道处于一种健康的状态。建模后,肠道菌群大量死亡。灌胃期,通过灌服NLP,肠道菌数显著增加。
2.3 属水平上的分类情况
图1可见,Ⅰ期共检测出160个科、409个属,主要由乳酸杆菌属、拟杆菌属、副拟杆菌属、别样杆菌属、理研杆菌属、双歧杆菌属、小螺菌属、臭气杆菌属、生物分类地位未定的TM7属等组成,分别占到总菌属的63.08%、12.89%、4.71%、3.89%、2.16%、1.54%、1.31%、1.26%、1.16%、0.55%。Ⅱ期共检测出150个科、365个属,主要由拟杆菌属、乳酸杆菌属、肠杆菌属、副拟杆菌属、十八号梭菌属、假单胞菌属以及克雷伯氏菌属构成,它们分别占到总菌属的34.03%、33.31%、17.24%、9.36%、0.50%、0.45%、0.40%。乳酸杆菌属、螺旋菌属、双歧杆菌属较建模前极显著降低,而拟杆菌属、副拟杆菌属、肠杆菌属的占比都极显著增加,副萨特氏菌、克雷伯氏菌属、肠球菌属、埃希氏菌属/志贺氏菌,粪杆菌属等的比例都显著升高。模型组中肠杆菌属占到总菌属的92.86%,而乳酸杆菌属只占2.80%,说明抗生素的摄入会改变肠道菌群结构,益生菌如乳酸杆菌属、双歧杆菌属的数量减少而致病菌如埃希氏菌属、志贺菌属、粪杆菌属等菌属的比例升高。Ⅲ期主要检测出143科、341属,主要由乳酸杆菌、拟杆菌属、肠杆菌属、副拟杆菌属、十四号a梭菌属、螺旋杆菌、十八号梭菌属、别样杆菌属、布劳特氏菌属、克雷伯氏菌属等构成,它们分别占总菌属的39.16%、25.64%、12.79%、7.82%、5.39%、0.89%、0.81%、0.79%、0.76%、0.62%。该期与灌胃前期相比,乳酸杆菌属、别样杆菌属的比例极显著升高,而拟杆菌属、肠杆菌属、副拟杆菌属的比例显著降低,乳球菌属、肠杆状菌属、双歧杆菌属等占比有所提高,并且在这个时期出现了灌胃后期未检测到的中村氏菌属、布劳特氏菌属、动胶菌属、罗宾逊氏菌属等。模型组主要由肠杆菌属及十四号a梭菌属和布劳特氏菌属组成,三者占到总菌属的88.75%,而乳酸杆菌属仅占到2.21%,说明随着抗生素的持续使用,会造成菌群严重不平衡,从而影响肠道的正常生理功能。Ⅳ期共检测出132科、280属,主要由乳酸杆菌属、拟杆菌属、副拟杆菌属、螺旋杆菌属、别样杆菌属、粪杆菌属、十八号梭菌属、生物分类地位未定的丹毒丝菌属、副萨特氏菌属以及肠杆菌属等,分别占总菌属的50.05%、24.46%、11.59%、2.86%、1.46%、1.27%、1.17%、1.10%、0.55%、0.47%。该期乳酸杆菌属、粪杆菌属、螺旋杆菌属、别样杆菌属的比例显著增加,肠杆菌属、克雷伯氏菌属极显著降低,生物分类地位未定的丹毒丝菌属、解黄酮菌属极显著增加。由上可知,抗生素会造成肠道菌群的严重失衡,而NLP能够有效调控肠道菌群的比例,从而维持肠道的正常生理功能。
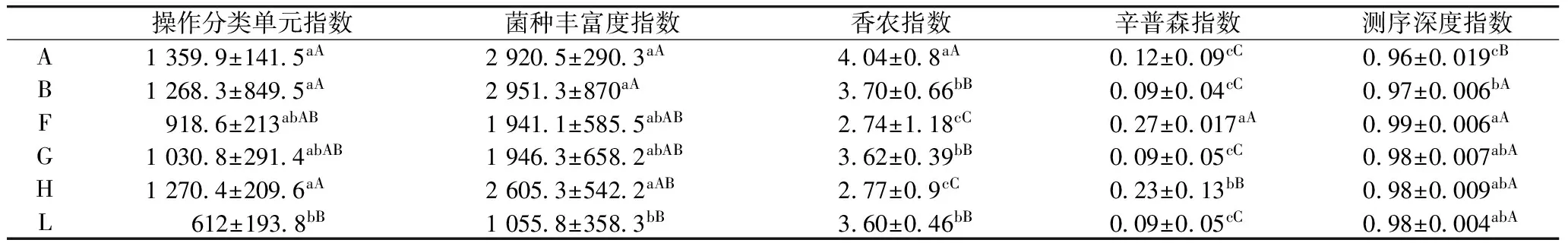
表1 NLP对各组肠道菌群多样性指数的影响结果
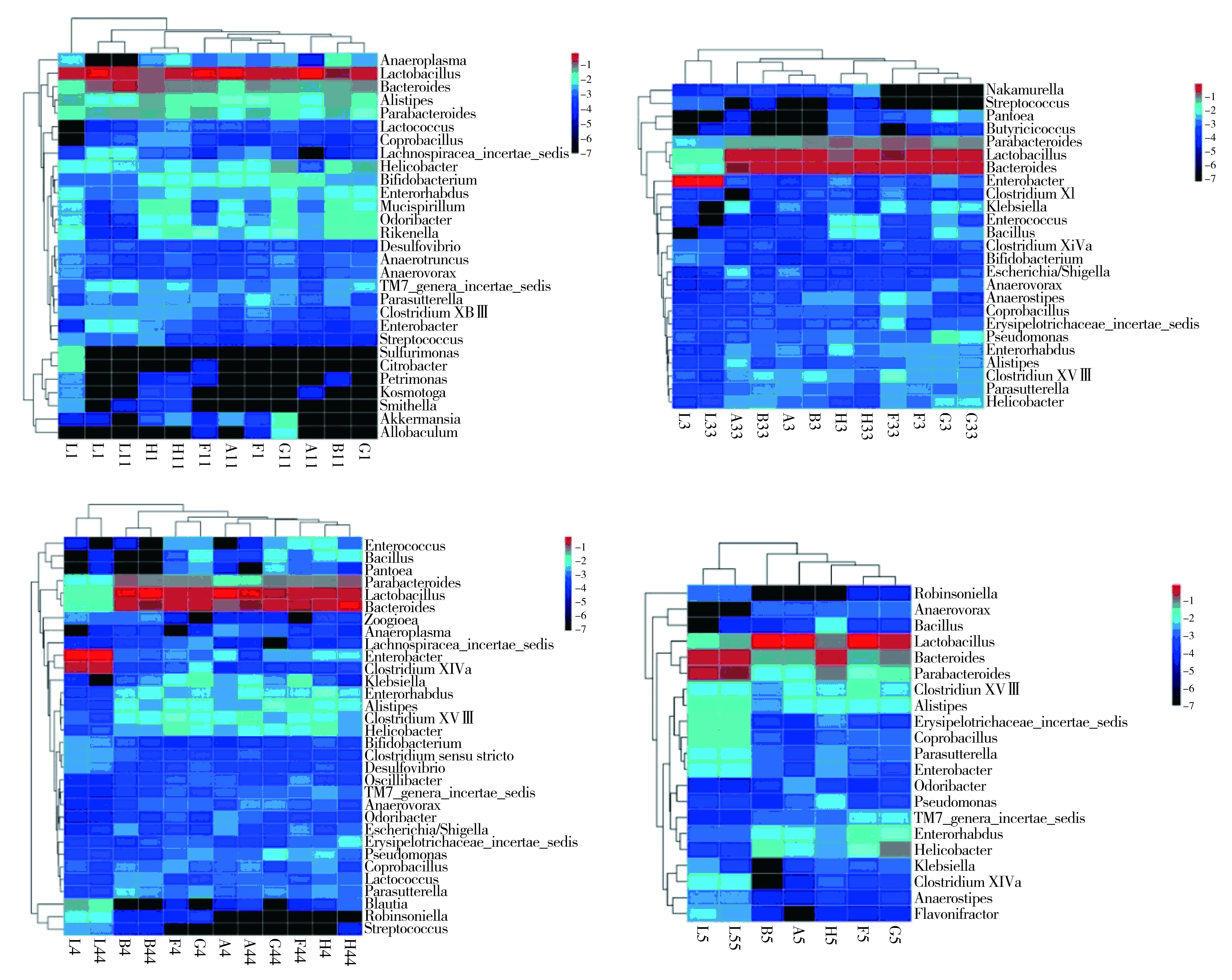
图1 NLP对小鼠肠道菌群的属水平上的分类情况影响注:图从左往右分别为Ⅰ,Ⅱ,Ⅲ,Ⅳ期
2.4 聚类分析
2.4.1 基于OTU的聚类分析(97%相似度)
由图2可见,在Ⅰ期,模型组与其他各组之间的OTU为1时,它们的相似度小于0.33,当OTU为2时,相似水平小于0.51,OTU为3时,相似水平小于0.52,OTU大于12时,样本之间的相似性达到80%以上,且模型组的相似水平最高为0.79。在Ⅱ期,由于抗生素建模,导致肠道中菌群数量及比例发生变化,模型组与其他各组的相似性仅为0.07,较建模前极显著下降。各个组之间的相似性都有所提高,OTU为1时,相似性仅为0.07,OTU为2时相似性为0.52,OTU大于10,各组的相似性超过80%,模型组的相似性达到0.96,高于建模前的水平。灌胃后期当OTU为1时,模型组与其他组间相似性为0.09,较灌胃前期有所增加,各组之间的相似性继续提高,而模型组之间的相似性有所下降为0.87,当OTU为2时,模型组与其余组之间的相似性小于0.59,当OTU大于10时,样本间的相似性超过80%。停灌期模型组与其余各组间的相似性继续增加,达0.2,且各个组之间的OTU相似度都显著升高,与建模前差异不显著,当OTU大于6时,各组间的相似性大于80%。
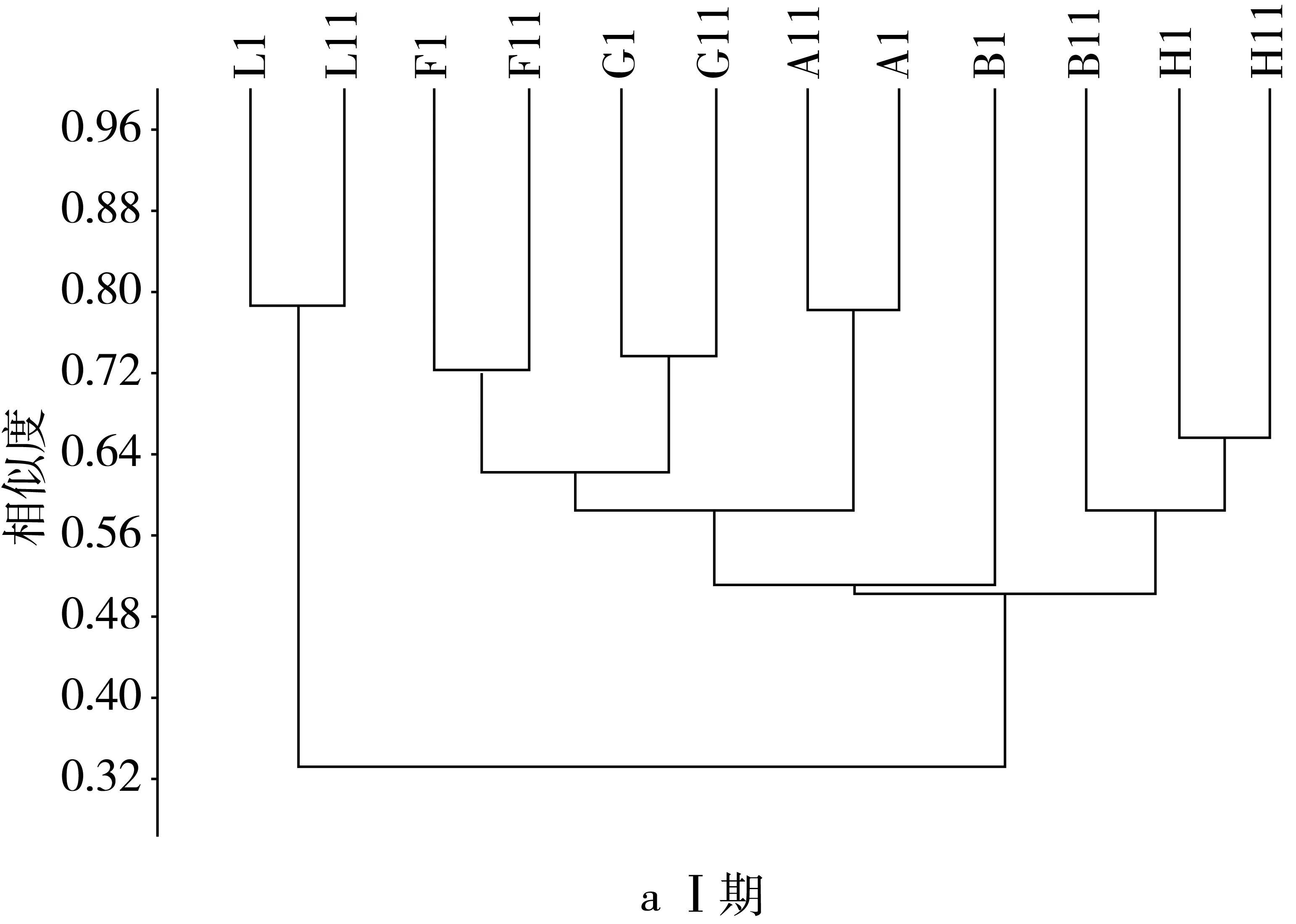
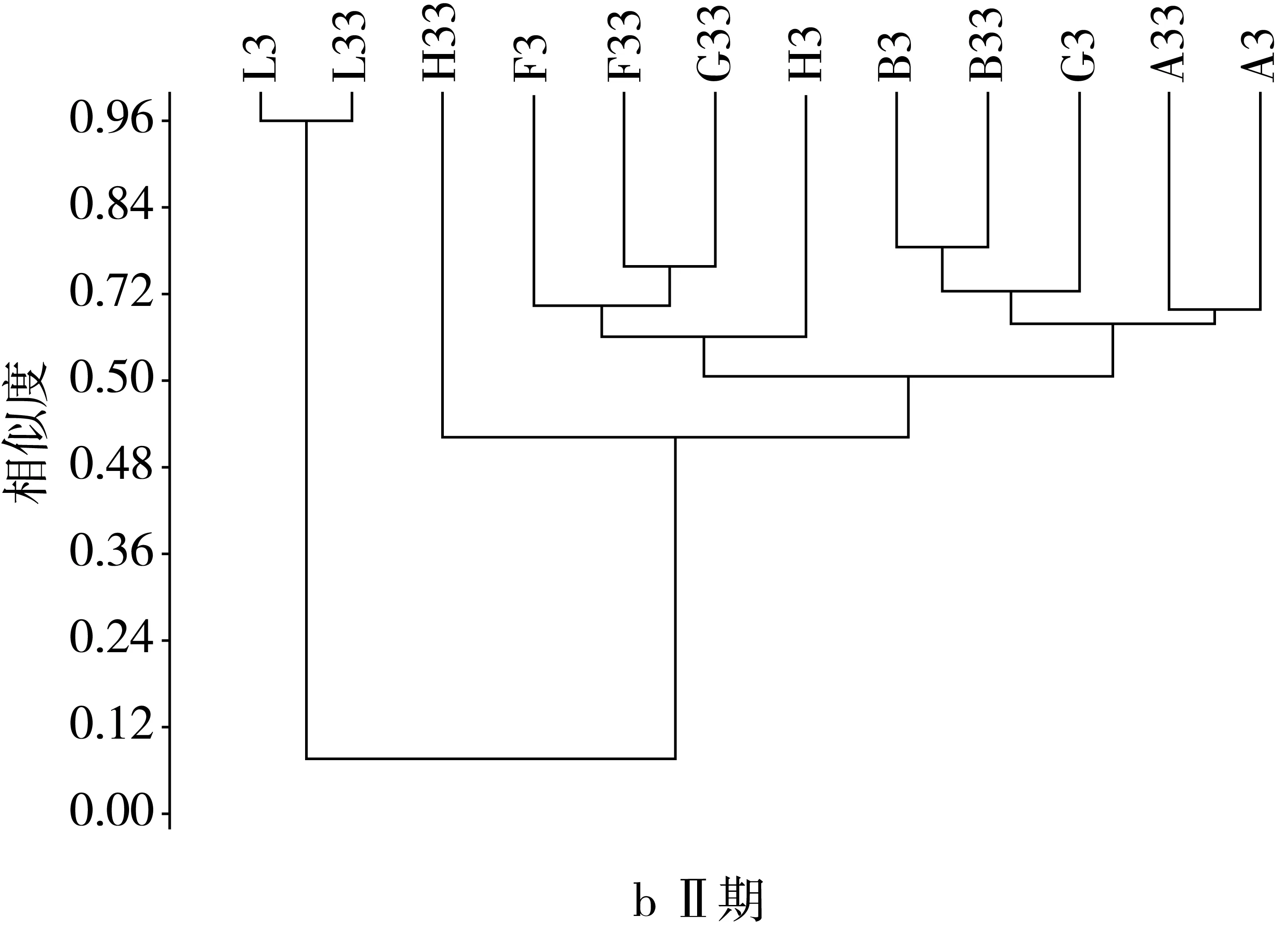
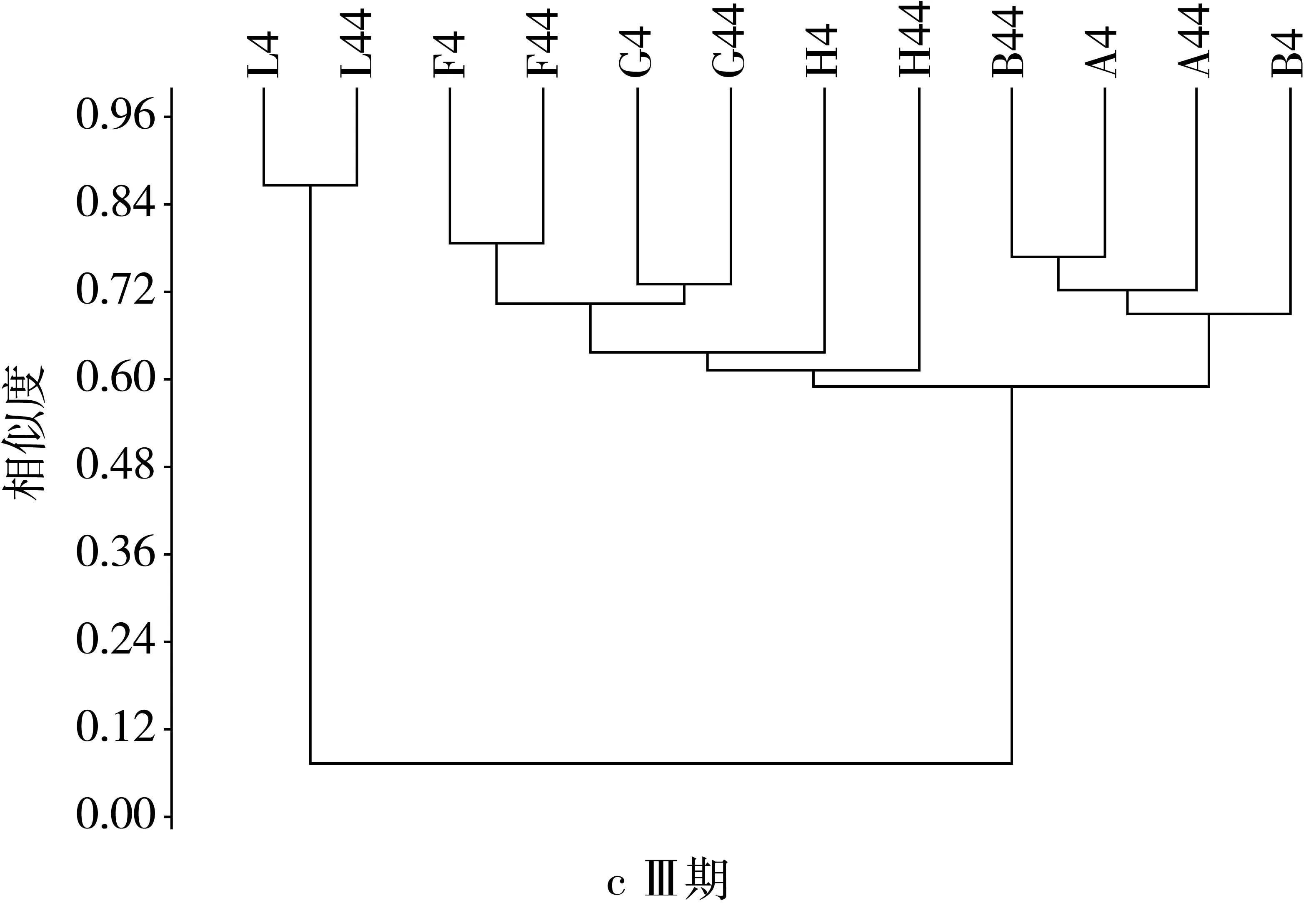
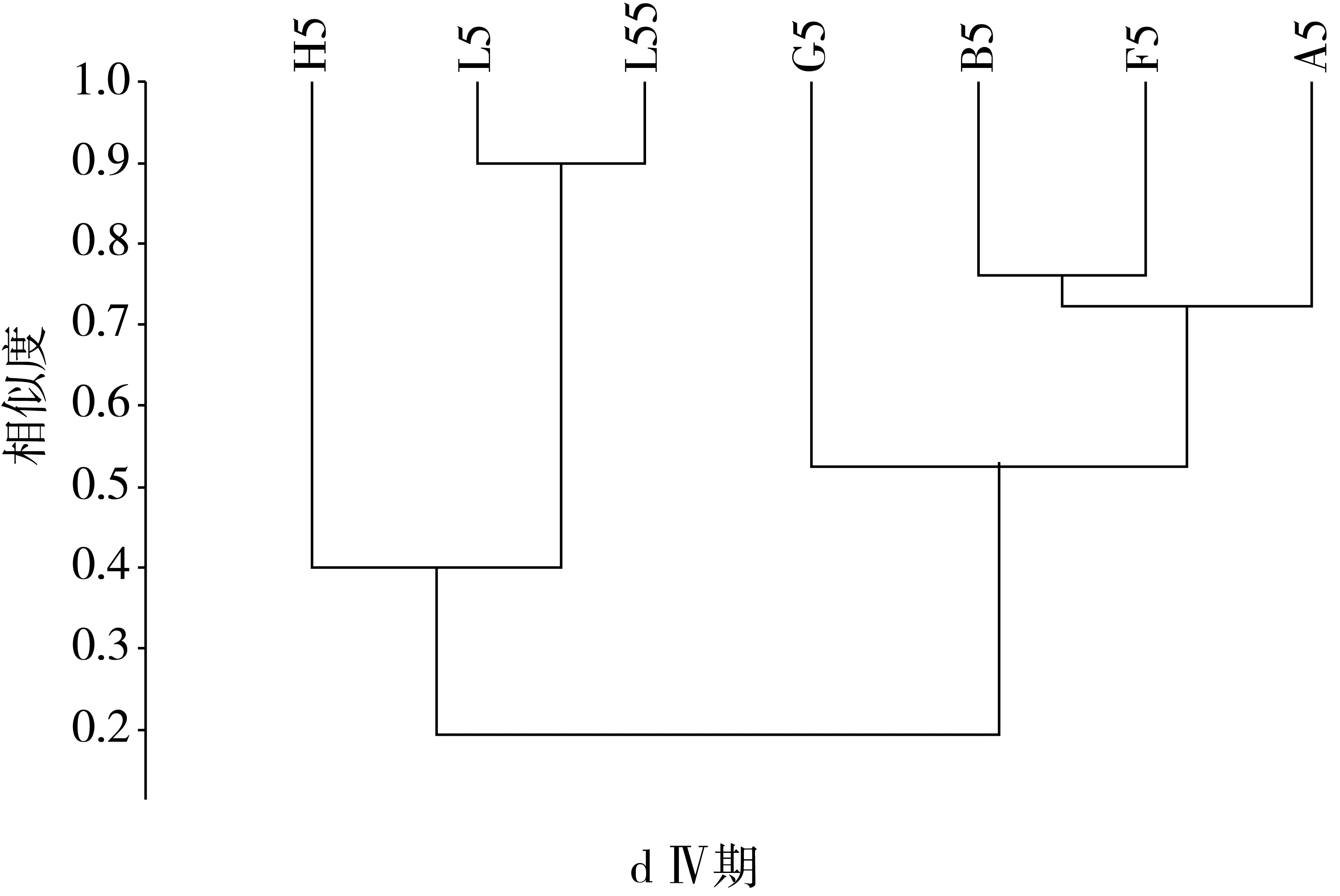
图2 NLP对小鼠肠道菌群基于OUT水平上的聚类分析结果
2.4.2 基于属水平的聚类分析
由图3可见,建模前期主要属为乳酸杆菌属、拟杆菌属、别样杆菌属、副拟杆菌属、螺旋杆菌属、双歧杆菌属、厌氧棍状菌属、厌氧贪食菌属、臭气杆菌属和理研菌属等。各组之间的属水平相似度大于0.58,F组属水平相似度最高为0.91,BGH与A、L之间在属水平差异不显著,各组的相似度均在60%以上。灌胃前期与建模前相比种属比例发生变化,除模型组与其他各组间的差异极显著增大,其相似性仅为0.07,而其他各组间的相似度都在80%以上,FG两组的相似度最高达到0.9,与建模前相比,ABFGH各组间的相似度较建模前显著升高,而根据2.3节的结果显示各组间相似度高的主要菌群为乳酸杆菌属、拟杆菌属、副拟杆菌属、假单胞菌属,十四号梭菌属、双歧杆菌属、粪杆菌属、副萨特氏菌属和螺旋杆菌属等,平均的相似度达到0.82。并且与A、B两组相比,FGH三组的相似度较建模前都显著增加,说明中剂量的NLP对小鼠的肠道菌群的调控作用更强,更有利于肠道菌群的恢复。由结果可知,灌胃后期AB组的属水平相似度保持不变,BF相似度有所提高,与模型组相比,各组相似度略微增加,而其余各组相似度都较灌胃前期有所下降,可见灌胃后期NLP对肠道菌群的调控作用更强。停灌期模型组与其余各组的相似度极显著增加达到0.23,停灌后AB组的相似度较灌胃后期显著增加达到0.92,AF的相似度最高为0.94,BF的相似度较灌胃后期也继续增加达到0.92,说明低剂量的NLP能够在停止灌胃后,继续作用肠道,调控肠道菌群的组成和比例,使其恢复到肠道正常水平组成。
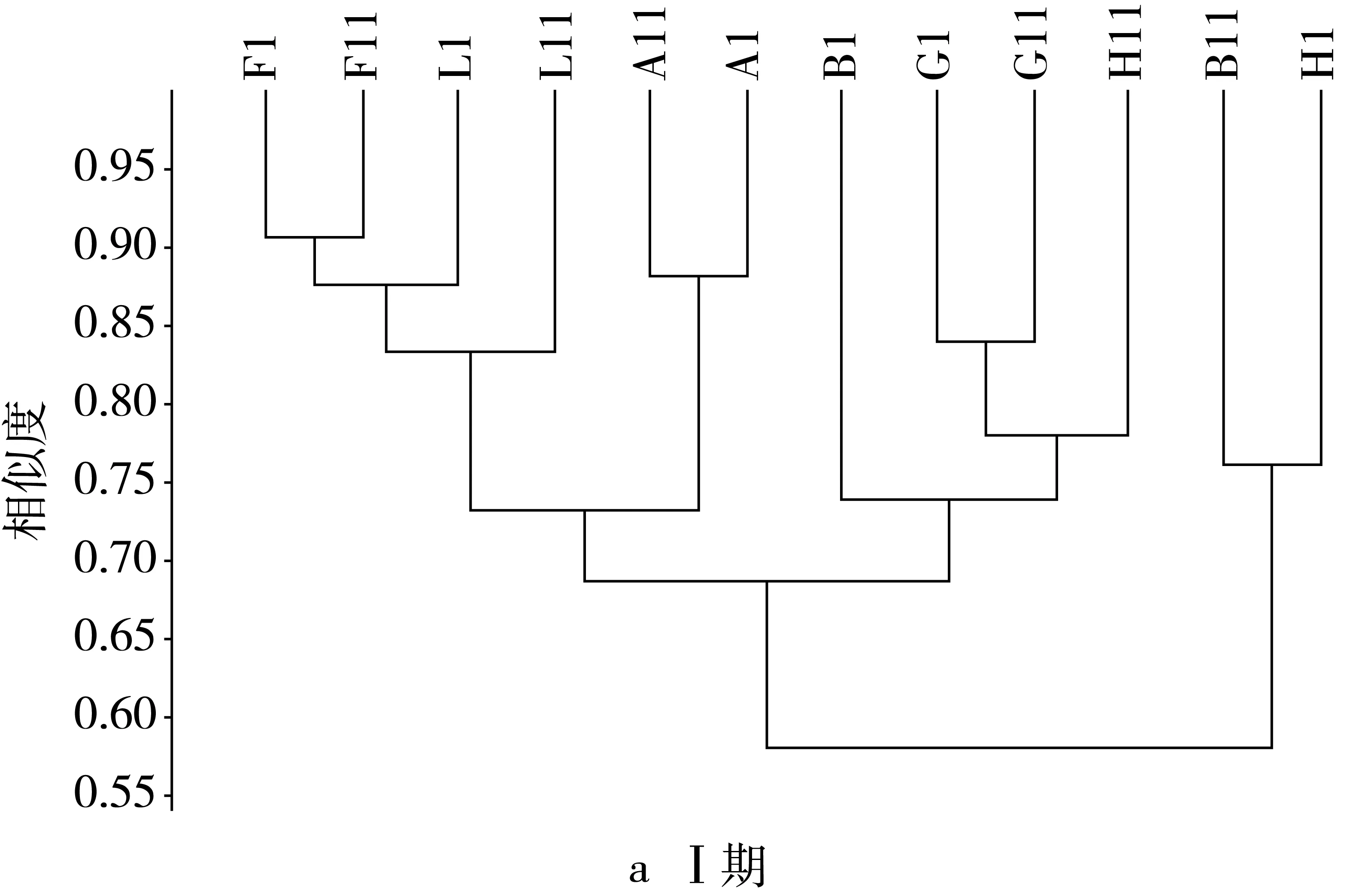
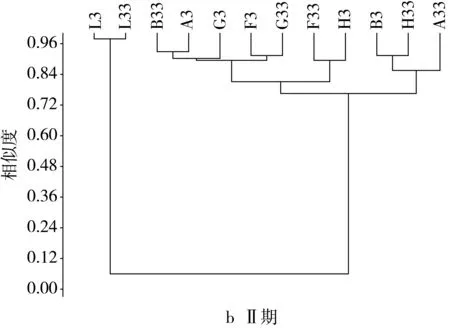
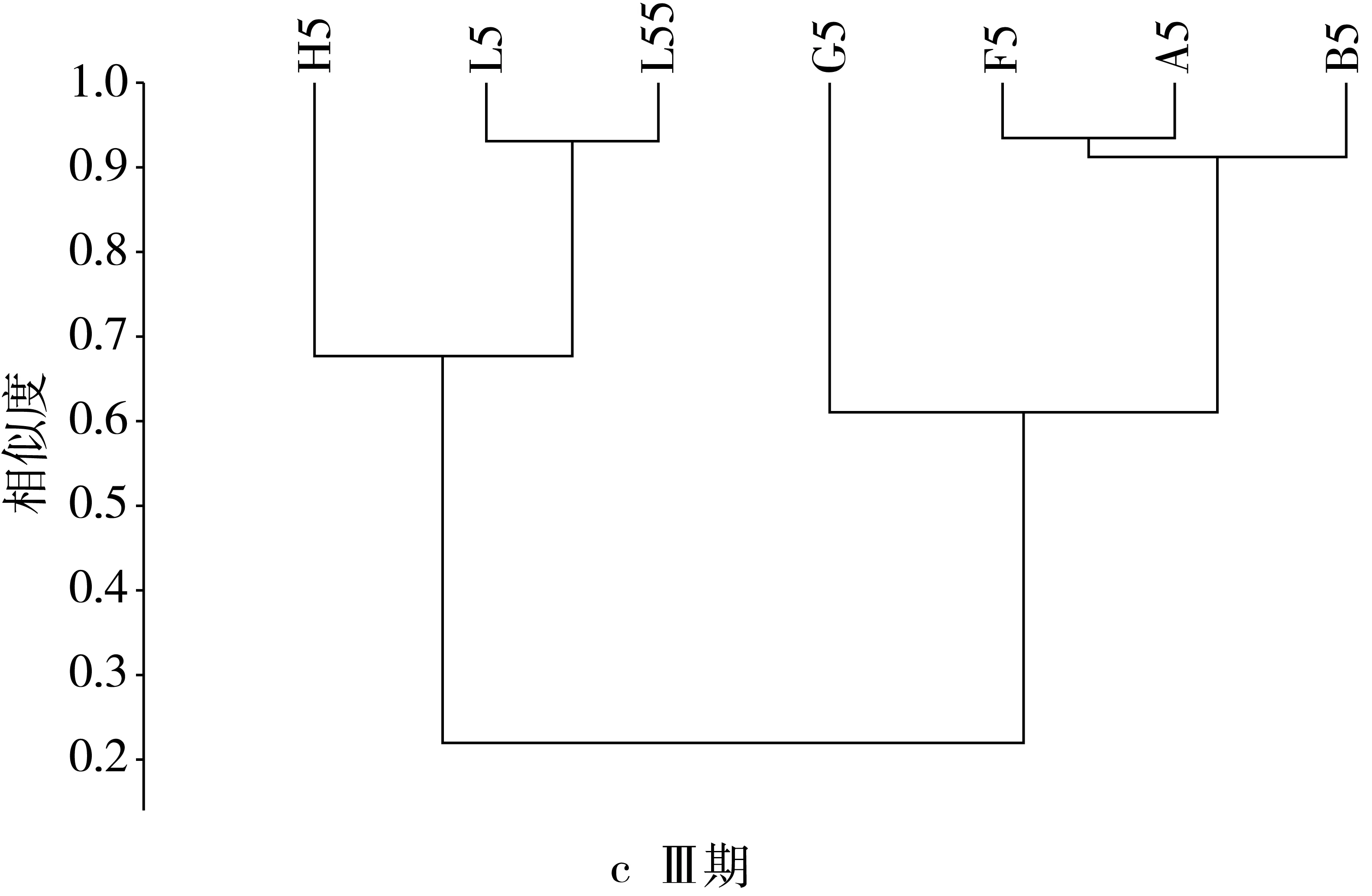
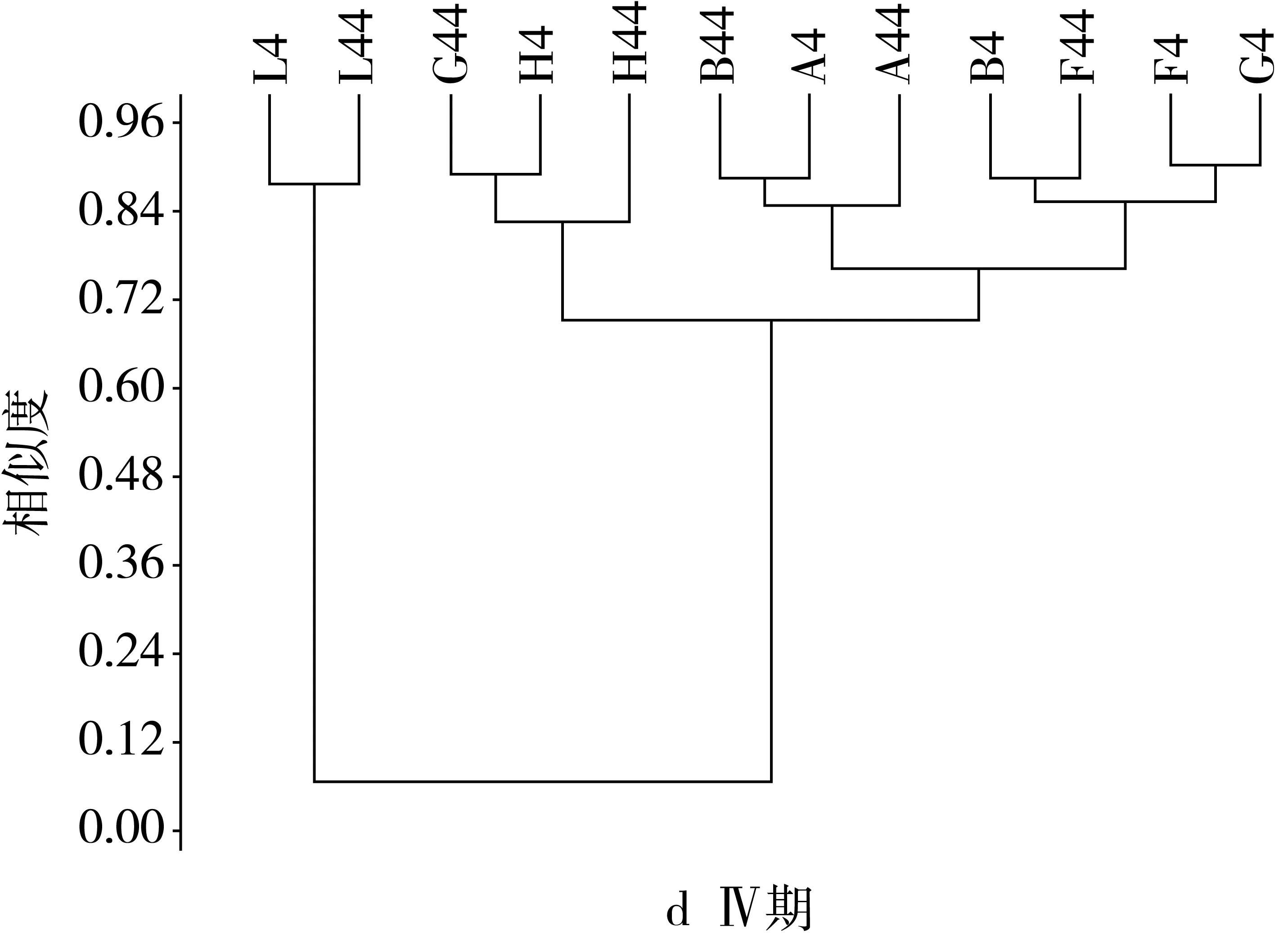
图3 NLP对小鼠肠道菌群基于属水平上的聚类分析结果
2.5 Unifrac.Weighted分析
表2表明,在不同的组之间存在差异,AH、HL、BL、FL、GL、AL与AA、AB、AF、BB、BF、FF、FG、GG、HH、LL,HL、BL、FL、GL、AL与AG、BG,GH与AL、BL、FL、GL,FH与BL、FL、GL,BL与BH,BH与AA、FF、GG、LL,FH、GH与AA、FF、LL,LL与AG、BG差异极显著;BL与AH,FL、GL与AH、BH,AL与FH,HL与FH、GH,BH与AB、AF、BB、BF、FG、HH,AG、BG与AA、FF,LL与AB、AF、BB、FG、HH差异显著。在几个不同的时间点上,各样品的微生物群落结构的差异性与灌胃时间和取样时间无相关联系。在其分组的组数中,由于对各组进行了不同剂量的纳豆冻干粉制剂的灌胃使得肠道中的微生物发生改变,从而导致样本之间的差异性与试验之前不同,产生了差异。
2.6 纳豆菌、益生菌、致病菌的变化情况
图4显示,纳豆菌的比例在建模前为0.03%,在建模后,纳豆菌的比例逐渐增加,在灌胃前期纳豆菌的比例为0.23%,灌胃后期纳豆菌的比例达到0.25%,在停止灌胃后,纳豆菌的比例为0.16%。纳豆菌在各期肠道菌群中的比例不同,在灌胃前期排第10位,建模后期12位,停灌后14位,说明纳豆菌的定植能力极强,能够有效的抵抗抗生素的作用。结果表明:建模前益生菌的比例为43.08%,致病菌的比例为0.81%,益生菌和致病菌的比值(简称益致比)为53.19;建模后灌胃NLP,益生菌的比例显著降低至28.87%,致病菌的比例极显著增加至15.53%,益致比极显著降至1.86;灌胃后期益生菌的比例有所增加,达到30.99%,而致病菌的比例下降至11.20%,益致比增至2.71;停止灌胃后,肠道菌群自由恢复,由于没有抗生素的介导,NLP对肠道菌群的调控作用继续增加,益生菌的比例继续增加,达到39.20%,而致病菌的比例极显著降低至1.28%,益致比极显著增至30.63%,这与建模前的水平差异不显著。益生菌和益致比的水平在建模前最高,而建模后极显著降低,在灌胃NLP后逐渐恢复,停灌后基本达到建模前的水平,呈现“V”型曲线,而致病菌的变化正好相反。
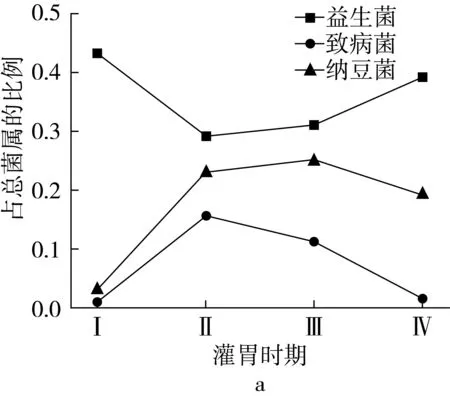
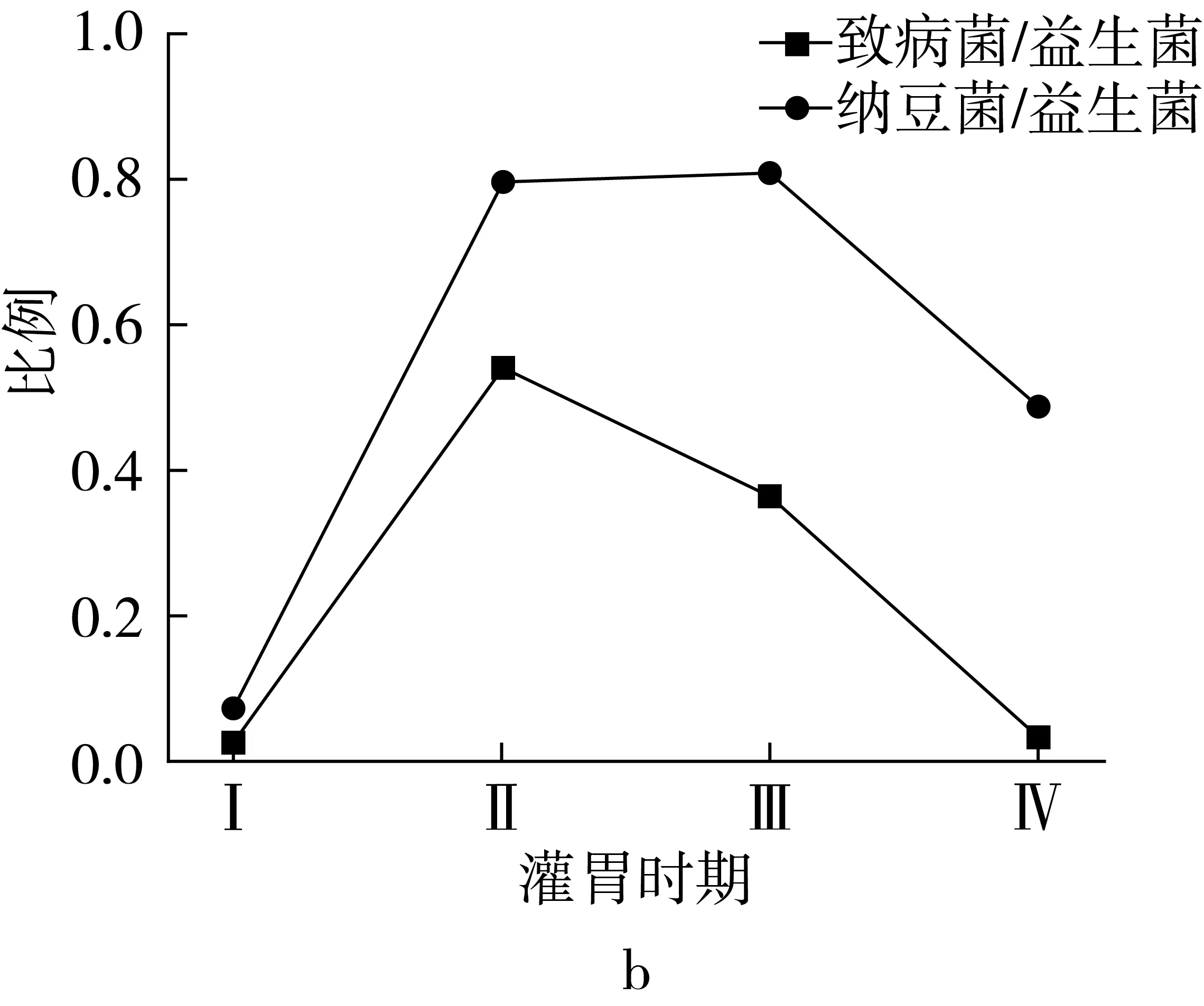
注:图b是图a中3个变量相互间对应灌胃时期的比例。图4 纳豆菌、益生菌、致病菌及其三者比例变化情况
表2 Unifrac.Weighted分析结果
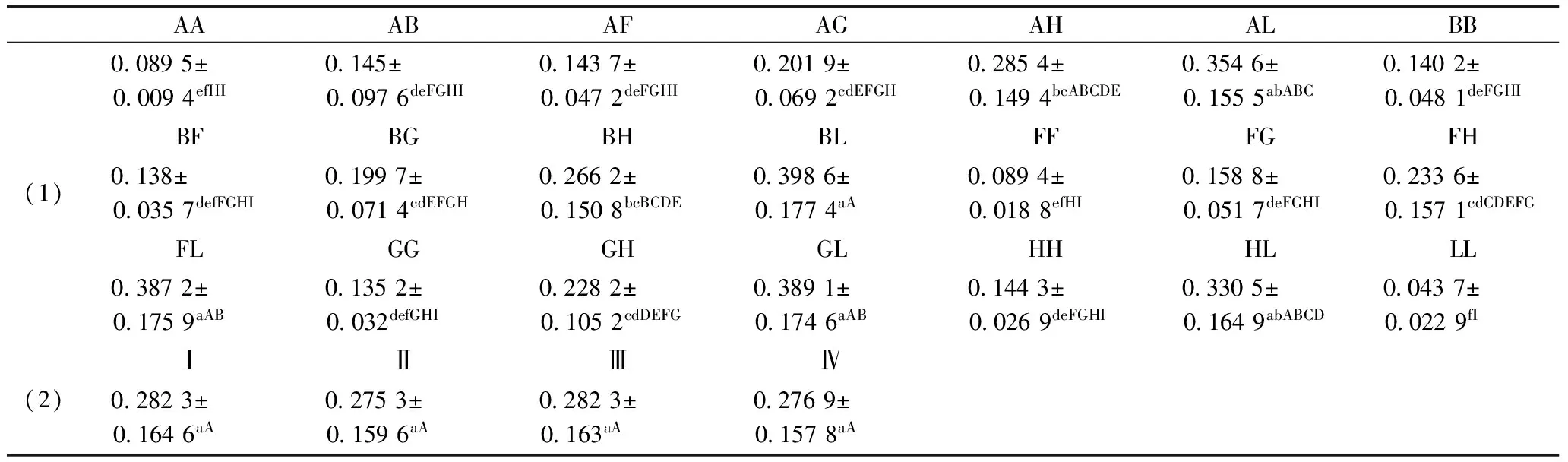
AAABAFAGAHALBB(1)00895±00094efHI0145±00976deFGHI01437±00472deFGHI02019±00692cdEFGH02854±01494bcABCDE03546±01555abABC01402±00481deFGHIBFBGBHBLFFFGFH0138±00357defFGHI01997±00714cdEFGH02662±01508bcBCDE03986±01774aA00894±00188efHI01588±00517deFGHI02336±01571cdCDEFGFLGGGHGLHHHLLL03872±01759aAB01352±0032defGHI02282±01052cdDEFG03891±01746aAB01443±00269deFGHI03305±01649abABCD00437±00229fI(2)ⅠⅡⅢⅣ02823±01646aA02753±01596aA02823±0163aA02769±01578aA
注:(1)为不同组之间的Unifrac weighted的值。(2)为不同时间点上的组间差异。
3 讨论与结论
纳豆菌能产生大量芽孢,耐热性强,耐酸性强,因此能够顺利到达肠道并且发挥作用。益生菌是一种对宿主有益的活性微生物[13],是定植于人体肠道、生殖系统内[14],能产生确切健康功效从而改善宿主微生态平衡、发挥有益作用的活性有益微生物的总称。人体、动物体内有益的细菌或真菌主要有:酪酸杆菌、乳酸菌,双歧杆菌、嗜酸乳杆菌、放线菌、酵母菌等[15]。本试验检测到的益生菌主要有乳酸菌、双歧杆菌、放线菌、嗜酸乳杆菌等;致病菌主要有肠杆菌科,包括大肠杆菌,肠球菌,变形杆菌,大肠埃希氏菌,沙门氏菌,志贺氏菌等。致病菌在肠道中能够大量繁殖,释放毒素,侵袭肠道黏膜上皮细胞,引起细胞死亡造成溃烂[16]。本试验中致病菌在建模前数量很大,但是经过建模期,致病菌的数量减少,而在灌胃期致病菌的数量显著减少,说明纳豆菌能够抑制致病菌的生长繁殖,减少致病菌的定植。陈兵等[17]发现纳豆芽孢杆菌增加了肠道厌氧菌群中的乳酸菌、双歧杆菌、梭菌、拟合杆菌等的数量,部分需氧菌数量下降。黄俊才等[18]发现纳豆芽孢杆菌显著性的增加了仔猪结肠内容物中乳酸菌、双歧杆菌的数量,与甘露聚糖联用时显著的降低了大肠杆菌数量。吴德华等[19]研究发现不同浓度的纳豆芽孢杆菌能够显著增加乳酸菌数量而降低大肠杆菌量,不含有纳豆芽孢杆菌时大肠杆菌数量显著上升。祁红兵等[20]研究纳豆菌的米糠发酵物对小鼠肠道菌群的调节,发现纳豆芽孢杆菌及其米糠发酵成分均对小鼠的肠道正常菌群具有调节作用,两者复合效果更佳;尹惠霖[21]发现饲料中添加纳豆芽孢杆菌能够显著改善肠道微生态环境,能有效促进乳酸菌的生长,且对致病菌具有显著的抑制作用;熊峰[22]发现纳豆芽孢杆菌制剂对肉鸡肠道的大肠杆菌、沙门氏菌具有抑制作用,对乳酸菌具有显著的增殖作用。
PCR分析结果可用于后续的试验;多样性指数随着NLP的剂量的增加,菌种丰富度指数逐渐增大,香农系数先增大后减小,辛普森系数和测序深度系数先减小后增大,发现中剂量NLP调节组的多样性水平更高;从属水平上看,乳酸杆菌属在建模后,灌胃前期极显著降低,灌胃后期显著升高,停灌后继续升高,最后接近正常水平,而拟杆菌属和肠杆菌属正好相反,模型组主要以肠杆菌属为主,停灌后主要以拟杆菌属和副拟杆菌属为主;从属水平的聚类分析结果表明,建模前各处理间的相似度大于0.58,建模后肠道菌群显著变化,灌胃前期的相似度仅为0.07,灌胃后期略微上升,在停灌后的相似度达到0.23;在建模后灌胃NLP,灌胃前期纳豆菌的比例为0.27%,灌胃后期达到0.32%,停灌后纳豆菌的比例为0.21%;益生菌和益致比的水平在建模前最高,而建模后极显著降低,在灌胃NLP后逐渐恢复,停灌后基本达到建模前的水平,呈现“V”型曲线,而致病菌的变化正好相反;结果表明,NLP能够有效调节抗生素介导的小鼠肠道菌群水平。本试验研究结果为揭示纳豆芽孢杆菌的肠道菌群调节机理提供科学依据,对人类健康和传统发酵食品微生物的开发具有十分重要的意义。
[1]刘玉军,张晓峰.抗生素滥用的危害及防范[J].中外医疗,2012,973(1):188-189
Liu Y P,Zhang X F.The harm and prevention of abuse of antibiotics[J].Chinese and Foreign Medical,2012,973(1):188-189
[2]Carles Ubeda,Eric G.Pamer.Antibiotics,microbiota,and immune Defense[J].Trends in Immunology,2012,33(9):459-466
[3]陶湘林,欧阳晶,黄璇,等.一种日本纳豆粉的成分分析[J].农产品加工(学刊),2012(8):33-35
Tao X L,Ouyang J,Huang X,et al.The composite analysis of one of Japanese natto powder[J].Academic Periodical of Farm Products Processing,2012(8):33-35
[4]齐凤兰,奚锐华,陈有容.纳豆中营养与活性成分的分析研究[J].中国食物与营养,2004(2):33-35
Qi F L,Xi R H,Chen Y R.The study on nutrition and active components in natto[J].Chinese Journal of Food and Nutrition,2004(2):33-35
[5]安晓琼,李梦琴.纳豆的生理功能[J].食品与药品,2006,8(01A):68-71
An X Q,Li M Q。The physiological functions of natto[J].Food and Drug,2006,8(01A):68-71
[6]须见洋行.纳豆キナーゼと线溶系[J].化学と生物,1991,29(2):119-123
Hiroyuki S.Natto kinase and soluble system[J].Chemistry and Creatures,1991,29(2):119-123
[7]沈柱英,黄占旺,曹靖文.纳豆菌糖肽对免疫功能低下小鼠的免疫调节作用[J].营养学报,2014(4):381-385
Shen Z Y,Huang Z W,Cao J W.The immunoregulating effect of bacillus natto glycopeptides in immno-supperssed mice[J].Journal of Nutrition,2014(4):381-385
[8]Ercolini D.High-throughput sequencing and metagenomics:moving forward in the culture-independent analysis of food microbial ecology[J].Applied and Environmental Microbiology,2013,79(10):3148-3155.DOI:10.1128/AEM.00256-13
[9]米其利,李雪梅,管莹,等.高通量测序在食品微生物生态学研究中的应用[J].食品科学,2016(23):302-308
Mi Q L,Li X M,Guan Y,et al.Application of high-throughput sequencing in food microbial ecology:a review[J].Food Science,2016,37(23):302-308
[10]张帅.2,4-二硝基苯甲醚的零价铁强化生物还原技术研究[D].南京:南京理工大学,2015:24-25
Zhang S.Study on enhanced biological reduction treatment technology of 2,4-dinitroanisole by zero-valent iron[D].Nanjing:Nanjing University of Science & Technology,2015:24-25
[11]陈燕.缺氧状态下吡啶的生物强化降解技术研究[D].南京:南京理工大学,2015:55-56
Chen Y.The bioaugmentation technology of prydine under anoxic conditions[D].Nanjing:Nanjing University of Science & Technology,2015:55-56
[12]Pala-Ozkok I,Rehman A,Yagci N,et al.Characteristics of mixed microbial culture at different sludge ages:Effect on variable kinetics for substrate utilization[J].Bioresource Technology,2012,126(6):274-282.
[13]Scharek L,Guth J,Reiter K,et al.Influence of a probioticEnterococcusfaeciumstrain on development of the immune system of sows and piglets[J].Veterinary Immunology and Immunopathology,2005,105(1,2):151-161.
[14]郭彤,胥保华,马玉龙,等.嗜酸乳杆菌和两歧双歧杆菌体外粘附Caco-2细胞及其对病原菌粘附性能的影响[J].中国兽医学报,2008,28(5):527-531
Guo T,Xu BH,Ma YL,et al.In vitro properties of adhered to caco-2 cells of lactobacillus acidophilus and Bifidobacterium bifidum and their antagonistic activity against pathogen and discuss their mechanisms[J].Chinese Journal of Veterinary Science,2008,28(5):527-531
[15]蔡凯凯,黄占旺,叶德文,等.益生菌调节肠道菌群及免疫调节作用机理[J].中国饲料,2011(18):34-37
Cai K K,Huang Z W,Ye D W,et al.The mechanism of probiotics which regulate intestinal flora and immunomodulatory effects[J].Chinese Feed,2011(18):34-37
[16]张英春,韩雪,单毓娟,等,益生菌抑制致病菌作用的机制研究进展[J].微生物学通报,2012(9):1306-1313
Zhang Y C,Han X,Shan Y J,et al.Recent advances in mechanism on probiotic bacteria inhibition of pathogens[J].Bulletin of Microbiology,2012(9):1306-1313
[17]陈兵,朱凤香,陈巧云,等.纳豆芽孢杆菌分离纯化及对大白鼠肠道微生态系统的影响[J].浙江农业学报,2003,15(4):223-227
Chen B,Zhu F X,Chen Q Y,et al.Isolation and purification of bacillus natto sawamura and its effect on the intestinal microecology systems[J].Journal of Zhejiang Agricultural sciences,2003,15(4):223-227
[18]黄俊才,林映才,冯定远,等.纳豆菌、甘露寡糖对仔猪肠道pH、微生物区系及肠黏膜形态的影响[J].畜牧兽医学报,2005,36(10):1021-1027
Huang J W,Lin Y C,Feng D Y,et al.Effect of natto and intestinal pH,colonic microflora population and intestinal membrane shape of early weaning piglet[J].Journal of Animal Science and Veterinary Medicine,2005,36(10):1021-1027
[19]吴德华,杜莉,徐汉坤,等.纳豆芽孢杆菌对仔犬日增重和肠道菌群的影响[J].家畜生态学报,2009,30(3):64-67
Wu D F,Du L,Xu H K,et al.Effect of bacillus natto on the growth and intestinal microbiota in weaning canines[J]. Journal of Animal Science and Veterinary Medicine,2009,30(3):64-67
[20]祁红兵,陈玉栋,陈钧.纳豆菌的米糠发酵物对小鼠肠道菌群的调节[J].中国粮油学报,2010(4):61-64
Qi H B,Chen Y D,Chen J.Regulation ofbacillusnatto subtilis fermented on intestinal microflora in mice[J].Journal of the Chinese Cereals and Oils Association,2010(4):61-64
[21]尹惠霖,纳豆芽孢杆菌对草鱼幼鱼生理生化指标和肠道功能的影响[D].长沙:湖南农业大学,2014
Yin H L.Effect ofbacillusnatto on physiological indexes,biochemical indexes and intestinal function of juvenile grass carp[D].Changsha: Hunan Agricultural University,2014
[22]熊峰.大豆低聚糖和纳豆芽孢杆菌制剂及其组合对肉鸡生产性能、肠道消化酶及菌群平衡的影响[D].乌鲁木齐:新疆农业大学,2008
Xiong F.Effect of soybean-oligosaccharides,bacillusnatto preparation and their combination on production capability,intestinal digestiye enzyme and microflora in broilers[D].Wulumuqi:Xinjiang Agricultural Univesity,2008.
Effect of Natto Lyophilized Powder on Intestinal Flora of Mice Based on Miseq Method
Huang Zhanwang Wang Suzhen Wu Gaofeng Wu Shaofu Huang Yongping Chen Jiani
(College of Food Science and Engineering,Jiangxi Agricultural University;Jiangxi Key Laboratory of Natural Products and Functional Food,Nanchang 330045)
Antibiotics was abused in recent years,and it inhibits or kills microbes,which made the body dysbacteriosis.Therefore,it is very necessary to look for a safe and effective antibiotic replacement,and probiotics is an effective alternate.Natto lyophilized powder was the raw material and the normal mice and low intestinal flora in mice was used as animal testing model.In vivo gavage experiment and Miseq method were used to study the effect of natto lyophilized powder on mice intestinal flora.Further the biological information of mice was analyzed.The diversity of intestinal flora among multiple samples and the classification of the single sample’s level were analyzed.Ultimately,the changes in the number of bacteria in Bacillus natto and probiotics and pathogens were analyzed. The expected results provided the scientific basis of revealing the regulating mechanism of bacillus natto on the intestinal flora,and had a very vital significance for human health and the development of the traditional fermented food microorganism.
natto lyophilized powder,intestinal flora,miseq method,diversity
R151
A
1003-0174(2017)11-0026-08
国家自然科学基金(31160337)
2016-10-18
黄占旺,男,1964年出生,教授,食品微生物与发酵代谢产物
