甲乙苯脱氢制甲基苯乙烯反应工艺及动力学研究
2017-12-06郝明坤李瑞江朱学栋倪燕慧
郝明坤,李瑞江,朱学栋,卓 超,倪燕慧,鲁 航
(1.华东理工大学大型工业反应器工程教育部工程研究中心,上海 200237;2.南京炼油厂有限责任公司)
甲乙苯脱氢制甲基苯乙烯反应工艺及动力学研究
郝明坤1,李瑞江1,朱学栋1,卓 超2,倪燕慧1,鲁 航1
(1.华东理工大学大型工业反应器工程教育部工程研究中心,上海 200237;2.南京炼油厂有限责任公司)
使用工业脱氢催化剂,在温度580~635 ℃、水与甲乙苯质量比2.0~4.0、体积空速0.5~1.5 h-1、压力(a)30~101 kPa的实验条件范围内,研究了工艺参数对甲乙苯脱氢制甲基苯乙烯反应的影响规律。结果表明:随着温度的升高,甲乙苯转化率提高,甲基苯乙烯选择性下降;随着水与甲乙苯配比的增加,转化率和选择性均上升;体积空速降低时,虽能提高转化率,但会使选择性降低;压力降低时,既可提高转化率,又有利于选择性的升高;适宜的工艺条件为压力(a)50 kPa、温度620 ℃、水与甲乙苯质量比2.0、体积空速0.5 h-1。利用实验数据,对甲乙苯脱氢反应进行了动力学研究。假设并简化反应网络,根据不同反应机理提出3种可能的甲乙苯脱氢反应动力学模型,对模型进行统计学检验筛选后,确定双位吸附模型为最佳反应动力学模型,并估算了该模型的参数,可为反应器的设计和最佳操作条件的选择提供依据。
甲乙苯 甲基苯乙烯 脱氢 反应工艺 反应动力学
甲基苯乙烯为无色透明液体,常用来代替苯乙烯,主要应用于树脂涂料、热固性聚酯塑料等方面[1-3]。与苯乙烯相比,甲基苯乙烯具有较高的沸点、较低的蒸气压,可明显地减少潜在的危害性[4-5];与聚苯乙烯相比,聚甲基苯乙烯具有较低的密度、较高的热变形温度、较好的流动性等特点[1-2],具有更广阔的应用空间。目前我国苯乙烯的生产量仍不能满足市场需求,须依靠大量进口来平衡需求[6]。在这种情况下,需对甲基苯乙烯的生产给予足够重视,解决我国苯乙烯市场供量不足的问题,大力发展聚甲基苯乙烯新工艺技术[2]。近年来,随着碳九芳烃的深度利用开发,甲乙苯脱氢制甲基苯乙烯技术的开发成为研究方向之一[7-8]。
甲乙苯脱氢制甲基苯乙烯技术最早是由美国的赫斯特和莫比尔公司联合开发的。在20世纪80年代,国内研究者吴荣安[9]、朱晓苓[10]、李琪[11]等分别对甲乙苯脱氢制甲基苯乙烯进行了研究,这些研究均侧重于无铬脱氢催化剂的研制与性能考察,而有关甲乙苯脱氢反应动力学的研究迄今未见报道。
本课题采用工业GS脱氢催化剂,对甲乙苯脱氢制甲基苯乙烯过程进行反应特性研究及工艺参数优化,对甲乙苯脱氢反应进行动力学分析,为反应器的设计和最佳操作条件的选择提供必要的依据。
1 实 验
1.1 原 料
间、对甲乙苯混合物,纯度98.6%(间甲乙苯和对甲乙苯的质量分数分别为50.4%和48.2%),由南京炼油厂提供。
1.2 催化剂
工业GS脱氢催化剂,尺寸为Φ3 mm×5 mm,已成功应用到乙苯脱氢工业生产中,上海石油化工研究院研制。该催化剂以氧化铁为主要活性组分,添加碳酸钾、铈盐、钼盐、氧化镁等为助剂[12]。
1.3 反应器
等温积分管式反应器,尺寸为内径2.54 cm、外径3.5 cm、长度80 cm。
1.4 实验步骤
本实验采用30 g原颗粒催化剂,在实验操作条件下能够达到排除外扩散要求[13]。甲乙苯与水分别称量后经计量泵送入反应系统,混合后通过油浴锅汽化。随后物料经保温管线进入反应管反应。反应产物经过冷凝后进入脱氢液收集装置进行收集。每隔2 h取样一次,对样品进行气相色谱分析。
2 结果与讨论
采用工业GS脱氢催化剂,考察了温度、水与甲乙苯配比、空速、压力等工艺参数对甲乙苯转化率、甲基苯乙烯选择性的影响。
2.1 温度的影响
在常压、水与甲乙苯质量比2.0、体积空速1.0 h-1的条件下,考察温度对甲乙苯脱氢反应的影响,结果见图1。从图1可知:在620 ℃以下,甲乙苯转化率较低,随着温度的提高,甲乙苯转化率增大,特别是在温度由600 ℃提高到635 ℃时,甲乙苯转化率的提高明显;随着温度的提高,甲基苯乙烯选择性不断下降。因此,甲乙苯脱氢反应的起始温度设定在620 ℃左右比较合理,此时甲乙苯转化率及甲基苯乙烯选择性均较高。
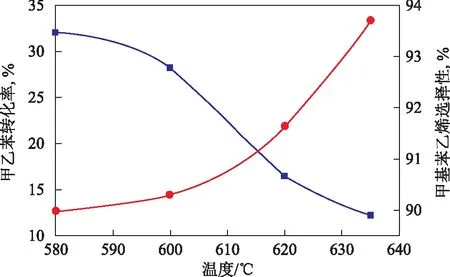
图1 温度对甲乙苯转化率和甲基苯乙烯选择性的影响●—甲乙苯转化率; ■—甲基苯乙烯选择性。图2~图4同
2.2 水与甲乙苯配比的影响
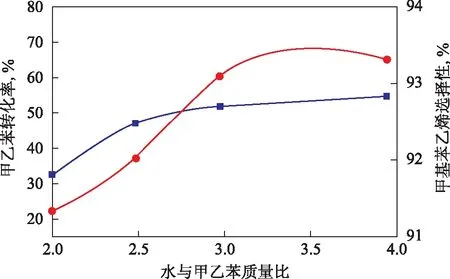
图2 水与甲乙苯配比对甲乙苯转化率和甲基苯乙烯选择性的影响
在常压、温度620 ℃、体积空速1.0 h-1的条件下,考察水与甲乙苯配比对甲乙苯脱氢反应的影响,结果见图2。从图2可知,水蒸气的加入能够降低反应组分的分压,促进主反应平衡向生成甲基苯乙烯的方向移动,从而提高甲乙苯转化率,并且使甲基苯乙烯的选择性上升。加入水蒸气还能发生水煤气变换反应,从而清除催化剂上的积炭。但水蒸气用量太多时,对提高甲乙苯平衡转化率的作用不是很显著,并且能耗增加,使设备生产能力降低。
2.3 空速的影响
在常压、温度620 ℃、水与甲乙苯质量比2.0的条件下,考察空速对甲乙苯脱氢反应的影响,结果见图3。从图3可看出,随着空速增大,物料在催化剂上的停留时间减少,导致甲乙苯转化率降低,但甲基苯乙烯选择性上升。在空速较低时,虽然甲乙苯转化率较高,但由于裂解、聚合及深度裂解等副反应加剧而使催化剂表面结炭严重,从而使催化剂活性下降,导致甲基苯乙烯选择性较低;提高空速时,虽然甲乙苯转化率有所降低,但甲基苯乙烯选择性提高,故空速的最适宜范围与催化剂的活性和反应温度有关。
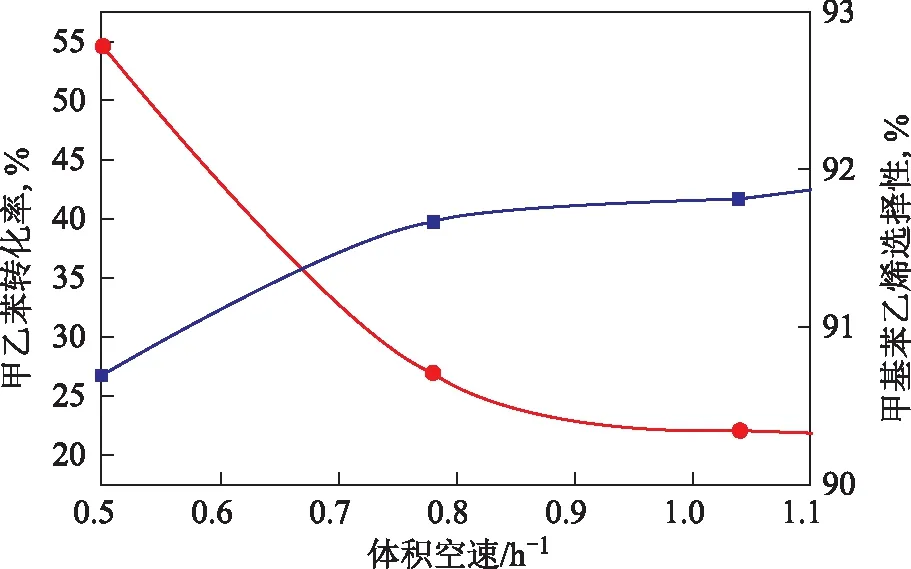
图3 空速对甲乙苯转化率和甲基苯乙烯选择性的影响
2.4 压力的影响
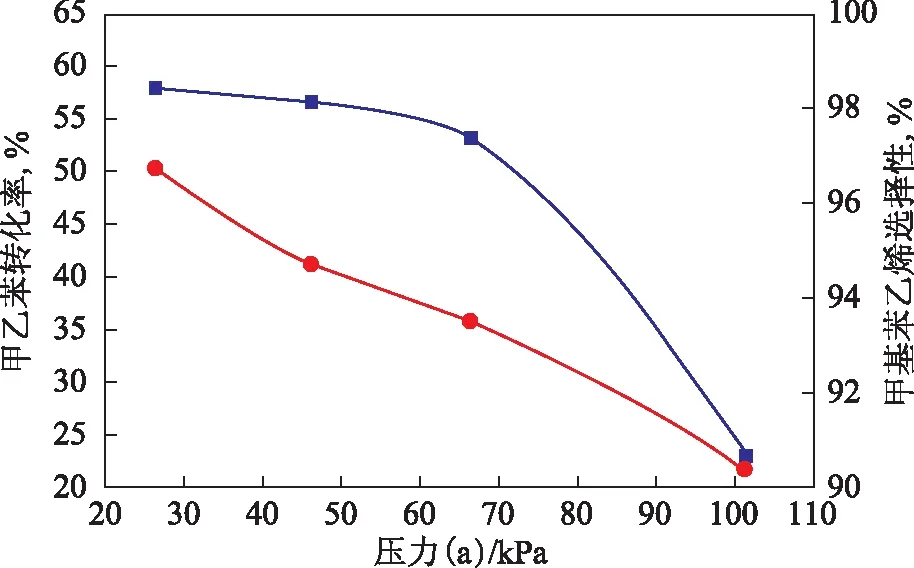
图4 压力对甲乙苯转化率和甲基苯乙烯选择性的影响
在温度620 ℃、水与甲乙苯质量比2.0、体积空速1.0 h-1的条件下,考察压力对甲乙苯脱氢反应的影响,结果见图4。从图4可以看出,由于甲乙苯脱氢反应为可逆增分子反应,故压力的降低有利于提高甲乙苯转化率以及甲基苯乙烯选择性,抑制副反应的发生。
通过上述实验研究和综合分析,推荐适宜的甲乙苯脱氢工艺条件为:压力(a)50 kPa,温度620 ℃,水与甲乙苯质量比2.0,体积空速0.5 h-1。
3 甲乙苯脱氢反应动力学
3.1 反应网络
根据甲乙苯脱氢实验的产物分析结果可知,主要反应产物为甲基苯乙烯,副产物的量较少,主要包括甲苯、二甲苯、苯乙烯、乙苯、苯。
甲乙苯脱氢反应网络可假设如下[9]:
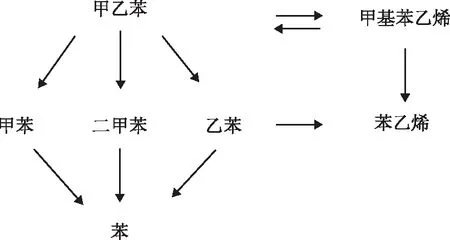
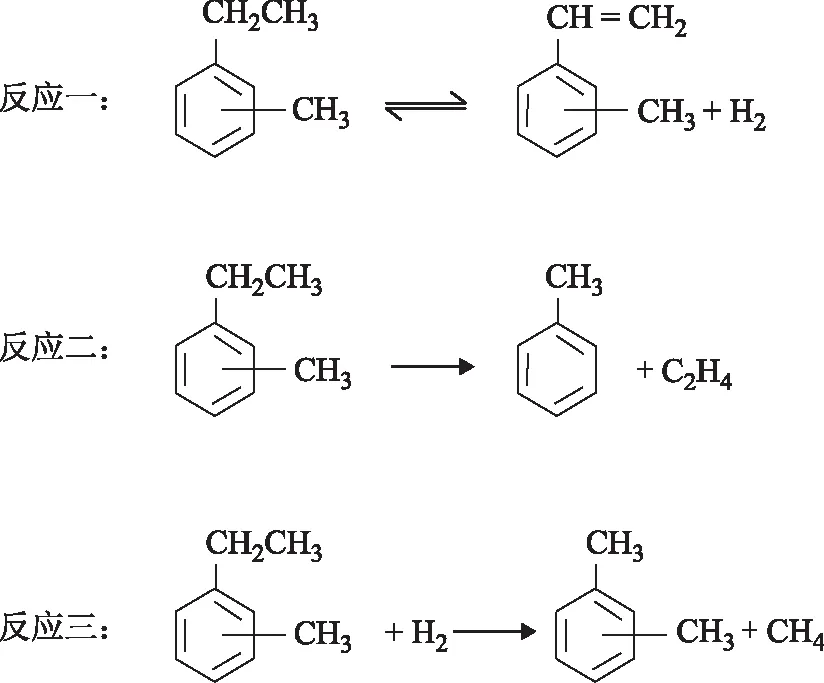
由于甲乙苯脱氢反应中副反应较多,为了便于研究反应动力学,对此脱氢反应网络进行简化。由于生成苯、乙苯、苯乙烯等副产物的量较少,所以主要考虑主反应和生成甲苯、二甲苯的副反应。吴荣安[9]、李琪[11]的研究结果表明,间、对甲乙苯异构体的脱氢性能相似,且脱氢过程中两者不存在异构化反应,故将间、对甲乙苯脱氢简化为一个脱氢反应。简化后甲乙苯脱氢中涉及的反应为:
3.2 动力学建模
甲乙苯与乙苯在结构上类似,文献中已有许多关于乙苯脱氢反应动力学的报道,故本课题以乙苯脱氢反应动力学研究成果为基础,对甲乙苯脱氢反应进行动力学研究。根据不同的脱氢反应机理,提出3种可能的甲乙苯脱氢反应动力学模型,分别为单位吸附模型、双位吸附模型和经验模型。
3.2.1单位吸附模型基于Langmuir-Hinshelwood理论,Carrà等[14]提出了苯乙烯的生成速率方程。在这个模型的基础上,甲乙苯脱氢反应过程可表示如下:
甲乙苯吸附过程:

表面反应过程:

式中:[]表示催化剂表面吸附活性空位;MEB表示甲乙苯;MST表示甲基苯乙烯;TL表示甲苯;DB表示二甲苯。
甲乙苯脱氢产物中甲苯、二甲苯、甲烷、乙烯的含量很低,可忽略不计;本实验进料中水和甲乙苯的配比较高,甲乙苯分压较小,故甲乙苯分压对反应速率的影响很小,因此反应速率方程可简化如下:
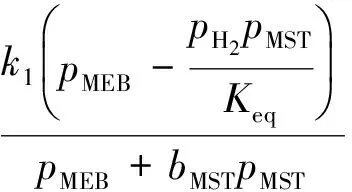
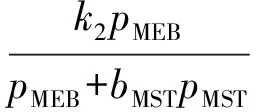
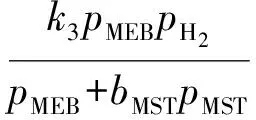
式中:r1,r2,r3分别为反应1~反应3的速率;k1,k2,k3分别为反应1~反应3的反应速率常数;p为各组分的分压;bMST为甲基苯乙烯吸附常数;Keq为主反应平衡常数。
3.2.2双位吸附模型依据Langmuir-Hinshelwood反应机理,Lee[15]对Hougen和Watson提出的经典动力学模型进行了改进。依据Lee提出的反应机理和动力学模型,甲乙苯脱氢反应机理可表示如下:
甲乙苯、氢气的吸附过程:


表面反应过程:

甲乙苯脱氢产物中甲苯、二甲苯、甲烷、乙烯的含量很低,可忽略不计;由于反应在高温下进行,氢气的吸附系数与甲乙苯和甲基苯乙烯等烃类的吸附系数相比甚小,故分母项中忽略氢气项,反应速率方程可表示如下:
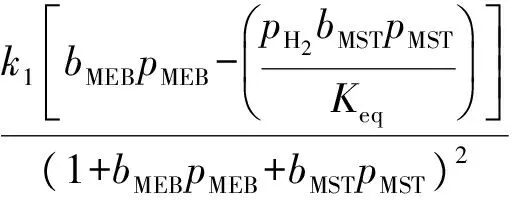
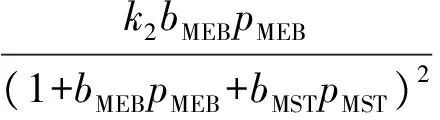
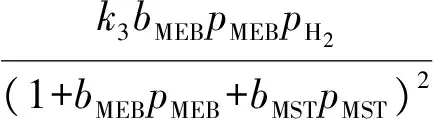
ki=ki0e(-Ei/RT),i=1,2,3,
bj=bj0e(-Aj/RT),j=MEB,MST
式中:ki0为指前因子;Ei为活化能;bj0为指前因子;Aj为吸附活化能;bj为吸附常数。
3.2.3经验模型适用于乙苯脱氢的经验模型最早是由Wenner和Dybdal提出的[16],甲乙苯脱氢反应过程可表示如下:

反应速率方程可表示如下:
r2=k2pMEB
r3=k3pMEBpH2
3.3 模型筛选与参数估计
将动力学实验数据代入速率方程,利用龙格库塔算法(MATLAB ODE45)可求解微分速率方程。最优化方法选用Levenberg-Marquardt算法,不断迭代计算,直至使目标函数值最小,最终完成参数估算[17]。其中目标函数S表示如下:
w2(XTL,e,k-XTL,c,k)2+w3(XDB,e,k-XDB,c,k)2]
式中:XMST,e,k,XTL,e,k,XDB,e,k分别为甲基苯乙烯、甲苯、二甲苯转化率的实验值,XMST,c,k,XTL,c,k,XDB,c,k分别为甲基苯乙烯、甲苯、二甲苯转化率的理论计算值;w1,w2,w3为权重因子,由于主产物甲基苯乙烯与副产物甲苯、二甲苯的含量相差很大,故采用权重因子调节各组分残差平方和在目标函数中的权重。
采用决定性指标ρ2和F检验值两种判断标准对动力学模型进行筛选,检验结果见表1。由表1可知,双位吸附模型的决定性指数ρ2均大于0.9,F检验值最大,且F>10F0.05,故可认为本实验考察范围内,双位吸附模型为最佳动力学模型。
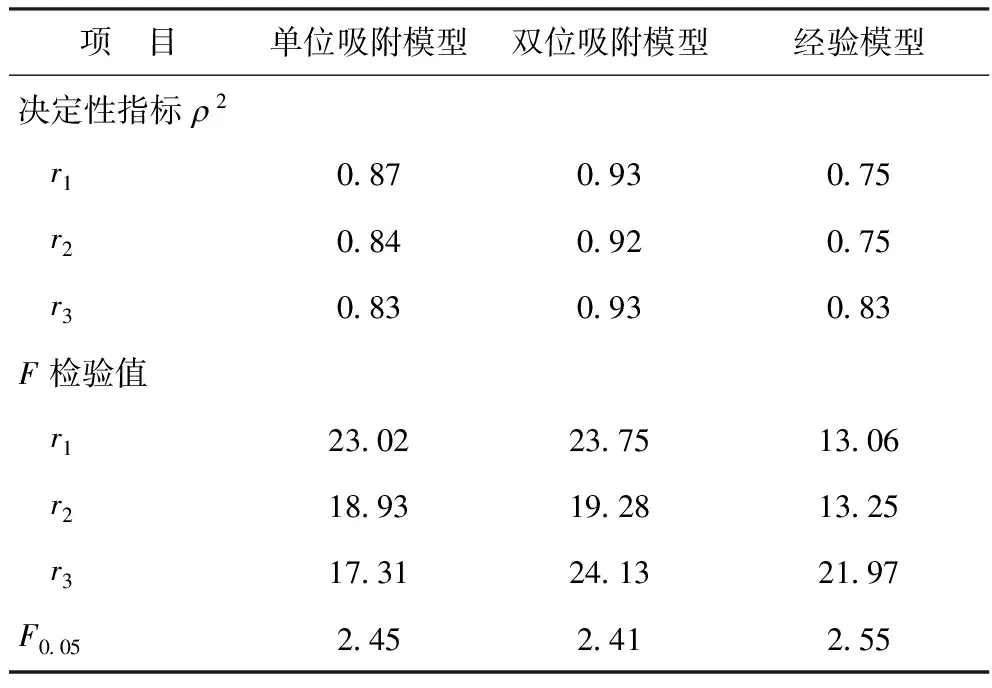
表1 动力学模型的统计学检验结果
双位吸附模型的参数估算结果见表2。

表2 双位吸附模型的参数估计结果
4 结 论
(1)温度、水与甲乙苯配比、空速、压力对甲乙苯转化率以及甲基苯乙烯选择性的影响规律为:随着温度的升高,转化率提高,选择性下降;随着水与甲乙苯配比的增加,转化率和选择性均上升;体积空速降低时,虽能提高转化率,但会使选择性降低;压力降低时,既可提高转化率,又有利于选择性的升高。
(2)适宜的甲乙苯脱氢工艺条件为:压力(a)50 kPa,温度620 ℃,水与甲乙苯质量比2.0,体积空速0.5 h-1。
(3)提出了3种甲乙苯脱氢反应动力学模型。经筛选,确定双位吸附模型为最佳模型,并估算了该模型参数值,统计学检验结果显示:ρ2>0.9,F>10F0.05,故在本实验考察范围内,所采用的假定和提出的双位吸附动力学模型是合理的。
[1] 郝国璋.新型塑料单体——对甲基苯乙烯[J].合成树脂及塑料,1985(2):45-49
[2] 蔡光宇.新工艺生产聚甲基苯乙烯[J].中国科技信息,1992(12):39-40
[3] 曹正国,荆晓平,任伟,等.一种用于乙烯基甲苯生产的精馏装置及精馏方法:中国,CN104072328 A[P].2014-10-01
[4] 维美.新型塑料——聚对甲基苯乙烯[J].化工新型材料,1983(7):15-16
[5] 吴鑫干.一种比苯乙烯更好的单体对甲基苯乙烯正在走向工业化[J].现代化工,1984(6):28-31
[6] 陈雷,马胜泽,王金昭,等.苯乙烯的市场及技术进展[J].弹性体,2016,26(3):90-96
[7] 冯海强,朱跃辉,高继东,等.一种用于甲基乙苯脱氢制备甲基苯乙烯的催化剂及制备方法:中国,CN102950005A[P].2013
[8] 朱志荣,梁铮.用于甲乙苯脱氢制甲基苯乙烯的催化剂:中国,CN102000587A[P].2011-04-06
[9] 吴荣安,白玉珩,林励吾.对甲基乙苯脱氢制对甲基苯乙烯[J].石油化工,1990,19(8):511-517
[10] 朱晓苓,张培辉,潘伯华,等.甲乙苯脱氢制甲基苯乙烯的研究[J].上海化工学院学报,1980(1):54-63
[11] 李琪,胡家臻.甲乙苯脱氢催化剂的研制[J].化学反应工程与工艺,1988,10(2):69-74
[12] 宋磊.GS-11催化剂催化乙苯脱氢制苯乙烯反应性能[J].化学反应工程与工艺,2013,29(1):92-96
[13] 陈建春.乙苯脱氢副反应及动力学的研究[D].上海:华东理工大学,2003
[14] Carrà S,Forni L.Kinetics of catalytic dehydrogenation of ethylbenzene to styrene[J].Industrial & Engineering Chemistry Process Design and Development,1965,4(3):281
[15] Lee W J,Froment G F.Ethylbenzene dehydrogenation into styrene:Kinetic modeling and reactor simulation[J].Industrial & Engineering Chemistry Research,2008,47(23):9183-9194
[16] Sheppard C M,Maier E E,Caram H.Ethylbenzene dehydrogenation reactor model[J].Industrial & Engineering Chemistry Process Design and Development,1986,25(1):207-210
[17] 王超.低水烃比型负压乙苯脱氢催化剂反应动力学研究及反应工艺剖析[D].上海:华东理工大学,2014
STUDYONREACTIONCONDITIONSANDKINETICSOFDEHYDROGENATIONOFETHYLTOLUENETOMETHYLSTYRENEWTBZ
Hao Mingkun1, Li Ruijiang1, Zhu Xuedong1, Zhuo Chao2, Ni Yanhui1, Lu Hang1
(1.LargeIndustrialReactorEngineeringResearchCenteroftheMinistryofEducation,EastChinaUniversityofScienceandTechnology,Shanghai200237; 2.NanjingRefineryCo.Ltd.)
With the industrial dehydrogenation catalyst,the ethyl toluene dehydrogenation was conducted at 580—635 ℃,30—101 kPa,water/ethyl toluene mass ratio of 2.0—4.0,and space velocity ranging from 0.5—1.5 h-1.The results indicated that the conversion of ethyl toluene increases as the temperature rises while the selectivity for methylstyrene is the opposite;increasing water/methyl toluene ratio leads to higher conversion and selectivity;the effect of reducing LHSV is the same as increasing temperature,while higher reaction pressure is in favor of both conversion and selectivity.The most optimal reaction conditions are:50 kPa,620 ℃,the water-to-reactant ratio of 2.0 and the LHSV of 0.5 h-1. The kinetics of dehydrogenation reaction of ethyl toluene was studied by using experimental data.Three possible ethyl toluene dehydrogenation reaction kinetics models were proposed in the premise of assumptive and simplified reaction network and based on the different reaction mechanisms.After the statistical test for 3 models,the two-site adsorption model was chosen as the best model,and then the parameters of the model were determined.The results can be used for the reactor design and the selection of optimal operating conditions.
ethyl toluene; methylstyrene; dehydrogenation; reaction process; reaction kinetics
2017-06-05;修改稿收到日期2017-08-24。
郝明坤,硕士研究生,化学工艺专业,研究方向:催化反应工程及化工工艺。
李瑞江,E-mail:ruijiangli@ecust.edu.cn。
