黄连素治疗阿尔兹海默病的研究进展
2017-12-06高子蕊北京大学医学部基础医学院北京100191
高子蕊,初 明 (北京大学医学部基础医学院,北京100191)
黄连素治疗阿尔兹海默病的研究进展
高子蕊,初 明 (北京大学医学部基础医学院,北京100191)
黄连素,又称小檗碱,是从毛茛科黄连属植物黄连等根茎中提取的一种天然的异喹啉类生物碱,广泛应用于胃肠道感染、糖尿病和便秘等的治疗.此外,已经有众多证据表明黄连素对阿尔兹海默病(AD)的发病过程有显著的抑制作用.因此,小檗碱可能会成为一种改善甚至治愈阿尔兹海默病的新手段.本研究将讨论黄连素在AD进程中的药理学机制,包括抑制Aβ形成,延缓氧化应激和神经炎症,减弱Tau毒性和降低酶的活性等几个方面.
黄连素;阿尔兹海默病;药理机制
0 引言
阿尔兹海默病(Alzheimer's disease,AD)是一种进展性的退行性神经病变.统计结果显示,全世界约有4400万人患有痴呆,其中 AD占 50%~75[1].目前,该病在美国影响着超过500万人的健康,预计到2050年,每33秒就有一例新的AD病例发病,即每年新发病例近百万例,预计总发病率将达到1380万[2].AD的发病机制仍不清楚,但现普遍认为是由淀粉样蛋白Aβ的积聚引起的,原因是Aβ的过量产生和或其清除机制的失效.在淀粉样变性过程中,位于脂筏的淀粉样前体蛋白(amyloid precursor protein,APP)相继被 β-分泌酶 1(β-site APP cleaving enzyme1,BACE1)和γ-分泌酶裂解产生Aβ(最常见的残基亚型是 Aβ40和 Aβ42)[3].Aβ 会产生多种病理效应.其一,具有α-螺旋结构的可溶性Aβ转化为不溶性β-折叠片的纤维形式,最终会形成参与构成老年斑(Senile Plaques, SP)的致密淀粉样蛋白核[4].致密斑块中不溶性Aβ,也可以再次转化为可溶性Aβ并释放到周围脑中[5].其二,Aβ单体可以自聚集形成非斑块 Aβ 寡聚物(Aβ oligomers,AβO),也称为淀粉样蛋白衍生的可扩散配体(Aβ-derived diffusible ligands,ADDL),它能结合神经元的表面受体,并改变其突触的结构,从而破坏神经元通讯功能[6].同时,可溶性AβO可以影响突触间隙中的重要神经递质谷氨酸[7],产生兴奋性突触传递的长时程抑制(long time depression, LTD)效应[8],并诱导 AD 患者脑中突触的神经递质受体(如:nAChR)内化和抑制[9].其三,可溶性AβO可促进tau的过度磷酸化[10],进而破坏其调节轴突运输的正常功能,并导致神经原纤维缠结(neurofibrillary tangles, NFTs)的形成,引起认知紊乱[9].最后,研究[11-14]发现,可溶性 Aβ 寡聚体能够在AD的进展过程中诱导氧化应激,促进AD的进展过程.
黄连为毛茛科黄连属植物黄连、三角叶黄连或云连的干燥根茎.中国现存最早的药学专著《神农本草经》描述黄连的药性为“味苦,寒.主治热气……久服使人不忘”.从黄连中提取到的有效成分为黄连素,是一种天然的异喹啉类生物碱,又称小檗碱.黄连素的作用十分广泛,常用于抗感染,糖尿病、高脂血症、动脉粥样硬化的治疗等.近年研究发现,黄连素对包括AD在内的神经系统疾病亦有效果.本研究将总结近年来黄连素在治疗AD中的研究情况(图1),从以下几个方面阐述黄连素治疗AD的基础机制.
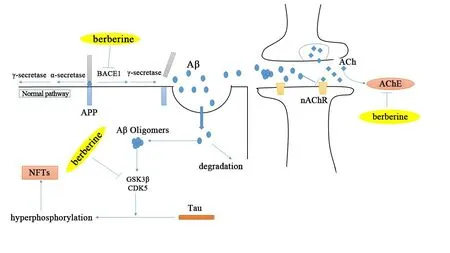
图1 黄连素治疗AD的可能机制
1 黄连素作用于淀粉样蛋白Aβ的致病途径
最近的研究表明黄连素治疗AD可能是通过减少Aβ的产生实现的.体外研究[15]表明,黄连素通过阻断磷酸肌醇3-激酶/蛋白激酶B和促分裂原抑制Aβ诱导的白细胞介素-6和单核细胞趋化蛋白-1的产生,并下调环氧化酶-2和一氧化氮合酶的表达,激活原发性小胶质细胞和BV2细胞中的蛋白激酶信号通路.
Durairajan等[16]证明了黄连素在 AD转基因小鼠模型中能作用于淀粉样蛋白Aβ病理过程,抑制神经胶质的增生和改善认知障碍.Asai等[17]发现在一定浓度范围内黄连素使淀粉样蛋白Aβ水平降低,调节在神经胶质瘤H4细胞(稳定表达典型APP)中的APP加工,而没有细胞毒性.Zhu等[18]报道,黄连素通过抑制HEK293细胞中ERK1/2通路的激活而抑制BACE的表达,从而降低Aβ40/42的产生.目前,黄连素减少Aβ的产生的具体机制仍不清楚.
2 黄连素作用于tau的致病途径
众所周知,NFTs是AD的特征性神经损伤的病理表现,它们由高度磷酸化的微管相关蛋白tau组成.tau的过度磷酸化使其失去调节轴突运输的正常功能,并导致NFTs和可溶性tau的形成.据报道[19],黄连素抑制由钙调蛋白A诱导的tau过度磷酸化和其诱导产生的细胞毒性,进而减少其对神经母细胞瘤-2a细胞轴突运输的损害.此外,有学者[20]发现在小鼠模型中,黄连素使钙调蛋白 A诱导的 tau在Ser198/199/202,Ser396,Ser404,Thr205 和 Thr231 位点的磷酸化显著减少,同时还有助于恢复磷酸蛋白2A的活性,并限制GSK-3β的活化,进一步抑制GSK-3β对tau的Tyr216和Ser9位点的磷酸化作用.
3 黄连素抑制AD中的氧化应激
一般认为氧化应激在AD发病中扮演重要角色.越来越多的证据表明黄连素可以抑制大脑和中枢神经系统中氧化应激的过程.最近的研究[21]证明,黄连素可以通过调节神经递质,影响细胞代谢,对抗氧化应激和神经炎症等多种途径治疗老年痴呆.
过去十年中对AD的发病机理进行了广泛的研究,其中一个十分重要的致病特点是氧化应激可能会引发一个与活动性的、自我进展性的慢性神经炎症.而慢性神经炎症会进一步促进氧化应激的形成.最后,这个恶性循环可能导致AD中不可逆的神经元功能障碍和细胞死亡.Aβ的产生过程中有两种重要的蛋白水解酶参与——β-分泌酶和 γ-分泌酶.氧化应激效应可能上调β-分泌酶和γ-分泌酶活性进而促进Aβ产生.此外,细胞内Aβ单体的积聚和NFT的形成可能显著促进氧化炎症过程,这一恶性循环最终将引起严重的神经损害.
许多研究都显示黄连素抑制氧化应激的作用将有益于多种临床疾病.实验[22]证明,黄连素能够猝灭超氧化物阴离子和一氧化氮,并对高反应性过氧亚硝酸盐和羟基自由基发挥自由基清除活性.除了其高自由基清除效应,黄连素表现出强烈的Fe2+螯合活性[23].有研究[24]表明黄连素可以通过抑制炎症反应相关物,下调和上调GPx和CuZn超氧化物歧化酶的表达而产生抗氧化作用,抑制RhoA/ROCK信号传导通路的活化,改善氧化剂-抗氧化剂平衡以实现对氧化应激的抑制,这一作用也使黄连素成为糖尿病的新候选药物.
有研究[25]证明黄连素的氧化应激作用在不同神经退行性疾病如AD、帕金森病和亨廷顿舞蹈病中均表现出治疗潜力.Luo等[26]的研究发现黄连素通过减少丙二醛和活性氧的产生对大鼠皮层神经元中Aβ-诱导的细胞死亡起保护作用.综上所述,黄连素抗氧化应激的作用可能在包括AD在内的多种疾病中得到应用.
4 黄连素延迟AD中的神经炎症的产生
神经炎症在AD的致病过程中发挥着十分重要的作用.与此同时,许多观察表明黄连素可能通过抑制神经炎症的恶性发展而延迟,甚至逆转AD的发生.
AD的发病过程与炎症息息相关.第一,炎症引起的神经功能紊乱通过促进 Aβ产生和清除的失败而导致Aβ的过量堆积.其次,支持性证据表明,AD中的炎症诱导NFT的形成,这是由于tau的过度异常磷酸化的增加导致的.第三,各种研究支持神经性炎症和氧化应激之间的恶性循环是AD中的重要致病特征,这种循环可能会放大Aβ的病理堆积和tau的异常磷酸化过程[3].
有多个文献指出黄连素可以通过降低神经激肽的释放而在各种神经退行性疾病中具有治疗潜力.基于大量基础研究[27],认为Aβ的堆积和tau高磷酸化是脑中神经激肽合成的驱动因素.因此,可以推断黄连素减缓Aβ堆积和tau高度磷酸化的过程,然后降低AD脑中神经炎发生的风险.然而,在通过双侧注射Aβ到大鼠海马中而建立的AD大鼠模型中,通过胃注射氯化黄连素(50 mg/kg)可以改善空间记忆损伤,但增加IL-1β的表达,诱导一氧化氮合酶(inducible nitric oxide synthase, iNOS)的产生[28],表明黄连素在炎症反应中的效应可能是双面的.总体而言,仍然有必要明确黄连素在AD的神经炎症中的确切作用.
5 黄连素抑制乙酰胆碱酯酶(acetylcholinesterase,AChE)和丁酰胆碱酯酶(butyrylcholinesterase,BChE)的活性
AChE主要存在于中枢神经系统中,其主要作用是催化神经递质乙酰胆碱(ACh)水解为胆碱.这个过程可以将激活的胆碱能神经元返回到其静息状态.AD的发病机制与大脑 ACh缺乏有关[29].因此,AChE是AD的重要致病因子,并且很多对抗AD的药物研究筛选试剂集中在AChE抑制剂上,用以减轻胆碱能缺乏和改善神经传递[29].此外,BChE在病因学中也起重要作用.已经发现,当在组织培养中将BChE加入Aβ时,Aβ神经毒性被放大[30].
许多研究证明黄连素对AChE具有抑制作用,Xiang等[31]探讨了黄连素抑制AChE的分子机制,他们提出,黄连素与AChE的结合主要是由有利的熵增加所驱动,该结合是以两种分子的相互作用为主,小的构象变化为辅而形成.此外,黄连素也被发现是BChE抑制剂[32].因此,黄连素是AChE和 BChE的双重抑制剂.
6 黄连素减少了危险因素在AD中的作用
许多结果表明认知衰退和心血管高危因素如年龄、心脏病、中风、高同型半胱氨酸血症、高血压、糖尿病和肥胖之间存在密切联系.因此,理论上来说,降低这些风险因素可以降低认知衰退和AD的风险[33].
众所周知,所有这些血管风险因素都有助于动脉粥样硬化性血管疾病的进展和动脉粥样硬化斑块的形成.研究[34]表明黄连素通过激活AMPK/mTOR信号通路促进自噬,抑制炎症,从而产生抗动脉粥样硬化的作用.流行病学研究[35]表明,服用降胆固醇药物与AD的发生率降低具有相关性.高胆固醇血症主要通过影响血脑屏障通透性,导致脑内胆固醇代谢异常来增加AD风险.此外,细胞膜上的胆固醇可促进APP与脂筏的结合,随后,这些APP将通过淀粉样蛋白代谢途径分解成 Aβ[36].Wang 等[37]的研究表明黄连素可能通过抑制胆固醇的肠道吸收干扰肠内胆固醇胶束化过程,并减少肠细胞胆固醇摄取和分泌来降低血清胆固醇的水平.因此,黄连素的这种效应可能对AD的进展过程有抑制作用.
越来越多的证据[38]表明糖尿病是AD的危险因素,很可能与大脑中胰岛素信号的损伤相关.最近报道[39]的黄连素在链脲霉素诱导的糖尿病大鼠模型中有改善记忆功能障碍的有益效果.研究[40]发现黄连素治疗可以增加链脲菌素诱导的糖尿病大鼠体内胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)的分泌.体内和体外实验[41]证明黄连素可以调节GLP-1释放,可能有助于解释其抗AD潜能.
7 黄连素具有单胺氧化酶(monoamine oxidase,MAO)抑制活性
在人类中有两种MAO同种型,命名为MAO-A和MAO-B.MAO-A抑制剂已被证明是有效的抗抑郁药,而MAO-B抑制剂是对抗包括AD和帕金森病在内的神经变性疾病的潜在化合物[42].Riederer等[43]研究了在MAO-B抑制剂的AD中的神经保护作用的机制.有研究[44]利用LED荧光光谱法测定了黄连素抑制下单胺氧化酶B活性的失活.Kulkarni等[45]的研究表明黄连素具有抑制单胺氧化酶-A[参与去甲肾上腺素和5-羟色胺(5-HT)降解的酶]的活性,进而发挥抗抑郁效应.因此,黄连素的MAO抑制效应可能也是其阻止AD进展过程的原因之一.
8 结语
阿尔兹海默病是一种进展性的神经退行性疾病,是威胁老年人健康的“四大杀手”之一,目前暂时没有有效的药物来逆转或终止它的发生和发展.因此,阿尔兹海默病不仅让数以万计的患者承受着痴呆的痛苦,同时也让众多的家庭及整个社会承受着巨大的财政负担.黄连素来源于传统的中草药,《神农本草经》中记载为“久服使人不忘”.近年来,黄连素对于阿尔兹海默病的多种作用机制逐渐被发现和报道,其中包括抑制Aβ的沉积,抑制胆碱酯酶、单胺氧化酶的作用,延缓神经炎症和氧化应激的发生等.也许不久的将来,黄连素及其类似物将成为逆转甚至治愈阿尔兹海默病的良药.
[1] Prince M, Albanese E, Guerchet M, et al.World alzheimer report 2014: dementia and risk reduction.an analysis of protective and modifiable factors[J].J Exp Med, 2014, 46(6):1007-1029.
[2] Alzheimer's Association.2016 Alzheimer's disease facts and figures[J].Alzheimers Dement,2016,12(4):459-509.
[3] Cai Z, Wang C, Yang W.Role of berberine in Alzheimer's disease[J].Neuropsychiatr Dis Treat,2016,12:2509-2520.
[4] Hardy J.The amyloid hypothesis for Alzheimer's disease: a critical reappraisal[J].J Neurochem,2009,110(4):1129-1134.
[5] Laduron S, Deplus R, Zhou S, et al.MAGE-A1 interacts with adaptor SKIP and the deacetylase HDAC1 to repress transcription[J].Nucleic Acids Res,2004,32(14):4340-4350.
[6] Dal Prà I, Chiarini A, Gui L, et al.Do astrocytes collaborate with neurons in spreading the “ infectious” aβ and Tau drivers of alzheimer's disease[J].Neuroscientist,2015,21(1):9-29.
[7] Feng Y, Gao J, Yang M.When MAGE meets RING: insights into biological functions of MAGE proteins[J].Protein Cell,2011,2(1):7-12.
[8] Kim JH, Anwyl R,Suh YH, et al.Use-dependent effects of amyloidogenic fragments of(beta)-amyloid precursor protein on synaptic plasticity in rat hippocampus in vivo[J].J Neurosci,2001,21(4):1327-1333.
[9] Ittner LM, Götz J.Amyloid-β and tau--a toxic pas de deux in Alzheimer's disease[J].Nat Rev Neurosci,2011,12(2):65-72.
[10] Cedazo-Mínguez A, Popescu BO, Blanco-Millán JM, et al.Apolipoprotein E and beta-amyloid(1-42) regulation of glycogen synthase kinase-3beta[J].J Neurochem,2003,87(5):1152-1164.
[11] Harris ME, Carney JM, Cole PS, et al.beta-Amyloid peptide-derived,oxygen-dependent free radicals inhibit glutamate uptake in cultured astrocytes: implications for Alzheimer's disease[J].Neuroreport,1995,6(14):1875-1879.
[12] Greenough MA, Camakaris J, Bush AI.Metal dyshomeostasis and oxidative stress in Alzheimer's disease[J].Neurochem Int,2013,62(5):540-555.
[13] Young KJ, Bennett JP.The mitochondrial secret(ase) of Alzheimer's disease[J].J Alzheimers Dis,2010,20(Suppl 2):S381-S400.
[14] Galimberti D, Ghezzi L,Scarpini E.Immunotherapy against amyloid pathology in Alzheimer's disease[J].J Neurol Sci,2013,333(1-2):50-54.
[15] Jia L, Liu J, Song Z, et al.Berberine suppresses amyloid-beta-induced inflammatory response in microglia by inhibiting nuclear factor-kappaB and mitogen-activated protein kinase signalling pathways[J].J Pharm Pharmacol,2012,64(10):1510-1521.
[16] Durairajan SS, Liu LF, Lu JH, et al.Berberine ameliorates β-amyloid pathology, gliosis, and cognitive impairment in an Alzheimer's disease transgenic mouse model[ J].Neurobiol Aging, 2012,33(12):2903-2919.
[17] Asai M,Iwata N,Yoshikawa A,et al.Berberine alters the processing of Alzheimer's amyloid precursor protein to decrease Abeta secretion[J].Biochem Biophys Res Commun,2007,352(2):498-502.
[18] Zhu F, Wu F, Ma Y, et al.Decrease in the production of β-amyloid by berberine inhibition of the expression of β-secretase in HEK293 cells[J].BMC Neurosci,2011,12:125.
[19] Liu X, Zhou J, Abid MD, et al.Berberine attenuates axonal transport impairment and axonopathy induced by Calyculin A in N2a cells[J].PloS ONE,2014,9(4):e93974.
[20] Yu G, Li Y,Tian Q,et al.Berberine attenuates calyculin A-induced cytotoxicity and Tau hyperphosphorylation in HEK293 cells[J].J Alzheimers Dis,2011,24(3):525-535.
[21] Huang M, Chen S, Liang Y, et al.The Role of Berberine in the Multi-Target Treatment of Senile Dementia[J].Curr Top Med Chem,2016,16(8):867-873.
[22] Siow YL, Sarna L, O K.Redox regulation in health and disease--Therapeutic potential of berberine[J].Food Research International,2011,44(8):2409-2417.
[23] Shan WJ, Huang L, Zhou Q, et al.Synthesis, biological evaluation of 9-N-substituted berberine derivatives as multi-functional agents of antioxidant, inhibitors of acetylcholinesterase, butyrylcholinesterase and amyloid-β aggregation[J].Eur J Med Chem,2011,46(12):5885-5893.
[24] Yin J, Xing H, Ye J.Efficacy of berberine in patients with type 2 diabetesmellitus[J].Metab Clin Exp,2008,57(5):712-717.
[25] Kumar A, Ekavali, Chopra K, et al.Current knowledge and pharmacological profile of berberine: An update[ J].Eur J Pharmacol,2015,761:288-297.
[26] Luo T,Jiang W,Kong Y,et al.The protective effects of jatrorrhizine on β-amyloid (25-35)-induced neurotoxicity in ratcortical neurons[J].CNS Neurol Disord Drug Targets,2012,11(8):1030-1037.
[27] Lathe R, Sapronova A, Kotelevtsev Y.Atherosclerosis and Alzhei-mer--diseases with a common cause? Inflammation, oxysterols,vasculature[J].BMC Geriatr,2014,14:36.
[28] Zhu F, Qian C.Berberine chloride can ameliorate the spatial memory impairment and increase the expression of interleukin-1beta and inducible nitric oxide synthase in the rat model of Alzheimer's disease[J].BMC Neurosci,2006,7:78.
[29] Galimberti D, Scarpini E.Old and new acetylcholinesterase inhibitors for Alzheimer's disease[J].Expert Opin Investig Drugs,2016,25(10):1181-1187.
[30] Diamant S, Podoly E, Friedler A, et al.Butyrylcholinesterase attenuates amyloid fibril formation in vitro[J].Proc Natl Acad Sci U S A,2006,103(23):8628-8633.
[31] Xiang J, Yu C, Yang F, et al.Conformation-activity studies on the interaction of berberine with acetylcholinesterase:Physical chemistry approach[J].Progress in Natural Science, 2009, 19 (12):1721-1725.
[32] Jung HA, Min BS, Yokozawa T, et al.Anti-Alzheimer and antioxidant activities of Coptidis Rhizoma alkaloids[J].Biol Pharm Bull,2009,32(8):1433-1438.
[33] Kumar A, Ekavali, Mishra J, et al.Possible role of P-glycoprotein in the neuroprotective mechanism of berberine in intracerebroventricular streptozotocin-induced cognitive dysfunction[J].Psychopharmacology(Berl),2016,233(1):137-152.
[34] Liu WH,Hei ZQ,Nie H,et al.Berberine ameliorates renal injury in streptozotocin-induced diabetic rats by suppression of both oxidative stress and aldose reductase[J].Chin Med J(Engl),2008,121(8):706-712.
[35] Wolozin B, Kellman W, Ruosseau P, et al.Decreased prevalence of alzheimer disease associated with 3-Hydroxy3-Methyglutaryl Coenzyme A Reductase Inhibitors[J].Arch Neurol,2000,57(10):1439-1443.
[36] Xue-Shan Z, Juan P, Qi W, et al.Imbalanced cholesterol metabolism in Alzheimer's disease[J].Clin Chim Acta,2016,456:107-114.
[37] Wang Y, Yi X, Ghanam K, et al.Berberine decreases cholesterol levels in rats through multiple mechanisms,including inhibition of cholesterol absorption[J].Metab clin Exp,2014,63(9):1167-1177.
[38] Akter K, Lanza EA, Martin SA, et al.Diabetes mellitus and Alzheimer's disease: shared pathology and treatment[J].Br J Clin Pharmacol,2011,71(3):365-376.
[39] Bhutada P,Mundhada Y,Bansod K,et al.Protection of cholinergic and antioxidant system contributes to the effect of berberine ameliorating memory dysfunction in rat model of streptozotocin-induced diabetes[J].Behav Brain Res,2011,220(1):30-41.
[40] Perry T, Greig NH.The glucagon-like peptides: a new genre in therapeutic targets for intervention in Alzheimer's disease[J].J Alzheimers Dis,2002,4(6):487-496.
[41] Lu SS, Yu YL, Zhu HJ, et al.Berberine promotes glucagon-like peptide-1(7-36) amide secretion in streptozotocin-induced diabetic rats[J].J Endocrinol,2009,200(2):159-165.
[42] Riederer P, Lachenmayer L, Laux G.Clinical applications of MAO-inhibitors[J].Curr Med Chem,2004,11(15):2033-2043.
[43] Riederer P, Danielczyk W, Grünblatt E.Monoamine Oxidase-B Inhibition in Alzheimer's disease[J].Neurotoxicology,2004,25(1-2):271-277.
[44] Castillo J, Hung J, Rodriguez M, et al.LED fluorescence spectroscopy for direct determination of monoamine oxidase B inactivation[J].Anal Biochem,2005,343(2):293-298.
[45] Kulkarni SK, Dhir A.On the mechanism of antidepressant-like action of berberine chloride[J].Eur J Pharmacol,2008,589(1-3):163-172.
Research progress of berberine in the treatment of Alzheimer's disease
GAO Zi-Rui,CHU Ming
School of Basic Medical Sciences,Peking University Health Science Center, Beijing 100191, China
Berberine, a natural isoquinoline alkaloids that extracted from the Rhizoma coptidis and other rhizomes of the Ranuculaceae family,is widely used in the treatment of gastrointestinal infections, diabetes and constipation and so on.In addition,a lot of evidence proves that berberine has a significant inhibitory effect on the pathology process of Alzheimer's disease(AD).As a result, berberine may be considered as a new potential therapeutic approach to inprove or even cure AD.This review attempts to discuss the pharmacological basis,through which berberine may affect the progression of AD,including inhibiting the formation of Aβ, retarding oxidative stress and neuroinflammation, weakening Tau toxicity, and decreasing enzyme activity and other aspects.
berberine; Alzheimer's disease; pharmacological mechanism
R285
A
2095-6894(2017)11-07-05
2017-09-10;接受日期:2017-09-30
国家自然科学基金(81603119);北京市自然科学基金(71-62099);北京市重点学科基础医学学科建设项目(BMU20110254)
高子蕊.研究方向:免疫药理.
E-mail:17888837859@ 163.com
初 明.博士,副教授,硕导.研究方向:炎症与肿瘤.
E-mail:famous@ bjmu.edu.cn
