纵横对比看平衡
2017-12-05王洪升
王洪升
一个化学反应,我们最关心的三个问题是反应进行的方向、反应进行的快慢和反应进行的程度。高中化学反应研究的对象主要是有气体参与的可逆反应和溶液中溶质的行为。提起溶液,必绕不开水,那纯水微观是如何表征的呢?向水中加入弱电解质(弱酸、弱碱),溶质在水中又是如何表征的呢?向水中加入盐(强酸强碱盐、强酸弱碱盐、弱酸强碱盐、弱酸弱碱盐),溶质在水中又是如何表征的呢?
本文深度挖掘溶液中的三大平衡,即水的电离平衡、弱电解质的电离平衡和盐的水解平衡,希望对大家的复习有所帮助。
一、横向研究——探讨各自平衡
1.水的电离平衡
例1 将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性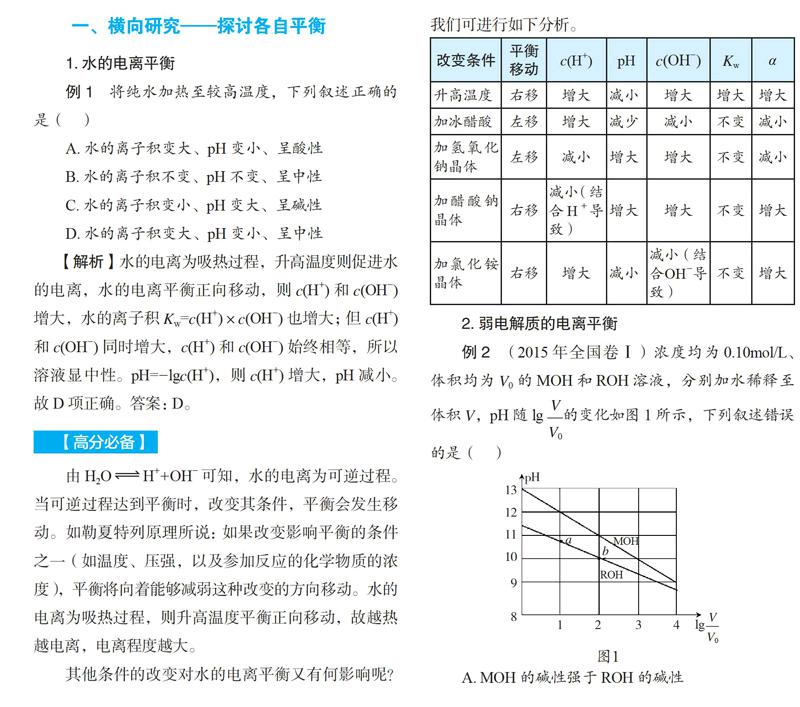
【解析】水的电离为吸热过程,升高温度则促进水的电离,水的电离平衡正向移动,则c(H+)和c(OH-)增大,水的离子积Kw=c(H+)×c(OH-)也增大;但c(H+)和c(OH-)同时增大,c(H+)和c(OH-)始终相等,所以溶液显中性。pH=-lgc(H+),则c(H+)增大,pH减小。故D项正确。答案:D。
【高分必备】
由H2OH++OH- 可知,水的电离为可逆过程。当可逆过程达到平衡时,改变其条件,平衡会发生移动。如勒夏特列原理所说:如果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的方向移动。水的电离为吸热过程,则升高温度平衡正向移动,故越热越电离,电离程度越大。
其他条件的改变对水的电离平衡又有何影响呢?我们可进行如下分析。
2.弱电解质的电离平衡
例2 (2015年全国卷Ⅰ)浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图1所示,下列叙述错误
的是( )
A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则
增大
【解析】由图象可知,起始时0.1mol/L的MOH溶液pH=13,则MOH为强碱,在溶液中完全电离,0.1mol/L的ROH溶液pH约为11.5,则ROH为弱碱,在溶液中部分电离,电离程度很小。A项中,MOH为强碱,ROH为弱碱,则强碱碱性强于弱碱,故A项正确;B项横坐标为lg,横坐标值越大,意味着溶液的总体
积越大,加水越多,弱电解质在水溶液中越稀越电离,即b点ROH碱的物质的量浓度小于a点ROH碱的物质的量浓度,故b点电离程度大于a点,B项正确;C项加水无限稀释,则溶液的碱性接近水,故无限稀释c(OH-)趋近于10-7mol/L,C项正确;D项当lg=2时,
两溶液同时升高温度,由于MOH为强碱,溶液中M+浓度不变,但ROH为弱碱,升高温度,促进ROH的电离,则c(R+)增大,因此比值减小,故D项错误。
答案:D。
【高分必备】
弱电解质的电离为可逆过程,当可逆过程达到平衡时,改变其条件,平衡会发生移动。弱电解质的电离为吸热过程,则升高温度平衡正向移动,故越热越电离,电离程度越大。弱电解质的电离为微粒数目增多的反应,加水稀释相当于气体反应扩大容器体积从而导致减压,平衡将向微粒数目增多的反应移动,故越稀越电离,电离程度越大。
下面以CH3COOHH++CH3COO- 为例,研究其他条件的改变对弱电解质的电离平衡的影响。
【高分必备】
盐的水解为可逆反应,当可逆反应达到平衡时,改变其条件,平衡会发生移动。盐的水解为吸热反应,则升高温度平衡正向移动,故越热越水解,水解程度越大。盐的水解为微粒数目增多的反应,加水稀释相当于气体反应扩大容器体积,从而导致减压,平衡将向微粒数目增多的反应移动,故越稀越水解,水解程度越大。
下面以CH3COO-+H2OCH3COOH+OH- 为例,研究其他条件的改变对盐的水解平衡的影响。
二、纵向研究——探讨三大平衡关系
1.概念表述
水的电离平衡:水是一种极弱的电解质,能发生微弱的电离。在一定条件下,水电离产生的H+和OH-又会结合生成水,当电离速率与结合速率相等时,则水的电离达到平衡,即水的电离平衡。
弱电解质的电离平衡:在一定条件下,当弱电解质电离成离子的速率和离子结合成弱电解质分子的速率相等时,溶液中各分子和离子的浓度都不再发生变化,则电离达到平衡状态,即弱电解质的电离平衡。
盐的水解平衡:在一定条件下,由盐电离出来的弱酸根阴离子或弱碱阳离子与水电离出来的H+或OH-結合生成弱电解质的反应,当结合速率与电离速率相等时,则可水解的盐达到水解平衡状态,即盐的水解平衡。
记忆技巧:一个水分子使另一个水分子解离,从而达到平衡为水的电离平衡;一个水分子使弱电解质解离,从而达到平衡为弱电解质的电离平衡;弱酸根阴离子或弱碱阳离子使水分子解离,从而达到平衡为盐的水解平衡。endprint
