谷胱甘肽比率荧光探针分子的设计合成及其光谱性能
2017-12-05吴红梅
吴红梅, 郭 宇
(辽宁工业大学 化学与环境工程学院, 辽宁 锦州 121001)
谷胱甘肽比率荧光探针分子的设计合成及其光谱性能
吴红梅, 郭 宇*
(辽宁工业大学 化学与环境工程学院, 辽宁 锦州 121001)
将喹啉和丹磺酰胺两种荧光基团同时引入配体L1,利用L1与锌离子自组装构筑三核锌有机-金属大环化合物H-1(比率荧光探针),实现了对生物分子谷胱甘肽(GSH)的有效识别。利用紫外光谱、荧光光谱、1H NMR、ESI-MS等表征方法研究了H-1对生物分子谷胱甘肽(GSH)的光谱识别作用。紫外滴定光谱表明,当向H-1中加入谷胱甘肽分子后,425 nm处的吸收峰强度降低,320 nm处的吸收峰强度增大,等吸收点为355 nm。利用320 nm处的吸光度值模拟计算平衡常数,lgK为4.03±0.11,说明H-1与GSH形成了1∶1的包合物。荧光光谱分析表明,当向H-1中加入GSH后,以340 nm光激发,波长为513 nm处丹磺酰胺的荧光强度下降,并且发生红移,而396 nm处喹啉基团的荧光强度增大。利用喹啉基团与丹磺酰胺基团荧光发射峰强度变化的比值可以精准检测谷胱甘肽分子,检测限可达到2.5×10-6mol·L-1。
谷胱甘肽; 比率荧光探针; 三核锌大环化合物; 识别
1 引 言
谷胱甘肽(GSH)是一种在细胞内含量较高的非蛋白质巯基化合物,是由半胱氨酸、谷氨酸和甘氨酸组成的小分子肽,作为体内重要的自由基清除剂和抗氧化剂,能结合重金属、自由基等有害物质,将其排出体外,在人体中扮演着非常重要的角色。因此,谷胱甘肽含量的变化可与许多疾病相关联,如神经组织退化、癌症、牛皮癣、艾滋病、糖尿病等[1-3]。研究对GSH的识别与传感,是生物化学和药物化学领域的重要课题,可以为众多疾病的致病性检测提供前提,进而可以更充分地了解疾病的发生、发展等特点,为靶向性治疗疾病提供有力帮助。
近年来,检测GSH的方法主要有液相色谱[4]、量子点[5]、电化学[6]、有机小分子荧光探针[7-9]等,它们应用了GSH分子含有巯基(—SH)的特征,通过与巯基发生特殊反应而实现的。但这些方法在样品处理、运行时间、参数测定等方面具有局限性。荧光光谱检测法可以根据荧光参数(荧光强度、波长、寿命等)的变化实现对微观现象的响应,并将微观信息转变为可视化的光信息表达出来,具有光和化学稳定性强、简便快捷、灵敏度高的优点,能够实现对目标分子的实时监测,在临床医学、化学、生物学、环境等领域已得到广泛应用[10-13]。特别是利用有机-金属大环结构良好的主客体化学性能[14-15],通过大环结构开放的窗口、特定形状和尺寸的空腔,能够允许特定结构的生物分子进入空腔,通过限域的空腔、静电作用、氢键等协同作用实现对目标分子的高灵敏度识别[16-17]。然而,传统的荧光探针根据单一发射波长处荧光强度的变化来检测目标分子,会受到荧光探针分子在微环境中的浓度、检测环境(粘度、温度、pH等)、仪器设备、光源强度的波动、稳定性等影响,不易控制检测结果的精确度。比率荧光探针是用两个荧光团的发射峰强度的比值作为检测信号,在同一检测环境下受干扰的误差可相互抵消,比值不受影响,因此可以得到更加精准的检测结果,不仅有利于分析对客体的识别作用,还可以增加对客体识别的灵敏度和选择性响应范围[18-19]。
本文利用含有喹啉和丹磺酰胺双荧光基团的配体L1(N-(3,5-双(2-((2-奎啉亚甲基)甲酰肼基))苯基)-5-(二甲基氨基)萘-1-磺酰胺)与锌离子自组装构筑有机-金属三元大环化合物H-1(比率荧光探针),利用紫外光谱、荧光光谱、1H NMR、ESI-MS等表征方法研究了H-1对生物分子谷胱甘肽(GSH)的光谱识别作用。
2 实 验
2.1仪器与药品
仪器:荧光光谱测定使用Edinburgh instruments FS-920稳态荧光光谱仪;紫外光谱测定使用HP8453紫外可见光谱仪;电喷雾质谱(ESI-MS)使用HPLC-Q-Tof MS 型质谱仪测定,甲醇为流动相;红外光谱使用Nicolet NEXUS670FT-IR光谱仪测定;C、H、N元素分析使用Vario EL Ⅲ元素分析仪;1H NMR使用Varian INOVA400核磁共振谱仪(TMS为内标)。
药品:丹磺酰氯、2-喹啉甲醛、水合肼、三乙胺、5-氨基间苯二甲酸、氯化亚砜、乙酸乙酯、无水硫酸钠、冰醋酸、甲醇、乙腈、丙酮、乙醇。
2.2实验过程
2.2.1配体L1的合成
合成过程主要包含以下4步,如图1所示:(1)在5-氨基间苯二甲酸(1mmol,0.18g)的水溶液中滴加1mmol三乙胺使其溶解,然后利用恒压漏斗将溶解在10mL丙酮中的丹磺酰氯(1mmol,0.27g)逐滴加入装有5-氨基间苯二甲酸的烧瓶中,室温搅拌24h,除去丙酮,用盐酸将剩下溶液的pH值调至3左右。再用乙酸乙酯进行萃取,有机相用无水Na2SO4干燥,除去溶剂,得到淡黄色固体,即化合物1。(2)称取化合物1(4.83mmol,2g)放入烧瓶中,加入100mL左右的甲醇,然后用恒压漏斗逐滴加入过量的SOCl2,室温搅拌24h,用乙酸乙酯萃取,有机相用无水Na2SO4干燥,除去溶剂,得到黄色粉末,即化合物2。(3)称取化合物2(4.52mmol,2g)放入烧瓶中,加入110mL左右的乙醇溶液及过量的水合肼(80%),回流24h,冷却后得到黄色固体,即化合物3。(4)称取化合物3(4.52mmol,2g)放入烧瓶中,加入110mL左右的甲醇,再向其中加入2-喹啉甲醛(9.50mmol,1.02g),滴加5-6滴冰醋酸,回流24h,产物为浅黄色固体,得到配体L1,产率为76.9%。1H NMR (d6-DMSO)δ:2.80(s,6H,HCH3),7.3(d,1H,J=6.8Hz),7.70(s,4H,J=7.2Hz),7.85(d,2H,J=10.4Hz),8.11(m,5H,J=31.6Hz),8.22(d,2H,J=8.4Hz),8.33(d,1H,J=6.4Hz),8.40(d,1H,J=8.8Hz ),8.50(t,3H,J=17.6Hz),8.59(s,2H),11.29(s,1H,HSO2NH),12.43(s,2H,HCONH)。元素分析: L1(C40H32N8O4S·3H2O):C62.00,H4.94, N14.46;Found:C62.13,H4.86, N14.47。 IR (KBr 压片,cm-1)ν:738(w),790(w),1016(w),1140(s),1320(m),1428(w),1503(m),1599(m),1669(m),3249(w),3437(s)。ESI-MSm/z:755.1([L1+Cl-]),719.2([L1-H+])。
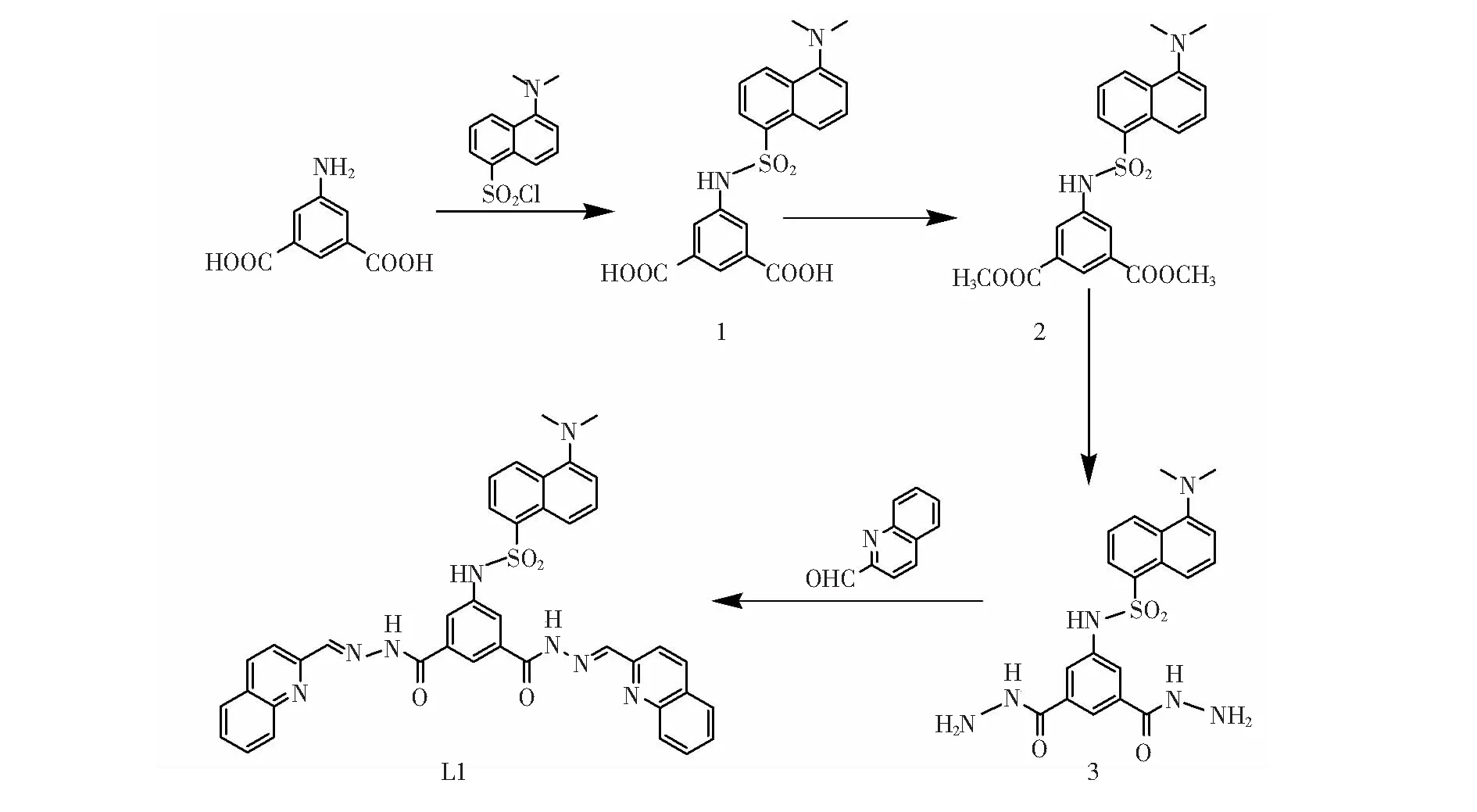
图1 配体L1的合成路线
2.2.2有机-金属(锌)配合物H-1的合成
称取L1(0.30mmol,186.2mg) 和Zn(NO3)26H2O(0.30mmol,89.2mg)溶解在15mL CH3CN/CH3OH (2∶8)溶液中,搅拌30min,再向其中加入过量的NH4PF6,沉淀得到淡黄色固体。ESI-MS测试见图2所示,从图中可以观察到3个峰,在1176.974处的信号对应于物种[Zn3(L1)3-4H+]2+(m/zcalcd:1176.974);在785.3582处的信号对应于物种[Zn3(L1)3-3H+]3+(m/zcalcd:785.3582);在721.2189处的信号对应于物种[ L1+H+]+(m/zcalcd:721.2189)。
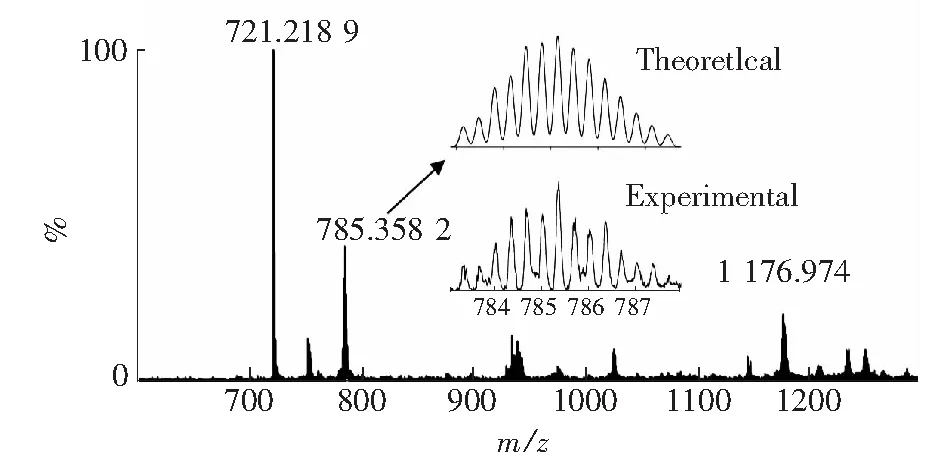
图2 H-1的ESI-MS,溶剂为DMF。
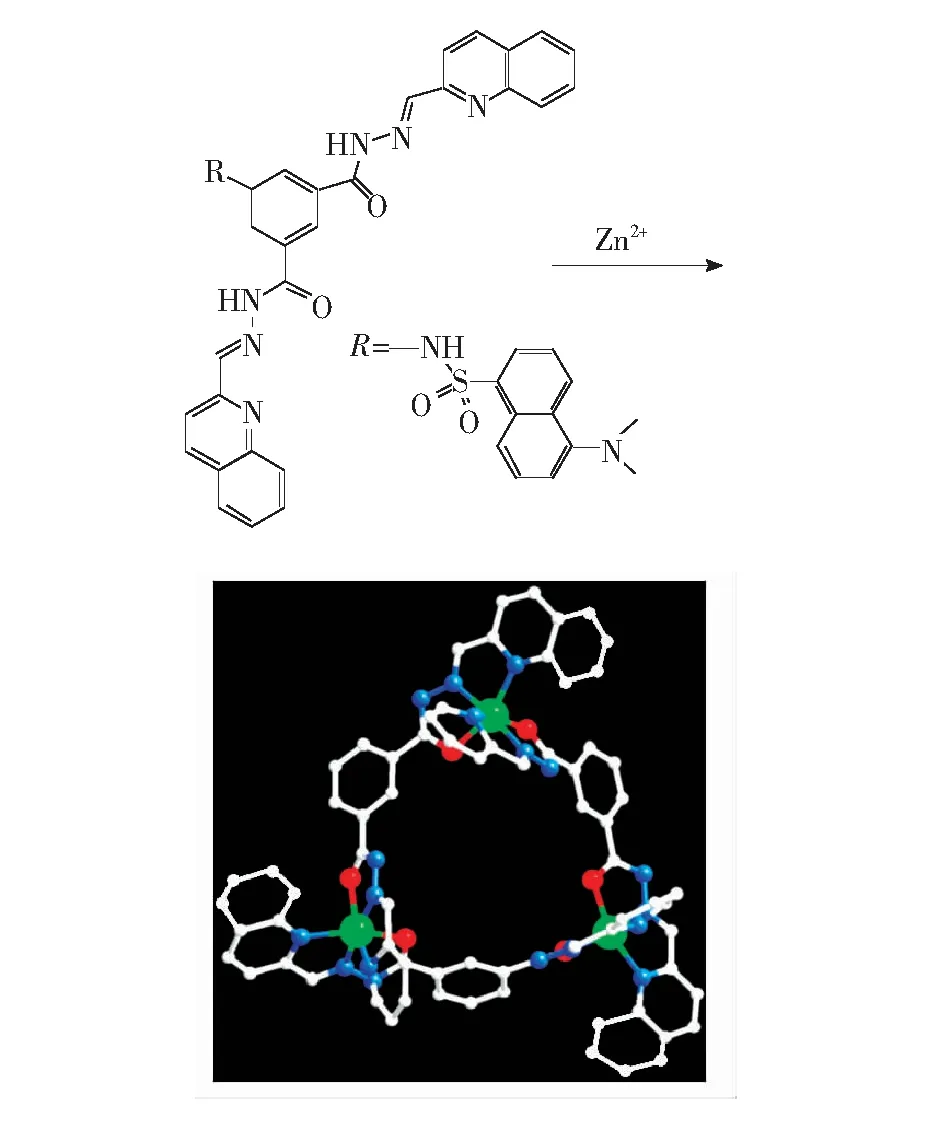
图3 三核锌有机-金属大环H-1的分子结构示意图
配合物H-1的结构:Zn2+与 L1通过双三齿配位点O、N、N单元配位,形成三核锌金属-有机三元大环配合物H-1,如图3所示。
2.3紫外光谱滴定
向比色皿中加入2mL10μmol/L 有机金属大环H-1的H2O/DMF(体积比1∶9)溶液,分别用谷胱甘肽(GSH)及其组成氨基酸(半胱氨酸(Cys)、甘氨酸(Gly)和谷氨酸(Glu))的DMF溶液滴定,测定H-1对谷胱甘肽及其组成氨基酸响应的紫外吸收光谱。
2.4荧光光谱滴定
在石英比色皿中加入2mL10μmol/L 有机金属大环H-1的H2O/DMF(体积比1∶9)溶液,向其中逐步滴加谷胱甘肽的DMF溶液直至饱和,用340nm的光激发,测定350~700nm的荧光发射光谱。
3 结果与讨论
3.1H-1对谷胱甘肽(GSH)紫外光谱测试
图4(a)为H-1对谷胱甘肽(GSH)的紫外响应光谱,当向H-1(10μmol/L)中加入GSH后,425nm处的吸收峰减弱,320nm处吸收峰的强度增加,等吸收点为355nm。通过紫外光谱滴定,以320nm处的吸光度值A320为基准,利用Oringin软件线性拟合计算平衡常数K,如图4(b)所示。
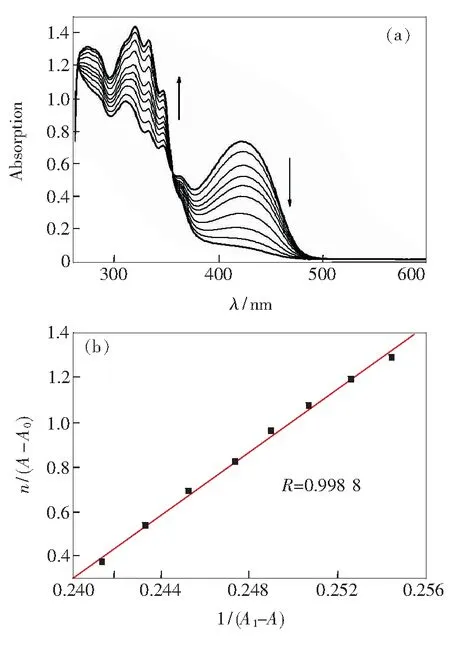
图4(a)向H-1中加入谷胱甘肽的紫外吸收光谱;(b)λ=320nm处吸收的平衡常数计算线性拟合图。
Fig.4UV-Vis titration spectra (a) and the linear fitting of the UV-Vis titration at320nm (b) of H-1upon the addition of GSH
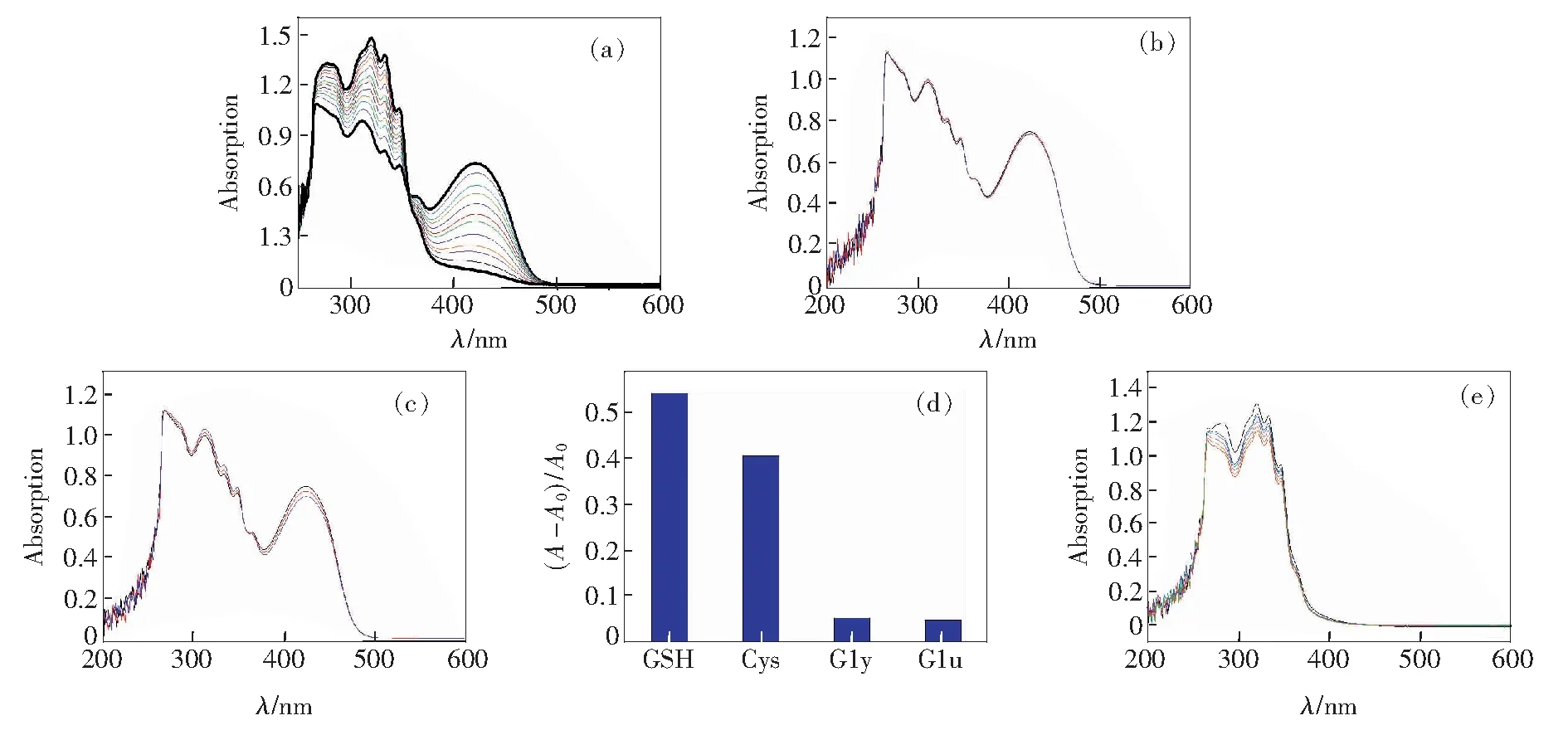
图5向H-1中加入谷胱甘肽组成氨基酸的紫外吸收光谱。 (a) 半胱氨酸;(b) 甘氨酸;(c) 谷氨酸;(d)在H-1中分别加入2倍的谷胱甘肽、半胱氨酸、谷氨酸、甘氨酸时,吸光度(A320)的比较图;(e)向配体L1中加入谷胱甘肽的紫外响应光谱。
Fig.5UV-Vis titration spectra of H-1in the presence of Cys (a), Gly (b), Glu (c), respectively. (d)The absorbance at320nm of H-1obtained by adding two times of GSH, Cys, Gly, Glu, respectively. (e) UV-Vis titration spectra of L1upon addition of GSH.
具体计算过程如下:
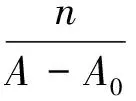
(1)
其中,K为平衡常数,A0为单纯大环化合物H-1的吸光度值,Al为加入过量GSH的最大吸光度值,A为在加入一定量浓度为C0的GSH后的吸光度值,n为加入谷胱甘肽的倍数。
为了清晰地理解H-1识别GSH的过程,又分别测试了H-1对组成GSH的氨基酸(半胱氨酸(Cys)、甘氨酸(Gly)和谷氨酸(Glu))的紫外响应及单纯配体L1对GSH的紫外光谱,见图5。H-1对半胱氨酸(Cys)也有良好的紫外响应,与向H-1中加入GSH时具有相同的光谱变化,加入2倍时体系平衡,如图5(a)所示。利用320nm处的吸光度值A320,模拟计算平衡常数,结果证明H-1与Cys是1∶2包合关系,平衡常数(lgKCys)为8.12±0.10;当向H-1中分别加入10倍谷氨酸(Glu)和10倍甘氨酸(Gly)时,响应很弱,如图5(b)和(c)所示。图5(d)为向单纯配体H-1中分别加入2倍GSH、Cys、Gly、Glu时的紫外吸收光谱比较图。图5(e)为向单纯配体L1中加入GSH的紫外光谱变化,从图中可以看出L1对GSH无响应。以上测试结果证明H-1对谷胱甘肽的响应除了三核锌有机-金属大环H-1所提供的静电、配位、几何学和类似笼状的功能外,还有组成谷胱甘肽的半胱氨酸(—SH)与有机-金属大环的氢键作用。
3.2H-1对谷胱甘肽响应的荧光光谱
三核锌大环化合物H-1结构中含有丹磺酰胺和喹啉两种荧光基团,可以作为比率荧光探针对GSH进行识别检测。当向H-1中加入GSH后,以340nm光激发,丹磺酰胺在波长为513nm处的荧光强度下降,并且发生红移;此时,喹啉基团在396nm处的荧光强度随之升高,如图6所示。这主要是由于丹磺酰胺荧光基团的发射过程是一个从单线态到三线态过程,所以被激发后将自身三线态的能量传递给喹啉基团,导致随着GSH的加入,丹磺酰胺基团的荧光强度下降、喹啉基团的荧光强度增大。F396和F513分别为喹啉基团和丹磺酰胺的特征峰发射强度,利用F396/F513的比值可以实现H-1对谷胱甘肽的比率检测,检测限可达到2.5×10-6mol·L-1。由图7可以看出,随着谷胱甘肽加入量的增加,F396/F513的比值升高,直至平衡。上述测试结果证明,金属有机大环H-1对GSH的识别过程除了大环化合物的限域作用外,还有包合在H-1内部的GSH与H-1上的丹磺酰胺相连的—NH基团和底部三元环的酰胺基团之间的相互作用。
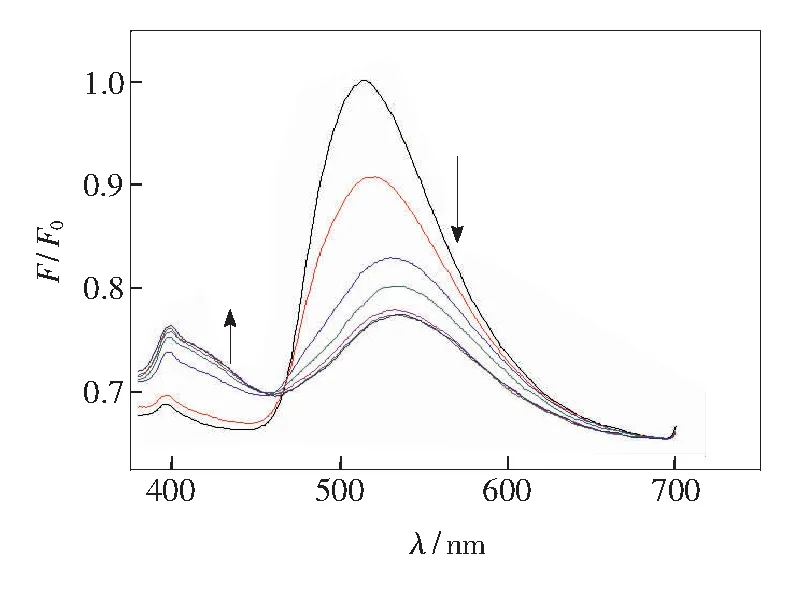
图6 向H-1加入GSH的荧光滴定曲线
Fig.6Fluorescence titration spectra of H-1in the presence of GSH
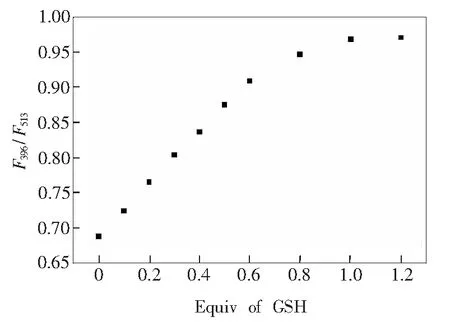
图7 GSH的加入量与F396/F513的比值关系图
Fig.7Relationship between the addition amount of GSH andF396/F513
4 结 论
本文利用具有比率荧光特性的三核锌有机-金属三元大环仿生系统研究了其对生物分子谷胱甘肽的识别作用。结果表明,H-1能够1∶1包合谷胱甘肽,平衡常数lgK为4.03±0.11;通过H-1空腔的限域作用、GSH与H-1氢键作用,实现了对GSH的比率荧光检测,即加入GSH后丹磺酰胺基团的荧光波长发生红移,且荧光强度下降、喹啉基团的荧光强度增大。以喹啉基团与丹磺酰胺基团荧光发射强度的比值为信号精准检测谷胱甘肽分子,具有误差小、灵敏度高的优点。
[1] LU S C. Regulation of hepatic glutathione synthesis: current concepts and controversies [J].FASEBJ., 1999, 13(10):1169-1183.
[2] PASTORE A, FEDERICIA G, BERTINI E,etal.. Analysis of glutathione: implication in redox and detoxification [J].ClinicaChim.Acta, 2003, 333(1):19-39.
[3] GUO Y S, WANG H, SUN Y S,etal.. A disulfide bound-molecular beacon as a fluorescent probe for the detection of reduced glutathione and its application in cells [J].Chem.Commun., 2012, 48:3221-3223.
[4] ZHANG W, WAN F, ZHU W,etal.. Determination of glutathione and glutathione disulfide in hepatocytes by liquid chromatography with an electrode modified with functionalized carbon nanotubes [J].J.Chromatog. B, 2005, 818(2):227-232.
[5] LIU J, BAO C, ZHONG X,etal.. Highly selective detection of glutathione using a quantum-dot-based OFF-ON fluorescent probe [J].Chem.Commun., 2010, 46:2971-2973.
[6] NARANG J, CHAUHAN N, JAIN P,etal.. Silver nanoparticles/multiwalled carbon nanotube/polyaniline film for amperometric glutathione biosensor [J].Int.J.Biolog.Macromol., 2012, 50(3):672-678.
[7] SHAO N, JIN J, WANG H,etal.. Design of bis-spiropyran ligands as dipolar molecule receptors and application toinvivoglutathione fluorescent probes [J].J.Am.Chem.Soc., 2010, 132(2):725-736.
[8] LI Y, LIU W M, ZHANG P P,etal.. A fluorescent probe for the efficient discrimination of Cys, Hcy and GSH based on different cascade reactions [J].Biosens.Bioelectron., 2017, 90:117-124.
[9] ZHANG L L, LI M M, ZHAO C C,etal.. A novel fluorescent probe for discrimination of Cys from GSH: inspiration from chemical ligation [J].TetrahedronLett., 2016, 57(5):578-581.
[10] JHONG Y, HSIEH W H, CHIR J L,etal.. A highly selective and turn-on fluorescence sensor for detection of cyanide [J].J.Fluoresc., 2014, 24:1723-1726.
[11] LIU X, LI T Z, WU Q H,etal.. Carbon nanodots as a fluorescence sensor for rapid and sensitive detection of Cr(Ⅵ) and their multifunctional applications [J].Talanta, 2017, 165:216-222.
[12] 刘静, 李东伟, 武小强, 等. 萘酰亚胺铁离子荧光探针的合成及识别性能 [J]. 发光学报, 2017, 38(2):226-231.
LIU J, LI D W, WU X Q,etal.. Synthesis and recognition performance of naphthalene imide-iron ion fluorescent probe [J].Chin.J.Lumin., 2017, 38(2):226-231. (in Chinese)
[13] 高勇, 汪军, 付妹, 等. 水溶性罗丹明基Fe3+荧光探针及其在细胞成像中的应用 [J]. 有机化学, 2017, 37:617-623.
GAO Y, WANG J, FU M,etal.. A water-soluble rhodamine-based fluorescent probe for Fe3+and its application in live cell imaging [J].Chin.J.Org.Chem., 2017, 37:617-623. (in Chinese)
[14] FRISCIC T. Supramolecular concepts and new techniques in mechanochemistry: cocrystals, cages, rotaxanes, open metal-organic frameworks [J].Chem.Soc.Rev., 2012, 41:3493-3510.
[15] KOBERL M, COKOJA M, HERRMANN W A. From molecules to materials: molecularpaddle-wheel synthons of macromolecules, cage compounds and metal-organic frameworks [J].DaltonTrans., 2011, 40:6834-6859.
[16] BUNZEN J, IWASA J, BONAKDARZADEH P,etal.. Self-assembly of M24L48 polyhedra based on empirical prediction [J].Angew.Chem.Int.Ed., 2012, 51(13):3161-3163.
[17] SUN Q F, SATO S, FUJITA M. An M18L24 stellated cuboctahedron through post-stellation of an M12L24 core [J].Nat.Chem., 2012, 4:330-333.
[18] JIN M, MOU Z L, ZHANG R L,etal.. An efficient ratiometric fluorescence sensor based on metal-organic frameworks and quantum dots for highly selective detection of 6-mercaptopurine [J].Biosens.Bioelectron., 2017, 91:162-168.
[19] LV Y Y, GU W, WANG J B,etal.. A ratiometric fluorescence chemodosimeter for detecting Hg2+in aqueous solutions and living cells [J].Sens.ActuatorsB:Chem., 2017, 246:1017-1024.
SynthesisofRatiometricFluorescentProbeforTheRecognitionofGlutathione
WUHong-mei,GUOYu*
(SchoolofChemicalandEnvironmentalEngineering,LiaoningUniversityofTechnology,Jinzhou121001,China)
Two fluorescent groups of quinoline and dansylamide were introduced into ligand L1together, and a trinuclear zinc metal-organic compound H-1as a ratiometric fluorescent probe was self-assembled by L1and zinc ion, and the sensitive recognition of γ-glutamyl-cysteinyl-glycine (GSH) was realized by H-1. The recognition process was studied by UV-Vis, fluorescence spectra,1H NMR and ESI-MS. UV-Vis adsorption titration results show that the addition of GSH to the solution of H-1causes a significant absorbance decrease at425nm and an obvious absorbance increase at320nm. The isobestic point is355nm. The equilibrium constant lgKof4.03±0.11is obtained with the absorbance value at320nm. This indicates that1∶1stoichiometric host-guest complexation of H-1for GSH is formed. The fluorescence spectra show that the addition of GSH to the solution of H-1causes an obvious dansyl-based fluorescence decrease at513nm upon excitation at340nm with a significant red-shift, and an increase of quinoline-based fluorescence at396nm. The ratio of dansyl-based fluorescence to quinoline-based fluorescence can be used to detect GSH and the detection limit is up to2.5×10-6mol·L-1.
glutathione (GSH); ratiometric fluorescent probe; trinuclear zinc metal-organic compound; recognition
2017-05-10;
2017-07-26
国家自然科学基金(21601075); 辽宁省自然科学基金(2015020249)资助项目
Supported by National Natural Science Foundation of China (21601075); Natural Science Foundation of Liaoning Province (2015020249)
1000-7032(2017)12-1561-06
O433.5
A
10.3788/fgxb20173812.1561
*CorrespondingAuthor,E-mail:guoyulnut@163.com

吴红梅(1979-),女,辽宁阜新人,博士,副教授,2009年于大连理工大学获得博士学位,主要从事荧光探针的设计及分子识别方面的研究。E-mail: wuhongmei@lnut.edu.cn

郭宇(1981-),男,辽宁沈阳人,博士,副教授,硕士研究生导师,2010年于大连理工大学获得博士学位,主要从事功能膜材料和光电材料的设计及应用方面的研究。E-mail: guoyulnut@163.com
