脑源性神经营养因子预处理神经干细胞移植对急性缺血性脑卒中小鼠的效果
2017-12-04王栋杨文桢侯博儒康军林任海军
王栋,杨文桢,侯博儒,康军林,任海军
·基础研究·
脑源性神经营养因子预处理神经干细胞移植对急性缺血性脑卒中小鼠的效果
王栋,杨文桢,侯博儒,康军林,任海军
目的 比较脑源性神经营养因子(BDNF)预处理对神经干细胞(NSCs)移植修复急性缺血性脑卒中的作用。方法 出生1 d C57BL/6小鼠,分离NSCs体外培养及鉴定。10周龄健康C57BL/6小鼠150只随机分为5组,A组(n=20)为假手术组,B(n=20)、C(n=20)、D(n=45)、E(n=45)组采用光化学诱导法建立急性脑缺血模型。造模24 h后,D组行单纯NSCs移植,E组行BDNF预处理的NSCs移植,C组移植等量溶剂。移植前1 d,移植后3 d、7 d、14 d、21 d、28 d,行加速转棒测试及前肢抓力测试,移植后28 d,D、E组取5只小鼠行微管相关蛋白2(MAP-2)、神经胶质纤维酸性蛋白(GFAP)免疫荧光染色。结果 移植后3 d、7 d、14 d、21 d、28 d,加速转棒时间由长到短依次为E组、D组、B组(p<0.05);移植后14 d、21 d、28 d,前肢抓力由大到小依次为E组、D组、B组(p<0.05)。移植后28 d,D组、E组均发现Edu/GFAP双阳性细胞及Edu/MAP-2双阳性细胞。结论 NSCs移植可促进缺血性脑卒中后行为功能恢复,经BDNF预处理后有更好效果。
缺血性脑卒中;神经干细胞;脑源性神经营养因子;体外培养;移植
脑卒中是全球范围内引起死亡、致残的重要原因。急性缺血性脑卒中是最常见的卒中类型,占脑卒中80%以上。脑卒中患者多伴有不同程度神经功能缺陷,如肢体运动及语言障碍[1-4]。
卒中后的损害效应不仅涉及神经元,对脑内其他细胞和细胞外基质也会产生影响。由于缺血性脑卒中后机体自身修复能力有限,难以产生新的功能性神经元。将外源性神经干细胞(neural stem cells,NSCs)植入中枢神经系统(central nervous system,CNS)疾病模型动物脑组织后,NSCs会向病灶区域迁移分化,并分泌神经营养因子,产生神经保护作用;同时减小病灶区梗死体积,促进运动、学习、记忆、感觉、认知等功能恢复[5-8]。NSCs移植为临床治疗急性CNS损伤和慢性退行性CNS疾病带来广阔应用前景[9-13]。
脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)是神经生长及发挥功能所必需的多肽类因子,属于神经营养生长因子家族,由大脑细胞分泌产生,脑内含量丰富,在神经元生长、存活、分化过程中发挥重要作用。缺血性脑卒中后,BDNF通过促进神经及血管再生,发挥抗缺血损伤作用;通过提高突触及轴突可塑性,促进学习、记忆和感觉运动等恢复[14-16]。
BDNF对体内外NSCs增殖分化发挥重要调节作用,可影响NSCs存活、增殖、凋亡和迁移。移植高表达BDNF的NSCs到脑内,可增加NSCs存活及血管再生,减少细胞死亡[17-18]。在创伤性脑损伤模型中移植高表达BDNF的NSCs,NSCs存活率增加,神经功能恢复效果更佳[19]。
本研究对比分析单纯NSCs移植与BDNF预处理NSCs移植对小鼠缺血性脑卒中的效果,探讨其相关机制。
1 材料与方法
1.1 试剂和仪器
表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF):PEPROTECH公司。Edu细胞增殖检测盒(货号c10640):THERMO FISHER SCIENTIFIC公司。胎牛血清、即用型山羊血清:杭州四季青生物试剂公司。DMEM/F12培养液、B27(不含维生素A)、Accutase原液:GIBCO公司。兔抗神经元特异性烯醇化酶(neuron-specific enolase,NSE)多克隆抗体、小鼠抗5-溴脱氧尿嘧啶核苷(5-Bromo-2-deoxyuridine,BrdU)单克隆抗体:ABCAM公司。兔抗小鼠巢蛋白(nestin)单克隆抗体、兔抗微管相关蛋白2(microtubule-associated protein 2,MAP-2)多克隆抗体、BDNF、Hochest33258原液、孟加拉红玫瑰红(rose bengal sodium salt,RB)、2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)、 Fluoro-Jade C(FJ-C)染 料 :SIGMA公司。兔抗胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体:BOSTER公司。TRITC标记山羊抗兔IgG:KPL公司。FITC标记山羊抗小鼠IgG:EARTHOX公司。牛血清白蛋白(albumin from bovine serum,BSA):SOLARBIO公司。
磷酸盐缓冲液(phosphate buffered saline,PBS,pH=7.4);一抗稀释液(BSA 1.2 g+10%NaN30.4 ml+Triton X-100 0.08 ml+PBS 40 ml);二抗稀释液(BSA 1.2 g+10%NaN30.4 ml+PBS 40 ml);2%氯胺酮-甲苯噻嗪混合液(盐酸氯胺酮溶液10 ml+甲苯噻嗪0.075 g+灭菌生理盐水15 ml)。
激光共聚焦显微镜(型号FV1000MPE)、荧光倒置显微镜、倒置相差显微镜:OLYMPUS公司。JZ300高精度张力换能器:北京新航科技有限公司。BL-420S生物机能实验系统、ZB-200加速转棒仪:成都泰盟科技有限公司。VT1000S振动切片机:LEICA公司。
1.2 实验动物及分组
出生1 d C57BL/6小鼠,体质量1 g,雌雄不限,用于NSCs体外分离及培养;10周龄C57BL/6小鼠,雌雄不限,体质量20~25 g,用于免疫组化及行为学实验。实验动物由兰州大学实验动物中心提供,实验过程严格按照动物伦理学规范要求进行。
加速转棒预训练3 d,转棒爬行时间>220 s小鼠150只纳入研究。随机分为5组:A组(n=20)切开头皮,暴露硬脑膜;B组(n=20)建模后不做干预;C组(n=20)建模后移植等量溶剂;D组(n=45)建模后单纯NSCs移植;E组(n=45)建模后移植BDNF预处理的NSCs。
实验过程中死亡或不列入统计学分析的小鼠,按相等的数量和相同的实验方法予以补充。
1.3 NSCs体外分离培养及鉴定
1.3.1 体外分离培养
出生1 d C57BL/6小鼠2只,无菌条件分离两侧海马,无菌预冷PBS漂洗后剪碎,4倍体积0.25%胰酶37℃水浴8 min,500 r/min离心5 min;弃上清,加入DMEM/F12基础培养液;改良抛光巴氏吸管吹打成细胞悬液,400目滤网过滤;500 r/min离心5 min,弃上清;加入提前预热的NSCs完全培养基2 ml(DMEM/F12基础培养液49 ml+B27 1 ml+EGF 1µg+bFGF 1µg)重悬细胞。1×109/L接种于25 cm2培养瓶,37℃、体积分数5%CO2、平衡湿度培养箱培养。原代培养至第3天出现悬浮细胞球,半量换液;1周后细胞球直径达100~130µm,收集细胞。Accutase原液2 ml消化10 min,1000 r/min离心5 min,弃上清;37℃预热的NSCs完全培养基吹打混匀,1×109/L接种培养。
1.3.2 鉴定
第3代细胞在传代过程加入BrdU(终浓度10 μmol/L),培养48 h后接种于24孔板中(含多聚赖氨酸包被的无菌玻片)继续培养12 h。撤除培养基,4℃预冷的4%PFA室温固定15 min,PBS室温摇床洗涤3次,每次5 min。0.5%Triton X-100室温摇床孵育20 min,PBS洗涤3次,每次5 min。每孔加入2 mol/L盐酸500µl,37℃摇床20 min。去除盐酸,加入硼酸缓冲液,室温摇床洗涤3次,每次15 min。每孔加即用型山羊血清200µl室温摇床封闭1.5 h。移除血清,分别加入兔抗小鼠Nestin一抗(1∶100)、小鼠抗BrdU一抗(1∶100),4℃摇床孵育12 h,PBS洗涤3次,每次10 min。分别避光加入TRITC标记的山羊抗兔IgG二抗(1∶100)、FITC标记的山羊抗小鼠IgG二抗(1∶100),摇床孵育1.5 h(37℃,90 r/min)。PBS洗涤3次,每次10 min。每孔加Hoechst33258(1∶2000)200 μl复染细胞核,室温摇床15 min;PBS洗3次,每次5 min。甘油-PBS封片,荧光显微镜下观察拍照。加入二抗以后所有步骤均需避光操作。
1.3.3 体外诱导分化及鉴定
取BrdU标记的第三代NSCs,1×104/L接种于24孔板(内含多聚赖氨酸包被的无菌玻片),每孔加NSCs促分化培养基(DMEM/F12基础培养液45 ml+10%胎牛血清5 ml)1 ml,轻晃培养板使细胞分散均匀;培养箱内继续培养,每2 d半量换液。2 d后细胞呈散射状向四周迁移,突起逐渐变长。培养10 d行NSE、GFAP免疫荧光染色。加兔抗小鼠NSE一抗(1∶500)、兔抗小鼠GFAP一抗(1∶100)、TRITC标记的山羊抗兔IgG二抗(1∶100)。染色、封片步骤同1.3.2。
1.4 模型建立及造模后NSCs移植
1.4.1 模型建立
在Watson等光化学诱导法基础上改进[20-24]。2%氯胺酮-甲苯噻嗪溶液0.5 ml/kg腹腔注射至小鼠完全麻醉,暴露颅骨,剥离骨膜。以Bregma点为原点,矢状缝右侧2.2 mm、冠状缝后0.8 mm,解剖镜下打磨颅骨暴露硬脑膜,至滴加PBS可见清晰大脑浅表血管为止,保持硬膜完整。眼眶下静脉注射10 mg/ml RB溶液2 μl/g,荧光显微镜下绿色激发光定点照射,照射面积1 mm2,时间4.25 min[25]。A组眼眶下静脉注射等量PBS溶液。术后4 h行神经功能缺损评分(Neurological Severity Scores,NSS),3分以上小鼠纳入实验。
1.4.2 模型鉴定
1.4.2.1 尼氏染色
造模后3 d取3只小鼠灌流取脑组织,切片厚30 μm,粘于多聚赖氨酸包被的载玻片上,室温过夜干燥;蒸馏水漂洗1 min,梯度酒精脱水(70%乙醇1 min,95%乙醇1 min,100%乙醇1 min,二甲苯20 min)。梯度酒精复水(100%乙醇5 min,95%乙醇1 min,50%乙醇1 min),1%甲分酚紫37℃染色10 min,蒸馏水漂洗3次,每次1 min;乙酸分化1 min。100%乙醇2 min(观察颜色脱去即可终止),二甲苯透明10 min,中性树胶封片后避光保存。
1.4.2.2 TTC染色
造模后3 d,取3只小鼠氨基甲酸乙酯麻醉,断头取脑。TTC溶液浸入15 min(37℃恒温,避光),每3~5 min翻动1次,期间注意观察(颜色要鲜红,不能变成暗红色),15 min后取出脑组织,放入模具,-20℃冰冻30 min,切成厚1 mm脑片;转移出模具后继续用TTC溶液染色10 min(37℃恒温,避光),注意观察翻动,保证每个脑片都能充分接触染料。4%PFA终止染色。
1.4.2.3 FJ-C染色
造模后3 d取3只小鼠灌流取脑组织,切片厚30 μm,粘于多聚赖氨酸包被的载玻片上,室温过夜干燥。依次浸润于无水乙醇3 min、95%乙醇1 min、75%乙醇1 min,蒸馏水漂洗1 min,0.06%高锰酸钾避光摇15 min,蒸馏水浸润2 min;0.0001%FJ-C工作液避光染色30 min,蒸馏水漂洗3次,每次1 min;37℃干燥30 min。二甲苯浸润10 min,中性树胶封片。高锰酸钾摇床后步骤均需严格避光。
1.4.3 NSCs移植
移植前24 h,用终浓度10µmol/L Edu标记NSCs[26]。造模后24 h,D组移植NSCs 2×106[27]。E组NSCs移植前用BDNF 100 ng/ml预处理1 h[28],基础培养基洗涤浓缩后再移植。
立体定向仪定位前囟后0.46 mm,矢状缝右旁1.0 mm,硬膜下2.5 mm[29],1 μl/min速度注射,留针5 min,5 min内缓慢拔出针头。
1.5 行为学测试
1.5.1 加速转棒测试
造模前1 d,移植后3 d、7 d、14 d、21 d、28 d,小鼠置于静止转棒上3 min,然后于5 min内将转速从0加速到40 r/min,记录从转棒上掉落的时间(两次被动旋转认为掉落)。测试3次,间隔5 min,取平均值。
1.5.2 前肢抓力测试
造模前1 d,移植后3 d、7 d、14 d、21 d、28 d,将小鼠其前肢放于张力换能器三脚架上,水平均匀牵拉小鼠尾巴,直到小鼠前肢完全松开三脚架。实验过程保持小鼠与三脚架处于水平位。连续测试5次,记录每次峰值,取5次平均值。
1.6 移植后免疫荧光染色
1.6.1 组织标本制备
NSCs移植后28 d,行为学测试结束后,D、E两组分别取5只小鼠,氨基甲酸乙酯0.17 ml/20 g腹腔注射麻醉,打开胸腔,暴露心脏,于右心耳横向剪一小口,左心室快速灌注4℃预冷PBS 20 ml,灌注4℃预冷4%PFA 20 ml。取脑组织浸入4%PFA,4℃固定48 h。振动切片机连续冠状切片,厚30 μm。
1.6.2 免疫荧光染色
脑片置24孔板内,3%BSA 1 ml室温摇床洗涤2次,每次5 min。每孔加0.5%TritonX-100 1 ml,室温摇床孵育20 min;3%BSA洗涤2次,每次5 min。每孔加入Edu反应混合液(1×Click-iT®reaction buffer 440 μl+Copper protectant 10 μl+Alexa Fluor®picolyl azide 1.2 μl+Reaction-buffer additive 50 μl)500 μl,室温避光孵育30 min。3%BSA洗涤2次,每次5 min。
避 光 , 加 MAP-2(1∶ 100)、 GFAP(1∶ 100)、Hoechst33342(1∶2000)一抗,TRITC标记山羊抗兔IgG二抗(1∶100)。染色、封片步骤同1.3.2。
1.6.3 尼氏染色和TTC染色
移植后28 d,各组取3只小鼠行尼氏染色和TTC染色,方法同前。
1.7 统计学分析
采用SPSS 21.0进行统计分析。组间比较采用单因素方差分析(One-Way ANOVA)。显著性水平α=0.05。Image J软件进行图像处理分析。
2 结果
2.1 NSCs体外分离培养鉴定
原代NSCs接种后2 h,倒置相差显微镜下可见大量散在单细胞(图1A);3 d可见大小不一神经球形成(图1B);7 d可见大神经球形成,由大量透光良好、形态圆润的单细胞聚集而成(图1C)。
第 3 代细胞行 BrdU(图 2A)、Nestin(图 2B)、Hochest33258(图2C)荧光染色,均呈阳性。Image J软件叠加后(图2D)呈混合阳性。
2.2 NSCs体外诱导分化鉴定
培养10 d时,细胞BrdU/GFAP(图3)、BrdU/NSE(图4)免疫荧光染色均阳性。BrdU/GFAP阳性细胞呈多样性,胞体多角形,突起较多且单个细胞间突起有相互交织呈网状的趋势。细胞核形态随着胞体形态而变化,呈大而圆或长而扁形状,位于胞体中央或周边。BrdU/NSE阳性细胞胞体呈椭圆形、梭形、三角形,突起细长呈双极样。

图1 NSCs体外培养的形态变化(倒置相差显微镜)
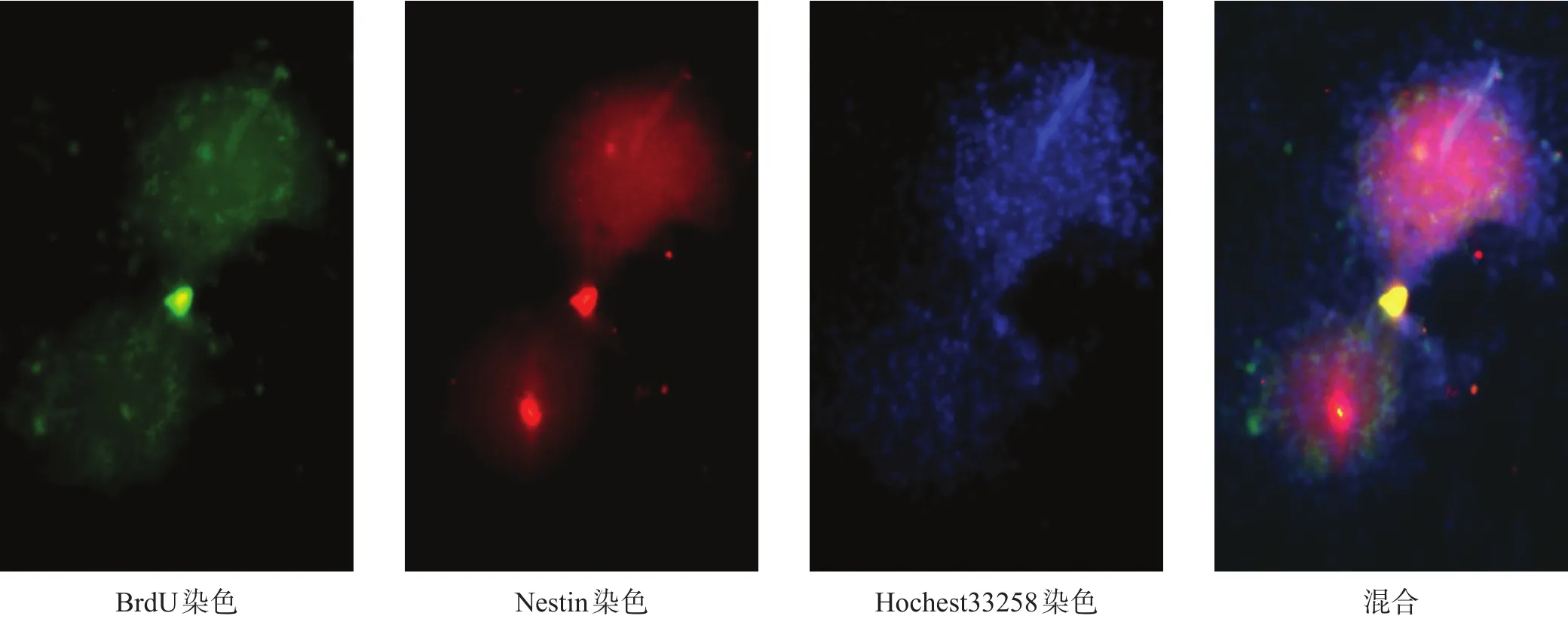
图2 NSCs体外培养鉴定(免疫荧光染色,200×)
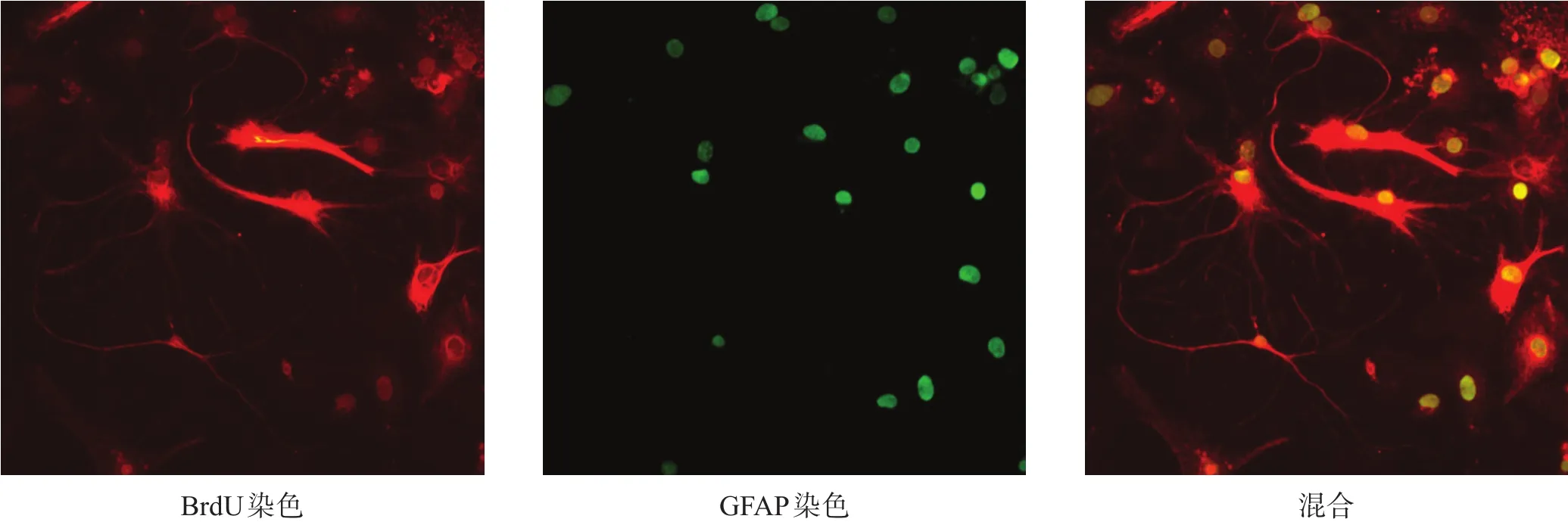
图3 NSCs体外分化成星形胶质细胞(免疫荧光染色,200×)
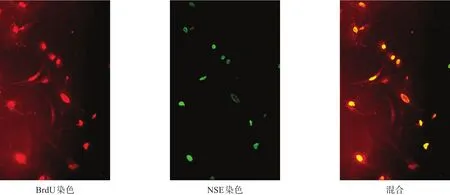
图4 NSCs体外分化成神经元(免疫荧光染色,200×)
2.3 急性缺血性脑卒中模型鉴定
2.3.1 大体观察
荧光照射后,血管内血液高速流动,随后血流减慢,血管逐渐被阻塞,荧光变暗(图5)。
2.3.2 模型鉴定
尼氏体是神经元的特征性结构之一,存在于神经元胞体粗面内质网及核糖体上,在病理情况下会溶解或消失[30]。造模后3 d,尼氏染色可见损伤区尼氏体数量减少,神经元坏死、数目减少,周围细胞水肿明显,部分细胞核固缩,细胞间隙增大,微血管内皮细胞肿胀(图6)。
TTC染色后正常组织显示为红色,坏死组织由于琥珀酸脱氢酶失活,不能与TTC发生反应,显示为白色(图6)。
FJ-C染色可在大脑急性损伤病变时标记退行性神经元,而正常神经元不染色[31-32](图6)。
染色结果表明,光化学诱导法建立模型成功。
2.4 NSCs移植后的存活及分化
移植后28 d,D、E两组均可见Edu/MAP-2阳性、Edu/GFAP阳性细胞,E组Edu阳性细胞数量更多(图7、图8)。
2.5 移植后尼氏、TTC染色
D、E组尼氏体数量较C组有所增加,神经元形态较完整。E组尼氏体及神经元数量多于D组(图9)。E组TTC白色区域小于D组(图10)。

图5 光栓法缺血模型建立示意图
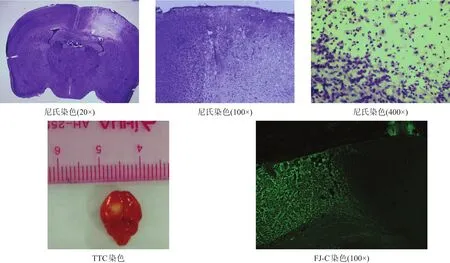
图6 光栓法缺血模型鉴定
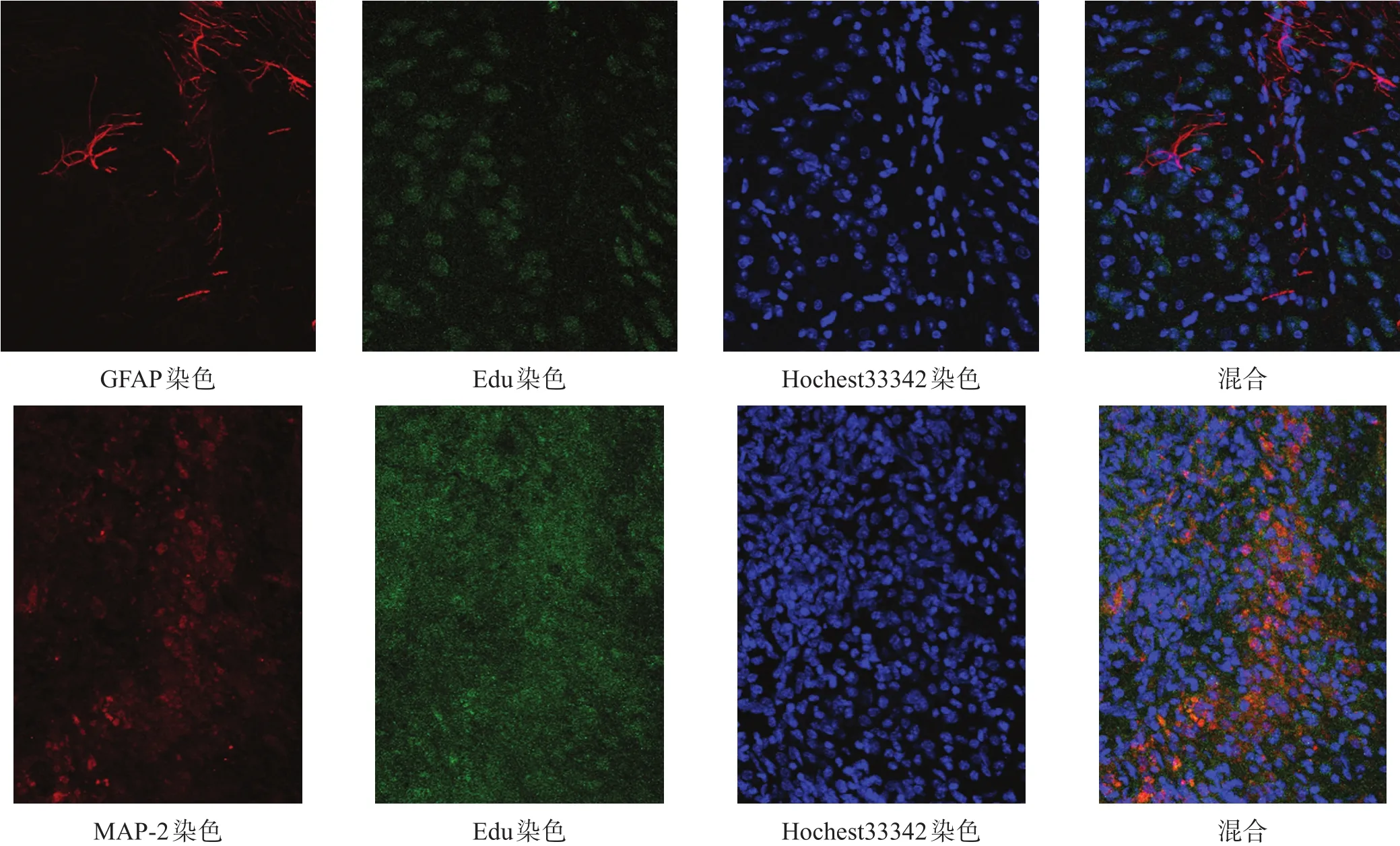
图8 E组NSC移植后分化情况(免疫荧光染色,200×)

图7 D组NSC移植后分化情况(免疫荧光染色,200×)
2.6 加速转棒测试
加速转棒测试可评估小鼠平衡及协调能力[33-34]。造模前1 d,各组间转棒时间均无显著性差异(P>0.05);移植后3 d,A组转棒时间较造模前略有下降,B、C、D、E组明显下降,移植后7 d各组转棒时间有所上升,B、C两组各时间点比较均无显著性差异(P>0.05),D、B两组及E、D两组间均有显著性差异(p<0.05)。见图11。
2.7 前肢抓力测试
造模前1 d,各组间抓力均无显著性差异(P>0.05)。移植后各时间点,B、C两组比较均无显著性差异(P>0.05);移植后7 d,D、B两组间有显著性差异(p<0.05),而E、D两组间无显著性差异(P>0.05);移植后14 d、21 d、28 d,D、B两组及E、D两组间均有显著性差异(p<0.05)。见图12。

图9 NSC移植后C组、D组、E组尼氏体数目(尼氏染色,400×)

图10 NSC移植后D组、E组损伤体积(TTC染色)
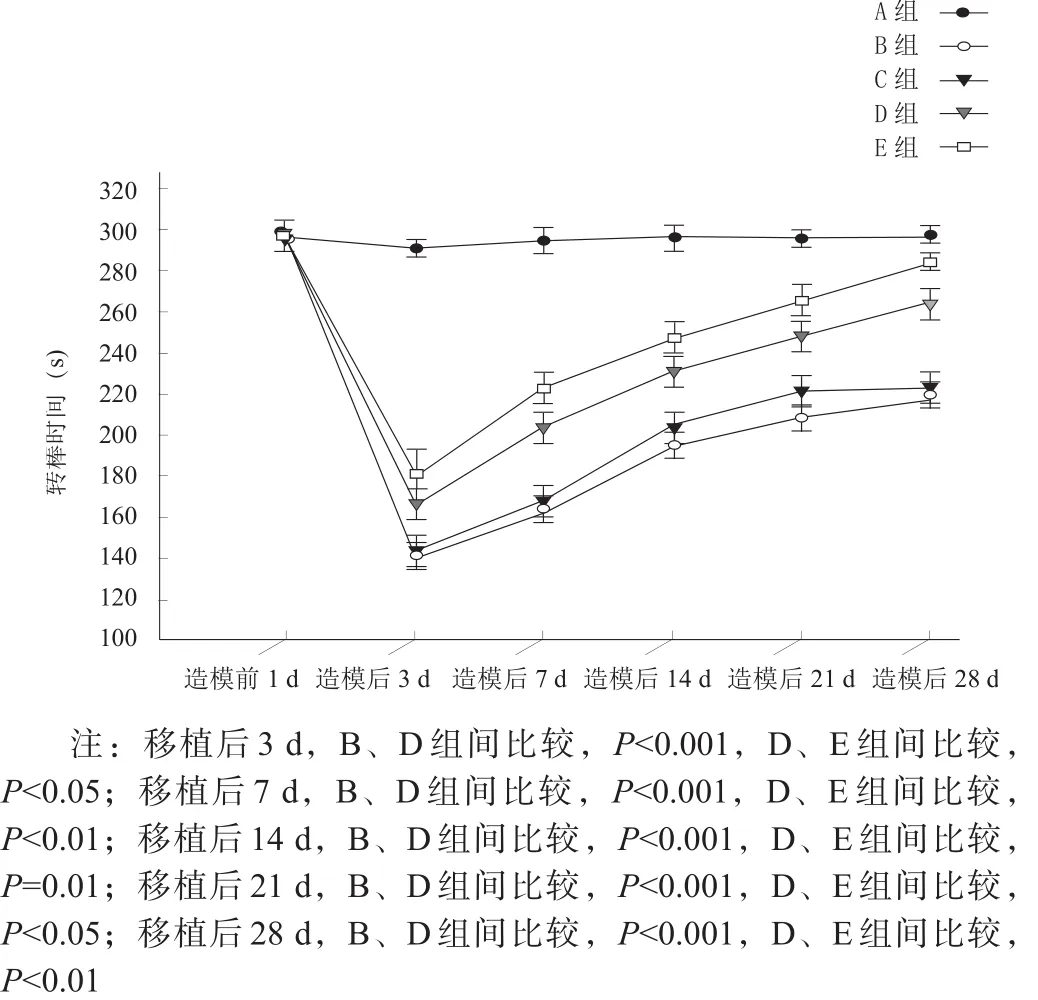
图11 造模前及移植后各时间点加速转棒测试结果

图12 造模前及移植后各时间点前肢抓力测试结果
3 讨论
NSCs是居存于CNS的前体细胞,主要分布于脑、脊髓、视网膜;在成年哺乳动物大脑中,NSCs主要存在于侧脑室下区及海马齿状回颗粒下区[35],胚胎期小鼠嗅球、海马、侧脑室室周等部位也存在NSCs[36-37]。NSCs具有多潜能分化及自我更新能力,可通过对称及不对称分裂分化产生子代NSCs及神经元、星形胶质细胞和少突胶质细胞[38-39]。NSCs植入体内后,在EGF、FGF、白血病抑制因子(leukemia inhibitory factor,LIF)刺激下增殖,进而通过视黄酸诱导分化为神经元、星形胶质细胞、少突胶质细胞,替代损伤丢失的神经细胞,为脑卒中等CNS疾病临床治疗带来新的希望[40]。
加速转棒测试主要反映运动协调能力。本研究显示,从移植后7 d起,B、C、D、E各组加速转棒时间有所上升;A组造模后转棒时间短暂下降,随后恢复正常,推测可能由于打磨颅骨时机械振动挤压脑组织所引起,未对小鼠脑组织产生实质性损害。B、C两组转棒时间上升有限,且无显著性差异,说明卒中后脑内注射基础培养基不会对小鼠行为恢复产生明显作用;卒中后小鼠存在一定神经自我修复功能,其机制可能是卒中后内源性NSCs激活,分化出新的神经元,替代梗死区坏死或无功能性的神经元、胶质细胞,通过胶质瘢痕修复促进神经功能恢复[41-43]。D组与B、C组比较,转棒时间明显增加,同时脑内出现Edu/GFAP、Edu/MAP-2阳性细胞,并向缺血半暗带区域迁移,证实体外培养的NSCs在体内依旧保持自我更新、增殖及多潜能分化能力,NSCs移植是治疗缺血性脑卒中的有效方法,可以促进卒中后小鼠神经功能恢复,也与之前其他研究结果一致[5,44-45]。
体内外相关研究证实,血管内皮生长因子(vascular endothelial growth factor,VEGF)在神经保护中发挥重要作用,经过BNDF处理后,VEGF表达显著上升。移植后存活的NSCs可以分泌BDNF、睫状神经生长因子(ciliary neurotrophic factor,CNTF)、胶质细胞源性神经营养因子(glial cell-derived neurotrophic factor,GDNF)等多种神经营养因子,并使其表达量上调,从而减少细胞凋亡,促进损伤灶局部受损神经元存活,增加移植后NSCs存活;BNDF对NSCs向神经元分化起推动作用,有利于神经突触重塑[46-49]。
本研究显示,E组行为恢复明显优于D组,同时E组脑内也存在Edu/GFAP、Edu/MAP-2阳性细胞,且E组神经元分化数多于D组,说明BDNF预处理对NSCs增殖、存活、分化、迁移有更好效果。具体机制有待深入研究。
抓力测试结果与加速转棒测试呈大致相同趋势,但起效时间略有延迟。
综上所述,外源性NSCs移植后,可在梗死区域发生迁移和分化,对缺血性脑卒中后脑组织修复及神经功能恢复发挥重要作用;而移植经BNDF预处理的NSCs,可在脑组织形态修复和神经功能恢复方面有更好疗效。
[1]Feigin VL,Norrving B,George MG,et al.Prevention of stroke:a strategic global imperative[J].Nat Rev Neurol,2016,12(9):501-512.
[2]Moskowitz MA,Lo EH,Iadecola C.The science of stroke:mechanisms in search of treatments[J].Neuron,2010,67(2):181-198.
[3]Marks MP,Lansberg MG,Mlynash M,et al.Effect of collateral blood flow on patients undergoing endovascular therapy for acute ischemic stroke[J].Stroke,2014,45(4):1035-1039.
[4]Detante O,Jaillard A,Moisan A,et al.Biotherapies in stroke[J].Rev Neurol(Paris),2014,170(12):779-798.
[5]Mine Y,Tatarishvili J,Oki K,et al.Grafted human neural stem cells enhance several steps of endogenous neurogenesis and improve behavioral recovery after middle cerebral artery occlusion in rats[J].Neurobiol Dis,2013,52:191-203.
[6]Tang Y,Wang J,Lin X,et al.Neural stem cell protects aged rat brain from ischemia-reperfusion injury through neurogenesis and angiogenesis[J].J Cereb Blood Flow Metab,2014,34(7):1138-1147.
[7]Doeppner TR,Ewert TA,Tonges L,et al.Transduction of neural precursor cells with TAT-heat shock protein 70 chaperone:therapeutic potential against ischemic stroke after intrastriatal and systemic transplantation[J].Stem Cells,2012,30(6):1297-1310.
[8]Andres RH,Horie N,Slikker W,et al.Human neural stem cells enhance structural plasticity and axonal transport in the ischaemic brain[J].Brain,2011,134(Pt 6):1777-1789.
[9]Karussis D,Petrou P,Kassis I.Clinical experience with stem cells and other cell therapies in neurological diseases[J].J Neurol Sci,2013,324(1-2):1-9.
[10]Minnerup J,Kim JB,Schmidt A,et al.Effects of neural progenitor cells on sensorimotor recovery and endogenous repair mechanisms after photothrombotic stroke[J].Stroke,2011,42(6):1757-1763.
[11]Buchet D,Garcia C,Deboux C,et al.Human neural progenitors from different foetal forebrain regions remyelinate the adult mouse spinal cord[J].Brain,2011,134(Pt 4):1168-1183.
[12]Naegele JR,Maisano X,Yang J,et al.Recent advancements in stem cell and gene therapies for neurological disorders and intractable epilepsy[J].Neuropharmacology,2010,58(6):855-864.
[13]Brundin P,Barker RA,Parmar M.Neural grafting in Parkinson's disease:problems and possibilities[J].Prog Brain Res,2010,184:265-294.
[14]Liu X,Zhang J,Sun D,et al.Effects of fluoxetine on brain-derived neurotrophic factor serum concentration and cognition in patients with vascular dementia[J].Clin IntervAging,2014,9:411-418.
[15]Jeong CH,Kim SM,Lim JY,et al.Mesenchymal stem cells expressing brain-derived neurotrophic factor enhance endogenous neurogenesis in an ischemic stroke model[J].Biomed Res Int,2014,2014:129145.
[16]Pikula A,Beiser AS,Chen TC,et al.Serum brain-derived neurotrophic factor and vascular endothelial growth factor levels are associated with risk of stroke and vascular brain injury:Framingham Study[J].Stroke,2013,44(10):2768-2775.
[17]PetridisAK,El MaaroufA.Brain-derived neurotrophic factor levels influence the balance of migration and differentiation of subventricular zone cells,but not guidance to the olfactory bulb[J].J Clin Neurosci,2011,18(2):265-270.
[18]Lee HJ,Lim IJ,Lee MC,et al.Human neural stem cells genetically modified to overexpress brain-derived neurotrophic factor promote functional recovery and neuroprotection in a mouse stroke model[J].J Neurosci Res,2010,88(15):3282-3294.
[19]Ma H,Yu B,Kong L,et al.Neural stem cells over-expressing brain-derived neurotrophic factor(BDNF)stimulate synaptic protein expression and promote functional recovery following transplantation in rat model of traumatic brain injury[J].Neurochem Res,2012,37(1):69-83.
[20]Klaric TS,Jaehne EJ,Koblar SA,et al.Alterations in anxiety and social behaviour in Npas4 deficient mice following photochemically-induced focal cortical stroke[J].Behav Brain Res,2017,316:29-37.
[21]Tsiminis G,Klaric TS,Schartner EP,et al.Generating and measuring photochemical changes inside the brain using optical fibers:exploring stroke[J].Biomed Opt Express,2014,5(11):3975-3980.
[22]Lozano JD,Abulafia DP,Danton GH,et al.Characterization of a thromboembolic photochemical model of repeated stroke in mice[J].J Neurosci Methods,2007,162(1-2):244-254.
[23]Zhang S,Boyd J,Delaney K,et al.Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia[J].J Neurosci,2005,25(22):5333-5338.
[24]Watson BD,Dietrich WD,Busto R,et al.Induction of reproducible brain infarction by photochemically initiated thrombosis[J].Ann Neurol,1985,17(5):497-504.
[25]Wang J,Feng X,Du Y,et al.Combination treatment with progesterone and rehabilitation training further promotes behavioral recovery after acute ischemic stroke in mice[J].Restor Neurol Neurosci,2013,31(4):487-499.
[26]Chehrehasa F,Meedeniya AC,Dwyer P,et al.EdU,a new thymidine analogue for labelling proliferating cells in the nervous system[J].J Neurosci Methods,2009,177(1):122-130.
[27]Wang LQ,Lin ZZ,Zhang HX,et al.Timing and dose regimens of marrow mesenchymal stem cell transplantation affect the outcomes and neuroinflammatory response after ischemic stroke[J].CNS Neurosci Ther,2014,20(4):317-326.
[28]Rosenblum S,Smith TN,Wang N,et al.BDNF pretreatment of human embryonic-derived neural stem cells improves cell survival and functional recovery after transplantation in hypoxic-ischemic stroke[J].Cell Transplant,2015,24(12):2449-2461.
[29]Paxinos G,Franklin BJ.The Mouse Brain in Stereotaxic Coordinates,Compact.Third Edition:The Coronal Plates and Diagrams in Stereotaxic Coordinates[M].San Diego,California:A Harcourt Science and Technology Company,2001:80-86.
[30]Gittins R,Harrison PJ.Neuronal density,size and shape in the human anterior cingulate cortex:a comparison of Nissl and NeuN staining[J].Brain Res Bull,2004,63(2):155-160.
[31]Damjanac M,Rioux Bilan A,Barrier L,et al.Fluoro-Jade B staining as useful tool to identify activated microglia and astrocytes in a mouse transgenic model of Alzheimer's disease[J].Brain Res,2007,1128(1):40-49.
[32]Schmued LC,Stowers CC,Scallet AC,et al.Fluoro-Jade C results in ultra high resolution and contrast labeling of degenerating neurons[J].Brain Res,2005,1035(1):24-31.
[33]Ferrara A,El Bejaoui S,Seyen S,et al.The usefulness of operant conditioning procedures to assess long-lasting deficits following transient focal ischemia in mice[J].Behav Brain Res,2009,205(2):525-534.
[34]Bouet V,Freret T,Toutain J,et al.Sensorimotor and cognitive deficits after transient middle cerebral artery occlusion in the mouse[J].Exp Neurol,2007,203(2):555-567.
[35]Doetsch F.The glial identity of neural stem cells[J].Nat Neurosci,2003,6(11):1127-1134.
[36]Ahmed S.The culture of neural stem cells[J].J Cell Biochem,2009,106(1):1-6.
[37]Walker MR,Patel KK,Stappenbeck TS.The stem cell niche[J].J Pathol,2009,217(2):169-180.
[38]Ming GL,Song H.Adult neurogenesis in the mammalian brain:significant answers and significant questions[J].Neuron,2011,70(4):687-702.
[39]Gage FH.Mammalian neural stem cells[J].Science,2000,287(5457):1433-1438.
[40]Hao L,Zou Z,Tian H,et al.Stem cell-based therapies for ischemic stroke[J].Biomed Res Int,2014,2014:468748.
[41]Sabelstrom H,Stenudd M,Reu P,et al.Resident neural stem cells restrict tissue damage and neuronal loss after spinal cord injury in mice[J].Science,2013,342(6158):637-640.
[42]Benner EJ,Luciano D,Jo R,et al.Protective astrogenesis from the SVZ niche after injury is controlled by Notch modulator Thbs4[J].Nature,2013,497(7449):369-373.
[43]Erlandsson A,Lin CH,Yu F,et al.Immunosuppression promotes endogenous neural stem and progenitor cell migration and tissue regeneration after ischemic injury[J].Exp Neurol,2011,230(1):48-57.
[44]Jensen MB,Yan H,Krishnaney-Davison R,et al.Survival and differentiation of transplanted neural stem cells derived from human induced pluripotent stem cells in a rat stroke model[J].J Stroke Cerebrovasc Dis,2013,22(4):304-308.
[45]Liu H,Cao J,Zhang H,et al.Folic acid stimulates proliferation of transplanted neural stem cells after focal cerebral ischemia in rats[J].J Nutr Biochem,2013,24(11):1817-1822.
[46]Piltonen M,Planken A,Leskela O,et al.Vascular endothelial growth factor C acts as a neurotrophic factor for dopamine neurons in vitro and in vivo[J].Neuroscience,2011,192:550-563.
[47]Lee HJ,Kim KS,Park IH,et al.Human neural stem cells over-expressing VEGF provide neuroprotection,angiogenesis and functional recovery in mouse stroke model[J].PLoS One,2007,2(1):e156.
[48]Zimmermann T,Remmers F,Lutz B,et al.ESC-derived BDNF-overexpressing neural progenitors differentially promote recovery in Huntington's disease models by enhanced striatal differentiation[J].Stem Cell Reports,2016,7(4):693-706.
[49]Wu CC,Lien CC,Hou WH,et al.Gain of BDNF function in engrafted neural stem cells promotes the therapeutic potential for Alzheimer's disease[J].Sci Rep,2016,6:27358.
Effect of Neural Stem Cell Transplantation Pretreated with Brain-derived Neurotrophic Factor on Acute Ischemic Stroke in Mice
WANG Dong,YANG Wen-zhen,HOU Bo-ru,KANG Jun-lin,REN Hai-jun
Department of Neurosurgery,Second HospitalAffiliated to Lanzhou University,Lanzhou,Gansu 730000,China
REN Hai-jun.E-mail:baiyunguan@hotmail.com
Objective To explore the effect of transplantation of neural stem cells(NSCs)pretreated with brain-derived neurotrophic factor(BDNF)on acute ischemic stroke in mice.Methods NSCs from a newborn(one day)C57BL/6 mouse were isolated and cultured in vitro.A total of 150 healthy C57BL/6 mice,ten-week-old,were randomly divided into five groups,that group A accepted sham operation,and groups B,C,D and E were subjected to focal ischemia by photothrombosis.Group D was transplanted NSCs 24 hours after ischemia,while group E transplanted NSCs pretreated with BDNF and group C accepted same volume of medium.All the groups were tested with rotarod test and grip strength one day before transplantation and three,seven,14,21 and 28 days after transplantation.The differentiation of NSCs in groups D and E were observed immunofluorescence staining of microtubule-associated protein-2(MAP-2)and glial fibrillary acidic protein(GFAP).Results The time on rotarod arranged from more to less was groups E,D and B(p<0.05)three,seven,14,21 and 28 days after transplantation,as well as grip strength 14,21 and 28 days after transplantation(p<0.05).The Edu/GFAP positive cells and Edu/MAP-2 positive cells were found in both groups D and E.Conclusion Transplanting NSCs can promote the behavioral recovery after ischemic stroke,and it is more effective as pretreated with BDNF.
ischemic stroke;neural stem cells;brain-derived neurotrophic factor;in vitro;transplantation
10.3969/j.issn.1006-9771.2017.11.006
R743.3
A
1006-9771(2017)11-1263-10
[本文著录格式] 王栋,杨文桢,侯博儒,等.脑源性神经营养因子预处理神经干细胞移植对急性缺血性脑卒中小鼠的效果[J].中国康复理论与实践,2017,23(11):1263-1272.
CITEDAS:Wang D,Yang WZ,Hou BR,et al.Effect of neural stem cell transplantation pretreated with brain-derived neurotrophic factor on acute ischemic stroke in mice[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(11):1263-1272.
1.甘肃省高等学校科研项目(No.2014B-001);2.甘肃电信萃英科研基金资助项目(No.lzudxcy-2014-8)。
兰州大学第二医院神经外科,甘肃兰州市730000。作者简介:王栋(1989-),男,汉族,陕西西安市人,硕士研究生,主要研究方向:重型颅脑损伤及脑血管病。通讯作者:任海军(1962-),男,汉族,甘肃兰州市人,主任医师、教授,硕士研究生导师,主要研究方向:重型颅脑损伤。E-mail:baiyunguan@hotmail.com。
2016-11-01
2017-01-23)
