转基因高蛋氨酸大豆对根际土壤主要有机元素和酶活性的影响
2017-12-02梁晋刚张正光
梁晋刚, 孟 芳, 张正光∗
转基因高蛋氨酸大豆对根际土壤主要有机元素和酶活性的影响
梁晋刚1,2, 孟 芳2, 张正光2∗
1农业部科技发展中心,北京100122;2南京农业大学植物保护学院,江苏 南京210095
【目的】为了评估转基因高蛋氨酸大豆ZD91对土壤生态系统的安全性,开展了其对土壤主要有机元素和酶活性影响的实验。【方法】连续2年,在大豆苗期、花期、鼓粒期和成熟期,采用抖落法采集根际土壤样品,通过室内测定,分析了转基因大豆ZD91对根际土壤含水量、pH、主要有机元素和酶活性的影响。【结果】转基因大豆ZD91较之对应的非转基因大豆对根际土壤含水量、pH、主要有机元素和酶活性无显著影响,但同一种酶活在不同年份和不同生育期存在显著差异。【结论】转基因大豆ZD91对土壤生态系统具有安全性。
转基因高蛋氨酸大豆;ZD91;土壤有机元素;土壤酶活性
随着转基因作物商业化种植面积的不断增大,转基因作物对土壤生态系统的安全性日益受到人们的广泛关注。转基因作物的外源基因及其表达产物可以通过植株残体或根系分泌物等进入土壤生态系统,土壤的特异生物功能类群以及土壤生物多样性都可能因此而发生改变。此外,外源基因的导入可能会造成转基因植物在农艺性状等方面与其对应的非转基因植物之间存在差异,这些差异可能会影响植物组织在土壤中的降解速率,进而影响土壤生物、生态过程和肥力水平(陈振华等,2008;李孝刚,2011)。因此,研究转基因作物对土壤生态系统的影响是其环境安全性评价的一个重要内容,对保证转基因作物安全应用具有重要意义。
目前,评估转基因作物对土壤生态环境的安全性,主要研究其根际土壤有机元素、土壤酶活性和土壤微生物多样性等的变化(王兵等,2013)。之前的研究发现,转基因作物的种植可能会导致土壤有机元素及土壤酶活性发生变化(Chen et al.,2011;Fließbach et al.,2012; Liu et al.,2010; Lupwayi et al.,2007; Motavalli et al.,2004; Sun et al.,2007)。
大豆籽粒中蛋白质含量丰富,可较好地满足人类和动物的需求,然而其含硫氨基酸尤其是蛋氨酸含量偏低,限制了大豆蛋白的营养品质。胱硫醚-γ-合酶是控制蛋氨酸合成的关键酶,Song et al.(2013)通过农杆菌介导法获得能够稳定表达胱硫醚-γ-合酶基因的高蛋氨酸大豆。本课题组前期的研究表明,转基因高蛋氨酸大豆ZD91较之对应的非转基因大豆ZD对根际土壤中细菌、丛枝菌根真菌群落结构、土壤微生物群落碳代谢功能均无显著影响(Liang et al.,2014,2015,2016)。 基于此,本文进一步研究转基因大豆ZD91对其根际土壤主要有机元素和酶活性的影响,以期为评估该转基因大豆对土壤生态系统的安全性提供更充分的依据。
1 材料与方法
1.1 实验材料及栽培方法
转胱硫醚-γ-合酶基因高蛋氨酸大豆ZD91及其受体自贡冬豆ZD,由中国农业科学院作物科学研究所提供。从2009年开始,大豆已连续多年种植于四川省南充市农业科学院实验基地(30°48′N、106°04′E),本次实验的供试材料采集于 2012—2013年。实验地面积约0.19 hm2,种植非豆科植物作为隔离带,并设置围栏,由专人监管。采用随机区组设计,每个品种设4个小区,小区面积60 m2。播种后按当地常规方式统一管理。
1.2 根际土壤样品的采集
样品采集分为 4个阶段,即苗期(seedling stage,SS)、花期(flowering stage,FS)、鼓粒期(podsetting stage,PS)和成熟期(Maturity stage,MS),采用抖落法采集根际土壤(Liang et al.,2014)。采用五点取样法进行取样,将每个小区5点的土壤样品混合为一个重复,过2 mm筛,-20℃冻存备用。
1.3 指标测定
1.3.1 土壤含水量测定 土壤含水量采用烘干称重法测定(陈丰等,2012)。取土壤样品于105℃烘干至恒重,利用以下公式计算土壤含水量。
含水量/%=(湿土重-干土重)/干土重×100。
1.3.2 土壤pH值测定 取风干土壤样品10 g置于50 mL锥形瓶中(水土体积比2.5∶1),间歇性搅拌或摇动30 min,静置30 min澄清后,用pH计测定悬池液的pH值(吴建平等,2015)。
1.3.3 土壤主要有机元素测定 根际土壤全碳、全氮含量的测定委托南京大学现代分析中心完成,运用Vario MICRO元素分析仪,检测依据是JY/T 017-1996元素分析仪方法通则。
1.3.4 土壤主要酶活性测定 根际土壤蔗糖酶和碱性磷酸酶活性测定分别参照关荫松(1986)和Wang et al.(2007)的方法。蔗糖酶的活性以反应中释放出的葡萄糖的量表示,碱性磷酸酶的活性以反应中释放出的酚的量表示,单位均为mg·g-1·d-1。
1.4 数据分析
所有数据通过SPSS 17.0软件进行统计分析,多处理间的差异采用单因素方差分析(One-way ANOVA)和Duncan′s多重比较。另外,选择单因素方差分析年份、生育期和栽培品种对土壤酶活性的影响。
2 结果与分析
2.1 根际土壤含水量、pH和有机元素的变化
如表1所示,在大豆生长各时期,转基因大豆ZD91与受体大豆ZD之间的土壤含水量、pH值均未出现显著差异,说明转基因大豆ZD91较之对应的非转基因大豆ZD对土壤含水量、pH值无显著影响。
如表2所示,在大豆生长各时期,转基因大豆ZD91与受体大豆ZD之间的土壤碳、氮元素含量均未出现显著差异,说明转基因大豆较之对应的非转基因大豆对土壤碳、氮元素含量无显著影响。土壤碳氮比值是土壤质量评价的一个敏感指标(Ge et al.,2013)。如表2所示,在大豆生长各时期,转基因大豆ZD91与受体大豆ZD之间的土壤碳氮比值均未出现显著差异。
2.2 根际土壤主要酶活性变化
2.2.1 蔗糖酶活性 由图1可知,2012年,转基因大豆ZD91和其受体大豆ZD的根际土壤蔗糖酶活性在不同生育期的变化无明显规律,成熟期时活性最高,分别为(0.75±0.02)和(0.72±0.07)mg·g-1·d-1。2013年,转基因大豆ZD91和其受体大豆ZD的根际土壤蔗糖酶活性在不同生育期呈均匀分布,与2012年不同,成熟期时活性最低,分别为(0.23±0.01)和(0.25±0.03)mg·g-1·d-1。 2 年中,转基因大豆ZD91与其受体大豆ZD的蔗糖酶活性在各个生育时期内均无显著差异。
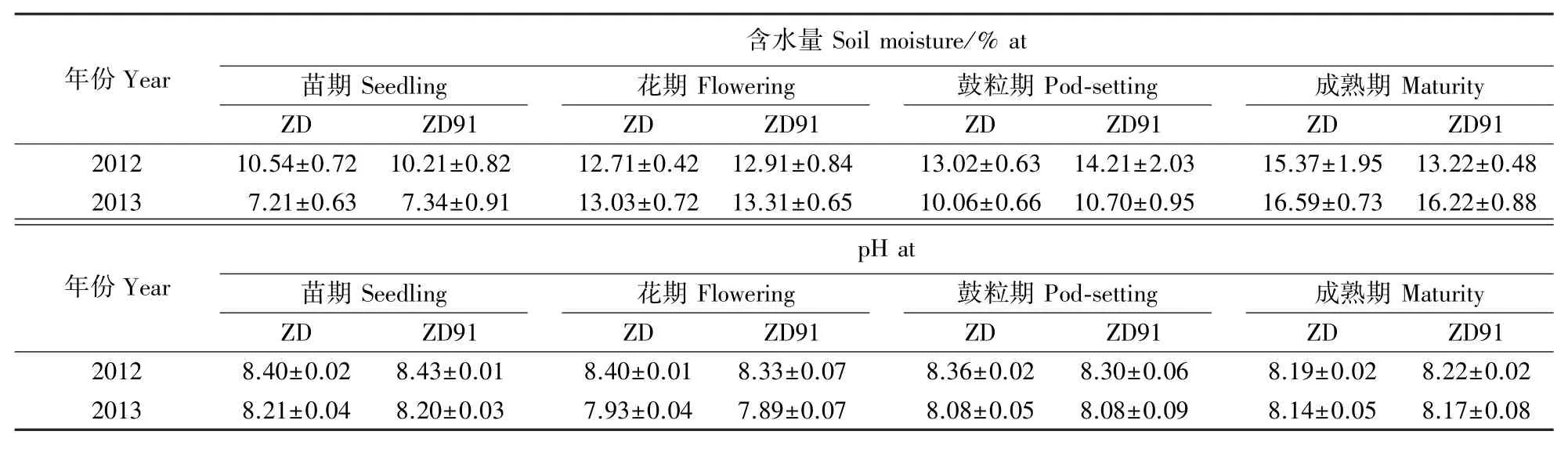
表1 大豆生长各时期根际土壤的含水量和p H值(平均值±标准误)Table 1 Mean values(±standard errors)of moisture and p H in rhizosphere soil under soybean at various developmental stages

表2 大豆生长各时期根际土壤的碳、氮元素含量(平均值±标准误)Table 2 Mean values(±standard errors)of C and N contents in rhizosphere soil under soybean at various developmental stages
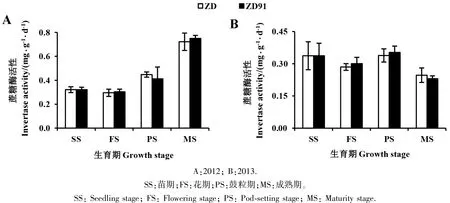
图1 转基因大豆ZD91及其受体大豆ZD根际土壤的蔗糖酶活性Fig.1 The invertase activity in rhizosphere soil of transgenic soybean ZD91 and its recipient ZD
2.2.2 碱性磷酸酶活性 由图2可知,2012年,转基因大豆ZD91和其受体大豆ZD的根际土壤碱性磷酸酶活性随大豆的生长呈现逐渐降低的趋势。苗期活性最高,转基因大豆 ZD91 为(1.64±0.01)mg·g-1·d-1,其受体大豆ZD为(1.58±0.08)mg·g-1·d-1。 2013年,转基因大豆ZD91和其受体大豆ZD的根际土壤碱性磷酸酶活性在不同生育期呈均匀分布。鼓粒期活性最高,转基因大豆 ZD91 为(0.87±0.01)mg·g-1·d-1,其受体大豆ZD为(0.85±0.03)mg·g-1·d-1。 2年中,转基因大豆ZD91与其受体大豆ZD的碱性磷酸酶活性在各个生育时期内均无显著差异。
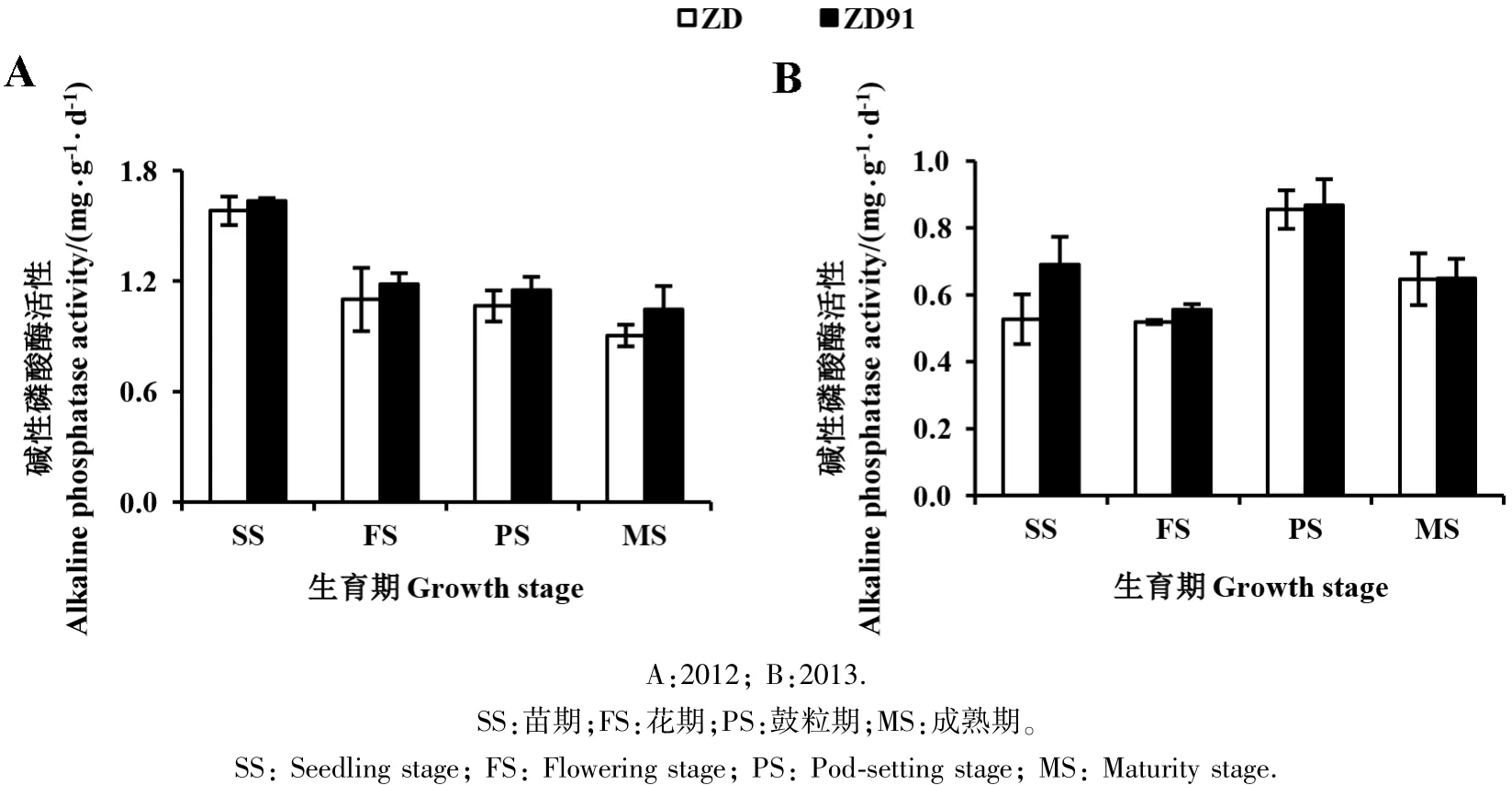
图2 转基因大豆ZD91及其受体大豆ZD根际土壤的碱性磷酸酶活性Fig.2 The alkaline phosphatase activity in rhizosphere soil of transgenic soybean ZD91 and its recipient ZD
2.2.3 土壤酶活性影响因素的ANOVA比较分析年份、生育期以及栽培品种对蔗糖酶和碱性磷酸酶活性影响的ANOVA比较分析(表3)发现,不同年份和不同生育期间的同种酶活性具有显著差异(碱性磷酸酶的不同生育期除外),说明这2种酶的活性主要受年份和生育期的影响,而栽培品种未对土壤酶活性产生影响。

表3 酶活与年份、生育期和栽培品种的ANOVA比较分析Table 3 ANOVA analysis of enzyme activity and year,growth stage and cultivar
3 讨论与结论
由于外源基因的插入,转基因植物的根系分泌物化学组成和数量就有可能发生变化,这种差异会对土壤含水量、有机元素含量等产生不同程度的影响(李孝刚,2011)。另外,转基因作物的外源基因表达产物在降解或富集过程中,可能会引起微生物新陈代谢途径的改变,从而引起土壤酶活性等的变化(蒲传亮,2013)。因此,土壤有机元素、酶活性分析已被用于转基因作物的安全性评价,并被证实可间接地反映土壤微生物生态系统的健康状况(Caldwell,2005; Liang et al.,2014; Monkiedje et al.,2002; Zhang et al.,2014)。 研究表明,转基因高蛋氨酸苜蓿会影响土壤中氮循环的相关细菌(Faragováet al.,2005)。本课题组前期研究表明,转基因高蛋氨酸大豆ZD91与其受体大豆ZD相比,根系分泌物中蛋氨酸含量无显著差异,且根际固氮细菌、氨氧化细菌和反硝化细菌数量均无显著变化(Liang et al.,2014)。
一些环境因素,包括土壤含水量、土壤有机元素等,对转基因作物和微生物互作的影响十分明显(李鑫鑫等,2010)。 Means et al.(2007)发现,只有在土壤含水量充足的条件下,草甘膦处理的转基因大豆根际土壤酶活性和微生物活性才会增强,推测土壤含水量是土壤微生物发生变化的关键因素之一。另外,庞延军等(2011)建立的一种适于转基因植物土壤微生态系统评价的体系指出,通过测定土壤含水量、有机元素、酶活等土壤相关指标,可评价转基因植物对土壤微生态的影响。
研究表明,外源基因的导入可能会影响植物分解速率和碳、氮水平,碳氮比(C/N)的增大会降低土壤微生物氮元素的利用度,从而会导致土壤降解速率的降低(陈丰等,2012)。另有研究显示,种植转基因作物对其根际土壤的各项生理生化指标都无明显影响,且不会产生副作用(杜娟等,2014)。本研究结果表明,转基因高蛋氨酸大豆ZD91较之对应的非转基因大豆对土壤主要有机元素无显著影响。
土壤酶在土壤生态系统的物质循环和能量流动方面扮演重要的角色,在一定程度上反映了土壤微生物的活性,是测定土壤质量的生物活性指标,因此评价不同转基因作物对土壤酶活的影响具有重要的生态学意义(杨万勤和王开运,2004)。土壤酶活性受很多因素影响,如植物根系、土壤类型、土壤有机元素等(Das & Varma,2011; Hannula et al.,2012)。商业化种植的转基因作物可能会对土壤特性以及土壤酶活性产生影响(Fließbach et al.,2012;Liu,2010)。前人研究发现,转基因作物对土壤酶活性的影响机理可能是转基因表达蛋白与土壤酶竞争土壤颗粒活跃表面的结合位点,从而影响土壤酶的活性(郭文文等,2009)。土壤中包含了多种多样的酶,研究时有必要选取具有代表性的酶进行分析(Flores et al.,2005; Ladd et al.,1996; Rao et al.,2003)。
本研究发现,土壤酶活性随着年份和生育期的改变而改变;相同生育期内,转基因大豆ZD91与其受体大豆ZD土壤酶活性没有显著差异,说明转基因大豆ZD91未对土壤酶活性产生影响。Icoz et al.(2008)、Liu et al.(2008)和 Shen et al.(2006)也发现,转基因作物与非转基因作物相比,土壤酶活性没有显著差异。
陈丰,彭欣,华小梅,张培培,桂恒,戚金亮,喻德跃,杨永华,2012.富含硫氨基酸转基因大豆对根际土壤有机元素和微生物群落多样性的影响.大豆科学,31(2):259-265.
陈振华,陈利军,武志杰,2008.转基因作物对土壤生物学特性的影响.土壤通报,39(4):971-976.
杜娟,吴季荣,俞明正,王燕霞,徐剑宏,史建荣,2014.转基因小麦根际土壤中荧光假单胞菌数量的变化.麦类作物学报,34(3):345-350.
关荫松,1986.土壤酶及其研究方法.北京:中国农业出版社.
郭文文,李建勇,诸葛玉平,宗晓庆,2009.转基因作物对土壤生态安全的影响.山东农业科学(10):86-90.
李孝刚,2011.转基因抗虫棉对土壤生态系统影响的研究.博士学位论文.南京:南京林业大学.
李鑫鑫,李晓晖,李亮,平淑珍,陈明,张维,燕永亮,赵新宇,陆伟,2010.转基因作物对于土壤微生物的影响.中国农业科技导报,12(6):24-27.
庞延军,张培培,彭欣,戚金亮,杨永华,杨荣武,桂恒,沈恒冠,陈丰,2011.一种适于转基因植物土壤微生态系统评价的体系及其应用:CN102169117 A.2011-08-31.
浦传亮,2013.高赖氨酸转基因玉米(SB401基因)对土壤酶活性及土壤细菌群落结构的影响.硕士学位论文.南京:南京农业大学.
王兵,杨星勇,郭涛,张兵新,闫文慧,申鸿,2013.转基因(LJAMP2)烟草对紫色土根际微生物和酶的影响.西南大学学报(自然科学版),35(5):152-158.
吴建平,梁国华,熊鑫,褚国伟,周国逸,张德强,2015.鼎湖山季风常绿阔叶林土壤微生物量碳和有机碳对模拟酸雨的响应.生态学报,35(20):1-10.
杨万勤,王开运,2004.森林土壤酶的研究进展.林业科学,40(2):152-159.
CALDWELL B A,2005.Enzyme activities as a component of soil biodiversity:a review.Pedobiologia,49(6):637-644.
CHEN Z,CHEN L,ZHANG Y,WU Z,2011.Microbial properties,enzyme activities and the persistence of exogenous proteins in soil under consecutive cultivation of transgenic cottons(Gossypium hirsutum L.).Plant Soil&Environment,57(2):67-74.
DASSK,VARMA A,2011.Role of enzymes in maintaining soil health∥SHUKLA G,VARMA A.Soil enzymology.Berlin:Springer:25-42.
FARAGOVÁ N, FARAGO J, DRABEKOVA J, 2005.Evaluation of abundance of aerobic bacteria in the rhizosphere of transgenic and non-transgenic alfalfa lines.Folia Microbiologica,50(6):509-514.
FLIEßBACH A, MESSMER M, NIETLISPACH B, INFANTE V,MADER P,2012.Effects of conventionally bred and Bacillus thuringiensis(Bt)maize varieties on soil microbial biomass and activity.Biol Fertil Soils,48(3):315-324.
FLORESS,SAXENA D,STOTZKY G,2005.Transgenic Bt plants decompose less in soil than non-Bt plants.Soil Biology& Biochemistry,37(6):1073-1082.
GES,XU H,JI M,JIANG Y,2013.Characteristics of soil organic carbon, total nitrogen, and C/N ratio in Chinese apple orchards.Open Journal of Soil Science,3(5):213-217.
HANNULA SE,DE BOER W,VAN VEEN J,2012.A 3-year study reveals that plant growth stage,season and field site affect soil fungal communities while cultivar and GM-trait have minor effects.PLoSONE,7(4):e33819.
ICOZ I, SAXENA D, ANDOW D, ZWAHLEN C, STOTZKY G,2008.Microbial populations and enzyme activities in soil in situ under transgenic corn expressing cry proteins from Bacillus thuringiensis.Journal of Environmental Quality,37(2):647-662.
LADD J N, FOSTER R C, NANNIPIERI P, OADES J M,1996.Soil structure and biological activity∥STOTZKY G,BOLLAGJM.Soil Biochemistry,Volume9.New York:Marcel Dekker:23-78.
LIANG J, MENG F, SUN S, WU C, WU H, ZHANG M,ZHANG H,ZHENG X,SONG X,ZHANG Z,2015.Community structure of arbuscular mycorrhizal fungi in rhizospheric soil of a transgenic high-methionine soybean and a near isogenic variety.PLoSONE,10(12):e0145001.
LIANG J, SUN S, JI J, WU H, MENG F, ZHANG M,ZHENG X,WU C,ZHANGZ,2014.Comparison of the rhizosphere bacterial communities of Zigongdongdou soybean and a high-methionine transgenic line of this cultivar.PLoSONE,9(7):e103343.
LIANG J,XIN L,MENG F,SUN S,WU C,WU H,ZHANG M,ZHANG H,ZHENG X,ZHANG Z,2016.High-methionine soybean has no adverse effect on functional diversity of rhizosphere microorganisms.Plant Soil& Environment, 62(10):441-446.
LIU N,ZHU P,PENG C,KANG L,GAO H,CLARKE N,CLARKE J,2010.Effect on soil chemistry of genetically modified(GM)vs.non-GM maize.GM Crops,1(3):157-161.
LIU W,2010.Do genetically modified plants impact arbuscular mycorrhizal fungi.Ecotoxicology,19(2):229-238.
LIU W,LU H,WU W,WEI Q,CHEN Y,THIES J,2008.Transgenic Bt rice does not affect enzyme activities and microbial composition in the rhizosphere during crop development.Soil Biology& Biochemistry,40(2):475-486.
LUPWAYI N, HANSON K, HARKER K, CLAYTON G,BLACKSHAW R, O′DONOVAN J, JOHNSON E, GAN Y,IRVINE R, MONREAL M, 2007.Soil microbial biomass,functional diversity and enzyme activity in glyphosate-resistant wheat-canola rotations under low-disturbance direct seeding and conventional tillage.Soil Biology & Biochemistry,39(7):1418-1427.
MEANSN E, KREMER R J, RAMSIER C, 2007.Effects of glyphosate and foliar amendments on activity of microorganisms in the soybean rhizosphere.Journal of Environmental Science and Health,Part B,42(2):125-132.
MONKIEDJE A, ILORI M O, SPITELLER M, 2002.Soil quality changes resulting from the application of the fungicides mefenoxam and metalaxyl to a sandy loam soil.Soil Biology& Biochemistry,34(12):1939-1948.
MOTAVALLI P,KREMER R,FANG M,MEANSN E,2004.Impact of genetically modified crops and their management on soil microbially mediated plant nutrient transformations.Journal of Environmental Quality,33(3):816-824.
RAO M A,SANNINO F,NOCERINO G,PUGLISI E,GIANFREDA L,2003.Effect of air-drying treatment on enzymatic activities of soils affected by anthropogenic activities.Biol Fertil Soils,38(5):327-332.
SHEN R F,CAI H,GONG W H,2006.Transgenic Bt cotton has no apparent effect on enzymatic activities or functional diversity of microbial communities in rhizosphere soil.Plant Soil,285(1):149-159.
SONG S, HOU W, GODO I, WU C, YU Y, MATITYAHU I,HACHAM Y, SUN S, HAN T, AMIR R, 2013.Soybean seeds expressing feedback-insensitive cystathionineγ-synthase exhibit a higher content of methionine.Journal of Experimental Botany,64(7):1917-1926.
SUN C,CHEN L,WU Z,ZHOU L,SHIMIZU H,2007.Soil persistence of Bacillus thuringiensis(Bt)toxin from transgenic Bt cotton tissues and its effect on soil enzyme activities.Biol Fertil Soils,43(5):617-620.
WANG Y, SHI J, WANG H, LIN Q, CHEN X, CHEN Y,2007.The influence of soil heavy metals pollution on soil microbial biomass, enzyme activity, and community composition near a copper smelter.Ecotoxicology and Environmental Safety,67(1):75-81.
ZHANG Y,XIE M,LI C,WU G,PENGD,2014.Impacts of the transgenic CrylAc and CpTI insect-resistant cotton SGK321 on selected soil enzyme activities in the rhizosphere.Plant Soil& Environment, 60(9):401-406.
Effect of a high-methionine transgenic soybean(Glycine max)on soil organic elements and enzyme activities in the rhizosphere
LIANG Jingang1,2, MENG Fang2, ZHANG Zhengguang2∗
1Development Center of Science and Technology, Ministry of Agriculture, Beijing 100122, China;2College of Plant Protection, Nanjing Agricultural University, Nanjing, Jiangsu 210095, China
【Aim】 In order to evaluate the safety of transgenic high-methionine soybean ZD91 to the soil component of ecosystems,we studied the impact of transgenic soybean ZD91 on the main organic elements and enzyme activities in the soil.【Method】 Rhizosphere soil samples were collected at four different growth stages(seedling, flowering, pod-setting, and maturity)in two consecutive growing seasons,and the effect on soil moisture,pH,a mounts of total Cand total N,and invertase and alkaline phosphatase activities were measured under the laboratory conditions.【Result】 The results showed that growing transgenic soybean ZD91 had no significant effects on soil moisture,pH,the concentrations of main soil organic elements and enzyme activities in rhizosphere compared to similar parameters in soil under non-transgenic soybean.Invertase and alkaline phosphatase activities showed significant differences in different years and different growth stages.【Conclusion】 Transgenic soybean ZD91 is safety for soil ecosystem.
transgenic high-methionine soybean; ZD91; soil organic element; soil enzyme activity
10.3969/j.issn.2095-1787.2017.04.008
2017-05-31 接受日期(Accepted):2017-07-01
转基因生物新品种培育科技重大专项(2016ZX08011-003)
梁晋刚,男,农艺师。研究方向:转基因生物安全评价与检测。E-mail:jgliang0513@sina.com
∗通信作者(Author for correspondence),E-mail:zhgzhang@njau.edu.cn
(责任编辑:杨郁霞)
