结直肠癌组织SHP-2和STAT3蛋白表达及临床意义
2017-12-01谭婉燕马清峰
谭婉燕,马清峰
(1华中科技大学同济医学院附属梨园医院消化科,武汉 430077;2华中科技大学同济医学院附属梨园医院检验科;*通讯作者,E-mail:402140571@qq.com)
结直肠癌组织SHP-2和STAT3蛋白表达及临床意义
谭婉燕1,马清峰2*
(1华中科技大学同济医学院附属梨园医院消化科,武汉 430077;2华中科技大学同济医学院附属梨园医院检验科;*通讯作者,E-mail:402140571@qq.com)
目的 观察STAT3和SHP-2蛋白在结直肠癌中的表达,探讨其与结直肠癌临床病理特征的关系。 方法 采用免疫组织化学法检测168例结直肠癌及40例癌旁正常组织中STAT3和SHP-2的表达情况,分析其表达与结直肠癌临床病理参数的关系;采用Western-blot方法检测40例结直肠癌组织及其癌旁正常组织中STAT3和SHP-2的表达情况。 结果 免疫组化结果显示,STAT3阳性表达率在结直肠癌组织明显高于正常大肠组织,而SHP-2阳性表达率在结直肠癌组织明显低于正常大肠组织,差异均有统计学意义(P<0.05)。Western-blot检测方法显示,在结直肠癌组和正常组中,STAT3的蛋白水平分别为0.421 3±0.112 7和0.301 7±0.079 9,SHP-2的蛋白水平分别为0.239 6±0.065 5和0.766 5±0.113 3,且组间比较差异均有统计学意义(P<0.001)。STAT3蛋白的表达与分化程度、淋巴结转移、远处转移和TNM分期有关,与性别、年龄、浸润程度无关;SHP-2蛋白的低表达与分化程度和淋巴结转移有关,与性别、年龄、浸润程度、远处转移、TNM分期无关。结直肠癌中,STAT3和SHP-2蛋白表达呈负相关(r=-0.501,P<0.05) 结论 在结直肠癌组织中,STAT3高表达,SHP-2低表达,两者可能共同参与了肿瘤发生、发展的过程,并可能成为潜在的治疗靶点。
结直肠癌; STAT3; SHP-2; 免疫组织化学; 蛋白免疫印迹
结直肠癌在我国已成为第三大常见恶性肿瘤[1,2],它的发生与遗传因素、环境因素、饮食因素及慢性肠道炎症等有关。其中慢性炎症诱发结直肠肿瘤是近几年研究的热点之一。
信号转导及转录活化因子3(signal transducer and activator of transcription 3,SATA3)是慢性炎症促进肿瘤相关炎症形成及肿瘤发生过程中的关键节点,它可通过介导炎症介质细胞外信号调控肿瘤细胞、免疫细胞等,使肿瘤细胞存活并促进其持续增生[3]。SHP-2属于蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPase)家族成员之一,有研究证实,SHP-2对STAT3的磷酸化有间接抑制作用,在多种肿瘤的发生、发展中扮演抑癌蛋白的角色[4,5]。本研究通过免疫组化、Western-blot方法检测STAT3和SHP-2蛋白在人结直肠癌组织中的表达情况,分析他们与患者临床病理因素的关系,初步探讨STAT3和SHP-2在结直肠癌发生、发展中的作用,为其应用于临床诊治和预后判断方面提供一定的实验依据。
1 材料与方法
1.1 材料

1.1.2 主要试剂 鼠抗人单克隆STAT3抗体、兔抗人单克隆SHP-2抗体分别购自Bioworld和Abcam公司。免疫组化用STAT3抗体和SHP-2抗体稀释比例分别为1 ∶200和1 ∶100。Western-blot试验用STAT3抗体和SHP-2抗体稀释比例分别为1 ∶600和1 ∶1 000。羊抗兔二抗、DAB显色试剂盒购自博士德公司,ECL发光液购自Thermo Scientific公司,BCA蛋白浓度测定试剂盒购自碧云天公司,GAPDH抗体购自杭州贤至生物有限公司。
1.2 方法
1.2.1 免疫组织化学法检测 168例结直肠癌组织中的STAT3和SHP-2表达采用SABC法,操作按试剂盒说明书进行。组织切片经脱蜡、水化、加热修复抗原、3%过氧化氢溶液消除内源性过氧化物酶活性,1 ∶50羊血清封闭液室温封闭抗原15 min,一抗在4 ℃下孵育过夜(工作浓度1 ∶100),生物素化二抗室温孵育15 min,滴加ABC复合物,DAB显色,苏木精对比染色后封片,光学显微镜下观察,以PBS替代一抗作为阴性对照。
1.2.2 免疫组织化学结果判定 根据蛋白在细胞内的定位,分别以蛋白表达阳性信号强度和阳性表达面积两种指标进行综合评分。计数20个高倍视野的免疫组织化学反应着色的细胞,染色强度积分为:无染色0分,染成淡黄色1分,黄色2分,棕褐色3分;染色面积积分为:着色范围≤10%为0分,10%-25%为1分,25%-50%为2分,50%-75%为3分,>75%为4分。若两者积分之和≥3分则为阳性,低于3分则为阴性。
1.2.3 Western-blot方法检测 40例结直肠癌组织中的STAT3和SHP-2蛋白的表达分别取各组结直肠标本组织,用适量RIPA裂解液匀浆组织,测蛋白浓度后,各样品取50 μg总蛋白上样电泳,根据蛋白分子量配制10%的PAGE胶电泳。根据预染Marker显示,判断目的蛋白得到充分分离后,停止电泳。取出凝胶根据Marker切下目的条带,用蒸馏水冲洗,剪与PAGE凝胶相同大小的PVDF膜和滤纸,然后用半干式电转的方法将蛋白质转移至PVDF膜上,5%牛血清白蛋白37 ℃封闭2 h,1 ∶600的鼠抗STAT3单克隆抗体和1 ∶1 000抗SHP-2单克隆抗体中4 ℃孵育过夜;生物素标记的羊抗兔IgG中37 ℃孵育2 h,DAB显色,见有清晰条带出现即用双蒸水终止显色。所得图像用扫描仪扫描,应用BandScan图像分析系统测量条带的吸光度值,将目的蛋白吸光度值与GAPDH的比值作为结果。
1.3 统计学处理
2 结果
2.1 STAT3和SHP-2在结直肠癌组织和正常结直肠组织中的表达
2.1.1 免疫组化学方法观察STAT3和SHP-2在结直肠癌和正常结直肠组织中的表达 免疫组化染色结果显示,STAT3的阳性表达主要位于细胞质,少部分位于细胞核(见图1),结直肠癌组织中STAT3蛋白表达阳性率为58.3%(98/168),与正常结直肠组织27.5%(11/40)比较,结直肠癌组织中STAT3的表达明显升高,差异有统计学意义(P<0.05)。SHP-2的阳性表达主要位于细胞质,也有少部分位于细胞核(见图2),结直肠癌组织中SHP-2蛋白表达阳性率为25.6%(43/168),与正常结直肠组织42.5%(17/40)比较,结直肠癌组织中SHP-2的表达明显降低,差异有统计学意义(P<0.05)。
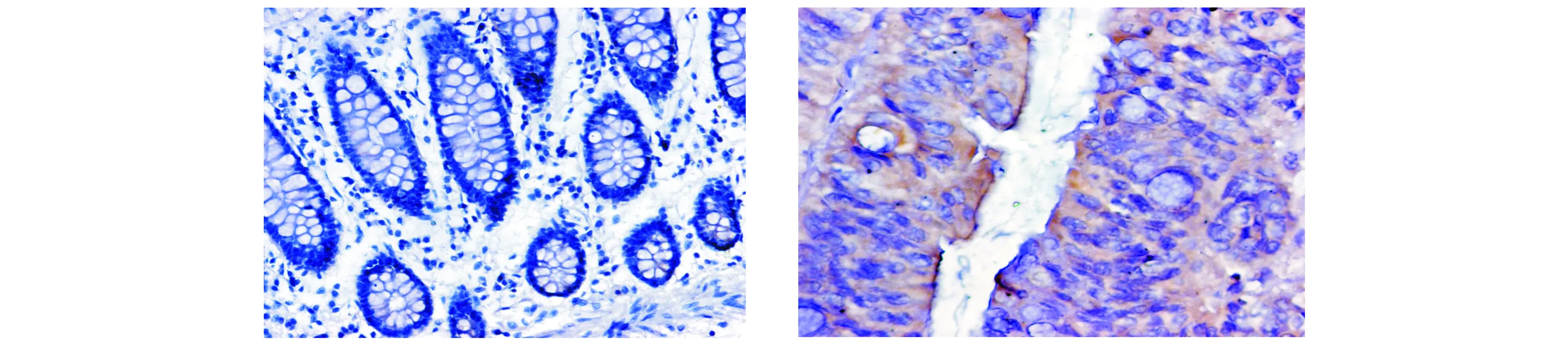
A.正常结直肠组织 B.结直肠癌组织图1 STAT3在结直肠癌和正常结直肠组织中的表达 (SABC,×400)Figure 1 Expression of STAT3 in colorectal carcinoma tissues and normal colorectal tissues (SABC,×400)
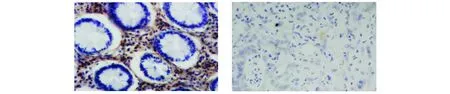
A.正常结直肠组织 B.结直肠癌组织图2 SHP-2在结直肠癌和正常结直肠组织中的表达 (SABC,×400)Figure 2 Expression of SHP-2 in colorectal carcinoma tissues and normal colorectal tissues (SABC,×400)
2.1.2 Western-blot方法观察STAT3和SHP-2在结直肠癌和正常结直肠组织中的表达 STAT3和SHP-2蛋白的定量采用与GAPDH的蛋白水平相比较的方法进行测量。结直肠癌组织中STAT3的蛋白水平为0.421 3±0.112 7,配对正常结直肠组织中STAT3的蛋白水平为0.301 7±0.079 9,两组比较差异有统计学意义(P<0.000 1,见图3)。结直肠癌组织中SHP-2的蛋白水平为0.239 6±0.065 5,配对正常结直肠组织中SHP-2的蛋白水平为0.766 5±0.113 3,两组比较差异有统计学意义(P<0.000 1,见图4)。
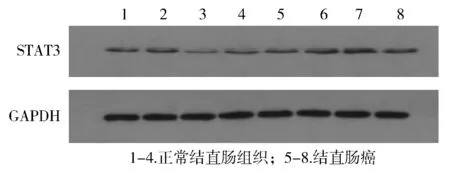
图3 正常结直肠组织和结直肠癌中STAT3的Western blot分析Figure 3 Expression of STAT3 protein in colorectal carcinoma tissues and matched adjacent nontumor tissues by Western blot
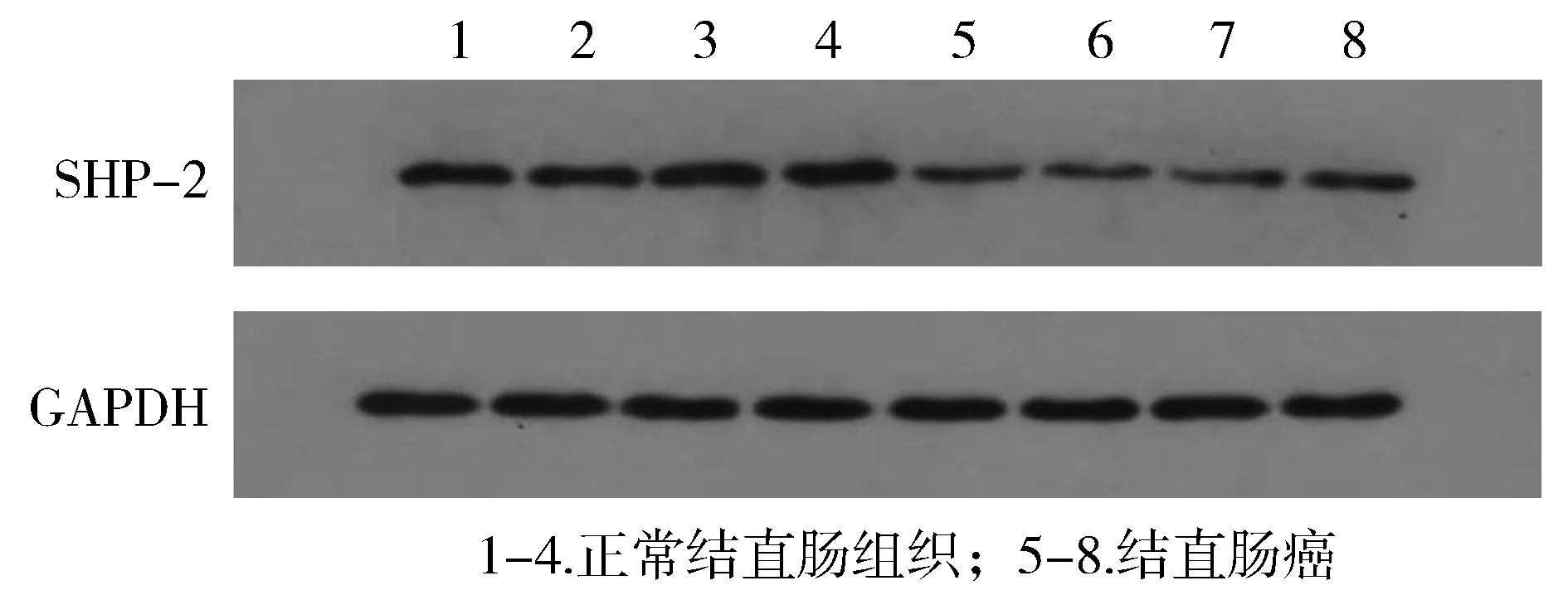
图4 正常结直肠组织和结直肠癌中SHP-2的Western blot分析Figure 4 Expression of SHP-2 protein in colorectal carcinoma tissues and matched adjacent nontumor tissues by Western blot
2.2 STAT3和SHP-2在结直肠癌组织表达与临床病理特征之间的关系
结直肠癌组织中,STAT3的表达与分化程度、淋巴转移、远处转移和TNM分期相关(P<0.05),而与年龄、性别、浸润程度无关(P>0.05);SHP-2的表达与分化程度、淋巴转移相关(P<0.05),而与年龄、性别、浸润程度、远处转移、TNM分期无关(P>0.05,见表1)。
表1STAT3和SHP-2在结直肠癌组织中表达与临床病理特征的关系例(%)
Table1ExpressionofSTAT3andSHP-2incolorectalcarcinomapatientswithdifferentclinicopathologicalfeaturescases(%)
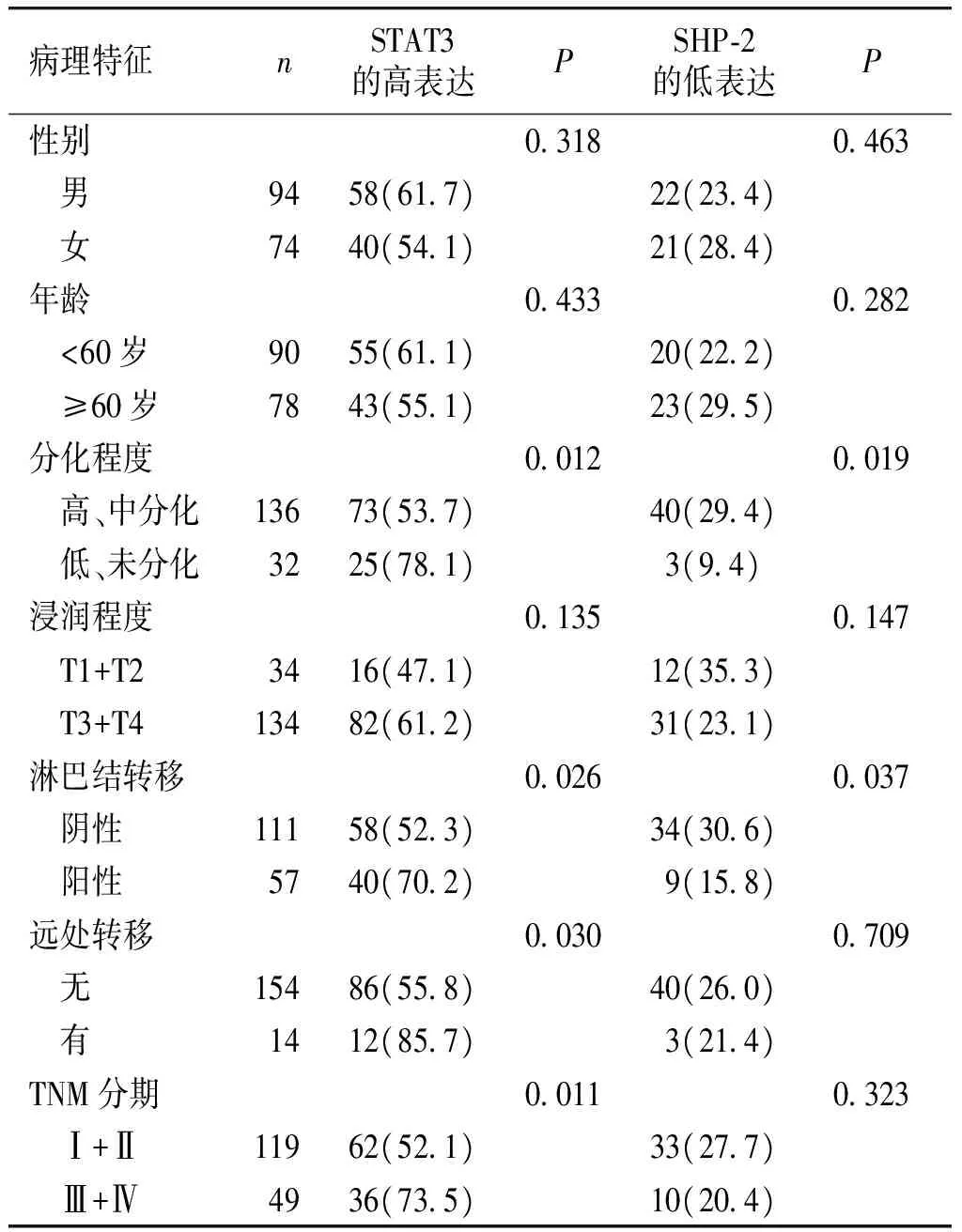
病理特征nSTAT3的高表达PSHP⁃2的低表达P性别03180463 男9458(617)22(234) 女7440(541)21(284)年龄04330282 <60岁9055(611)20(222) ≥60岁7843(551)23(295)分化程度00120019 高、中分化13673(537)40(294) 低、未分化3225(781)3(94)浸润程度01350147 T1+T23416(471)12(353) T3+T413482(612)31(231)淋巴结转移00260037 阴性11158(523)34(306) 阳性5740(702) 9(158)远处转移00300709 无15486(558)40(260) 有1412(857) 3(214)TNM分期00110323 Ⅰ+Ⅱ11962(521)33(277) Ⅲ+Ⅳ4936(735)10(204)
2.3 STAT3和SHP-2蛋白表达的相关性
Spearman等级相关分析显示,结直肠癌组织中,STAT3和SHP-2蛋白表达呈负相关(r=-0.501,P<0.05)。
3 讨论
全球每年有超过120万的结直肠癌新发病例,其中约20%具有家族遗传性,其他结直肠癌的发生与不良生活习惯、肠道的共生菌和病原体以及慢性肠道炎症有关,其中由慢性炎症诱发的结直肠癌近几年受到广泛关注。菌群失调、组织损伤及坏死产物均能激活免疫细胞中STAT3通路,使其持续活化,后者能继续刺激肿瘤微环境中的免疫细胞产生过多的细胞因子;而过多的细胞因子、趋化因子及活性氧等则诱发了DNA突变,这些细胞在慢性炎症作用下通过抑制凋亡、加速增殖,最终导致了肿瘤的发生[6-8]。
信号转导及转录活化因子3(signal transducer and activator of transcription 3,STAT3)是STATs家族成员之一。STAT3在调控炎症反应和免疫反应中有着非常重要的作用,同时也是众多致癌信号通路的重要衔接点。一般情况下,细胞因子、生长因子等可与细胞表面相应受体结合,从而启动细胞内酪氨酸激酶磷酸化的级联反应,胞质中的STAT3可自身活化,活化的STAT3可转至细胞核内,发挥转录调控的作用。当某些细胞因子、致癌因子激活SATA3时,异常活化的SATA3可调控下游分子如c-Myc、Cyclin Dl、Bcl-2等抗凋亡及细胞生存等相关蛋白的表达,维持炎症反应,促进肿瘤细胞增殖,减少细胞死亡[9]。有研究发现[10-14],肝癌、胃癌、结肠癌、肺癌、乳腺癌等肿瘤中的STAT3活性均发生高频率的异常活化,且活化程度与肿瘤患者的预后呈显著负相关。本研究发现,STAT3在结直肠癌组织中表达明显高于正常组织,且与肿瘤的分化程度、淋巴转移、远处转移和TNM分期密切相关。STAT3可能参与了结直肠癌发生、发展的进程,并在结直肠癌侵袭、转移过程中发挥着重要作用。
SHP-2属于蛋白酪氨酸磷酸酶(Protein tyrosine phosphatase,PTPase)家族成员之一,具有两个SH2功能域和一个PTP功能域,其中SH2功能域是与酪氨酸磷酸蛋白质的结合位点,两者结合后使PTP酶激活,从而作为多种生长因子(如PDGF、EGF、IGF-1等)胞外刺激因素的下游信号分子,参与信号转导。SHP-2能够直接或者间接地调控STAT磷酸化,从而影响其转录活性[15-16]。有研究表明[17],SHP2能够通过JAK1/2及STAT3的去磷酸化,负向调控JAK/STAT3通路的功能,抑制STAT3的激活[18-20]。Toso等[21]发现,在前列腺癌中,SHP2与抑癌蛋白PTEN正向相关,通过下调JAK/STAT3通路的活性发挥抑癌功能。Bard-Chapeau等[22]亦发现,SHP-2在肝细胞中对STAT3有重要的负调控作用,在肝细胞中敲除SHP-2可导致STAT3磷酸化水平明显增高,使肝脏中的炎症信号增强,从而推动了炎症引发的肝癌形成。因此,肠组织中SHP2可通过STAT3通路,促进STAT3的持续活化,影响了肠上皮细胞的增殖分化,调节肠道炎症的发生,从而调控结直肠癌的起始与进展。本实验免疫组化和Western-blot结果表明,与正常结直肠组织比较,STAT3在结直肠癌中表达明显上调,SHP-2明显下调。同时,SHP-2的表达与结直肠癌的分化程度和淋巴结转移密切相关,在分化程度较低及出现淋巴结转移的患者中,SHP-2的阳性表达率明显降低。SHP-2表达下降有可能成为结直肠癌淋巴转移及不良预后的标志物,并可能成为潜在的治疗靶点。
总之,在结直肠癌中,STAT3表达上调,SHP-2的表达下调,二者的表达呈负相关。SHP-2可能通过负向调控STAT3通路来发挥抑癌作用,但具体作用机制和信号通路有待进一步研究。
[1] Douaiher J, Ravipati A, Grams B,etal. Colorectal cancer-global burden, trends, and geographical variations[J]. J Surg Oncol, 2017, 115(5):619-630.
[2] 张玥,石菊芳,黄慧瑶,等.中国人群结直肠癌疾病负担分析[J].中华流行病学杂志,2015,36(7):709-714.
[3] Yu H, Pardoll D, Jove R. STATs in cancer inflammation and immunity: a leading role for STAT3[J]. Nat Rev Cancer, 2009, 9(11): 798-809.
[4] Zhang L, Yang Z, Ma A,etal. Growth arrest and DNA damage 45G down-regulation contributes to Janus kinase/signal transducer and activator of transcription 3 activation and cellular senescence evasion in hepatocellular carcinoma[J]. Hepatology, 2014, 59(1): 178-189.
[5] Bard-Chapeau EA, Li S, Ding J,etal. Ptpn11/Shp2 acts as a tumor suppressor in hepatocellular carcinogenesis[J]. Cancer Cell, 2011,19(5): 629-639.
[6] Iliopoulos D, Hirsch HA, Struhl K. An epigenetic switch involving NF-kappaB, Lin28, Let-7 MicroRNA, and IL6 links inflammation to cell transformation[J].Cell,2009,139(4):693-706.
[7] Greten FR, Karin M. NF-κB linking inflammation and immunity to cancer development and progression[J]. Nat Rev Immunol, 2005,5(10):749-759.
[8] Grivennikov S, Karin E, Terzic J,etal. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitisassociated cancer[J]. Cancer Cell, 2009,15(2):103-113.
[9] 侯嘉杰,孙倍成.STAT3:慢性炎症介导肿瘤发生和进展的关键节点[J].生物化学与生物物理进展,2014,41(1):69-78.
[10] Morikawa T, Baba Y, Yamauchi M,etal. STAT3 expression,molecular features, inflammation patterns, and prognosis in a database of 724 colorectal cancers[J]. Clin Cancer Res, 2011, 17 (6):1452-1462.
[11] Schütz A , Röser K , Klitzsch J ,etal. Lung adenocarcinomas and lung cancer cell lines show association of MMP-1 expression with STAT3 activation[J].Transl Oncol, 2015, 8 (2): 97-105.
[12] Ku JM, Kim SR, Hong SH,etal. Cucurbitacin D induces cell cycle arrest and apoptosis by inhibiting STAT3 and NF-κB signaling in doxorubicin-resistant human breast carcinoma (MCF7/ADR) cells[J]. Mol Cell Biochem, 2015,409 (1-2): 33-43.
[13] Cai QW, Li J, Li XQ,etal.Expression of STAT3, MMP-1 and TIMP-1 in gastric cancer and correlation with pathological features[J]. Mol Med Report,2012,5 (6): 1438-1442.
[14] Kao JT, Feng CL, Yu CJ,etal. IL-6, through p-STAT3rather than p-STAT1, activates hepatocarcinogenesis and affects survival of hepatocellular carcinoma patients: a cohort study[J]. BMC Gastroenterol, 2015,15(1): 50-60.
[15] Leibowitz MS, Srivastava RM, Andrade Filho PA,etal. SHP2 is overexpressed and inhibits p STAT1-mediated APM component expression, T-cell attracting chemokine secretion, and CTL recognition in head and neck cancer cells[J]. Clin Cancer Res, 2013, 19(4): 798-808.
[16] Dittrich A, Quaiser T, Khouri C,etal. Model-driven experimental analysis of the function of SHP-2 in IL-6-induced Jak/STAT signaling[J].Mol Biosyst, 2012,8 (8): 2119-2134.
[17] Mohi MG, Neel BG. The role of Shp2 (PTPN11) in cancer[J].Curre Opin Genet Dev, 2007, 17(1): 23-30.
[18] Toso A, Revandkar A, Di Mitri D,etal. Enhancing chemotherapy efficacy in pten-deficient prostate tumors by activating the senescence-associated antitumor immunity[J].Cell Rep, 2014, 9(1): 75-89.
[19] Sturla LM, Zinn PO, Ng K,etal. Src homology domain-containing phosphatase 2 suppresses cellular senescence in glioblastoma[J].Br J Cancer, 2011, 105(8): 1235-1243.
[20] Zhang W, Chan RJ, Chen H,etal. Negative regulation of Stat3 by activating PTPN11 mutants contributes to the pathogenesis of Noonan syndrome and juvenile myel-omonocytic leukemia[J]. J Biol Chem, 2009, 284(33): 22353-22363.
[21] Toso A, Revandkar A, Di Mitri D,etal. Enhancing chemotherapy efficacy in Pten-deficient prostate tumors by activating the senescence-associated antitumor immunity[J].Cell Rep, 2014, 9(1): 75-89.
[22] Bard-Chapeau EA,Li S,Ding J,etal.Ptpn11/Shp2 acts as a tumor suppressor in hepatocellular carcinogenesis[J].Cancer Cell,2011,19(5):629-639.
ExpressionandclinicalsignificanceofSHP-2andSTAT3incolorectalcarcinoma
TAN Wanyan1,MA Qingfeng2*
(1DepartmentofGastroenterology,LiyuanHospital,TongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology,Wuhan430077,China;2DepartmentofClinicalLaboratory,LiyuanHospital,TongjiMedicalCollegeofHuazhongUniversityofScienceandTechnology;*Correspondingauthor,E-mail:402140571@qq.com)
ObjectiveTo investigate the expression of STAT3 protein and SHP-2 protein in colorectal carcinoma(CRC), and to explore its relationships with clinical characteristics.MethodsImmunohistochemisty was used to detect the expression of STAT3 and SHP-2 in 168 cases of CRC tissues and 40 cases of normal tissues. The expression of STAT3 and SHP-2 was compared between patients with different clinicopathological features of CRC. The expression of STAT3 and SHP-2 in 40 cases of CRC tissues and matched adjacent non-tumor tissues was detected by Western-blot.ResultsThe results of immunohistochemisty demonstrated that the positive expression rate of STAT3 protein in 168 cases of CRC was significantly higher than that of normal tissues(P<0.05), but the positive expression rate of SHP-2 protein in 168 cases of CRC was significantly lower than that of normal tissues(P<0.05). Western-blot results showed that STAT3 protein in CRC was higher than that of matched adjacent non-tumor tissues(0.421 3±0.112 7vs0.301 7±0.079 9,P<0.05), but SHP-2 protein level in CRC was lower than that of matched adjacent non-tumor tissues(0.239 6±0.065 5vs0.766 5±0.113 3,P<0.001). The expression of STAT3 in CRC tissues was correlated with differentiation grade,lymph node metastasis,distant metastasis and TNM stage, but not related to gender, age and invasion depth. The expression of SHP-2 in CRC tissues was correlated with differentiation grade and lymph node metastasis, but not related to gender, age, invasion depth, distant metastasis and TNM stage. The expression of STAT3 protein was negatively correlated with the expression of SHP-2 in colorectal carcinoma protein(r=-0.501,P<0.05).ConclusionThe expression of STAT3 is higher but SHP-2 is lower in CRC patients, suggesting that the two proteins may be involved in the evolution and development process of CRC, which may be used as potential therapeutic targets in the treatment.
colorectal carcinoma; STAT3; SHP-2; immunohistochemistry; Western-blot
湖北省自然科学基金资助项目(2014CFB434)
谭婉燕,女,1978-12生,硕士,副主任医师,E-mail:2898077793@qq.com
2017-07-30
R735.3
A
1007-6611(2017)11-1172-05
10.13753/j.issn.1007-6611.2017.11.018
