连接链对包含CisoDGRC结构抗菌肽诱导乳腺癌细胞凋亡的影响
2017-12-01岳晨莉
侯 磊,岳晨莉,何 莉,贾 辉,白 俊*
(1陕西省人民医院肿瘤内科,西安 710068;2武警陕西省总队医院呼吸内科;3西安交通大学第二附属医院肿瘤科;*通讯作者,E-mail:edgemen@163.com)
连接链对包含CisoDGRC结构抗菌肽诱导乳腺癌细胞凋亡的影响
侯 磊1,岳晨莉2,何 莉1,贾 辉3,白 俊1*
(1陕西省人民医院肿瘤内科,西安 710068;2武警陕西省总队医院呼吸内科;3西安交通大学第二附属医院肿瘤科;*通讯作者,E-mail:edgemen@163.com)
目的 分别使用LLII和GG寡肽作为连接链,构建包含CisoDGRC结构的抗菌肽(CDAK,CGAK),探讨连接链的不同对包含CisoDGRC结构抗菌肽诱导αvβ3阳性乳腺癌细胞凋亡能力的影响。 方法 不同浓度CDAK(LLII)与CGAK(GG)作用于MDA-MB-231细胞24 h,使用CCK-8计算CDAK与CGAK的半数致死量(IC50)。PBS(control)、随机肽(CRLK)、CDAK(LLII)与CGAK(GG)分别作用于MDA-MB-231细胞24 h,流式细胞仪分析四组细胞凋亡率和线粒体膜电位,Western-blot分析四组细胞中cleaved-Caspase-3蛋白表达情况。 结果 在MDA-MB-231细胞中,CGAK IC50较CDAK减少。CGAK组和CDAK组较control组和CRLK组,凋亡细胞比例与cleaved-Caspase-3蛋白相对表达量增多(P<0.05),线粒体膜电位降低(P<0.05)。CGAK组相较CDAK组,凋亡细胞比例及cleaved-Caspase-3蛋白相对表达量增多(P<0.05),膜电位之间差异无统计学意义(P>0.05)。CRLK组与control组各指标差异无统计学意义(P>0.05)。 结论 作为连接链,GG较LLII能够进一步提高包含CisoDGRC结构抗菌肽诱导αvβ3阳性乳腺癌细胞凋亡的能力。
连接链; 乳腺癌; 抗菌肽; 细胞凋亡
近年来由于噬菌体展示技术的运用,越来越多的能够特异性识别肿瘤的小分子多肽被发现[1]。多肽相对于蛋白质来讲,长度仅为10-30个氨基酸,具有较低的免疫原性和抗耐药性,并且高效低毒,易于合成、重组与改造,成为抗肿瘤新药开发的良好生物分子[2]。目前,利用多肽抗肿瘤的研究中,多肽复合物通常由3部分构成,2个功能结构域和1个连接域[3-5]。两个功能结构域分别扮演着肿瘤导向作用和肿瘤杀伤或示踪作用,可将其称为引导域和功能域。引导域通常模仿一些配体和抗体的识别序列,能够特异性识别并结合肿瘤细胞膜上相对高表达的受体。如NGR序列,能够特异性识别肿瘤细胞表面高表达的氨基肽酶N(CD13),而研究进一步发现,NGR不仅能够识别CD13,而且能够通过脱酰胺作用转变成isoDGR结构,使其对一种在肿瘤细胞膜上高表达的黏附因子αvβ3具有较高的亲和力,并且发现isoDGR结构通过双硫键形成的环形结构(CisoDGRC)能够进一步增加其亲和力与稳定性[6,7]。因此对于αvβ3阳性肿瘤细胞,CisoDGRC结构是一种理想的引导域选择。功能域通常由具有诱导肿瘤细胞凋亡和抑制其增殖的活性物质构成[8,9]。如抗菌肽,因其肽链具有阳离子的α-螺旋结构,使其能够与肿瘤细胞膜及线粒体膜所带负电荷的磷脂相互作用,进而诱导细胞凋亡,所以常被作为一种抗肿瘤活性物质,目前已发现超过190种具有抗肿瘤功能的抗菌肽[10,11]。因(KLAKLAK)2结构具备抗菌肽所特有的阳离子α-螺旋结构,因此常被作为抗菌肽用于研究[12]。本研究在前期实验中使用CisoDGRC作为引导域,(KLAKLAK)2结构作为功能域,构建了一种针对αvβ3阳性乳腺癌细胞特异性的抗肿瘤多肽,并在实验中验证了其具有特异性识别和杀伤αvβ3阳性乳腺癌细胞的能力[13]。
目前,该领域研究主要集中在筛选较强特异性和更高亲和力的引导域与更具杀伤性的功能域,对于连接链的关注较少。然而连接链的不同能够影响多肽空间结构,而空间结构的改变能够进一步影响整个多肽的活性,因此连接链也是一个需要重视的领域。本研究中,在前期已构建的抗肿瘤多肽基础上,结合文献报道[12,14],在引导域和功能域不变的情况下,将连接链由LLII序列更换为GG结构,比较更换后抗肿瘤多肽在诱导αvβ3阳性乳腺癌细胞凋亡能力上是否发生了改变。
1 材料与方法
1.1 主要试剂
L-15不完全培养液购买于江苏凯基生物技术股份有限公司,肽牛血清购买于杭州四季青生物工程材料有限公司。兔抗人cleaved-Caspase-3抗体购买于美国cell signaling technology公司。Annexin-Ⅴ/PI双染凋亡试剂盒、CCK-8试剂盒购买于上海七海复泰生物科技有限公司。免疫印迹增强化学发光法试剂盒购买于美国Thermo公司。蛋白裂解液(Ripa)购买于陕西先锋生物科技有限公司。
1.2 细胞株与多肽合成

1.3 细胞培养
MDA-MB-231细胞采用L-15不完全培养液(含10%肽牛血清)在5%CO2、饱和湿度、37 ℃培养箱内培养。毎2-3 d传代1次,待细胞处于对数生长期后行后续实验。
1.4 细胞毒性检测
MDA-MB-231细胞接种于96孔板,用含不同浓度CDAK(20,40,100,200,400 μg/ml)、CGAK(20,40,100,200,400 μg/ml)培养液100 μl孵育24 h,设4个复孔,结束培养前4 h各孔中加入10 μl CCK-8溶液,酶标仪读取各孔A450值,取均值,未加多肽孔代表100%细胞存活,计算细胞存活百分比。使用软件Graphpad Prism 5.0计算细胞半数致死量(IC50)。
1.5 流式细胞仪分析细胞凋亡
用含PBS(多肽同体积)、CRLK(200 μg/ml)、CDAK(200 μg/ml)、CGAK(200 μg/ml)培养液孵育MDA-MB-231细胞24 h,胰酶消化细胞后,取5×105细胞加入500 μl 1×Binding Buffer重悬,加入5 μl AnnexinⅤ-FITC室温避光15 min,10 μl PI冰浴5 min,400目筛网滤过细胞悬液后上机检测。同时以不加AnnexinⅤ-FITC及PI的细胞悬液作为阴性对照。
1.6 流式细胞仪分析线粒体膜电位
用含PBS(多肽同体积)、CRLK(200 μg/ml)、CDAK(200 μg/ml)、CGAK(200 μg/ml)培养液孵育MDA-MB-231细胞24 h,胰酶消化细胞,PBS洗涤细胞2次,加入JC-1工作液500 μl,将细胞均匀悬浮,细胞培养箱中37 ℃孵育20 min,JC-1缓冲液洗涤2次,重悬后400目筛网滤过细胞,流式细胞仪分析。
1.7 Western-blot检测cleaved-Caspase-3蛋白
用含PBS(多肽同体积)、CRLK(200 μg/ml)、CDAK(200 μg/ml)、CGAK(200 μg/ml)培养液孵育MDA-MB-231细胞24 h,含有蛋白酶抑制剂的裂解液提取蛋白,BCA法测定蛋白浓度。相同剂量蛋白样品使用SDS-PAGE分离,目的条带使用PVDF膜转膜,含5%脱脂牛奶的TBS-T封闭2 h,加一抗后4 ℃温育过夜,TBS-T洗3次,每次15 min,加相应二抗,室温温育1 h,TBS-T洗3次,每次15 min,ECL发光法检测蛋白表达状况。胶片扫描成图片后使用Image-Pro Plus软件进行灰度值分析。
1.8 统计学分析

2 结果
2.1 多肽对MDA-MB-231细胞毒性
使用CCK-8检测CDAK、CGAK对MDA-MB-231细胞毒性,并计算IC50值。CDAK、CGAK对细胞均有生长抑制作用(P<0.05,见图1),且呈现剂量依赖性。24 h的IC50(半数致死量)分别为:263 μg/ml(CDAK)、218 μg/ml(CGAK)。实验结果表明,两种多肽均能抑制MDA-MB-231细胞生长,且相对于CDAK,CGAK细胞毒性更大。
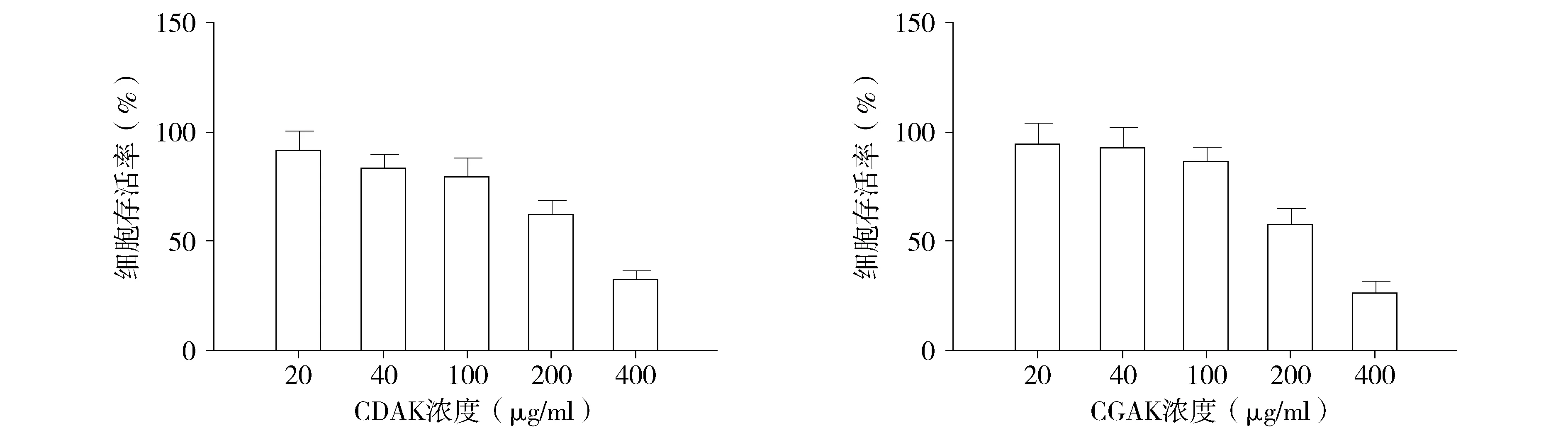
图1 不同浓度CDAK和CGAK作用于MDA-MB-231细胞24 h的细胞存活率Figure 1 Cell survival rate of MDA-MB-231 cells treated with different concentrations of CDAK or CGAK for 24 h
2.2 多肽对MDA-MB-231细胞凋亡的影响
流式细胞仪检测CDAK、CGAK、CRLK对MDA-MB-231细胞凋亡的影响,结果显示:CDAK、CGAK、CRLK作用24 h后,MDA-MB-231凋亡率分别为(22±2.61)%,(32±2.77)%,(10±1.02)%。结果表明,相对于control,CDAK、CGAK均能诱导MDA-MB-231细胞凋亡(P<0.05),而CRLK对细胞凋亡并无明显影响(P>0.05,见图2)。CGAK相较于CDAK,诱导细胞凋亡能力明显增加,且差异具有统计学意义(P<0.05,见图2)。提示CGAK具有更强诱导MDA-MB-231细胞凋亡的能力。
2.3 多肽对MDA-MB-231细胞线粒体膜电位的影响
流式细胞仪检测CDAK、CGAK、CRLK对MDA-MB-231细胞线粒体膜电位的影响,结果显示:CDAK、CGAK、CRLK孵育细胞24 h,反应MDA-MB-231细胞线粒体膜电位的荧光比值分别为1.8±0.24,1.7±0.37,3.4±0.33。结果表明,相对于control组,CDAK和CGAK能够明显降低细胞线粒体膜电位(P<0.05),但CDAK组与CGAK组之间差异无统计学意义(P>0.05),而CRLK对细胞线粒体膜电位并无明显影响(P>0.05,见图3)。表明CDAK、CGAK均具有损伤MDA-MB-231细胞线粒体膜的功能,但两者之间差异并无统计学意义。
2.4 多肽对MDA-MB-231细胞cleaved-Caspse-3蛋白的影响
使用Western-blot检测cleaved-Caspase-3蛋白表达,结果显示:相较于control组,CDAK组和CGAK组细胞cleaved-Caspase-3蛋白相对表达量均增加(P<0.05),且CGAK组蛋白相对表达量高于CDAK组(P<0.05)。CRLK组蛋白相对表达量较control组差异无统计学意义(P>0.05,见图4)。表明CDAK与CGAK均能诱导cleaved-Caspase-3蛋白表达,并且相较于CDAK,CGAK能够诱导更多cleaved-Caspase-3蛋白表达。
3 讨论
抗菌肽由富含正电荷的两性氨基酸构成,与带负电荷的细胞膜能够相互作用,通过电子吸引力作用于细胞膜,极性区域插入胞膜内,导致胞膜稳定性下降,进而破坏细胞膜引起细胞凋亡、死亡,或是形成孔道使抗菌肽进入细胞内,损伤线粒体膜诱导凋亡发生。肿瘤细胞膜由于其表面易暴露更多的负电磷脂,细胞膜稳定性差,因而对抗菌肽更加敏感[15,16]。本研究中构建的两条抗菌肽,不仅抑制了乳腺癌细胞MDA-MB-231的增殖,并且诱导了其凋亡的发生,促进了Caspase-3的生成。进一步证实了抗菌肽能够诱导肿瘤细胞凋亡发生。同时线粒体膜电位检测,证实两种多肽均能损伤MDA-MB-231细胞线粒体进而诱导细胞凋亡。
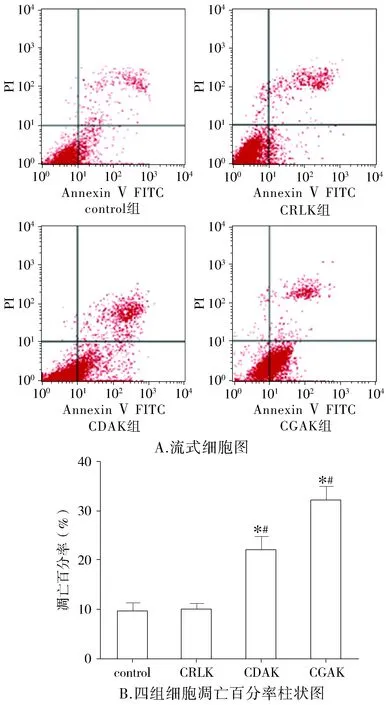
与control组比较,*P<0.05;与左侧相邻组比较,#P<0.05图2 流式细胞仪检测不同多肽作用MDA-MB-231细胞24 h细胞凋亡率Figure 2 The apoptosis of MDA-MB-231 cells treated with different peptides for 24 h analyzed using flow cytometry
为了提高抗菌肽的肿瘤特异性杀伤作用,目前研究多是通过增加一个有效载体,携带抗菌肽定位于肿瘤组织,发挥治疗作用。随着噬菌体展示技术发展,已筛选出众多能够特异性识别和结合肿瘤细胞表面受体的小分子多肽。如经典的RGD模序和NGR模序,可以靶向定位于肿瘤和肿瘤血管。本研究构建的抗菌肽选择了CisoDGRC序列作为载体。isoDGR由NGR序列脱酰胺作用后生成,NGR到isoDGR转变失去其识别CD13的能力,但获得可结合avb3的能力[6]。avb3是一种整合素,在肿瘤细胞上过表达,负责黏附和迁移。同时对isoDGR序列的研究表明,环状isoDGR(CisoDGRC)具有二硫桥限制的基序可增加肿瘤靶向效率和弯曲构象的稳定性[7]。因此,本研究前期实验选择CisoDGRC序列作为载体,引导抗菌肽作用于CD13(-)avb3(+)乳腺癌细胞[13],结果表明,构建的抗菌肽CDAK的确能够特异性识别CD13(-)avb3(+)乳腺癌细胞MDA-MB-231。
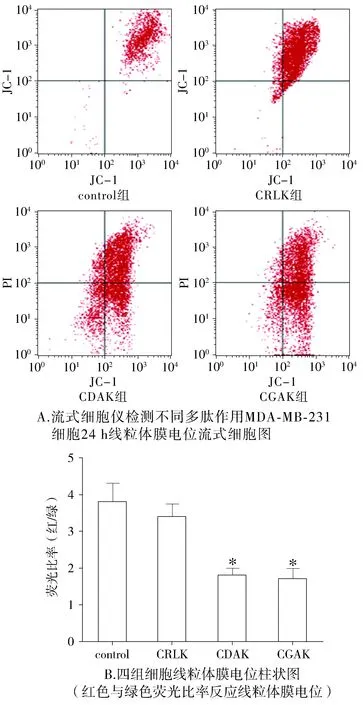
与control组比较,*P<0.05图3 流式细胞仪检测不同多肽作用MDA-MB-231细胞24 h线粒体膜电位Figure 3 The mitochondrial membrane potential of MDA-MB-231 cells treated with different peptides for 24 h analyzed using flow cytometry
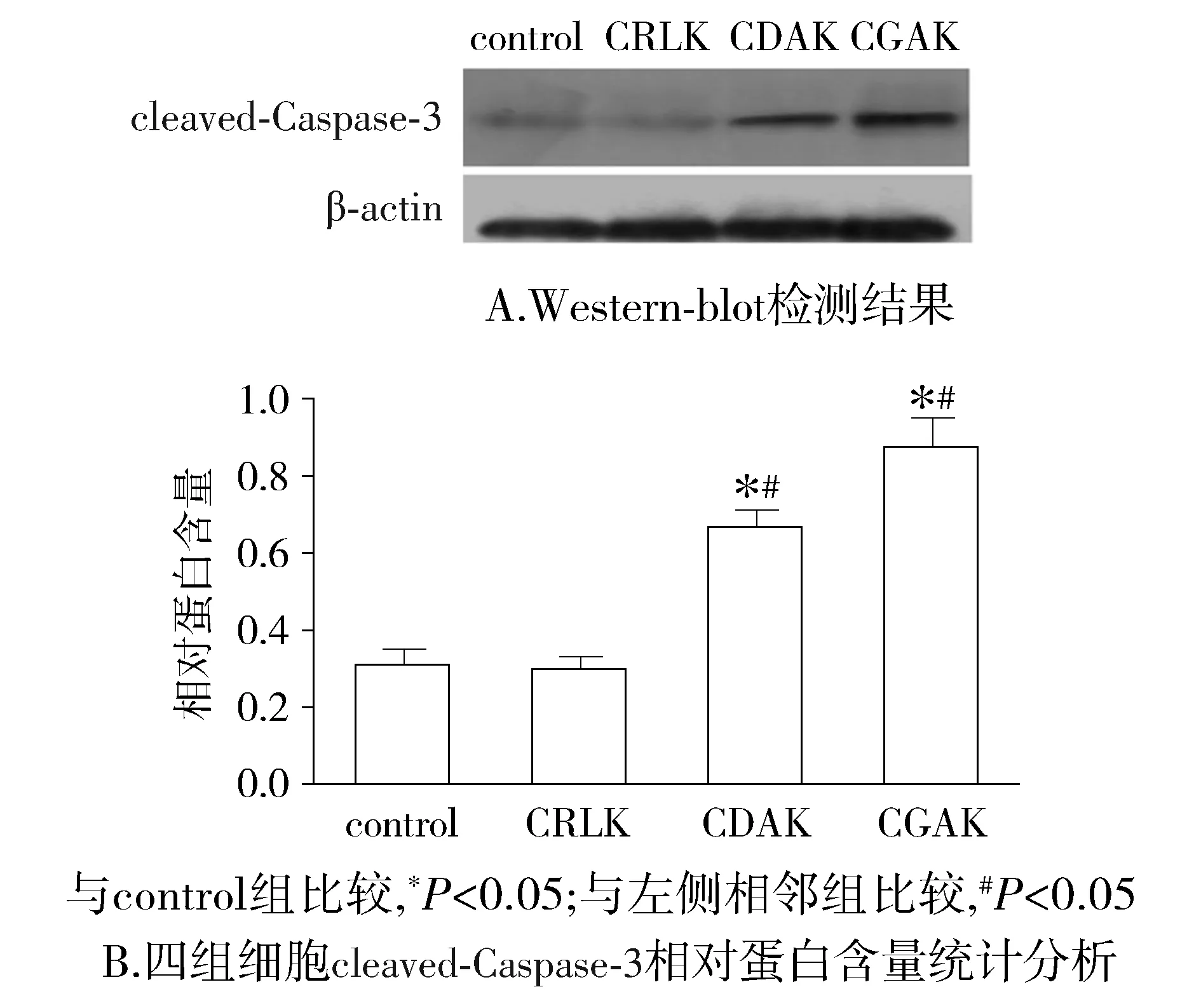
图4 Western-blot检测不同多肽作用MDA-MB-231细胞24 h cleaved-Caspase-3蛋白表达Figure 4 The protein expression of cleaved-Caspase-3 in MDA-MB-231 cells treated with different peptides for 24 h analyzed using Western-blot
目前对于抗肿瘤多肽研究,主要集中在寻找一个更加有效的载体和抗肿瘤活性更强的多肽上。而对于构成抗肿瘤多肽非常关键的连接部分缺乏足够重视。众所周知,蛋白质的功能与其空间结构密切相关,而空间结构主要受氨基酸序列影响。因此,氨基酸序列不同可以影响到多肽结构,进而导致其功能改变。本实验中,将已证实具有识别avb3阳性乳腺癌细胞,并能够诱导其凋亡的抗菌肽CDAK,所含有的连接链进行改造。通过查阅文献,选择连接链GG结构,理论上甘氨酸残基由于分子结构小,不能形成稳定的α螺旋或β折叠结构,使多肽具有更加灵活的活动度和弯曲性,增加了抗菌肽部分靠近细胞膜的几率,进而能够增加其抗肿瘤活性。本实验结果也表明,连接链的改变的确增加了抗菌肽诱导MDA-MB-231凋亡的能力,但检测线粒体膜电位结果显示,CGAK相对于CDAK在降低线粒体膜电位上并无明显优势。为何凋亡率增加而线粒体膜电位无改变,需要进一步去研究。同时,连接链的改变是否在体内实验中有一致结果,在其他抗肿瘤多肽中是否也能改变多肽的抗瘤活性,及是否还存在更加合适的连接链为本课题组进一步的研究方向。
[1] 夏江华,冯军.多肽偶联药物的研究进展[J].世界临床药物,2014,35(9):556-559.
[2] 孙立春.受体靶向多肽载体抗肿瘤药物[J].上海医药,2015,36(1):69-74.
[3] Huang D, Zhang S, Zhong T,etal. Multi-targeting NGR-modified liposomes recognizing glioma tumor cells and vasculogenic mimicry for improving anti-glioma therapy[J]. Oncotarget, 2016, 7(28):43616-43628.
[4] 刘惊涛,惠晓丽,刘秦元,等.肿瘤血管内皮特异性靶向肽GX1与NGR在胃癌中显像差异分析[J].现代肿瘤医学,2014,22(4):729-732.
[5] 杨芳,何冰,代文兵,等.肿瘤转移靶向肽修饰的阿霉素脂质体对高转移性乳腺癌细胞的靶向特异性研究[J].中国药学,2014,23(2):83-88.
[6] Corti A, Curnis F. Isoaspartate-dependent molecular switches for integrin—ligand recognition[J]. J Cell Sci, 2011,124(Pt 4):515-522.
[7] Curnis F, Cattaneo A, Longhi R,etal. Critical role of flanking residues in NGR-to-isoDGR transition and CD13/integrin receptor switching[J]. J Biol Chem, 2010, 285(12):9114-9123.
[8] Corti A, Curnis F, Rossoni G,etal. Peptide-mediated targeting of cytokines to tumor vasculature: the NGR-hTNF example[J]. BioDrugs, 2013, 27(6):591-603.
[9] Curnis F, Fiocchi M, Sacchi A,etal. NGR-tagged nano-gold: a new CD13-selective carrier for cytokine delivery to tumors[J]. Nano Res, 2016, 9(5):1393-1408.
[10] Tonk M, Vilcinskas A, Rahnamaeian M. Insect antimicrobial peptides: potential tools for the prevention of skin cancer[J].Appl Microbiol Biotechnol, 2016,100(17):7397-7405.
[11] Kuroda K, Fukuda T, Krstic-Demonaco MS,etal. miR-663a regulates growth of colon cancer cells, after administration of antimicrobial peptides, by targeting CXCR4-p21 pathway[J]. BMC Cancer, 2017, 17(1):33.
[12] Bouchet S, Tang R, Fava F,etal. The CNGRC-GG-D(KLAKLAK)2 peptide induces a caspase-independent, Ca2+-dependent death in human leukemic myeloid cells by targetingsurface aminopeptidase N/CD13[J]. Oncotarget, 2016, 7(15):19445-19467.
[13] Hou L, Zhao X, Wang P,etal. Antitumor activity of antimicrobial peptides containing cisoDGRC in CD13 negative breast cancer cells[J]. PLoS One, 2013, 8(1):e53491.
[14] Ellerby HM, Arap W, Ellerby LM,etal. Anti-cancer activity of targeted pro-apoptotic peptides[J].Nat Med,1999,5(9):1032-1038.
[15] Felício MR, Silva ON, Gonçalves S,etal. Peptides with dual antimicrobial and anticancer activities[J]. Front Chem, 2017, 5:5.
[16] Burns KE, Mccleerey TP, Thévenin D. pH-selective cytotoxicity of pHLIP-antimicrobial peptide conjugates[J]. Sci Rep, 2016, 6:28465.
EffectofconnectionchainonapoptosisinducedbyantibacterialpeptidecontainingCisoDGRCinbreastcancercells
HOU Lei1,YUE Chenli2,HE Li1,JIA Hui3,BAI Jun1*
(1DepartmentofMedicalOncology,ShaanxiProvincialPeople’sHospital,Xi’an710068,China;2DepartmentofRespiratoryMedicine,ShaanxiProvincialCorpsHospital;3DepartmentofOncology,SecondAffiliatedHospitalofXi’anJiaotongUniversity;*Correspondingauthor,E-mail:edgemen@163.com)
ObjectiveTo construct antibacterial peptides CDAK and CGAK containing CisoDGRC structure respectively using LLII and GG peptides as a link chain, and to explore the effects of different connection chains on the ability of antibacterial peptides containing CisoDGRC structure to induce apoptosis in αvβ3-positive breast cancer cells.MethodsMDA-MB-231 cells were treated with different concentrations of CDAK(LLII)and CGAK(GG)for 24 h. The CCK-8 kit was used to calculate the median lethal dose(IC50) of CDAK and CGAK. PBS(control), random peptide(CRLK), CDAK(LLII)and CGAK(GG)were applied to MDA-MB-231 cells for 24 h. Flow cytometry was used to analyze the apoptotic rate and mitochondrial membrane potential in the four groups. Western-blot was used to analyze the cleaved-Caspase-3 protein expression in the four groups.ResultsIn MDA-MB-231 cells, IC50of CGAK decreased compared with CDAK. Compared with control group and CRLK group, the proportion of apoptotic cells and cleaved-Caspase-3 protein relative expression increased in CGAK group and CDAK group(P<0.05), while the mitochondrial membrane potential decreased(P<0.05). Compared with CDAK group, the proportion of apoptotic cells and cleaved-Caspase-3 protein relative expression increased in CGAK group(P<0.05), while the difference of membrane potential was not statistically significant(P>0.05). There was no significant difference in all indexes between control group and CRLK group(P>0.05).ConclusionAs a linker, GG can further enhance the ability of antibacterial peptides containing CisoDGRC structure to induce the apoptosis of αvβ3-positive breast cancer cells compared with LLII.
connection chain; breast cancer; antibacterial peptides; apoptosis
陕西省自然科学基础研究计划项目(2016JM8094)
侯磊,男,1979-09生,博士,主治医师,E-mail:zhaoyalan1981@163.com
2017-08-19
R737.9
A
1007-6611(2017)11-1149-05
10.13753/j.issn.1007-6611.2017.11.013
