大鼠骨髓间充质干细胞在心肌缺血微环境中Cav1.2的表达
2017-12-01马爱群王亭忠
张 静,马爱群,魏 峰,王亭忠
(1新疆医科大学第四附属医院心脏中心,乌鲁木齐 830000;2西安交通大学医学院第一附属医院心内科;*通讯作者,E-mail:wz200811@126.com)
大鼠骨髓间充质干细胞在心肌缺血微环境中Cav1.2的表达
张 静1,马爱群2*,魏 峰2,王亭忠2
(1新疆医科大学第四附属医院心脏中心,乌鲁木齐 830000;2西安交通大学医学院第一附属医院心内科;*通讯作者,E-mail:wz200811@126.com)
目的 观察大鼠骨髓间充质干细胞(mesenchymal stem cells,MSCs)在心肌缺血微环境中向心肌细胞分化过程中Cav1.2的分化表达。 方法 采用左冠状动脉前降支(left anterior descending coronary artery,LAD)结扎术建立大鼠急性心肌梗死(myocardial infarction,MI)模型(n=52),并行心电图检查。将绿色荧光蛋白(green fluorescent protein, GFP)标记MSCs,贴壁培养,用心外膜下注射法将GFP标记的MSCs移植到心肌梗死周边区域;移植后7 d开胸取心脏组织,HE染色观心肌梗死区域病理变化。将移植后3,5,7 d的大鼠分为3 d组、5 d组、7 d组,每组10只动物,免疫荧光染色观察各组移植的MSCs上Cav1.2蛋白的表达;激光捕获显微切割技术分离各组心肌组织中GFP标记的MSCs群,应用real-time PCR测定各组心肌组织中Cav1.2及未移植大鼠MSCs mRNA的相对表达量;移植后9 d,对移植区域行TUNEL凋亡染色。 结果 免疫荧光染色观察3 d组、5 d组、7 d组心肌组织中移植的MSCs均不表达Cav1.2;real-time PCR测定显示,3 d组、5 d组、7 d组中Cav1.2相对表达量与未移植的MSCs相比均无明显变化(P>0.05),移植后9 d未观察到MSCs的表达,TUNEL凋亡染色显示移植的MSCs发生了凋亡。 结论 在大鼠心肌缺血微环境中移植的MSCs不表达Cav1.2且不能长期存活。
心肌梗死; 骨髓间充质干细胞; 移植; Cav1.2
干细胞是一类具有自我复制与分化潜能的细胞,通过特定诱导能够分化出相应心肌细胞替代受损或坏死的宿主心肌细胞,从而不同程度改善心脏功能[1]。大量动物实验[2,3]表明,心肌梗死区域局部移植MSCs的可向心肌细胞分化,但干细胞作为外源性物质移植入心脏的安全性存在质疑,尤其是导致心律失常方面存在争议,有研究[2]观察到心肌梗死患者接受MSCs移植后会发生心律失常。心律失常的发生发展与心肌中离子通道的分化表达有重要关系,钙离子通道对心肌细胞动作电位的产生、传导和维持动作电位时间等起到重要作用。其中,Cav1.2作为心肌主要L型钙通道之一,是细胞兴奋时钙内流最主要的途径,在心肌动作电位的产生、兴奋收缩偶联、激素和神经递质的分泌、释放等过程中起着重要的调节作用[4]。因此,移植后的MSCs是否具有钙离子通道的电生理特性对于移植后心脏是否发生心律失常起到至关重要的作用,本文拟研究MSCs移植到大鼠心肌缺血微环境中是否表达Cav1.2,为移植后心律失常发生的研究提供实验基础。
1 材料与方法
1.1 实验动物
80 g清洁级雄性SD大鼠1只用于骨髓供体,180-200 g清洁级雄性SD大鼠52只用于建立MI模型,均由西安交通大学医学院实验动物中心提供。所有动物均获得动物实验管理委员会的批准,并符合动物实验管理条例和美国NIH发布的实验动物应用和保护指南。
1.2 主要仪器及试剂
激光显微切割仪购于瑞士LEICA公司,BX51型光学显微镜购于日本Olympus公司,兔抗大鼠Cav1.2抗体购于美国Santa cruz公司,山羊抗兔IgG-Cy3购于北京康为世纪生物科技有限公司。
1.3 MSCs的分离、标记
采用Percoll’s密度梯度离心法结合贴壁培养法分离纯化MSCs,采用文献[5]的方法,以携带GFP的慢病毒载体转染标记,并传代培养。
1.4 MI模型的建立
100 g/L水合氯醛以3 ml/kg的剂量腹腔注射麻醉SD大鼠(n=50),常规备皮、消毒、铺巾,剪开皮肤,钝性分离,血管弯钳撑开肋骨,适当用力将心脏挤出,在平左心耳下缘2 mm处,以7/0无损伤缝合线结冠脉前降支近端,心电图观察心肌梗死后ST段的改变,待心率、心律及呼吸正常且平稳后,缝合皮肤,术后连续3 d肌肉注射青霉素钠。
1.5 GFP标记的MSCs的体内移植
将成功建立MI模型的46只大鼠接受MSCs移植,采用建立MI模型的同样方法麻醉、开胸、暴露心脏,用1 ml胰岛素注射器于心肌梗死局部发白区即MI周边区圆周分布均匀迅速注射MSCs细胞悬液,注射后的心脏归位。
1.6 实验分组及处理方法
将成功建立移植模型的36只大鼠于移植后第3,5,7,9天分别随机处死10,10,10,6只。第3,5,7天处死的10只中,5只用于HE染色及免疫荧光染色,5只用于real-time PCR法检测,第9天处死的6只,用于TUNEL凋亡染色。
1.7 统计学分析
2 结果
2.1 心肌梗死前后心电图的改变
LAD结扎前示心电图正常(见图1A);结扎后5 min示ST段抬高,大于0.3 mV(见图1B);结扎后30 min出现病理性Q波(见图1C)。
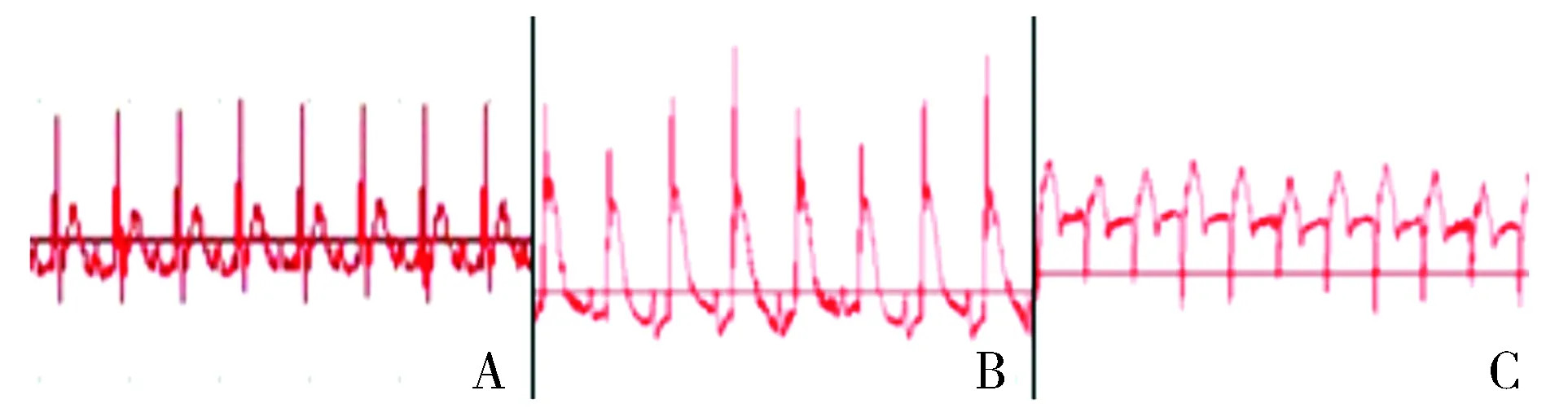
A.LAD结扎前 B.LAD结扎后5 min C.LAD结扎后30 min图1 心肌梗死前后不同时期心电图的变化Figure 1 Electrocardiogram changes before and after myocardial infarction
2.2 心肌大体标本及梗死区域病理学变化
心肌梗死部位颜色发白(见图2A),心脏横切面、梗死区域室壁明显变薄且成透亮白色(见图2B)。HE染色示梗死区域大量纤维及胶原组织增生,肌纤维排列紊乱,间质网络结构破坏,肌丝断裂(见图2C)。
2.3 移植的MSCs局部分布特点及Cav1.2的表达
通过免疫荧光显微镜观察移植的GFP标记的MSCs,在心肌组织内排列方向与心肌细胞一致,呈带状分布,通过Cav1.2的免疫荧光染色观察到于移植后3,5,7 d数量递减趋势,均无Cav1.2的表达(见图3)。
2.4 GFP标记的MSCs移植前后mRNA的表达
移植的MSCs上Cav1.2在移植后3,5,7 d之间比较及与未移植的MSCs相比,其相对表达量均无明显变化(P>0.05,见图4)。
2.5 TUNEL凋亡染色
移植的MSCs数量逐渐减少,移植后9 d,MSCs细胞数量明显减少,观察不到其的存活,移植区域行TUNEL凋亡染色示移植区域的GFP标记的MSCs在光镜下呈棕褐色(见图5),提示移植的MSCs发生了凋亡。
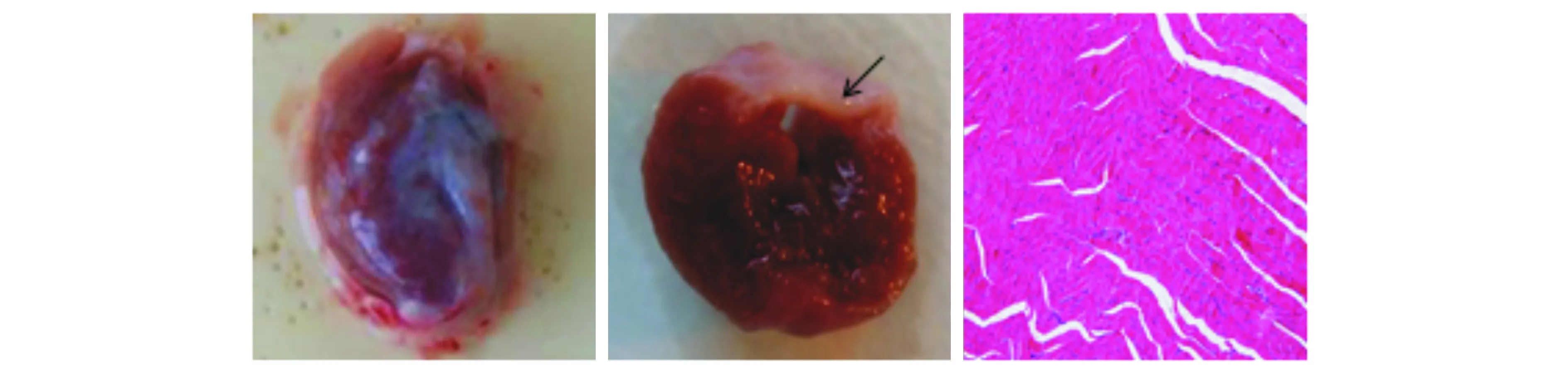
A.心脏大体形态改变B.心脏横切面C.心肌梗死区(HE染色×200)图2 MI模型7 d心脏大体形态及组织病理学改变Figure 2 General gross and pathological changes of the AMI model at day 7 after infarction
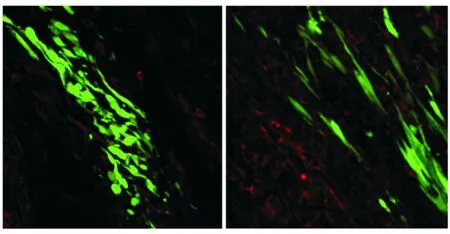
A.移植后3 d B.移植后7 d图3 心肌组织中GFP标记的MSCs上Cav1.2的免疫荧光染色 (×600)Figure 3 The transplanted GFP-labeled MSCs in vivo by immunofluorescence staining (×600)
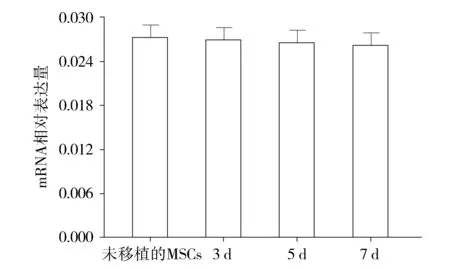
图4 不同移植时间及未移植MSCs中Cav1.2 mRNA的相对表达Figure 4 Relative expression of Cav1.2 mRNA in transplanted MSCs and non-transplanted MSCs
3 讨论
正常心肌细胞的动作电位主要由钾、钠、钙离子的跨膜流动形成,其中,心肌细胞通过L-型钙通道的慢向Ca2+内流构成心室肌细胞动作电位平台期的基础。本实验小组前期实验已证实移植的MSCs在体内心肌缺血微环境中可表达cTnI、MYH、Cx43等部分心肌细胞特异性标志物,说明移植的MSCs在形态学上能够朝心肌细胞方向分化,但本实验结果提示移植的MSCs不能表达Cav1.2,即不能获得正常心肌细胞主要钙离子通道的电生理特性,Cav1.2钙通道是心肌细胞兴奋时钙内流的主要途径,对细胞的生理机能起到至关重要的作用。心肌细胞内钙的浓度分布及时相变化等直接影响细胞收缩功能、节律变化、细胞生长及死亡,与心律失常的发生相关。
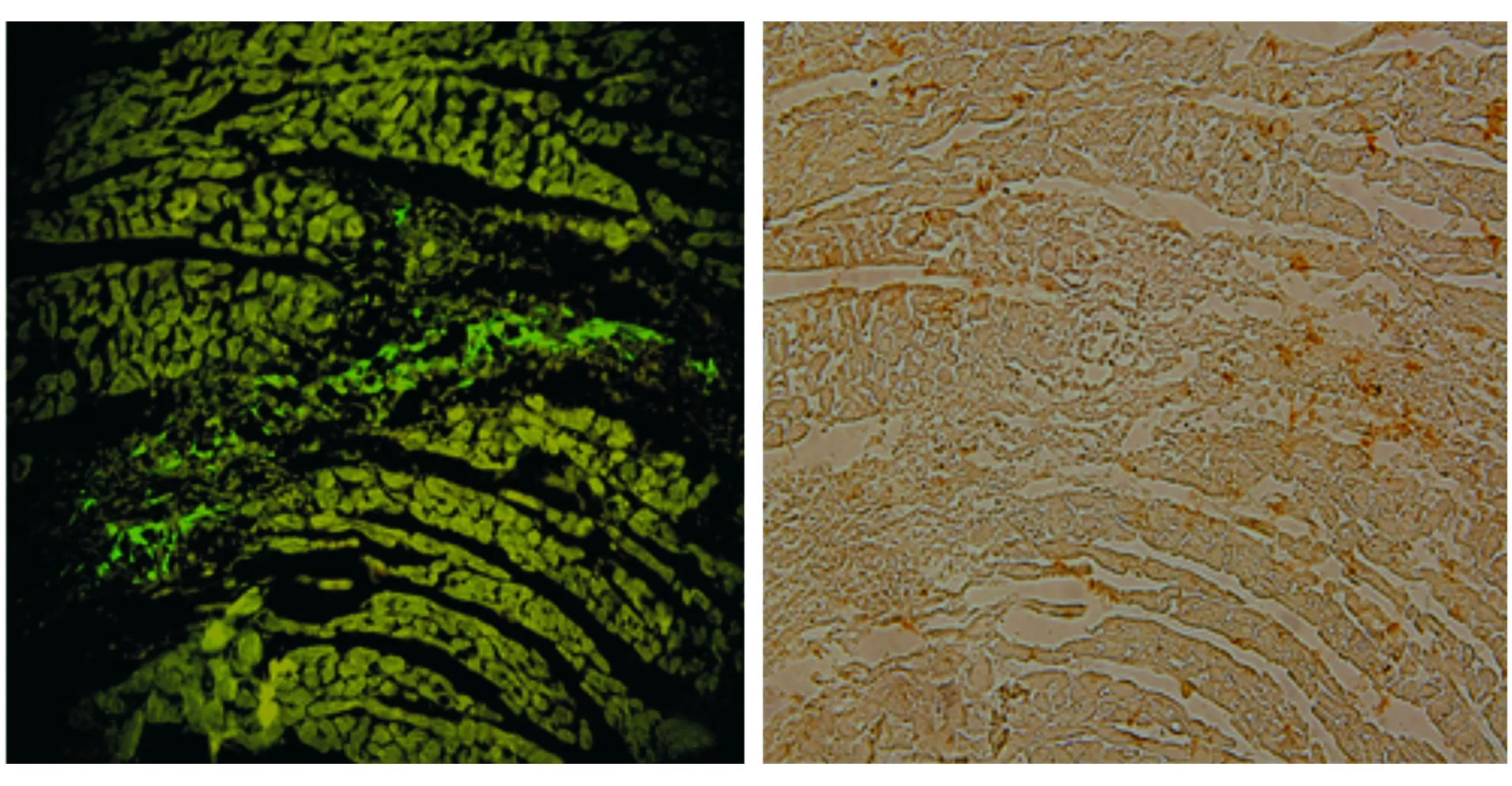
A.移植9 d时移植MSCs的区域 B.相同移植部位的MSCs凋亡染色后呈棕褐色图5 移植9 d后TUNEL凋亡染色 (×200)Figure 5 TUNEL staining of the apoptosis in transplanted zone at day 9 (×200)
大量的动物证实移植的MSCs的分化具备环境诱导依赖性[6]。移植的MSCs所处环境是病态环境,周围既有正常的心肌细胞,也有受损或异常的心肌细胞以及纤维瘢痕组织等,MSCs具有多向分化潜能,可以向受损或异常的心肌细胞或者纤维瘢痕组织分化,微环境的异质性可能会影响MSCs向正常心肌细胞分化,除此而外,Cav1.2周围相互作用蛋白的表达异常也影响其表达及电生理特性[7]。本实验证实移植的MSCs在体内心肌缺血微环境中不表达Cav1.2,其表达缺失是由于离子通道本身还是其相互作用蛋白的异常所致尚不明确。Cav1.2表达异常可能会增加移植MSCs与宿主心肌细胞间电生理耦联的异质性,可能会引起异常的心电活动,可能是MSCs移植导致宿主心律失常的主要原因之一[8,9]。
另外,随着MSCs移植入体内的时间延长,存活的MSCs数量逐渐减少,本实验证实其在心肌缺血微环境中发生了凋亡,既往有动物实验证实MSCs移植后24 h,50%以上的移植细胞发生了凋亡,7 d后超过90%的移植细胞发生了凋亡[10],推测其原因与心肌梗死后心肌局部微环境缺氧缺血、移植区域自由基的产生、炎性反应等使梗死周边释放大量炎性因子和凋亡因子促进移植的MSCs凋亡相关[11-13],MSCs移植后发生凋亡也可以影响Cav1.2的正常表达,因此,怎样诱导MSCs移植后Cav1.2的表达,从而避免心律失常的发生,有待进一步研究。
[1] Smith SJ Jr. Reducing the global burden of ischemic heart disease and stroke: a challenge for the cardiovascular community and the United Nations[J]. Circulation, 2011, 124(3):278-279.
[2] Afzal MR, Samanta A, Shah ZI,etal. Adult bone marrow cell therapy for ischemic heart disease: evidence and insights from randomized controlled trials[J].Circ Res,2015,117(6):558-575.
[3] Perin EC, Dohmann HF, Borojevic R,etal. Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure[J]. Circulation, 2003, 107(18):2294-2302.
[4] Bodi I,Mikala G,Koch SE,etal. The L-type calcium channel in the heart:the beat goes on[J]. J Clin Invest, 2005, 115(12):3306-3317.
[5] 魏峰,马爱群,王亭忠,等.慢病毒载体介导GFP标记大鼠骨髓间充质干细胞[J].西安交通大学学报(医学版),2010,31(3):288-292.
[6] Tosh D, Slack JM. How cells change their phenotype[J]. Nature Rev Mol Cell Biol,2002,3(3):187-194.
[7] Kerr NC, Gao Z, Holmes FE,et,al. The sodium channel Nav1.5a is the predominant isoform expressed in adult mouse dorsal root ganglia and exhibits distinct inactivation properties from the full-length Nav1.5 channel[J].Mol Cell Neurosci,2007,35(2):283-291.
[8] Chen W, Wang R, Chen B,etal. The ryanodine receptor storesensing gate controls Ca2+waves and Ca2+triggered arrhythmias[J]. Nat Med, 2014, 20(2): 184192.
[9] Luo M, Anderson ME. Mechanis ms of altered Ca2+handling in heart failure[J]. Circ Res, 2013, 113(6): 690708.
[10] Chen J, Baydoun AR, Xu R,etal. Lysophosphatidic acid protects mesenchymal stem cells against hypoxia and serum deprivation-induced apoptosis[J]. Stem Cells, 2008, 26(1):135-145.
[11] Liu J, Wang H, Li J. Inflammation and inflammatory cells in myocardial infarction and reperfusion injury: a double-edged sword[J]. Chin Med Insights Cardiol, 2016, 10:79-84.
[12] Siao CJ, Lorentz CU, Kermani P,etal. ProNGF, a cytokine induces after myocardial infarction in humans, targets pericytes to promote microvascular damage and activation[J]. J Exp Med, 2012, 209(12):2291-2305.
[13] Halabian R, Tehrani HA, Jahanian-Najafabadi A,etal. Lipocalin-2-mediated upregulation of various antixidants and growth factors protects bone marrow-derived mesenchymal stem cells against unfavorable microenvironments[J]. Cell Stress Chaperones, 2013, 18(6):785-800.
TheexpressionofCav1.2inratallogeneicmesenchymalstemcellsinthemicroenvironmentofmyocardialischemia
ZHANG Jing1,MA Aiqun2*,WEI Feng2,WANG Tingzhong2
(1DepartmentofCardiovascularMedicine,FourthAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830000,China;2DepartmentofCardiovascularMedicine,FirstAffiliatedHospital,Xi’anJiaotongUniversityMedicalSchool;*Correspondingauthor,E-mail:wz200811@126.com)
ObjectiveTo observe the expression of Cav1.2 of allogeneic mesenchymal stem cells(MSCs) in microenvironment of rat myocardial ischemiainvivo.MethodsThe myocardial infarction(MI) rat models were established by ligating the left anterior descending coronary artery(LAD). The MSCs were labeled by green fluorescent protein(GFP) and cultured using direct adherent culture methods. GFP-labeled MSCs were injected into the surrounding area of the epicardium myocardial infarction(n=52). Then the gross specimens were observed and HE staining was performed on infarct areas after transplantation for 7 d. The rats were divided into three groups according to transplantation time:3 d group, 5 d group and 7 d group. The protein expression of Cav1.2 in each group was observed by immunofluorescence staining, and the relative mRNA was acquired by laser capture microdissection and measured by real-time PCR. The transplanted areas were observed by TUNEL staining at day 9.ResultsThe transplanted MSCs did not express Cav1.2 at day 3, 5, 7.Compared with non-transplanted MSCs, the relative expression of Cav1.2 showed no significant changes at day 3, 5, 7 by real-time PCR in the transplanted MSCs(P>0.05), and the expression of Cav1.2 was not observed at day 9 by TUNEL staining, but there was apoptosis in the transplanted MSCs.ConclusionThe transplanted allogeneic MSCs could not express Cav1.2 in the microenvironment of myocardial ischemia, and could not effectively survive for a long time.
myocardial infarction; mesenchymal stem cell; transplantation; Cav1.2
国家自然科学基金资助项目(30800455)
张静,女,1984-07生,硕士,主治医师,E-mail:303918935@qq.com
2017-08-07
R36
A
1007-6611(2017)11-1092-04
10.13753/j.issn.1007-6611.2017.11.002
