灵发素(LFS)诱导烟草叶片愈伤组织的研究
2017-12-01,,,,,,,,
, , , , ,, , ,
(1.广西大学, 南宁 530005; 2.广西壮族自治区烟草公司百色市公司, 广西 百色 533899;3.中国医学科学院医用生物技术研究所, 北京 100050)
灵发素(LFS)诱导烟草叶片愈伤组织的研究
李廷洋1,周凤珏1,许鸿源1,周文亮2,龚银花1,赖洪敏2,陈念平1,解云英3,许鸿章3
(1.广西大学, 南宁 530005; 2.广西壮族自治区烟草公司百色市公司, 广西 百色 533899;3.中国医学科学院医用生物技术研究所, 北京 100050)
[目的]研究LFS诱导烟草叶片愈伤组织的生物活性和使用浓度;[方法]以MS为基本培养基,添加不同浓度LFS配制成诱导培养基,以烟草幼叶切片作外植体,进行愈伤组织诱导;[结果] 1) LFS 0.05~2.00 mg/L皆表现出诱导烟草叶片愈伤组织的生物活性;2) 最适浓度为1.50 mg/L,10 d出愈率48%,20 d达100%。愈伤组织的褐化与板结程度轻微,每瓶平均鲜重产量为8.3 g,而ck组只有1.7 g;[结论]LFS作为单一诱导剂添加于MS可以快速、优质、高效地获得烟草叶片愈伤组织。
灵发素; 烟草; 愈伤组织
烟草(NicotianatabacumL.)的愈伤组织(Callus)是生产再生植株,获得遗传良性变异,进行品种改良的重要材料。同时,烟草作为植物生物技术研究的模式植物,其愈伤组织也是细胞生物学、分子生物学和基因学等基础研究的重要试验材料。有关获得烟草愈伤组织的技术研究报告颇多,但是归纳起来,其共同点有: 1) 基本培养基。绝大多数是用MS(Murashige和Skoog,1962),偶然有用H(Bourgin和Nitsch,1967)。 2) 诱导剂。几乎全部是使用以下2类5种植物生长物质,即生长素类(Auxin)中的3种:2,4-D(2,4-二氯苯氧乙酸),NAA(萘乙酸)和IBA(吲哚丁酸);细胞分裂素类(Cytokinin)中的2种:BA(N6-苄基腺嘌呤)和KT(激动素),而且还必需是其中的2种,甚至3~5种进行复配使用,才能达到诱导愈伤组织的效果。这些现有获得烟草愈伤组织的技术方案有如下缺点: 1) 培养基的配制程序繁杂费工。 2) 被大多数人普遍采用的2,4-D和NAA均有明显的毒性和残留。特别是廉价易得、应用最广的2,4-D原本就是除草剂,极易使刚获得的愈伤组织发生褐化和板结,严重影响其质量,甚至导致外植体和新生愈伤组织的死亡。为此,技术人员不得不频繁地把外植体转接到新鲜的培养基上,以减轻2,4-D的累积和伤害,耗费工时。3) 获得的愈伤组织产量低,质量差。在相关报导中,几乎无一例外,从原始外植体获得愈伤组织后,都必须及时转入另外某种不同的专用增殖培养基进行扩繁,才能达到收获愈伤组织的目的[1-2]。灵发素(Lingfasu,LFS;代号PGR-08)是一种新型的生物源植物生长物质,属于腺嘌呤衍生物,无毒害和残留。它同时兼具细胞分裂素(CTK)的基本化学结构和生物活性,又同时具有生长素(Auxin)的生物活性[3-5]。LFS已在被公认为难以组培的中药材——三七的愈伤组织诱导中获得成功[6]。蓝桃菊等[7]、陈念平等[8]和梁琼月等[9]已相继在诱导甘蔗和半夏愈伤组织中获得成功,但尚未见LFS诱导烟草愈伤组织的研究报告。
1 材料与方法
1.1 试验材料
烟草品种为云烟85,种子由广西烟草公司百色市公司提供;LFS为中国医学科学院医药生物技术研究所提供的重结晶品,纯度≥98%;2,4-D,NAA和BA,等购自南宁市医药站化剂公司,进口分装。
1.2 试验设计和方法
1.2.1 外植体的制备
按常规方法用烟草种子获得无菌烟草植株,当生长至5、6片叶时,自上而下取其第3片展开功能叶,在无菌条件下,切除距叶柄以上约2 mm部分叶片和叶显著差异水平。
表1 不同浓度LFS对烟草叶片愈伤组织诱导率的影响
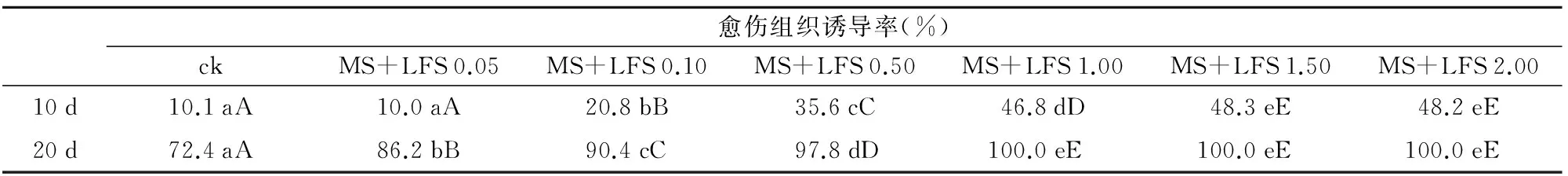
愈伤组织诱导率(%)ckMS+LFS0.05MS+LFS0.10MS+LFS0.50MS+LFS1.00MS+LFS1.50MS+LFS2.0010d10.1aA10.0aA20.8bB35.6cC46.8dD48.3eE48.2eE20d72.4aA86.2bB90.4cC97.8dD100.0eE100.0eE100.0eE
注:ck为MS+2,4-D 0.10+NAA 0.50+BA 0.20。数据后的不同小写字母表示处理间达到5%的显著差异水平,大写字母表示达到1%极
尖以下约2 mm部分叶片;再沿主脉两侧分切成约5 mm×5 mm的方片作外植体,备用。同时取15个方片分成3组,每组5个方片,用扭力天平快速称量并计算每5个方片的平均鲜重FW1(g),以便最后计算愈伤组织的产量。
1.2.2 培养基的制备
按常规配制MS固体培养基,分别添加LFS 0.05,0.10,0.50,1.00,1.50,2.00 mg/L作为烟草愈伤组织的单一诱导剂,形成6组含有不同浓度灵发素的烟草愈伤组织诱导培养基。为了更直观地比较LFS与传统诱导剂诱导效果的差别,参考传统方法拟定了MS+2,4-D 0.10 mg/L+NAA 0.50 mg/L+BA 0.2 mg/L作对照组(ck)。各组培养基均调pH=5.8~6.0;常规灭菌,备用。
1.2.3 接种与培养
上述7组诱导培养基,每组接种10瓶,每瓶接5个方片外植体。在昼/夜(30±1)℃/(26±1)℃,光强2 000~2 500 lx条件下培养诱导烟草愈伤组织。
1.2.4 测定项目
培养10 d,每组随机取3瓶统计愈伤组织诱导率,愈伤组织诱导率(%)=出愈方片数/接种方片数×100%(不论出愈方片污染与否及出愈多少);20 d终止培养,每组随机取3瓶统计以下指标:愈伤组织诱导率(同上);转绿率(%)=有愈伤组织转绿方片数/出愈方片数×100%(不论愈伤组织转绿方片的实际转绿程度,以肉眼可辨为准);褐变率(%)=出愈方片褐变数/出愈方片数×100%;褐变程度,以“+”多少表示;板结率(%)=愈伤组织紧实难以增殖分化的方片数/出愈方片数×100%;净鲜重(g/瓶 ),每组随机取3瓶无污染者,去除培养基后,以吸水纸去掉游离水,扭力天平迅速称量每瓶培养物(含外植体方片及其愈伤组织和附生物)的总鲜重(FW2)(g),计算每瓶收获愈伤组织的净鲜重(FW)(g)=FW2-FW1(培养前平均每5个方片的鲜重)。以上均记录3瓶的平均值。
2 结果与分析
2.1 不同浓度LFS对烟草叶片愈伤组织诱导率的影响
由表1可见,添加LFS浓度在0.05~2.00 mg/L的情况下,都显示出能够诱导烟草叶片外植体脱分化发生愈伤组织的生物活性。培养10 d时,添加LFS浓度在0.10~2.00 mg/L的处理均与对照(ck)达到1%极显著差异水平,并且在LFS浓度为1.50 mg/L时,对愈伤组织的诱导率最高;培养20 d时,所有添加LFS的处理与对照(ck)均达到1%极显著差异水平,并且在LFS浓度为1.00 mg/L及以上时诱导率达到100.0%,添加LFS浓度为1.00 mg/L及以上的3个处理间没有显著性差异。
由此可知,LFS作为单一诱导剂,在相同的时间内,无论是愈伤组织发生的快慢,还是效率的高低,都优于目前常用的由2,4-D,NAA和BA组成的复合诱导剂。以添加LFS 1.50 mg/L为例,10 d愈伤组织诱导率即达48.3%,是ck组(10.1%)的4.8倍;20 d愈伤组织诱导率100%,而ck组只有86.2%。
2.2 LFS对烟草叶片愈伤组织产量和质量的影响
表2表明:所有添加LFS的处理都显著提高了烟草叶片愈伤组织的净鲜重和转绿率,并且显著降低了愈伤组织的褐化率、褐化程度及板结率。在烟草叶片愈伤组织产量和质量的各方面,添加LFS的处理与ck处理均达到5%的显著差异水平,其中褐化率和板结率已达到1%极显著差异水平,但各处理间在不同性状方面的具体表现差异各不相同。
在净鲜重和转绿率方面,添加LFS浓度在0.10~2.00 mg/L的处理均与对照(ck)达到1%极显著差异水平,并且在添加LFS浓度为1.50 mg/L时,净鲜重质量最大,但添加LFS浓度为1.50 mg/L的处理与浓度为2.00 mg/L的处理间不存在显著性差异;而转绿率最高的是添加LFS浓度为1.00 mg/L的处理,LFS浓度为1.00~2.00 mg/L的3个处理间不存在显著性差异。
在褐化率和板结率方面,添加LFS的各处理均与对照(ck)达到1%极显著差异水平,在添加LFS浓度为1.50 mg/L时,愈伤组织的褐化率和板结率都最低,并且添加LFS浓度为1.50 mg/L的处理与浓度为2.00 mg/L的处理间不存在显著性差异。
由此可见,在同样条件下: 1) LFS诱导烟草叶片愈伤组织的产量高于传统配方的ck组。如LFS 1.50 mg/L,20 d收获鲜重8.3 g/瓶,是ck组(1.7 g/瓶)的4.9倍。2) LFS诱导烟草叶片愈伤组织的质量优于传统配方的ck组。具体表现在,与ck组相比板结率和褐化率低,褐化程度轻,而转绿率(即自养能力)却显著高于ck组。
表2 不同浓度LFS对烟草叶片愈伤组织产量和质量的影响(培养20 d)
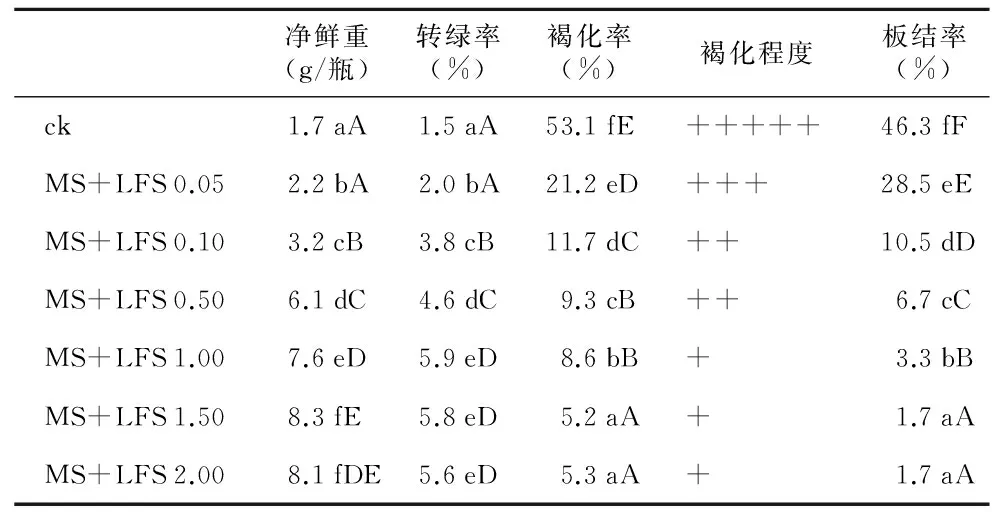
净鲜重(g/瓶)转绿率(%)褐化率(%)褐化程度板结率(%)ck1.7aA1.5aA53.1fE+++++46.3fFMS+LFS0.052.2bA2.0bA21.2eD+++28.5eEMS+LFS0.103.2cB3.8cB11.7dC++10.5dDMS+LFS0.506.1dC4.6dC9.3cB++6.7cCMS+LFS1.007.6eD5.9eD8.6bB+3.3bBMS+LFS1.508.3fE5.8eD5.2aA+1.7aAMS+LFS2.008.1fDE5.6eD5.3aA+1.7aA
注:ck为MS+2,4-D 0.10+NAA 0.50+BA 0.20。不同小写字母表示处理间达到5%的显著差异水平,大写字母表示达到1%极显著差异水平。
3 结 论
LFS作为单一诱导剂添加到MS基本培养基中,可以快速、高效地获得优质烟草叶片愈伤组织。并且在本次试验条件下,添加LFS浓度为1.50 mg/L时,在培养烟草叶片愈伤组织的各时期的诱导率以及愈伤组织在产量和质量的各方面都表现优良,是培养烟草叶片愈伤组织时添加LFS的最佳浓度。
[1]余光辉,梅刘娟,余刘卉,等.烟草光能兼养型愈伤组织的诱导和培养条件[J].中南民族大学报(自然科学版),2012,31(2):42-44.
[2]岳彩鹏,李品,黄象南,等.烟草愈伤组织的诱导及细胞悬浮培养条件的建立[J].烟草科技,2007:56-59.
[3]许鸿源.PGR-08生物活性及其应用研究(简报)[J].广西农学院学报,1989,8(1):34.
[4]许鸿源,许鸿章,杨美纯,等.PGR-08理化性质及其生物活性的研究[J].广西植物,2003,23(5):461-463.
[5]Xu HongYuan,Xu HongZhang,He Bing,et al.Lingfasu and Its Use on Plant Tissue Cuture in Vitro.In Zhihong Xu et al.Edited.“Biotechnology and Sustainable Agriculture 2006 and Beyond”[J].Springer,2007:97-101.
[6]许鸿源,蒙爱东,李春霞,等.灵发素对三七愈伤组织发生和增殖的影响[J].中药材,2004,27(1):1-3.
[7]Tao-ju LAN,Hong-yuan XU,Bing HE,et al.Effects of cytokinins on tissue culture of sweetening plant,Siraitia Grosvenorii Swingle C.Jeffrey.In Yang-rui LI et al.Edited.“Meeting the challenges of sugar crops & integrated Industries in developing countries”Published by Engineering House Press Co[J].Egypt,6,10,2008:562-565.
[8]陈念平,蓝桃菊,龚银花,等.灵发素(LFS)对诱导甘蔗愈伤组织的影响[J].种子,2013,32(11):1-2.
[9]梁琼月,何冰,周凤珏,等.灵发素(LFS)对诱导半夏体细胞胚胎发生过程中一些生化指标的影响[J].中国医药科学,2012,2(11):9-11.
Study on LFS to Induce Callus of Tobacco Leaf
LITingyang1,ZHOUFengjue1,XUHongyuan1,ZHOUWenliang2,GONGYinhua1,LAIHongmin2,CHENNianping1,XIEYunying3,XUHongzhang3
2016-10-27
国家“重大新药创制”科技重大专项(2012 ZX 09301002-001-018);广西壮族自治区烟草公司应用基础专项经费(桂烟科2012-26号)资助。
李廷洋(1990—),女,河南南阳人,硕士研究生,研究方向:作物生理与调控。
许鸿源,E-mail:xuhy08@126.com。
10.16590/j.cnki.1001-4705.2017.04.126
S 572
A
1001-4705(2017)04-0126-03
