金钗石斛IAA内生细菌筛选及对干旱胁迫下玉米种子萌发的影响
2017-12-01,,,,,,,
, , , , , , ,
(贵州师范大学生命科学学院, 贵阳 550001)
金钗石斛IAA内生细菌筛选及对干旱胁迫下玉米种子萌发的影响
高阳,朱双丽,吴庆珊,雷珣,安忠琦,王玉倩,牛晓娟,翁庆北
(贵州师范大学生命科学学院, 贵阳 550001)
从金钗石斛植株中分离并筛选产吲哚乙酸(IAA)的内生细菌,研究在不同浓度PEG-6000模拟的干旱胁迫条件下,产IAA内生菌发酵上清液浸种处理对玉米种子萌发的影响。从金钗石斛分离出645株内生细菌,通过salkowskis法筛选表明,63.4%的内生菌具有分泌IAA的能力,其中有9株菌分泌量较高,分泌量为12.8~34.5 mg/L。基于16 SrRNA基因序列分析,初步鉴定它们为芽孢杆菌属(Bacillus)和类芽孢杆菌属(Paenibacillus)细菌。将内生菌发酵上清液浸种处理玉米种子,在未加PEG以及5%、10%和15% PEG的干旱胁迫条件下,其种子萌发率与对照组的相当或降低。但部分产IAA内生菌浸种处理可缓解高度干旱胁迫作用:在20% PEG条件下,有7株内生菌浸种处理后玉米种子萌发率显著提高,较对照组提高了4.7%~13.3%;25% PEG条件下,内生菌LJYPD 10处理的玉米种子萌发率比对照组显著提高了5.3%。
金钗石斛; 内生细菌; IAA; 玉米; 种子萌发; 干旱胁迫
植物内生菌指在其生活史的一定阶段或全部阶段,生活于健康植物各种组织和器官内部,又不会引起植物明显病害的一类微生物[1]。植物内生菌在植物微生态系统中具有重要作用[2],其能提高植物在逆境中的抗性[3-4],并产生细胞分裂素(cytokinin)、赤霉素(gibberellin)[5]、吲哚乙酸(indole-3-acetic acid,IAA)等植物激素,对植物具促生作用[6-8]。
IAA是一种植物体内普遍存在的内源生长素,具有促进细胞分裂,调节种子萌发和植物生长发育的作用[8]。研究表明,当处于水分、干旱、高盐等逆境下,植物自身合成 IAA 的能力受到抑制,植物生长受到限制[9-11],外源IAA可以促进植物幼苗的伸长并降低幼苗细胞膜透性,并增强植物对不良环境的适应能力[11]。对具有分泌IAA能力的内生细菌进行研究有利于将植物促生细菌应用于农业生产。
我国干旱、半干旱土地面积约占全国总面积的47%[12]。贵州位于中国西南部,季风气候不稳定,气象灾害频发,主要表现为春旱和夏旱,干旱对贵州省尤其是西部地区农作物的种植带来很大影响[13]。玉米是我国主要的粮食作物之一,在贵州省种植范围较广。如何增强玉米自身的抗旱能力,是目前玉米栽培研究急需解决的问题。
金钗石斛(D.nobileLindl)因其药用价值与野生资源短缺而备受关注。野生金钗石斛大多附生在岩石上或树上,喜阴凉湿润环境,冬春季节稍耐干旱,能够抵抗恶劣环境[14]。本研究从石斛植物组织中分离内生细菌,筛选产IAA的菌株,研究其对PEG-6000模拟干旱胁迫条件下玉米种子萌发率的影响,为进一步研究内生菌对植物的促生及其抗逆作用提供依据。
1 材料与方法
1.1 材 料
于2014年在贵州省赤水市旺隆镇等地随机采集金钗石斛植株,置密封袋中,并尽快用于分析。玉米种子裕玉207购自遵义裕农种业有限责任公司。
1.2 培养基
内生菌分离培养基:NA培养基,YG培养基,R2A培养基,LB培养基,TSA培养基,金氏B培养基,牛肉膏蛋白胨培养基,YPD培养基,2×YT培养基,TB培养基[15]。
1.3 金钗石斛内生细菌的分离纯化
将金钗石斛植株洗净晾干,将根、茎、叶用75%乙醇浸泡2 min,无菌水冲洗3次;3%NaClO浸泡3 min,无菌水冲洗3次;0.1%升汞浸泡10 min,无菌水冲洗4~5次;75%乙醇浸泡1 min,无菌水冲洗3次。将表面消毒后的根、茎、叶分别置于盛有无菌水的研钵中研磨,并将稀释至102和103倍的研磨组织液涂布平板,37 ℃培养2~5 d[16]。最后1次冲洗植株的无菌水涂布平板,作为空白对照。挑取形态不同的菌落,接种试管斜面,37 ℃培养过夜后,4 ℃低温保存。
1.4 内生菌的发酵培养
从保存的斜面挑取适量菌体接种于5 mL液体培养基中,28 ℃ 120 r/min摇床培养16 h。将发酵液4 000 r/min离心15 min后,取上清液备用。
1.5 产IAA菌株的筛选
取0.1 mL上清液与等量salkowskis试剂(4.5 g/L FeCl3、10.8 mol/L H2SO4溶液)混匀,滴置于白色陶瓷板上室温避光30 min。颜色变红则表示能够分泌IAA。根据显色后颜色变化,初步筛选内生菌分泌IAA的能力[17]。以IAA(购自北京中生瑞泰科技有限公司)10.0 mg/L标准液为阳性对照,空白培养基为阴性对照。
配制IAA标准液浓度分别为0,5.0,10.0,15.0,20.0,25.0,30.0,35.0,40.0,45.0,50.0 mg/L。量取2.0 mL标准溶液,分别加入salkowskis试剂2.0 mL,混合并避光静置30 min后,测定OD530值[18]。以IAA浓度为横坐标,吸光值为纵坐标,制作标准曲线,拟合得到回归方程。取2.0 mL内生菌发酵上清液与等量salkowskis试剂混合,避光静置30 min。测定OD530值。根据标准曲线计算出IAA含量。以培养基代替发酵液作为空白对照。
1.6 内生细菌的分子鉴定
采用CTAB法提取内生细菌总DNA[19]。利用细菌通用引物27 F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492 R(5′-CTACGGCTACCTTGTTACGA-3′),PCR扩增16S rRNA 基因。PCR扩增体系:DNA 模板(70 ng/μL)2.0μL,引物(10μmol/L)各 1.0μL,2×PCR mix 25.0μL,补足双蒸水至50μL。PCR扩增条件:94 ℃预变性4 min,94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸3 min,30个循环后,72 ℃再延伸10 min。扩增产物送生工生物工程(上海)股份有限公司测序。
根据测定序列,利用BLAST(http://www.ncbi.nlm.nih.gov/blast/Blast.cgi)与GenBank数据库中的序列比对分析,进行初步鉴定。
1.7 产IAA内生细菌对种子萌发的影响
选取成熟饱满、大小适中且均匀一致的玉米种子,自来水反复冲洗表面污垢,75%酒精浸泡2 min,蒸馏水冲洗5次,置无菌滤纸上吸去表面水分后备用。用待测内生菌发酵上清液室温浸泡玉米种子,5 h后将种子均匀排列在铺有2层滤纸的培养皿中,25 ℃恒温培养。培养7 d后统计发芽率。每个处理60粒,3次平行。以培养基代替发酵上清液为对照。
表1 分泌IAA较强的内生菌
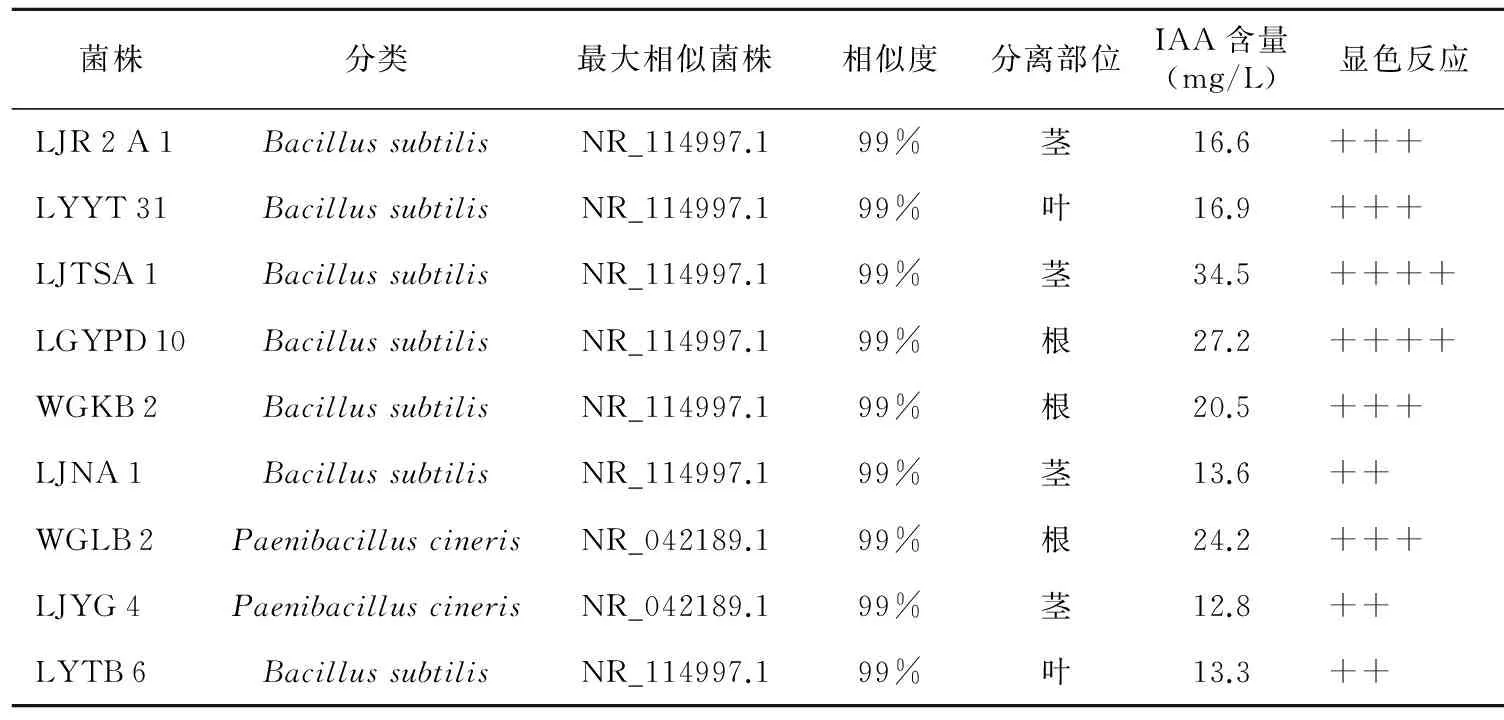
菌株分类最大相似菌株相似度分离部位IAA含量(mg/L)显色反应LJR2A1BacillussubtilisNR_114997.199%茎16.6+++LYYT31BacillussubtilisNR_114997.199%叶16.9+++LJTSA1BacillussubtilisNR_114997.199%茎34.5++++LGYPD10BacillussubtilisNR_114997.199%根27.2++++WGKB2BacillussubtilisNR_114997.199%根20.5+++LJNA1BacillussubtilisNR_114997.199%茎13.6++WGLB2PaenibacilluscinerisNR_042189.199%根24.2+++LJYG4PaenibacilluscinerisNR_042189.199%茎12.8++LYTB6BacillussubtilisNR_114997.199%叶13.3++
注:“++++”、“+++”、“++”、分别表示紫红色、红色、粉红色。
1.8 模拟干旱胁迫
在培养皿中加入15.0 mL质量分数分别为5%、10%、15%、20%、25%的PEG-6000(天津市致远化学试剂有限公司)溶液以饱和双层滤纸[20],其上放置种子。以15.0 mL双蒸水代替PEG-6000溶液作为对照。
1.9 统计分析
运用SPSS 21.0对实验数据进行统计分析,单因素方差分析(One-way ANOVA)进行均值显著性检验。
2 结果与分析
2.1 产IAA菌株筛选
从赤水采集的金钗石斛植株根、茎、叶中分离内生细菌,将分离的645株内生细菌用于产IAA菌株筛选。通过salkowskis试剂比色法对分泌IAA的内生菌进行初筛。其中409株内生菌发酵上清液与salkowskis混合后,颜色发生变化,表明大部分金钗石斛内生细菌具有分泌IAA的能力。但大部分内生菌发酵液与salkowskis混合显色后颜色较浅,分泌量较低。与对照10.0 mg/L IAA显色后的粉红色相比,筛选出9株显色较深的内生菌进一步用于定量测定,包括显色为粉红色,与10.0 mg/L IAA显色相当的LJNA 1、LJYG 4和LYTB 6;显色反应为红色的LJR 2 A 1、LYYT 31、WGKB 2、WGLB 2;以及显色为紫红色的LJTSA 1、LGYPD 10(表1)。培养基显色为无色。
进一步通过定量检测方法测定筛选出的内生菌IAA分泌量。分光光度计测定OD530,通过标准曲线线性回归方程(图1)计算各内生细菌IAA的分泌量。如表1所示,筛选获得的9株内生菌的IAA分泌量在12.8~34.5 mg/L之间。其中LJTSA 1的量最高(34.5 mg/L),LGYPD 10次之(27.2 mg/L),而LJYG 4最低(12.8 mg/L)。

图1 IAA标准曲线
2.2 金钗石斛产IAA内生菌的分子鉴定
提取金钗石斛内生菌DNA,PCR扩增16 SrRNA基因,测序,并与NCBI核酸数据库中的序列进行比对。结果表明,WGLB 2和LJYG 4初步鉴定为类芽孢杆菌属(Paenibacillus),其余7株为芽孢杆菌属(Bacillus)(表1)。
这9株内生菌分别分离自金钗石斛的根、茎、叶不同部位,其中,LJR 2 A 1、LJTSA 1、LJNA 1和LJYG 4等4株菌分离自茎,LGYPD 10、WGKB 2和WGLB 2等3株菌分离自根,LYYT 31和LYTB 6分离自叶。
2.3 产IAA内生菌对玉米种子萌发率的影响
将产IAA的内生菌发酵上清液浸种处理玉米种子。如表2所示,在干旱胁迫条件下,用培养基浸种处理后的对照组萌发率随着PEG浓度增加(干旱胁迫程度增加)而减小。在5% PEG的轻度干旱胁迫下,萌发率无显著变化。在10%、15% PEG的中度干旱胁迫条件下,萌发率从91.0%下降为88.0%、86.0%。在20%、25% PEG的重度干旱胁迫下,玉米种子萌发率极显著下降为66.0%和63.7%(p<0.01)。
表2 不同浓度PEG-6000干旱胁迫下产IAA内生菌对玉米种子萌发率的影响

PEG-6000浓度(%)对照(%)LJR2A1(%)LTYT31(%)LJTSA1(%)LGYPD10(%)WGKB2(%)LJNA1(%)WGLB2(%)LJYG4(%)LJTB6(%)091.0±1.5a82.0±0.6a87.0±3.2a87.0±1.2a89.0±2.1a83.3±0.9b90.3±1.3a87.7±0.9a87.7±0.7a87.7±0.3a591.0±2.1a83.0±0.6a89.0±2.1a86.0±3.0ab87.7±0.9a89.0±0.6a87.3±0.9a84.3±1.2b82.0±0.6b85.0±2.1a1088.0±1.7a77.3±1.2b80.0±0.6b83.0±1.5ab82.0±1.5b86.0±1.5ab86.7±1.2a81.3±0.9c87.0±0.6a83.3±1.2a1586.0±1.2a77.3±1.8b77.0±1.5b80.0±0.6bc82.0±1.5b88.0±0a81.3±0.9b77.7±0.9d85.0±1.2a84.3±0.9a2066.0±1.5b66.3±1.3c71.0±1.0c75.0±1.5c73.0±0.6c75.0±0.6c77.7±1.2c59.0±0.6e79.3±0.9c70.7±0.9b2563.7±2.2b64.7±0.9c61.0±1.5d46.0±1.0d69.0±0.6c52.7±1.5d51.3±0.7d49.3±0.9f65.3±0.7d64.3±1.8c
将产IAA的内生菌发酵上清液浸种处理玉米种子,测定内生菌处理对玉米种子萌发率的影响(表2)。随干旱胁迫程度加深,产IAA内生细菌浸种处理后玉米种子萌发率较对照组的总体表现为降低—增加—再降低。但不同内生菌对萌发率影响不同。未加入PEG时,与对照组相比,9株产IAA内生菌浸种后玉米种子萌发率均略有下降,其中LJR 2 A 1和WGKB 2浸种处理后的玉米种子萌发率显著下降,但其他内生菌对玉米种子萌发未有显著影响。在5%、10%和15% PEG条件下,产IAA内生菌上清液浸种处理后的玉米种子萌发率与对照组的相比,总体相当或略低。在5% PEG干旱胁迫下,仅LJYG 4菌株浸种后的玉米种子萌发率较对照组的显著降低,其他菌株对萌发率没有显著影响;在10% PEG干旱胁迫下,LJR 2 A 1、LYYT 31和WGLB 2浸种处理后的萌发率显著低于对照组;在15% PEG干旱胁迫下,只有WGKB 2菌株浸种玉米种子的萌发率略高于对照组的,但不显著,而LJR 2 A 1、LYYT 31、LJTSA 1、LJNA 1和WGLB 2浸种后的玉米种子萌发率则显著低于对照组的。
随着干旱胁迫程度加深,在20% PEG条件下,除WGLB 2浸种后的玉米种子萌发率(59.0%)显著低于对照组的(66.0%)、LJR 2 A 1处理后的萌发率与对照组的相当外,其余7株内生菌处理后的种子萌发率均高于对照组的。其中LJTSA 1、LGYPD 10和WGKB 2处理后的玉米种子萌发率分别为75.0%、73.0%和75.0%,显著高于对照组(p<0.05),LJNA 1和LJYG 4处理后的玉米种子萌发率分别为77.7%和79.3%,极显著高于对照组(p<0.01)。但当PEG增加为25%时,大部分菌株处理后的玉米种子萌发率又低于对照组,仅内生菌LGYPD 10处理后的种子萌发率(69.0%)高于对照组(63.7%)。
3 讨 论
干旱胁迫是植物生长的逆境之一。在逆境条件下,IAA能够帮助种子抵抗逆境,促进种子萌发。本研究从金钗石斛植株内生细菌中筛选获得9株分泌IAA较好的内生菌,并研究了在不同浓度PEG-6000干旱胁迫条件下,产IAA内生菌对玉米种子萌发的影响。为金钗石斛内生菌资源利用以及产IAA内生菌对干旱胁迫植物生长研究提供了依据。
IAA是植物生长过程中必需的一种激素。从植物中分离的内生细菌许多都能分泌IAA,包括芽孢杆菌属、类芽孢杆菌属、假单胞菌属(Pseudomonas)、微杆菌属(Microbacterium)、链霉菌属(Streptomyces)、肠杆菌属(Enterobacter)和泛菌属(Pantoea)等[11, 21-22]。内生菌分泌IAA的量差异较大,目前从春兰、细茎石斛等分离的内生和根围细菌产IAA量为0.5~287.5 mg/L[21-22]。本研究从金钗石斛中分离的645株菌内生菌,通过salkowski试剂法比色反应检测,63.4%的内生菌能分泌IAA,但大部分菌株分泌量低。筛选的9株产IAA较高的菌株IAA分泌量为12.8~34.5 mg/L,为芽孢杆菌属和类芽孢杆菌属细菌。色氨酸是植物体内生长素生物合成重要的前体物质,在培养基中加入色氨酸可提高内生菌IAA的分泌量[21,23]。
在干旱胁迫下,随着PEG浓度增加,产IAA金钗石斛内生菌对浸种处理后的玉米种子萌发的调控作用总体表现为抑制—促进—抑制。在5%、10%和15% PEG的中、低度干旱胁迫下,产IAA内生菌处理后的玉米种子萌发率总体低于对照处理的。在20% PEG重度干旱胁迫下,玉米种子萌发率极显著降低,而产IAA内生菌浸种处理有助于缓解玉米种子干旱胁迫影响,除WGLB 2和LJR 2 A 1 2株内生菌外,LTYT 31、LJTSA 1、LGYPD 10、WGKB 2、LJNA 1、LJYG 4、LJTB 6等7株内生菌浸种处理后,玉米种子萌发率较对照组(66.0%)提高了4.7%~13.3%不等。但当PEG增加到25%时,除内生菌LJYPD 10仍能缓解重度干旱胁迫影响,萌发率(69.0%)较对照组提高了5.3%外,其余内生菌菌株浸种处理抑制了玉米种子的萌发或与对照组相当,萌发率低于或略高于对照组的63.7%。
不同菌株处理对玉米种子干旱胁迫下萌发率影响不同。一方面,不同内生菌产生IAA量不同,而IAA作为一种植物生长激素,对不同植物都有一定的最适处理浓度范围,浓度太低则促生作用不明显,浓度太高则抑制种子萌发或植物生长。且在不同产地[24]、不同胁迫条件[25]下种子萌发的IAA最适浓度也不同。另一方面,内生菌还能产生除IAA外的其他促生物质并共同作用于植株。由于植物在种子萌发、苗期生长等过程中还需要氮、磷等元素,单独具有产IAA活性的菌株其促生能力比兼具解磷或固氮活性的菌株低[26]。
植物生长调节剂对种子萌发的调节是一个较为复杂的代谢过程。干旱胁迫可引起植物激素平衡的改变,内生菌可通过改变ANAC 072 转录因子、脱水响应原件结合蛋白2 A等植株干旱相关基因的表达或表达水平,产生IAA、赤霉素等植物激素,减少GsH、CAT、POD和多酚氧化酶等缓解干旱[27],来增加共生植株的干旱耐受[28],从而缓解干旱胁迫对植物的伤害,使植物在缺水环境下也能生长。目前,除产IAA内生菌外,本实验室还从金钗石斛内生菌中筛选了溶磷、解钾、固氮等具促生作用的内生菌。这些内生菌对逆境胁迫下金钗石斛种子萌发和植株的促生作用及机理还有待进一步研究。
[1]Kloepper J.W,Beauchamp C.J.A review of issues related to measuring colonization of plant roots by bacteria[J].Canadian Journal of Microbiology,1992,38(12):1 219-1 232.
[2]王志伟,纪燕玲,陈永敢.植物内生菌研究及其科学意义[J].微生物学通报,2015,42(2):349-363.
[3]Ravel F,Courty C,Coret A,et al. Beneficial effects ofNeotyphodiumloliion the growth and the water status in perennial ryegrass cultivated under nitrogen deficiency or drought stress[J].Agronomie,1997,17(3):173-181.
[4]Malinowski D P,Belesky D P.Tall fescue aluminum torelance is affected byNeotyphodiumcoenophyialumendophyte[J].J Plant Nutr,1999,22:1 335-1 349.
[5]Khan AL,Lee IJ.Endophytic Penicillium funiculosum LHL06 secretes gibberellin that reprogramsGlycinemaxL.growth during copper stress[J].BMC Plant Biology,2013,13(1):86.
[6]You YH,Yoon H,Kang SM,et al.Fungal diversity and plant growth promotion of endophytic fungi from six halophytes in Suncheon Bay[J].Journal of Microbiology and Biotechnology,2012,22(11):1 549-1 556.
[7]Hallmann J,Quadt Hallmann A,Mahaffee W F,et al.Bacterial endophytes in agricultural crops[J].Canadian Journal of Microbiology,1997,43(10):895-914.
[8]苑博华,廖祥儒,郑晓洁,等.吲哚乙酸在植物细胞中的代谢及其作用[J].生物学通报,2005,40(4):21-23.
[9]刘拴成,曹兴明,穆俊祥,等.外源激素对盐胁迫下番茄种子萌发及幼苗生长的影响[J].种子,2016,35(12):94-98.
[10]李静,崔继哲,弭晓菊.生长素与植物逆境胁迫关系的研究进展[J].生物技术通报,2012(6):13-17.
[11]童文君,张礼,薛庆云,等.不同产地美花石斛内生细菌分离及促生潜力比较[J].植物资源与环境学报,2014,23(1):16-23.
[12]魏良明,贾了然,胡学安,等.玉米抗旱性生理生化研究进展[J].干旱地区农业研究,1997,15(4):68-73.
[13]何永坤,唐余学,范莉,等.近50年西南地区玉米干旱变化规律研究[J].西南大学学报(自然科学版),2016,38(1):34-42.
[14]乙引,陈玲,张习敏.金钗石斛研究[M].北京:电子工业出版社,2009:98-101.
[15]周德庆,张纪忠,程皆能,等.微生物实验手册[M].上海:上海科学技术出版社,1983.
[16]詹伟,曾令亭,方正,等.香樟内生细菌的分离与发酵产物抗氧化活性评价[J].食品工业科技,2016,37(15):71-75.
[17]Glickmann E,Dessaux Y.A critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J].Applied and Environmental Microbiology,1995,619(2):793-796.
[18]傅晓方,韩红江,郝勇锋,等.玉米内生固氮菌的分离鉴定及对小麦幼苗的促生效应[J].西北农业学报,2012(1):66-71.
[19]王玉倩,潘舟强,翁庆北,等.云台山白云岩表层土可培养细菌多样性[J].云南大学学报(自然科学版),2015,37(4):616-622.
[20]姚晓华,吴昆仑.PEG预处理对青稞种子萌发和幼苗生理特性的影响[J].西北植物学报,2012,32(7):1 403-1 411.
[21]张礼,童文君,薛庆云,等.细茎石斛内生和根围细菌多样性及促生能力分析[J].植物资源与环境学报,2015,24(3):32-40.
[22]刘琳,孙磊,张瑞英,等.春兰根中可分泌吲哚乙酸的内生细菌多样性[J].生物多样性,2010,18(2):182-187.
[23]姚玉玲,王颖,王玉琴,等.矮生嵩草内生细菌溶磷、抑菌和产IAA能力的测定及鉴定[J].草地学报,2014,22(6):1 252-1 257.
[24]张薇,王文俊,李连芳,等.外源激素浸种对云南松种子发芽的影响[J].种子,2015,34(4):1-4.
[25]陶霞,李慧琳,万林,等.叶面喷施吲哚乙酸对油菜蕾薹期渍水的缓解效应[J].中国油料作物学报,2015,37(1):55-61.
[26]张磊,袁梅,孙建光,等.马铃薯内生固氮菌的分离及其促生特性研究[J].中国土壤与肥料,2016(6):139-145.
[27]Waqas M,Khan AL,Kamran M,et al.Endophytic fungi produce gibberellins and indoleacetic acid and promotes host-plant growth during stress[J].Molecules,2012,17(9):10 754-10 773.
[28]Sherameti I,Tripathi S,Varma A,et al.The root-colonizing endophyte Pirifomospora indica confers drought tolerance in Arabidopsis by stimulating the expression of drought stress-related genes in leaves[J].Molecular Plant Microbe Interactions,2008,21(6):799-807.
Screening of IAA Producing Endophytic Bacteria inDendrobiumnobileLindl and Effect onZeamaysSeed Germination Under Drought Stress
GAOYang,ZHUShuangli,WUQingshan,LEIXun,ANZhongqi,WANGYuqian,NIUXiaojuan,WENGQingbei
(School of Life Sciences, Guizhou Normal University,Guiyang 550001,China)
The indole-3-acetic acid (IAA) producing endophytic bacteria were isolated and screened fromDendrobiumnobileLindl.Under the condition of dought stress stimulated with different concentration of PEG-6000,the maize seed germination were studied after treating with the IAA-producing strains.The results showed that a total of 645 strains endophytic bacteria were isolated fromD.nobileLindl.,and 63.4% of the strains have the ability to produce IAA,using with the salkowskis reagent method,9 strains were screened,which produced 12.8-34.5 mg/L IAA and showed a higher ability of IAA production.Based on 16 S rRNA gene sequence analysis,these endophytic bacteria were identified asBacillussp.andPaenibacillussp..The IAA-producing endophytic bacteria were fermentated and the supernatant were used to soak the maize seeds.Under the condition of absence PEG or drought stress of 5%,10% and 15% PEG,the germination rate of the seeds treated with the endophytic bacteria were less than or equal to the control’s.Howerer,soaking with the IAA-producing endophytic bacteria could elliminate the high drought stress effect of the maize seeds.Under the condition of 20% PEG,there are 7 strains can significantly promote the seed germination,the germination rate of endophytic bacteria soaking seeds were increased by 4.7%-13.3% compared with the control.Under the condition of 25% PEG,the germination rate of the seeds treated with the endophytic bacteria LJYPD 10 was increased by 5.3% than the control’s.
DendrobiumnobileLindl; endophytic bacteria; IAA; maize (Zeamays);seed germination; drought stress
2016-11-24
贵州省优秀科技教育人才省长专项资金([2011] 47);贵州省大学生创新创业训练计划项目(201410663004)。
高 阳(1991—),女,硕士研究生,研究方向:应用生物化学;E-mail:504734134@qq.com。
翁庆北(1975—),女,博士,教授,研究方向:资源微生物学;E-mail:wengqb@ 126.com。
10.16590/j.cnki.1001-4705.2017.04.0036
S 513
A
1001-4705(2017)04-0036-06
