程序降温过程中吲哚乙酸对生菜种子抗低温胁迫的影响
2017-12-01,,,,,
, , , , ,
(上海理工大学医疗器械与食品学院,生物系统热科学研究所, 上海 200093)
·研究报告·
程序降温过程中吲哚乙酸对生菜种子抗低温胁迫的影响
张晨雪,韩颖颖,李维杰,刘宝林,沈梦琪,周强
(上海理工大学医疗器械与食品学院,生物系统热科学研究所, 上海 200093)
种子是植物越冬的重要生存策略,种子低温保存是种质资源保存的主要方式。选取含水生菜种子作为研究对象,利用程序降温仪制造不同的降温速率(3 ℃/h和60 ℃/h),研究吲哚乙酸(IAA)对种子抗寒性的影响。结果表明,相比于快速降温(60 ℃/h),慢速降温(3 ℃/h)有利于生菜种子内源IAA的积累。外源施加IAA可以降低程序降温(经慢速降温后更显著)过程中生菜种子的冷冻伤害,其中以200μm的IAA对种子进行预处理效果最显著。无论降温速率如何,生菜种子遇到低温胁迫后SOD活性和脯氨酸含量会显著增加。外源施加IAA浓度越高,对SOD活性产生抑制作用,而IAA对脯氨酸含量有促进作用。降温速率以及外源IAA浓度也会对冷相关的ICE 1、HOS 1基因的相对表达量产生影响。
吲哚乙酸; 生菜种子; 抗寒性; 低温胁迫
自然界中,植物的生长受到来自外界多方面的压力[1-2]。植物要存活,自身必须形成相关的应答机制。因此,如何响应这些压力成为植物是否能够生存的重要因素[1]。在这些非生物影响因素中,低温是比较常见外界胁迫因素[3]。
低温对植物生长影响较大,最主要的伤害是破坏细胞膜的结构,导致代谢失调[4]。因此植物逐渐形成了多种防御机制,其中最重要的一个方面是利用植物激素对低温胁迫产生响应。在植物主要的5大激素中,生长素是最早被发现的,生长素又称吲哚乙酸(indole-3-acetic acid,IAA),在植物体中主要通过色氨酸依赖途径合成,能够在适宜的条件下,控制植物的生长进程[5]。有关研究证实,生长素作为植物对环境适应的调控者存在,生长素通路的相关因子能够响应低温胁迫[6]。
植物通过种子进行越冬,所以种子与植物植株相比具有更强的抗寒能力[7]。对种子的抗寒机制进行研究可能会得到与植株抗寒不同的新的调控机制。
植物种质资源的保存主要以低温保存为主[7]。目前根据种子的耐低温能力,将种子分为2类,一类是正常型,这类种子耐干燥,耐低温,比如生菜、水稻;另一类是顽拗型,如椰子、油梨、红毛丹等,其种子的最低含水量要求较高,如果种子脱水至低于最低含水量,则种子失去萌发能力。这类种子由于含水量较高,造成对低温不耐受性,而长期保存种子的种子库温度控制在-10~-20 ℃,所以这类种子长期保存比较困难。考虑到有些濒危植物的种子属于顽拗性种子(如多毛坡垒,箭毒木),解决顽拗性种子的低温保存问题具有重要的意义[8]。
生菜种子是一种正常类型(orthodox)的种子,其干燥后种子含水量较低,能耐受寒冷,是低温保存的模式植物。顾琦珺等[9]研究了含水生菜种子低温保存过程中的物理学变化,以便对具有一定含水量的种子在低温处理过程中的机制变化进行探索,为顽拗性种子的低温保存提供节点;其研究表明,含水生菜种子在快速和慢速程序降温过程中快速降温能够产生2个放热曲线,而慢速降温只产生1个放热曲线。这些差异性可能是由于胚以及胚乳冰晶的产生不同步造成的。含水生菜种子的致死温度发生在-15~-20 ℃之间。
本实验选取生菜种子为研究对象,通过分析经程序降温至-20 ℃后的内源IAA含量变化以及外源施加不同浓度的IAA对经程序降温后发芽率以及抗逆胁迫有关生化指标的影响,分析种子的抗寒性与IAA、生长素响应通路之间的关系,以期对现有的研究进行补充,同时能够为其它类型种子的低温保存提供借鉴。
1 材料与方法
1.1 材 料
生菜种子(LactucasativaL.),IAA标准品,琼脂粉,双蒸水,甲醇,三氯甲烷,乙酸乙酯,0.2 mol/L的氢氧化钠溶液,0.1 mol/L的盐酸溶液,液氮。
1.2 种子预处理和程序降温
将干燥的生菜种子分别添加于含有0,100,200,500μmol/L浓度的IAA营养琼脂培养基,置于光照培养箱(光照16 h,黑暗8 h,光照强度为1 660 lx (21±1)℃下恒温吸水膨胀预处理11 h后取出,再置于程序降温仪中,分别进行快速降温(速率为60 ℃/h)和慢速降温(速率为3 ℃/h)至-20 ℃。
1.3 内源IAA相对含量测定
取4 g未施加外源IAA预处理、降温处理至-20 ℃的生菜种子进行内源IAA的提取。内源IAA的提取参考龚晓崇等[11]、谢勇平等[12]方法进行。
借助液相-质谱联用仪(Thermo Scientific Q Exactive LC-MS, 美国 Thermo)检测IAA的相对含量。色谱条件:BEHC 18色谱柱(100 mm×2.1 mm,1.7μm)流速:0.2 mL/min流动相设定:前2 min甲醇80%,水20%,2 min后甲醇50%,水50%,6 min甲醇30%,水70%。质谱条件:喷雾电压3 000 V,蒸发温度385 ℃ ,鞘气压力30 psi,毛细管温度249 ℃,采用全扫描质谱。每个样品做3次重复。
1.4 发芽率的统计
将程序降温处理后的生菜种子播种于MS固体培养基中,每个培养基播种50粒,每个IAA处理浓度做3个平行重复,放置于恒温培养箱中进行培养,每天12:00时统计其发芽情况,以种子露白,胚根长2 mm作为发芽依据。发芽率(%)=供试种子发芽数/供试种子总数×100%[10]。
1.5 SOD活性以及脯氨酸含量测定
将程序降温处理后至-20 ℃的生菜种子,根据章秀福等[13]氮蓝四唑(nitro-blue tetrazolium,NBT)光还原法进行SOD活性的测定,重复3次。
根据孙学文等[14]磺基水杨酸法测脯氨酸含量,重复3次。
1.6 反转录和real-time PCR
根据Trizol法提取处理后生菜种子总的RNA。选用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(TaKaRa,大连)运用2步法进行cDNA合成,完成反转录。在NCBI基因库中查找ICE 1,HOS 1基因序列,利用Beacon designer软件进行引物设计,引物设计见表1,引物合成委托生工生物工程(上海)有限公司完成。建立PCR反应体系后,以生菜的管家基因ACTIN为内参进行real-time PCR。用Excel 2003以及SPSS 19.0统计分析软件进行数据分析。
表1 引物序列
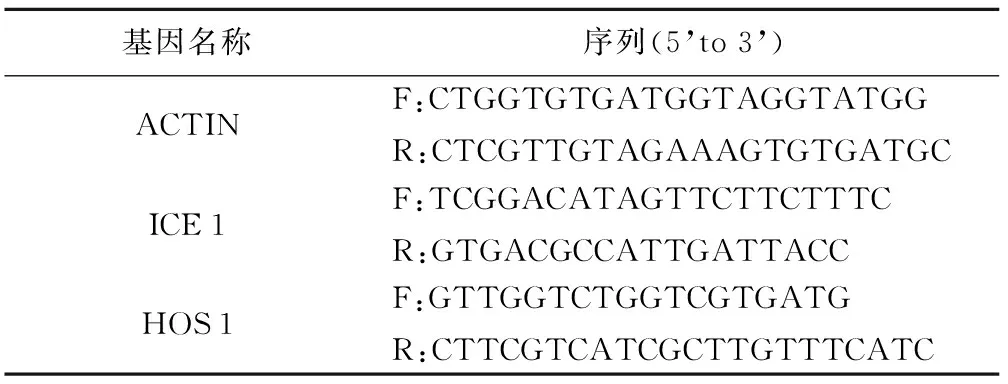
基因名称序列(5’to3’)ACTINF:CTGGTGTGATGGTAGGTATGGR:CTCGTTGTAGAAAGTGTGATGCICE1F:TCGGACATAGTTCTTCTTTCR:GTGACGCCATTGATTACCHOS1F:GTTGGTCTGGTCGTGATGR:CTTCGTCATCGCTTGTTTCATC
2 结果与分析
2.1 程序降温对内源IAA相对含量的影响
生菜种子内源IAA抽提后,经过LC-MS进行相对定量分析。分析负离子模式下提取的离子电流图,确定未经过程序降温处理以及经过快、慢速程序降温处理后的种子中IAA的相对含量。
不同处理后的种子IAA含量如图1所示,经过比较可知,快速和慢速降温处理后种子IAA相对含量都大于对照组的含量。进一步比较快速和慢速降温的含量,发现慢速降温的IAA相对含量远远大于快速降温。说明低温胁迫能够造成生菜种子内源IAA的积累,这可能是种子为了适应生存而产生的一种应急机制;利用2种不同降温速率产生的IAA进行相对定量比较,可以进一步推测外界温度变化的速率对其内源IAA的积累产生一定的影响,温度变化速率较慢可以更好地促进其内源IAA的积累。
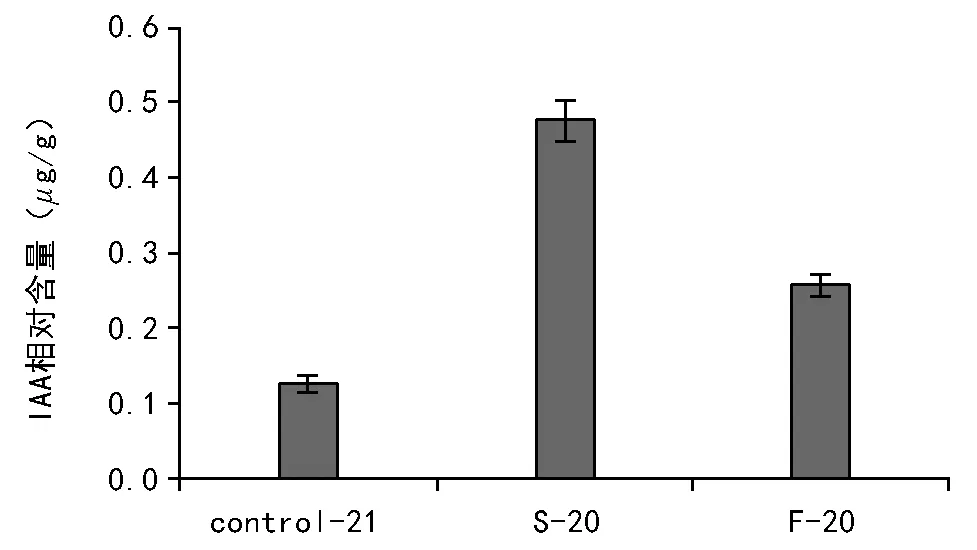
注:Control-21表示未经程序降温处理;S-20表示慢速降温至-20 ℃;F-20表示快速降温至-20 ℃。图1 不同处理内源IAA相对含量比较
2.2 IAA预处理后生菜种子的耐冻性
不同浓度的IAA处理生菜种子,并经过快、慢速降温后播种,并对发芽情况进行连续观测,直至不再有种子发芽为止,统计其发芽数并根据公式计算出发芽率。发芽率结果如图2所示。
不同浓度的IAA对未经程序降温的种子发芽率的影响不大,这说明外源IAA浓度对种子的生长发育产生的作用效果不大。生菜种子在经过程序降温处理后发芽率都有所下降,慢速降温的发芽率下降幅度略高于快速降温处理,这表明慢速降温持续冷冻的时间比较长,对种子造成的损害要大。而加入200μmol/L的IAA处理后,显著提高了慢速降温后的发芽率,表明施加此浓度的IAA对种子在慢速降温产生的低温胁迫中起到较好保护作用,降低了种子的冷冻伤害,因此200μmol/L为慢速降温中最适保护浓度。快速降温条件下,100~500μmol/L 的IAA 均能显著提高种子耐冻性和发芽率,3种施加浓度差异性不大。
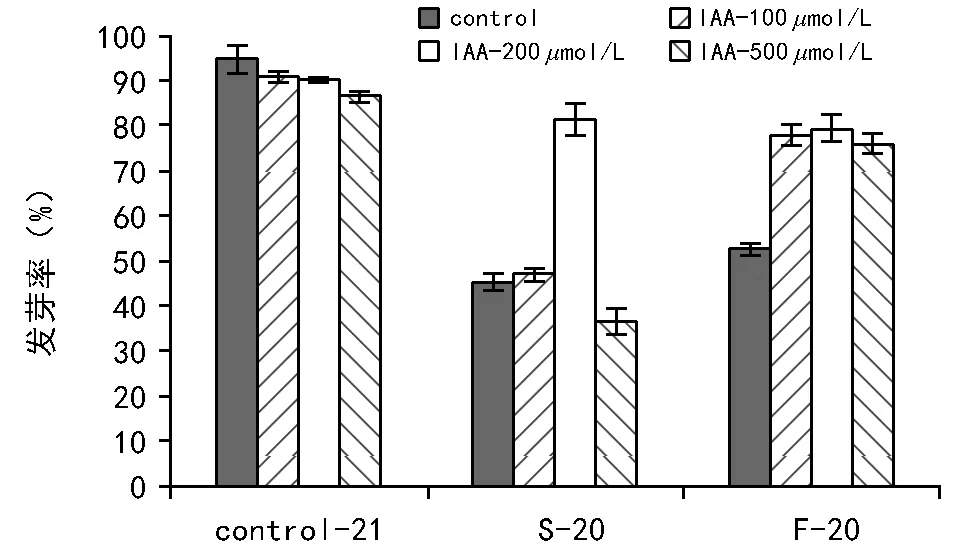
注:Control-21表示未经程序降温处理;S-20表示慢速降温至-20 ℃;F-20表示快速降温至-20 ℃。图2 不同处理后的种子发芽率
2.3 IAA预处理对SOD活性以及脯氨酸含量的影响
2.3.1 SOD活性结果与分析
在低温胁迫的过程中,植物会产生大量的自由基,自由基过多会给植物带来巨大的伤害。SOD的作用就是能够清除过多的自由基,抑制氧化作用的发生,从而减轻或避免冻害的发生,所以SOD指标能够作为检验其抗寒性的指标之一。分析不同浓度的IAA处理后的生菜种子SOD活性的变化,就能够间接得出IAA与抗寒性的关系以及不同浓度的IAA与其抵御冰冻伤害能力的关系。

注:Control-21表示未经程序降温处理;S-20表示慢速降温至-20 ℃;F-20表示快速降温至-20 ℃。图3 不同处理后种子SOD活性
SOD活性结果如图3所示,不论施加IAA与否,未经程序降温处理的种子SOD活性显著低于程序降温处理后的种子,IAA浓度对未程序降温的种子的SOD活性的影响不大。
在程序降温过程中,与常温(21 ℃)处理后的种子相比,SOD的活性都显著增加,这是种子自身固有的能够响应过冷温度的机制。不管外加IAA浓度是多少,快速降温后SOD活性增加量略高于慢速降温。不论是快速降温还是慢速降温,IAA预处理浓度越高, SOD活性越低。在快速降温过程中,这种随IAA浓度下降的趋势更加明显。慢速降温过程,施加200μmol/L IAA后SOD活性降到最低。
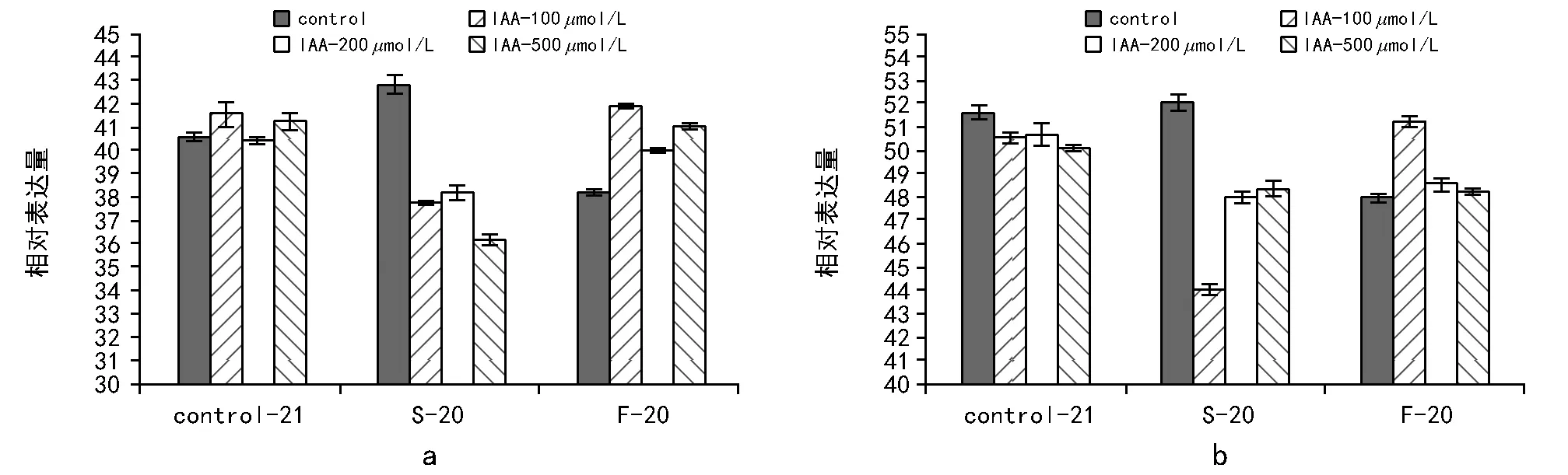
注:Control-21表示未经程序降温处理;S-20表示慢速降温至-20 ℃;F-20表示快速降温至-20 ℃。图5 不同处理后ICE 1(a)基因和HOS 1基因(b)相对表达量
2.3.2 脯氨酸含量结果与分析
由图4可知,在常温(21 ℃)下,无论是否施加外源的IAA或者是施加浓度不同的IAA进行培养,不会造成内部游离脯氨酸含量过多,并且其含量维持在较低的水平上。
不论是快速降温还是慢速降温后,当生菜种子受到低温胁迫时,与未经处理相比,游离的脯氨酸会发生很大程度的提高。相比于慢速降温,快速降温诱导产生的脯氨酸要高于慢速降温。施加外源的IAA(100~500μmol/L),能够显著提高脯氨酸的含量,这可能是脯氨酸合成机制中受到IAA的正调控。
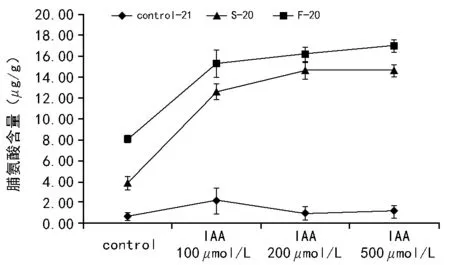
注:Control-21表示未经程序降温处理;S-20表示慢速降温至-20 ℃;F-20表示快速降温至-20 ℃。图4 不同处理后种子脯氨酸含量
2.4 IAA对冷相关的基因相对表达量的影响
2.4.1 低温胁迫下ICE 1的表达量分析
ICE 1是冷诱导过程中的重要因子,在常温条件下不活跃,但在遇到低温胁迫时能特定结合在CBF3的启动子上,随后CBF3再结合在下游目的基因的启动子上,诱导COR的表达,提高其抗寒性[15]。ICE 1基因编码ICE 1,故ICE 1基因是与冷调节相关基因。
分析经过处理后生菜种子ICE 1基因的相对表达量,结果如图5 a所示。慢速降温能够导致ICE 1基因表达量的相对上调,而快速降温则导致其表达量的相对下调,这说明降温速率差异对ICE 1的基因表达有影响。但是,慢速降温过程中,IAA抑制了ICE 1的表达,而快速降温过程中IAA促进了ICE 1的表达,这与IAA明显地促进快速降温条件下的种子耐冻性一致。
2.4.2 低温胁迫下HOS 1的表达量分析
HOS 1是调控ICE 1的一个泛素连接酶,调控ICE 1的水平[16]。HOS 1存在于细胞质,在遇到低温胁迫后,转移在细胞核中积累,这个过程能使冷反应的信息得到传输,从而产生响应[17],所以HOS 1基因也是与冷相关基因。分析HOS 1基因的相对表达量(图5 b)可知,在常温过程中,IAA浓度对HOS 1的表达量影响不大。 在程序降温过程中,它与ICE 1的表达趋势一致,即慢速降温条件下其水平提高,而在快速降温条件下水平受到抑制。施加IAA和程序降温之后,HOS 1与ICE 1也表现出相同的变化趋势。即在慢速降温过程中,施加IAA抑制HOS 1基因表达;在快速降温过程中,施加IAA浓度则促进HOS 1基因表达。这可能与HOS 1调控ICE 1的水平有关,所以其表达随着ICE 1 mRNA水平变化而变化。
3 讨 论
IAA是植物激素中最早被发现的一种,不仅仅是植物生长和发育过程中不可缺少的调节物质,还能在植物遇到生物非生物胁迫过程中起到一定的调控作用,这包括能够响应低温胁迫,所以说生长素通路是植物耐低温机制中重要的组成部分[18]。Du H等的研究发现,在通常情况下,低温处理会降低植物体内IAA氧化酶活性,从而使IAA的含量上升,同时与IAA生物合成和信号转导有关的基因会在转录水平上发生改变,这些改变与内源IAA水平保持一致[19]。所以可以得出结论,内源IAA水平受到了低温的控制。
本次研究对程序降温后内源IAA的变化进行测定,慢速降温和快速降温都能增加其含量,并且经慢速降温的IAA的含量明显高于快速降温处理后的IAA含量,这可能是因为慢速降温造成了更长时间的低温伤害,种子内源合成更高水平的IAA来抵抗胁迫,这从侧面证实了IAA在低温冷冻胁迫中发挥一定的保护作用,另一方面,研究了外施IAA对种子抗寒性的影响,分别进行发芽率表型实验以及SOD活性和脯氨酸含量的测定。发芽率是最直观的判断种子损伤程度的实验,快、慢速降温对种子产生了伤害,而施加外源的IAA对种子在降温的过程中大多能起到一定的保护作用,这种保护作用在快速降温中比较明显,同时不同浓度IAA对种子在快速降温中的保护作用差别不大。而在慢速降温中,200μmol/L的IAA对其保护作用最佳。脯氨酸和SOD都是植物体内有关抗逆境胁迫的指标物质。游离的脯氨酸作为渗透调节物质具有水溶性,能在细胞内无毒性积累,保持渗透平衡,其含量越多,保护性能越强[20]。本实验结果表明,程序降温造成了脯氨酸含量的提高,其中快速降温比慢速降温含量提高的多,印证了快速降温处理后发芽率更高的结果,表明抗寒性更强,并且其抗寒性与外源IAA浓度呈正比,暗示生长素通路调控内源脯氨酸的积累,这与Kuraishi S等[21]的研究结果相一致。但是生长素调控脯氨酸的具体的作用机制还有待研究。
SOD能消除植物低温胁迫产生的大量活性氧,从而使植物在低温下存活[22]。由本实验结果可知,程序降温能导致SOD活性显著增加。这可能是种子受到低温伤害的结果。对种子以IAA进行预处理然后进行程序降温,则 IAA预处理浓度越高,SOD活性越低。在快速降温过程中,这种抑制作用更加明显。SOD活性的高低显示了种子受到冷冻伤害的程度。IAA可能通过降低种子的冷冻伤害程度,从而抑制了表观SOD活性。慢速降温过程,施加200μmol/L IAA后SOD活性降到最低,与该浓度发芽率显著提高,也验证了这一点。
对IAA与冷相关基因ICE 1、HOS 1相对表达量的关系进行研究,发现ICE 1基因在快速降温中表达量的相对下调,而慢速降温其表达量的相对上调。总体来说,慢速降温过程中,IAA抑制ICE 1的表达,而快速降温过程中IAA促进ICE 1的表达,这与IAA明显地促进快速降温条件下的种子耐冻性一致。与快速降温不同,慢速降温过程中,IAA表现出对ICE 1的抑制作用,这可能与不同降温速率处理造成了不同的抗冷机制有关,还需要进一步研究。程序降温和IAA处理后,HOS 1也表现出与ICE 1相同的表达变化趋势,暗示两者之间的直接调控关系。
[1]Fahad S,Hussain S,Amar M,et al.Phytohormones and plant responses to salinity stress:a review [J].Plant Growth Regul,2015,75(2):391-404.
[2]Vivien S,Jérome D,Benjamin M,et al.Arabidopsis BNT 1,an atypical TIR-NBS-LRR gene,acting as a regulator of the hormonal response to stress[J].Plant Sci,2015,239:216-229.
[3]Rahman A.Auxin a regulator of cold stress response[J].Physiol Plantarum,2013,147(1):28-35.
[4]Björn LO,Veena S,Franz O,et al.Early steps in cold sensing by plant cells: the role of actin cytoskeleton and membrane fluidity[J].Plant J,2000,23(6):785-794.
[5]李静,崔继哲,弭晓菊.生长素与植物逆境胁迫关系的研究进展[J].生物技术通报,2012(6):13-17.
[6]Kemal K.Auxin and the integration of environmental signals into plant root development[J].Ann Bot-London,2013,112(9):1 655-1 665.
[7]陈晓玲,张金梅,辛霞,等.植物种质资源超低温保存现状及其研究进展[J].植物遗传资源学报,2013,14(3):414-427.
[8]李庆荣,郑郁善.顽拗性种子种质超低温保存研究进展[J].江西农业大学学报(自然科学版),2003,25(4):608-612.
[9]顾琦珺,刘宝林,夏全刚.莴苣种子的生长与低温保存研究[J].低温与超导,2013(10):52-55.
[10]龚晓崇,宋从凤,王鸣华,等.高效液相色谱法测定烟草和棉花中生长素含量[J].江苏农业学报,2012,28(1):225-227.
[11]谢勇平,郑新宇,林丹丽,等.高效液相色谱法同时分离测定包菜中4种植物生长素[J].新疆农业大学学报,2010,33(5):409-411.
[12]陈艳丽,范飞,刘建,王旭,等.不同生长调节剂与温度处理对生菜种子萌发的影响[J].种子,2014,33(10):24-27.
[13]章秀福,王丹英,储开富,等.镉胁迫下水稻SOD活性和MDA含量的变化及其基因型差异[J].中国水稻科学,2006,20(2):194-198.
[14]孙学文,刘艳芳.用甲苯萃取与未经萃取测定脯氨酸含量的比较——磺基水杨酸法[J].河北科技师范学院学报,2006,20(4):26-28,38.
[15]Chinnusamy V,Ohta M;Kanrar S,Byeong-ha L,et al.ICE 1:a regulator of cold-induced transcriptome and freezing tolerance in Arabidopsis[J].Genes and Development,2003,17(8):1 043-1 054.
[16]臧建磊,刘庆忠,李亚东,等.植物CBF转录因子及其在植物抗寒性中的作用[J].安徽农业科学,2011,39(11):6 329-6 331.
[17]Lee H,Gong X Z,Ishitani M,et al.The Arabidopsis HOS 1 gene negatively regulates cold signal transduction and encodes a RING-finger protein that displays cold-regulated nucleo-cytoplasmic partitioning[J].Gene Dev,2001,15(7):912-924.
[18]Kemal K.Auxin and the integration of environmental signals into plant root development[J].Ann Bot-London,2013,112(9):1 655-1 665.
[19]Du H,Liu HB,Xiong LZ.Endogenous auxin and jasmonic acid levels are differentially modulated by abiotic stresses in rice[J].Front Plant Sci,2013(4):397.
[20]王小华,庄南生.脯氨酸与植物抗寒性的研究进展[J].中国农学通报,2008,24(11):398-402.
[21]Kuraishi S,Kasamo K,Yamaki T.The Relationship between Growth and Proline Incorporation after Auxin Treatment of Mung Bean Hypocotyls[J].Physiol Plantarum,1968,21(4):842-850.
[22]窦俊辉,喻树迅,范术丽,等.SOD与植物胁迫抗性[J].分子植物育种,2010,8(2):359-364.
The Effect of IAA in Lettuce Seed on Cold Resistance Under Low Temperature Stress During Programmed Cooling
ZHANGChenxue,HANYingying,LIWeijie,LIUBaolin,SHENMengqi,ZHOUQiang
(School of Medical Instrument and Food Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China)
Seed is an important survival strategy for hibernating,and seed cryopreservation is the main way for germplasm resources conservation.In this paper,choosing lettuce seed as the object,and using programmed cooling apparatus to create different cooling rates(3 ℃/h and 60 ℃/h),study the mechanism of IAA responding to low temperature stress.The results showed that compared with fast cooling(60 ℃/h),slow cooling (3 ℃/h) is beneficial to the increasing of IAA;using IAA can reduce frozen hurt of the lettuce seed during the program cooling process,especially in 200μm IAA in slow cooling;regardless of cooling rate,SOD activity and proline content will increased significantly,and SOD activity was directly proportional to the IAA concentration,while proline content was having exactly the opposite effect;different cooling rates,and the concentrations of IAA can also influence to cold relative genes:ICE 1,HOS 1.
IAA; lettuce seed; cold hardiness; low temperature stress
2016-11-27
国家留学基金委出国留学项目资助(201308310174)。
张晨雪(1991—),女,山东淄博人;硕士研究生,主要从事植物生物化学、分子生物学研究;E-mail:409096575@qq.com。
通迅作者:韩颖颖(1977—),女,副教授,硕士生导师,E-mail:yyhan2007@163.com。
10.16590/j.cnki.1001-4705.2017.04.001
S 636.2
A
1001-4705(2017)04-0001-06
