矮生沿阶草茎尖离体培养及其植株再生
2017-11-30丁久玲郑凯
丁久玲+郑凯


摘要:以矮生沿阶草幼嫩茎尖为外植体,进行愈伤组织、丛生芽诱导以及壮苗、生根培养基筛选对比研究,建立矮生沿阶草组培快繁体系。结果表明,采用MS+0.1 mg/L BA+0.1 mg/L KT+1.0 mg/L NAA或MS+0.2 mg/L BA+0.05 mg/L KT+1.0 mg/L NAA,愈伤组织诱导率96%以上,愈伤组织致密、淡黄色;将诱导的愈伤组织接种于MS+25 mg/L BA+0.5 mg/L KT+0.2 mg/L NAA或MS+3.0 mg/L BA+0.05 mg/L KT+0.1 mg/L NAA或MS+2.0 mg/L BA+0.1 mg/L KT+0.1 mg/L NAA培养基中,可分化出较多的丛生芽;丛生芽接种于MS+2.5 mg/L BA+0.1~0.2 mg/L NAA培养基中进行壮苗培养,幼苗生长健壮、色泽良好;适宜矮生沿阶草组培苗生根的培养基为 1/4 MS+0. 2 mg/L NAA,外观表现良好。
关键词:矮生沿阶草;茎尖;离体培养;植株再生
中图分类号: S688.404+.3 文献标志码: A 文章编号:1002-1302(2017)20-0173-03
矮生沿阶草(Ophiopogon japonicus f. nanus)是近年来从日本引进的草坪草新品种,为百合科(Liliaceae)沿阶草属(Ophiopogon)多年生常绿草本植物,具耐阴、耐热、耐寒、常绿等特点,具有较强的观赏性,可作为四季常绿的草坪地被植物进行开发利用。随着对矮生沿阶草坪用性状研究的不断深入[1],其作為耐阴植物栽植于风景林下、建筑物遮阳处或复层绿化带下层越来越受到重视[2],在国内外绿化产业中的需求日益旺盛,其种苗工厂化繁殖亦受到重视。矮生沿阶草繁殖方法有种子繁殖、分株繁殖、组织培养等,种子繁殖速度较慢,分株繁殖易造成繁殖的种苗质量不高,组织培养可以加快其繁殖速度,种苗质量较高。我国对矮生沿阶草的组培快繁研究较少,仅有史清云等、李晶等对其快繁技术进行了研究,且二者均是以叶片作为外植体[3-4]。笔者对矮生沿阶草进行了多年研究,发表相关论文数篇[5-7]。本研究以矮生沿阶草幼嫩茎尖为外植体,从愈伤组织的诱导、愈伤组织的分化培养、壮苗培养及生根培养等几方面进行较为系统的研究,建立矮生沿阶草组培快繁体系,为快速繁殖优良的矮生沿阶草种苗提供技术支持。
1 材料与方法
1.1 供试材料
供试的矮生沿阶草材料由江苏绿苑园林建设有限公司苗木基地提供,选取1年生的健壮植株,从其基部将萌发高度约4 cm的幼芽剥离,将全部叶片和根部剪掉,只留约2 mm茎尖作为外植体。
1.2 方法
1.2.1 消毒处理 将外植体置于流水下反复冲洗0.5 h,加入适量的洗涤剂浸泡0.5 h,边浸泡边振荡,冲洗干净后移至超净工作台进行下一步的消毒处理。先用75%乙醇浸泡 15 s,之后用0.1% HgCl2消毒5 min,无菌水冲洗外植体5次。用灭菌纸将完全消毒好的外植体表面的水分吸干,待用。
1.2.2 愈伤组织的诱导 将消毒好的矮生沿阶草幼嫩茎尖接入诱导培养基上诱导愈伤组织(表1)。每种配方接种18瓶,每瓶接种4个外植体。在无菌室条件下,温度为(25±2) ℃,黑暗培养,2个月后观察愈伤组织诱导情况,记录愈伤诱导率,诱导率=(诱导出愈伤组织的外植体数/接种的外植体数)×100%。
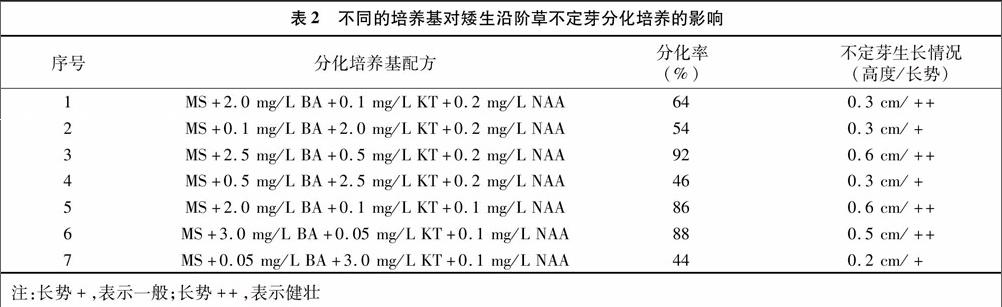
1.2.3 愈伤组织的分化培养 用优选的培养基进行愈伤组织的诱导后,把愈伤组织切成2 mm的小块,接入分化培养基中进行分化培养(表2),培养条件为温度(25±2) ℃、光照度1 500~2 000 lx、光照时间10~12 h/d。每种分化培养基配方接种18瓶,每瓶接种5个愈伤组织小块。经过分化培养后在愈伤组织上萌发出一定数量的不定芽,2个月后对分化的不定芽进行观察和统计,计算分化率,分化率=(分化出芽的材料数/接种的材料数)×100%。
1.2.4 壮苗培养 由于分化培养出的不定芽幼嫩,有必要进行壮苗培养。将优选的分化培养基上分化的不定芽切下接种于壮苗培养基上进行壮苗培养(表3)。每种壮苗培养基配方接种15瓶,每瓶接种4个不定芽(生长一致,高度为5~6 mm)。培养条件:温度和光照度同愈伤组织的分化培养,光照时间12~15 h/d。1个月后观察幼苗生长情况。
1.2.5 生根培养 选择优选的壮苗培养基对矮生沿阶草的幼苗进行壮苗培养后,把健壮的矮生沿阶草无根幼苗转移到生根培养基上培养(表4)。每种生根培养基配方接种12瓶,每瓶接种5株生长一致的幼苗,培养条件同上。3周后观察幼苗根系生长情况。
2 结果与分析
2.1 愈伤组织的诱导
不同的愈伤组织诱导培养基上的产生的愈伤组织有所不同(表1)。几种培养基中,配方5和配方2的愈伤组织诱导率较高,分别为99%和96%,愈伤组织均表现为致密、淡黄色。其余配方的愈伤组织诱导率较低,为52%~74%,且诱导出的愈伤组织外观表现不良,黄色或褐色,严重影响不定芽的分化。综上所述,通过适宜的培养基配方可以使矮生沿阶草幼嫩茎尖诱导出大量的愈伤组织,且愈伤组织外观表现良好,诱导矮生沿阶草愈伤组织适宜的培养基配方为MS+0.1 mg/L BA+0.1 mg/L KT+1.0 mg/L NAA或MS+0.2 mg/L BA+0.05 mg/L KT+1.0 mg/L NAA,愈伤组织诱导率96%以上,且外观表现良好。
2.2 分化培养
不同的培养基对愈伤组织进行培养,分化出的不定芽有所不同(表2)。几种培养基中,配方3的分化率最高,达到92%;其次是配方6和配方5,分化率分别为88%和86%;且3种培养基分化出的不定芽高度和长势无明显差异,高度为0.5~0.6 cm,生长健壮。其余配方的分化率较低,生长一般。因此,适宜的培养基可以使愈伤组织分化出较多的不定芽,通过本研究可判定,矮生沿阶草愈伤组织分化出较多不定芽的培养基为MS+2.5 mg/L BA+0.5 mg/L KT+0.2 mg/L NAA或MS+3.0 mg/L BA+0.05 mg/L KT+0.1 mg/L NAA或 MS+2.0 mg/L BA+0.1 mg/L KT+0.1 mg/L NAA。在优选的分化培养基上培养60 d,将高0.5 cm以上的不定芽从基部剪下,接种至相同的培养基上进行不定芽分化继代培养。每50 d继代1次,继代培养4代后不定芽达到6~7倍,进行壮苗培养。观察发现,继代培养分化的不定芽长势与愈伤组织分化的不定芽基本一致。endprint
2.3 壮苗培养
不定芽接种于不同的壮苗培养基上表现有所不同(表3)。配方3和配方4幼苗生长最好,高度分别达2.8、2.6 cm,且健壮、色泽深绿色;其次是配方7和配方8,幼苗高度分别为2.0、1.9 cm,但幼苗表现为淡绿色,生长一般;配方5和配方6的幼苗生长最差,高度分别为1.6、1.4 cm,外观表现为细弱、幼嫩,色泽黄绿色或淡绿色。综上所述,适宜的壮苗培养基可以使矮生沿阶草的不定芽变成健壮、且色泽好的幼苗,由本研究可知,矮生沿阶草适宜的壮苗培养基为MS+2.5 mg/L BA+0.1~0.2 mg/L NAA。
2.4 生根培养
把健壮的矮生沿阶草无根幼苗转移至生根培养基上进行培养(表4)。运用配方5对幼苗进行生根培养时,根系生长最好,长度达1.8 cm,外观表现为健壮、白色,且平均根数达到5.7条/株;其次是配方4,根系长度为1.5 cm,外观表现为较健壮、淡黄色,平均根数为2.8根/株;其他配方的培养出的组培苗根系长度较短,生长一般、色泽淡黄色或黄褐色。矮生沿阶草根系生长的好坏直接影响组培苗移栽成活率的高低,应选择健壮、长度长、具有白色根系的组培苗进行栽培。综上所述,适宜的生根培养基利于矮生沿阶草的幼苗根系的萌发和生长,由本研究可知,矮生沿阶草适宜的生根培养基为1/4MS+0.2 mg/L NAA。
3 讨论与结论
关于沿阶草属组培方面的研究较多,其中以叶片为外植体诱导愈伤组织者居多,以茎尖为外植体诱导愈伤者的较少。目前,仅有别运清等[8]、郑志仁等[9]分别以湖北麦冬的莖尖和黑麦冬带茎尖的幼嫩茎段为外植体的报道。本研究以矮生沿阶草的幼嫩茎尖为外植体,为沿阶草属植物的茎尖离体培养提供一定的依据。
不同的植物器官诱导愈伤组织,其培养基有所不同。以叶片为外植体筛选诱导愈伤组织的培养基的研究中,日本矮生沿阶草的培养基是MS+1.0 mg/L 2,4-D+0.25 mg/L KT+0.1 mg/L NAA[3],山麦冬理想的培养基是MS+1.5 mg/L 2,4-D+0.4 mg/L BA+1.0 mg/L NAA[10]。以茎尖为外植体筛选诱导愈伤组织的培养基的研究中,湖北麦冬在MS+2.0 mg/L BA+0.2~0.5 mg/L NAA的培养基中能完成愈伤组织的诱导[8],黑麦冬诱导愈伤组织的培养基[9]与湖北麦冬的相似。这些研究表明植物器官诱导愈伤组织需要细胞分裂素和生长素共同作用,且二者比例应适当,本研究得出了与此一致的结论,发现矮生沿阶草茎尖愈伤组织的诱导需要细胞分裂素(BA和KT)和生长素(NAA)的共同作用,二者的比例为0.2~0.25 ∶ 1.0,即需要较低含量的细胞分裂素和较高含量的生长素。本研究以茎尖为外植体诱导愈伤组织,适宜的培养基为MS+0.1 mg/L BA+0.1 mg/L KT+1.0 mg/L NAA或MS+0.2 mg/L BA+0.05 mg/L KT+1.0 mg/L NAA,与别运清等的研究结果[8-9]有一定的差异,这可能是植物材料本身造成的,本研究采用的是矮生沿阶草,而后者采用的是湖北麦冬和黑麦冬。
前人研究表明,色泽淡黄或淡绿色、质地紧密的愈伤组织易分化诱导出不定芽,而色泽发黄或褐色、质地疏松的愈伤组织严重影响不定芽的分化[11-12]。本研究利用诱导率较高的培养基培养出的愈伤组织色泽淡黄、结构致密,适宜诱导分化出大量的不定芽。
对于愈伤组织的分化培养,亦需要细胞分裂素和生长素的共同作用,与愈伤组织诱导相反,愈伤组织分化需要较高含量的细胞分裂素和较低含量的生长素。通过本研究可知,使矮生沿阶草愈伤组织分化出较多不定芽的培养基为MS+2.5 mg/L BA+0.5 mg/L KT+0.2 mg/L NAA或MS+3.0 mg/L BA+0.05 mg/L KT+0.1 mg/L NAA或MS+2.0 mg/L BA+0.1 mg/L KT+0.1 mg/L NAA。这与别运清等的研究结果[8-9]一致。从筛选出的分化培养基中分析,细胞分裂素的类型亦影响不定芽的分化,高含量的BA和低含量的KT利于分化出不定芽,而BA含量较低和KT含量较高时则不利于不定芽的分化。
经过壮苗培养的幼苗用生根培养基培养1个月后可进行炼苗移栽,经统计发现经1/4 MS+0.2 mg/L NAA生根培养基培养的组培苗其成活率高,达95%,而其他生根培养基培养出的组培苗其成活率低,约为36%~65%,这与组培苗根系的数量、色泽、和长度等有一定的关系。根系健壮、色泽嫩白、数量多的幼苗移栽成活率高。
参考文献:
[1]何任红,马爱军,巫建新,等. 日本矮生沿阶草在长江下游地区的引种适应性试验[J]. 草业科学,2006,23(7):96-98.
[2]丁久玲,俞禄生,沈益新,等. 沿阶草的绿化应用及研究进展[J]. 草原与草坪,2006(2):15-18.
[3]史清云,史云光. 日本矮生沿阶草的快繁技术[J]. 江苏农业科学,2007(3):132-133.
[4]李 晶,孙吉雄,梁慧敏. 日本矮生沿阶草愈伤组织的诱导及其分化[J]. 草业科学,2009,26(4):150-153.
[5]丁久玲,俞禄生,蔡庆生,等. 日本矮生沿阶草适宜光照条件的研究[J]. 西北植物学报,2006(9):1827-1831.
[6]丁久玲,俞禄生,沈益新,等. 矮生沿阶草适宜液肥配方的初步研究[J]. 中国农学通报,2011(6):112-116.
[7]丁久玲,郑 凯,沈益新,等. 矮生沿阶草快繁适宜温度条件的研究[J]. 草原与草坪,2007(4):58-60.
[8]别运清,丁 芹. 湖北麦冬茎尖离体培养与植株再生研究[J]. 河南农业科学,2004(9):53-55.
[9]郑志仁,娄玉霞,钱 宇,等. 黑麦冬的组织培养和快速繁殖[J]. 植物生理学通讯,2008,44(1):119-120.
[10]郑媛媛,慈 颖,曲杨乐,等. 山麦冬组织培养及无性系建立的研究[J]. 黑龙江农业科学,2009(5):14-16.
[11]梁云涛,潘英华,余建平,等. 高秆野生稻愈伤组织诱导分化研究[J]. 西南农业学报,2014(3):905-909.
[12]刘剑锋,阎秀峰,李 霞,等. 高山红景天叶片愈伤组织诱导与植株再生[J]. 东北林业大学学报,2007(2):33-34.endprint
