绵羊肺炎支原体延伸因子EF-P基因的克隆、表达及其重组蛋白免疫原性研究
2017-11-29田路路孟庆玲于伟伟李重阳才学鹏陈创夫
田路路,孟庆玲,乔 军,于伟伟,孟 丹,李重阳,才学鹏 ,陈创夫
(1.石河子大学 动物科技学院, 新疆石河子 832003; 2.中国农业科学院 兰州兽医研究所, 兰州 730046)
绵羊肺炎支原体延伸因子EF-P基因的克隆、表达及其重组蛋白免疫原性研究
田路路1,孟庆玲1,乔 军1,于伟伟1,孟 丹1,李重阳1,才学鹏2,陈创夫1
(1.石河子大学 动物科技学院, 新疆石河子 832003; 2.中国农业科学院 兰州兽医研究所, 兰州 730046)
为筛选绵羊肺炎支原体(MO)免疫相关蛋白,以MO新疆流行株基因组DNA为模板,通过PCR扩增其EF-P基因,测序后对其编码蛋白进行分子特征分析;用生物信息学软件预测其抗原表位集中区编码片段;进一步将该基因片段克隆入pET-32a(+)中,构建原核表达载体pET-32a(+)-EF-P,将pET-32a(+)-EF-P质粒转化至感受态细胞EscherichiacoliBL21(DE3)中,IPTG诱导目的蛋白表达后,检测重组蛋白反应原性和免疫原性。SDS-PAGE结果显示,EF-P重组蛋白分子质量为29.5 ku;Western blot结果显示,该重组蛋白可被MO阳性血清特异性识别,证实其具有良好的反应原性;小鼠免疫试验结果显示,该重组蛋白可诱导机体产生特异性抗体,采用正向间接血凝方法检测效价可达1∶64,提示其具有较强的免疫原性。
绵羊肺炎支原体;EF-P;克隆;表达;免疫原性
绵羊肺炎支原体(Mycoplasmaovipneumoniae, MO)是绵羊呼吸道疾病的重要致病菌之一,也可引起山羊呼吸道疾病[1-2],其定殖于呼吸道黏膜表面,可引起呼吸道感染,并导致咳嗽、呼吸困难和生长不良,还可引起免疫抑制现象[3]。该病已广泛分布于世界各地,给养羊业造成重大的经济损失[4-5]。目前,疫苗免疫接种已被证实是一种有效防控MO感染的主要手段。
1 材料与方法
1.1 质粒、菌种及试剂
MO新疆流行株(MO XJ1株)分离自新疆某羊场疑似MO感染羊的病料[14]。E.coliDH5α、E.coliBL21(DE3)和pET-32a(+) 质粒由石河子大学预防兽医学寄生虫实验室保存。pMD19-T载体、DNA marker、核酸限制性内切酶EcoRⅠ、XhoⅠ、T4DNA Ligase和蛋白Marker购自TaKaRa公司;质粒小量提取试剂盒和琼脂糖凝胶回收试剂盒购自诺维森(北京)生物科技有限公司;MO正向间接血凝诊断试剂盒(IHA)由中国农业科学院兰州兽医研究所提供。MO阳性血清分离自新疆塔城地区感染MO的绵羊;辣根过氧化物酶标记的兔抗羊IgG购自中彬金桥公司;增强型HRB-DAB底物显色试剂盒购自天根生化科技(北京)有限公司;昆明系雌鼠购自石河子大学实验动物中心。
1.2 总DNA的提取
取MO感染羊的肺组织,加入去离子水进行研磨,将研磨液置于1.5 mL EP管中,按照TaKaRa公司的病毒基因组DNA提取试剂盒操作说明提取绵羊肺炎支原体的DNA, -20 ℃保存,备用。
1.3 引物设计与合成
用Primer 5.0软件,根据GenBank中发表的MO基因序列(登录号: NZ_AFHO01000009),设计扩增全长EF-P基因的特异性引物:EF-P(C)-F:5′-ATGTCACGAAAATTTGAACTA-3′;EF-P(C)-X:5′-TTAGTCGTCAGATTTGATTGC-3′;同时设计扩增EF-P基因编码抗原表位集中区序列的特异性引物,并根据pET-32a(+)载体上的多克隆位点选择限制性内切酶,在上游引物中引入EcoRⅠ 酶切位点,下游引物中引入XhoⅠ酶切位点。上游引物EF-PE-F:5′-GAATTCAGACAAGCAACAAATTATG-3′,下游引物EF-PX-R:5′- CTCGAGTGCTGCTTTGTCTTGTAA-3′(下划线处分别为EcoRⅠ和XhoⅠ酶切位点),引物由华大基因生物公司合成。
1.4MO新疆株EF-P基因的PCR扩增及分子特征分析
采用20 μL反应体系进行PCR扩增:ddH2O 7 μL,2×PCR Mix 10 μL,模板2 μL,上、下游引物各0.5 μL。反应条件:预变性95 ℃ 5 min;变性94 ℃ 50 s,退火61 ℃ 40 s,延伸72 ℃ 30 s,共32个循环;最后72 ℃ 延伸10 min。10 g/L琼脂糖凝胶电泳后切胶回收目的片段,与pMD19-T载体4 ℃过夜连接;转入E.coliDH5α感受态细胞中。通过菌液PCR筛选阳性菌落,并送华大基因生物公司测序,将测序正确的质粒命名为pMD19-T-EF-P。利用生物在线软件对其编码氨基酸序列分子质量、糖基化位点、跨膜区、信号肽、高级结构等进行预测分析。
在女主人公的生活故事中,构成两性关系影响的男人有五位,他们是剑、李木、子墨、老师和“他”(抑或“金岳霖”)。这些男子分作两组,与女主人公形成两个“多角恋”关系。第一个多角恋即构成了“江山娇”叙述线。其恋情关系发生在江山娇与剑、李木和老师之间,时间在江山娇与李木结婚前。最终以江山娇与李木结婚而告结。第二个多角恋构成了“伊一”叙述线。其恋情关系在伊一与子墨、李木和“他”之间进行。这个恋情是无解的,乃至一直到伊一绝尘而去。
1.5重组表达载体pET-32a(+)-EF-P构建
将测序正确的pMD19-T-EF-P质粒与pET-32a(+) 质粒用EcoRⅠ和XhoⅠ在37 ℃条件下同时进行双酶切,反应结束后分别回收目的片段和载体片段,用T4DNA连接酶4 ℃过夜连接,将连接产物转入感受态细胞E.coliDH5α中,挑取单个菌落,进行PCR鉴定。取阳性克隆提取质粒进行双酶切鉴定,用10 g/L琼脂糖凝胶电泳检测,鉴定正确的重组表达载体质粒命名为pET-32a(+)-EF-P。
1.6 目的蛋白的诱导表达及免疫印迹分析
将鉴定正确的重组质粒pET-32a(+)-EF-P转化入E.coliBL21(DE3)中,次日挑取单个菌落37 ℃摇菌过夜,取150 μL菌液接种于15 mL含Amp抗性的液体LB培养基中,用1.0 mmol/L IPTG诱导4、6和8 h,12 000 r/min离心1 min后收集菌体,同时设置空载体和未加IPTG诱导的重组菌做阴性对照,进行SDS-PAGE电泳分析;以MO阳性血清为一抗,辣根酶标记的兔抗羊IgG为二抗,进行Western blot 分析。
1.7 EF-P重组蛋白的免疫原性研究
将10只25日龄的昆明系雌鼠随机分成试验组和对照组,每组各5只。免疫制剂的制备:50 μg EF-P重组蛋白与弗氏完全佐剂按体积比1∶1充分乳化后形成油包水型的制剂。试验组:V(50 μg EF-P重组蛋白溶液)∶V(弗氏完全佐剂)=1∶1;对照组:V(PBS缓冲液)∶V(弗氏完全佐剂)=1∶1。采用皮下多点注射方式进行首次免疫,免疫剂量为200 μL。首免14 d后进行二次免疫,试验组:V(50 μg EF-P重组蛋白溶液)∶V(弗氏不完全佐剂)=1∶1;对照组:V(PBS缓冲液)∶V(弗氏不完全佐剂)=1∶1。7 d后采血,分离血清,用MO IHA试剂盒测定小鼠(试验组和对照组)血清样品的抗体效价。
2 结果与分析
2.1EF-P基因的扩增及其编码蛋白的分子特征
对EF-P基因进行PCR扩增,条带大小与目的条带相符(图1)。经测序,EF-P基因全长2 085 bp,编码694个氨基酸,理论等电点5.38,该基因中G+C占37.27%,高于MO全基因组的平均G+C含量(28.85%)。利用网上在线工具预测EF-P蛋白的跨膜结构域和信号肽,发现其无跨膜结构域、信号肽。通过Motif Scan在线软件对结构域进行预测分析,显示在73~76、343~346位氨基酸处有2个酰胺化位点,在340~343、679~682位氨基酸处有2个潜在的N-糖基化位点,在17~24位氨基酸处有一个ATP/GTP结合位点,在245~248位氨基酸处有1个cAMP和cGMP依赖性蛋白激酶磷酸化位点,有13个酪蛋白激酶Ⅱ磷酸化位点和12个蛋白激酶磷酸化位点,在60~65、157~162、372~377、549~554位氨基酸处有4个N-酰基化位点,在51~66 位氨基酸处有1个GTP结合延伸因子标签(图2)。利用在线软件BepiPred 1.0b Server预测发现,在109~205位氨基酸处有4个优势抗原表位;经DNAMAN 分析发现在该区域内不存在终止密码子,可正常翻译;Motif Scan在线软件分析发现该段氨基酸序列存在多个功能结构域。

M.DNA marker DL2000; 1~4.菌液PCR产物 PCR products of bacterial liquid
图1MOEF-P基因的PCR扩增
Fig.1AmplificationofEF-PgeneofMObyPCR

图中有2个酰胺化位点(下划线),4个N端酰基化位点(斜体加粗),2个N端糖基化位点(波浪线),1个cAMP和cGMP依赖性蛋白激酶磷酸化位点(双下划线),13个酪蛋白激酶 Ⅱ磷酸化位点(阴影部分),12个蛋白激酶磷酸化位点(加粗)。
There are two amidation site (underlined),four N-terminal acylation sites (bold italic),two N-glycosylation sites (wave),one cAMP- and cGMP-dependent protein kinase phosphorylation site(double-underline),thirteen casein kinase Ⅱ phosphorylation site(shaded)and twelve protein kinase C phosphorylation site(bold).
图2MOEF-P基因核苷酸序列及其编码氨基酸序列
Fig.2NucleotidesequenceandencodedaminoacidsequenceofEF-PgeneofMO
2.2 EF-P蛋白二级结构及三级结构预测
采用PSIPRED在线软件对EF-P基因编码的蛋白质二级结构进行预测显示,其α-螺旋占40.63%,β-折叠占17.44%,无规卷曲占41.93%,无β-转角,利用Swiss-Model 数据库在线模拟EF-P蛋白的3D结构(图3)。
2.3 EF-P蛋白基因遗传进化分析
对基于该段基因序列推导的氨基酸序列进行分析并绘制遗传进化树发现,MOEF-P基因与殊异支原体、猪肺炎支原体和絮状支原体具有较高的同源性,绵羊肺炎支原体属间高度同源,两者氨基酸序列相似性高达99.14%,与猪肺炎支原体氨基酸相似性为93.66%,说明两者亲缘关系较近;与大肠杆菌和芽孢杆菌属不在同一支,说明亲缘关系较远(图4)。
2.4 重组表达载体的构建与鉴定
用特异性引物成功扩增优势抗原表位基因264 bp (图5),pET-32a(+)-EF-P经EcoRⅠ和XhoⅠ双酶切后得到目的片段和pET-32a(+)载体片段(图 6),表明成功构建重组表达质粒pET-32a(+)-EF-P。
2.5表达产物的SDS-PAGE和Westernblot分析
SDS-PAGE分析显示,IPTG诱导的样品在29.5 ku处有明显条带,且与理论分析值相符,重组菌在IPTG诱导8 h时表达量达到最高。
Western blot分析结果表明,重组蛋白可被MO阳性血清识别,说明重组蛋白EF-P具有较好的反应原性(图7)。
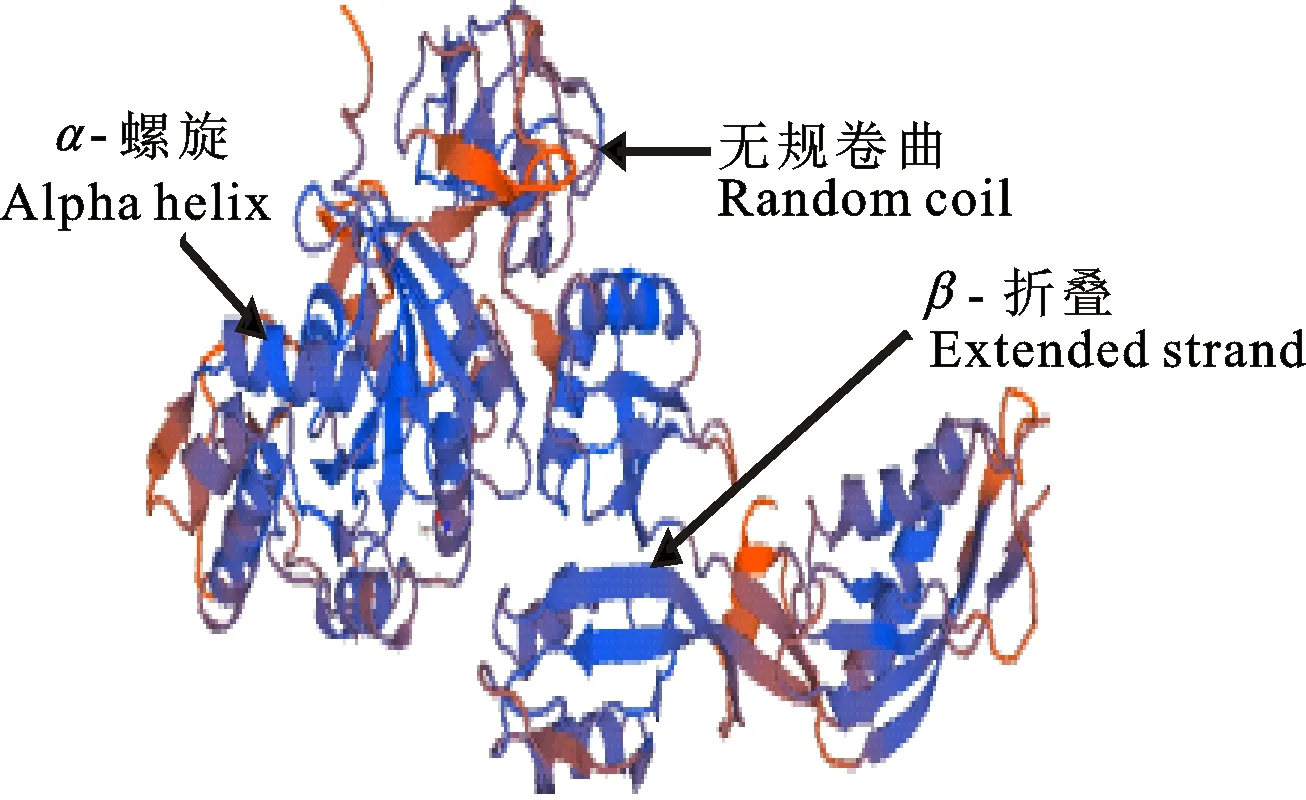
图3 PSIPRED软件预测的EF-P二级与三级结构Fig.3 Predicted secondary and tertiary structure of EF-P by using PSIPRED software

图4 EF-P基因系统进化关系Fig.4 Phylogenetic tree of Mycoplasma species based on EF-P gene

M.DNA marker DL2000;1~3.菌液PCR产物 PCR products of bacterial liquid
图5EF-P的PCR鉴定
Fig.5IdentificationofEF-PbyPCR

M.DNA marker DL5000; 1~2.pET-32a(+)-EF-P双酶切产物 The products from pET-32a(+)-EF-Pby double enzyme digestion
图6pET-32a(+)-EF-P的双酶切鉴定
Fig.6IdentificationofpET-32a(+)-EF-Pbydoubleenzymedigestion
2.6 重组蛋白的小鼠免疫试验
小鼠经重组蛋白免疫 2 次后,采血分离血清,用MO IHA试剂盒检测,结果证实重组表达的EF-P能刺激机体产生相对较强的免疫反应,抗体效价大于1∶64。表明重组蛋白EF-P具有较好的免疫原性。
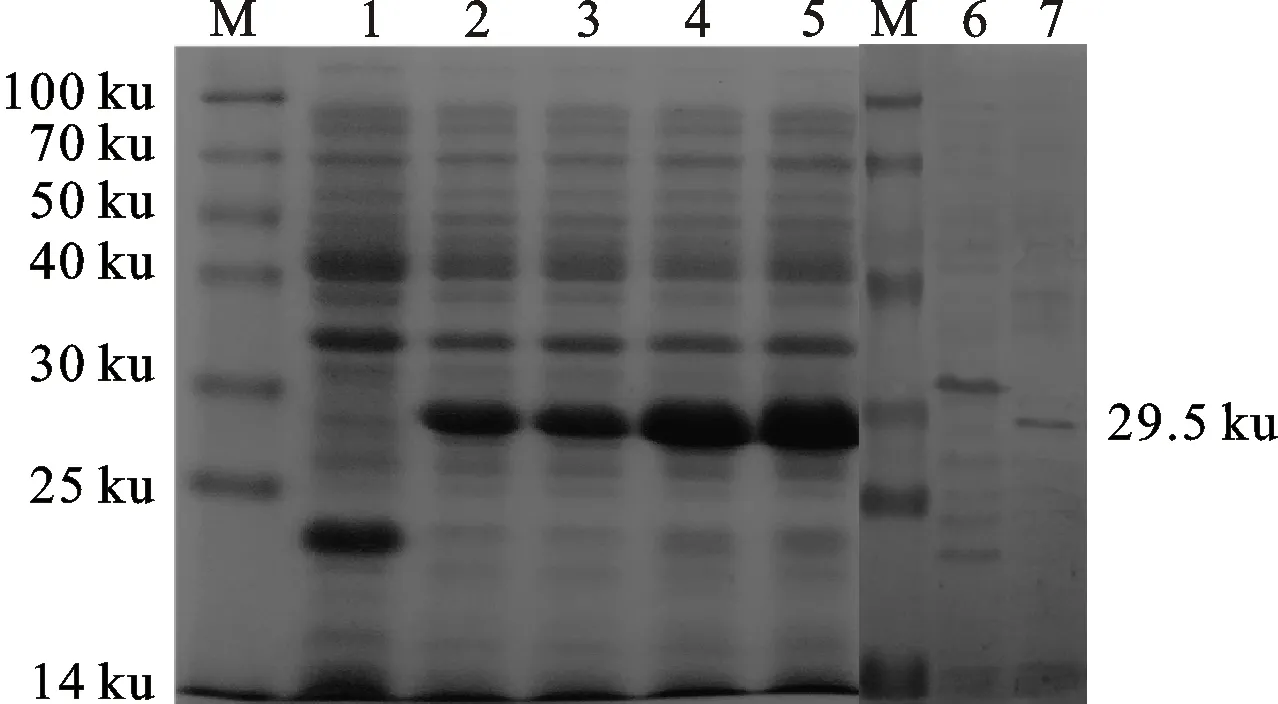
M.蛋白分子质量标准 Protein marker; 1.pET-32a(+)质粒诱导表达产物 pET-32a(+)plasmid induced by IPTG; 2~5.pET-32a(+)-EF-P重组菌IPTG诱导2、4、6、8 h的表达产物 pET-32a(+)-EF-Pplasmid induced 2 h,4 h,6 h and 8 h by IPTG; 6.未加诱导剂IPTG的 pET-32a(+)-EF-P重组菌的Western blot分析 Western blotting of the pET-32a(+)-EF-Pplasmid without IPTG;7.纯化的重组蛋白的Western blot分析 Western blotting of the purified recombinant using antiserum ofM.ovipneumoniae.
图7重组蛋白EF-P的SDS-PAGE和Westernblot分析
Fig.7AnalysisofrecombinantEF-PproteinbySDS-PAGEandWesternblot
3 讨 论
MO是一种无细胞壁的微生物,与细菌相比,其基因组编码的蛋白虽然较少,但其保护性抗原蛋白目前尚未被鉴定。对人肺炎支原体、猪肺炎支原体、结核分枝杆菌的相关研究发现,EF-Tu可作为一种潜在的抗原[15]。Alonso等[16]为鉴定潜在的诊断抗原,从自然感染的动物血清抗体中筛选出丝状支原体亚种,成功构建基因组文库,并在大肠杆菌中表达。Western blot分析表明,重组EF-Tu蛋白可被牛传染性胸膜肺炎阳性血清特异性识别。有研究表明,EF-Tu 是MO膜相关蛋白,动物免疫试验证实该重组蛋白能够诱导Th1、Th2型免疫应答产生较高的抗体水平,并且可促进干扰素-γ的表达量增加[17]。Dallo等[18]对肺炎支原体(M.pneumoniae)EF-Tu进行克隆,并在大肠杆菌中表达。通过His-tag亲和柱层析纯化后免疫动物,能刺激动物机体产生相应的抗体。全细胞放射性免疫沉淀试验显示,重组EF-Tu蛋白能够抑制支原体对纤连蛋白的黏附作用,证实EF-Tu蛋白是M.pneumoniae表面毒力因子。Pinto等[19]通过免疫蛋白质组学分析发现猪肺炎支原体7 447株的EF-Tu也具有免疫原性。许健等[20]利用双向电泳及免疫印迹的方法对MO MoGH3-3株抗原蛋白进行筛选,筛选到EF-Tu抗原。延伸因子P(EF-P)是一种新发现的蛋白翻译因子,主要参与富含脯氨酸密码子的mRNA的翻译,是细菌中富含脯氨酸蛋白生物合成必不可少的翻译因子。研究发现,富含脯氨酸的蛋白质不仅对细菌的生长极为重要,而且与致病菌(沙门氏菌或肠出血性大肠杆菌)的适应性和毒力密切相关。缺乏EF-P的肠道细菌适应性减弱,毒力也明显降低。然而,到目前为止对于EF-P的确切功能仍不是很清楚。Doerfel等[21]研究发现EF-P可作为新一代抗生素(antibiotic)一个有潜力的新靶点,用药物阻断EF-P可以削弱致病细菌的适应性,对抗耐药病原体引起的感染。本研究利用DNAStar、在线软件ABCpred及BepiPred 1.0 Server对EF-P蛋白抗原表位进行预测,截取优势抗原表位集中区第120~208 位氨基酸处的片段,对其进行克隆、表达及免疫原性分析。 EF-P优势抗原表位集中区片段长度为264 bp,编码88个氨基酸,在该段氨基酸序列中有N-酰基化位点、蛋白激酶磷酸化位点、酪蛋白激酶Ⅱ磷酸化位点和延伸因子Tu GTP结合结构域各1个。SDS-PAGE和Western blot检测结果证实,EF-P重组蛋白具有较好的反应原性;小鼠免疫试验证实,该重组蛋白能诱导机体产生较高水平的特异性抗体,证实EF-P蛋白具有较强的免疫原性。本研究为MO血清学诊断及新型疫苗研发提供科学依据。
Reference:
[1] GONCALVES R,MARIANO I,NUNEZ A,etal.Atypical non-progressive pneumonia in goats[J].TheVeterinaryJournal,2010,183(2):219-221.
[2] RIFATBEGOVIC M,MAKSIMOVIC Z,HULAJ B.Mycoplasmaovipneumoniaeassociated with severe respiratory disease in goats[J].VeterinaryRecord,2011,168(21):565.
[3] GOLTZ J P,ROSENDAL S,MCCRAW B M,etal.Experimental studies on the pathogenicity ofMycoplasmaovipneumoniaeandMycoplasmaargininifor the respiratory tract of goats[J].CcanadianJournalofVeterinaryResearch,1986,50(1):59-67.
[4] PARHAM K,CHURCHWARD C P,MCAULIFFE L,etal.A high level of strain variation within theMycoplasmaovipneumoniaepopulation of the UK has implications for disease diagnosis and management [J].VeterinaryMicrobiology,2006,118(1/2):83-90.
[5] MACKAY J M K,NISBET D I,FOGGIE A.Isolation of pleuropneumonia-like organisms (GenusMycoplasma) from case of sheep pulmonary adenomatosis (SPA) [J].VeterinaryRecord,1963,75(21):550-551.
[6] NAM D,CHOI E,SHIN D,etal.tRNAPro-mediated downregulation of elongation factor P is required for mgtCBR expression duringSalmonellainfection[J].MolecularMicrobiology,2016,102(2):221-232.
[7] RAJKOVIC A,HUMMELS K R,WITZKY A,etal.Translation control of swarming proficiency inBacillussubtilisby 5-amino-pentanolylated elongation factor P[J].TheJournalofBiologicalChemistry,2016,291(21):10976-10985.
[8] KATOH T,WOHLGEMUTH I,NAGANO M,etal.Essential structural elements in tRNAProfor EF-P-mediated alleviation of translation stalling[J].NatureCommunications,2016,7:11657.
[9] 尹正军,岳 华,汤 承,等.绵羊肺炎支原体延伸因子Tu基因的分子特性分析[J].畜牧兽医学报,2015,46(2):288-294.
YIN ZH J,YUE H,TANG CH,etal.Molecular characterization of the elongation factorTugene inMycoplasmaovipneumoniae[J].ActaVeterinariaetZootechnicaSinica,2015,46(2):288-294(in Chinese with English abstract).
[10] YOUNG C C,BERNLOHR R W,etal.Elongation factor Tu is methylated in response to nutrient deprivation inEscherichiacoli[J].JournalofBacteriology,1991,173(10):3096-3100.
[11] PORCELLA S F,BELLAND R J,JUDD R C.etal.Identification of an EF-Tu protein that is periplasm-associated and processed inNeisseriagonorrhoeae[J].Microbiology,1996,142(9):2481-2489.
[12] LAYH-SCHMITT G,PODTELEJNIKOV A,MANN M.etal.Proteins complexed to the P1 adhesin ofMycoplasmapneumoniae[J].Microbiology,2000,146(3):741-747.
[13] 张 轩.绵羊肺炎支原体多表位疫苗的研究及免疫试验[D].北京:中国农业科学院,2013.
ZHANG X.Research and immune experiments of multi-epitope vaccine ofMycoplasmaovipneumoniae[D].Beijing:Chinese Academy of Agricultural Sciences,2013(in Chinese with English abstract).
[14] 马 玉,乔 军,孟庆玲,等.绵羊肺炎支原体新疆流行株的分离鉴定及其膜蛋白P80基因序列分析[J].西南农业学报,2015,3:1375-1380.
MA Y,QIAO J,MENG Q L,etal.Isolation and identification ofMycoplasmaovipneumoniaeXinjiang isolates and its sequence analysis of P80 gene[J].SouthwestChinaJournalofAgriculturealSciences,2015,3:1375-1380(in Chinese with English abstract).
[15] MEDZHITOV R,JANEWAY C A.Innate immunity: impact on the adaptive immune response[J].CurrentOpinioninImmunology,1997,9(1):4-9.
[16] ALONSO JMMN,PRIETO M,PARRA F.Genetic and antigenic characterisation of elongation factor Tu fromMycoplasmamycoidessubsp.mycoidesSC[J].VeterinaryMicrobiology,2002,89(4):277-289.
[17] JIANG F,HE J,NAVARRO-ALVAREZ N,etal.Elongation factor Tu and heat shock protein 70 are membrane-associated proteins fromMycoplasmaovipneumoniaecapable of inducing strong Immune response in mice[J].PLoSOne,2016,11(8):e0161170.
[18] DALLO S F,KANNAN T R,BLAYLOCK M W,etal.Elongation factor Tu and E1 beta subunit of pyruvate dehydrogenase complex act as fibronectin binding proteins inMycoplasmapneumoniae[J].MolecularMicrobiology,2002,46(4):1041-1051.
[19] PINTO P M,CHEMALE G,DE CASTRO L A,etal.Proteomic survey of the pathogenicMycoplasmahyopneumoniaestrain 7448 and identification of novel post-translationally modified and antigenic proteins [J].VeterinaryMicrobiology,2007,121(1/2):83-93.
[20] 许 健,储岳峰,高鹏程,等.绵羊肺炎支原体免疫蛋白质组学的初步研究 [J].中国兽医科学,2012,42(2):150-153.
XU J,CHU Y F,GAO P CH,etal.Preliminary study on immunoproteomics ofMycoplasmaovipneumoniae[J].ChineseVeterinaryScience,2012,42(2):150-153(in Chinese with English abstract).
[21] DOERFEL L K,WOHLGENMUTH I,KOTHE C,etal.EF-P is essential for rapid synthesis of proteins containing consecutive proline residues[J].Science,2013,339(6115):85-88.
CorrespondingauthorQIAO Jun, male, Ph.D, professor.Research area: pathogenic molecular biology.E-mail: qj710625@163.com
(责任编辑:顾玉兰Responsibleeditor:GUYulan)
CloningandExpressionofEF-PGeneofMycoplasmaovipneumoniaeandImmunogenicityofRecombinantProtein
TIAN Lulu1, MENG Qingling1,QIAO Jun1, YU Weiwei1, MENG Dan1, LI Chongyang1,CAI Xuepeng2and CHEN Chuangfu1
(1.College of Animal Science and Technology, Shihezi University, Shihezi Xinjiang 832003, China; 2.Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, China)
In order to screen the related immune proteins ofMycoplasmaovipneumoniae(MO),EF-Pgene ofMycoplasmaovipneumoniae(MO) isolated from sheep was amplified by PCR and it’s molecular characteristics was analyzed after was sequenced in this study.It’s epitope clustering region was screened, cloned and expressed in prokaryotic cells.and then geneEF-Pwas amplified by PCR.It was synthesized and subcloned to pET-32a (+) to generate pET-32a(+)-EF-P.Then the pET-32a(+)-EF-Pwas transformed into competent cells ofE.coliBL21 (DE3) for expression after induced by IPTG.and it’s reactogenicity and were analyzed.SDS-PAGE showed that the molecular mass of recombinant protein was 29.5 ku.Western blot analysis showed that the recombinant protein was specifically recognized by the MO positive serum, and it had good reactogenicity.The immunization tests in mice showed that the recombinant protein could induce anti-serum antibody with the IHA titer of 1∶64, which confirmed that the recombinant protein had a strong immunogenicity.
Mycoplasmaovipneumoniae;EF-P;Cloning;Prokaryotic expression;Immunogenicity
2016-09-03
2016-09-30
China International Cooperation Program of Science and Technology (No.2014DFR31310); the Program of Youth Leading Talents in Science and Technology Innovation of Xinjiang Production and Construction Corps(No.2016BC001).
TIAN Lulu, female, master student.Research area: pathogenic molecular biology.E-mail:928929323@qq.com
日期:2017-11-17
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.006.html
2016-09-03
2016-09-30
国家国际科技合作专项(No.2014DFR31310);兵团中青年科技创新领军人才计划(2016BC001)。
田路路,女,硕士研究生,研究方向为病原分子生物学。E-mail: 928929323@qq.com
乔 军,男,博士,教授,主要从事畜禽病原分子生物学研究。E-mail: qj710625@163.com
S858.26
A
1004-1389(2017)11-1577-07
