储存玉米中黄曲霉毒素主要产生菌的检测及污染预防研究
2017-11-29刘增然张光一王南南
刘增然, 张光一, 王南南, 徐 曼
(河北经贸大学生物科学与工程学院, 石家庄 050061)
储存玉米中黄曲霉毒素主要产生菌的检测及污染预防研究
刘增然*, 张光一, 王南南, 徐 曼
(河北经贸大学生物科学与工程学院, 石家庄 050061)
通过对储存玉米霉变初期的感官症状观察、分离菌的PCR检测及在不同环境条件下的生长预测模型建立,探讨了识别、预防储存玉米发生黄曲霉毒素及其主要产生菌污染的实用方法。结果表明:籽粒色泽及致密性改变、表面有潮湿感、粮堆内局部发热等症状的出现可表征储存玉米有可能发生真菌污染。以毒素合成相关的全局性调控因子veA基因为靶标,对污染玉米样品分离菌进行PCR检测,扩增出约1.9 kb的条带,与预期大小相符,证明污染菌是黄曲霉或寄生曲霉。污染曲霉在不同玉米水分活度和环境温度下的生长数据,经Baranyi函数拟合、估测其最大生长速度,并建立了生长速度随玉米水分活度和环境温度变化的多项式回归模型;模型显示玉米水分活度和环境温度对污染曲霉的生长影响具有协同性;要确保储存玉米安全,储存参数的限值选择应远离适合污染菌生长的区域。本研究为储存玉米安全管理决策、玉米水分活度和环境温度限值的选择及调控提供支持,利于降低储存玉米的黄曲霉毒素及其主要产生曲霉 (黄曲霉或寄生曲霉)的污染风险。
玉米; 黄曲霉毒素; PCR检测; 生长模型; 感官变化
玉米作为三大粮食作物之一,粗纤维含量高、氨基酸平衡好,被广泛食用和饲用。其胚部组织疏松、吸湿性强、富含碳水化合物,易受真菌侵染[1]。玉米长期储存中如果管理不当,可能发生结露、虫蚀、局部发热、真菌孢子萌发并导致真菌毒素污染,造成经济损失。
已有证据表明,玉米的真菌及毒素污染与玉米品种、污染菌种属及环境条件有关[2]。很多研究基于高度保守DNA 序列 (如rDNA的内转录间隔区)或真菌毒素合成相关的结构基因 (如aflD、aflO、aflQ)与调控基因 (如aflR、aflS)进行分子检测,确定玉米是否被真菌污染[3-8]。已有研究证明,真菌的全局性调控因子VeA控制其生长分化、形态发生、次生代谢、环境胁迫应答、侵染宿主致毒致病[9],是真菌产生毒素所必需的基因。因此veA可以作为检测真菌是否存在及玉米籽粒是否为真菌毒素污染的靶标基因。
关于环境因子对玉米贮存中产黄曲霉毒素真菌的发育及其产毒的影响已有研究[10-13],证明玉米水分活度、环境温度是决定储存玉米霉变的主要因素。如果玉米籽粒含水量高或环境温度和湿度波动大,可能导致玉米霉变。李瑞芳等[14]、赵立等[15]、岳晓禹等[16]也分别利用马铃薯培养基、玉米籽粒、玉米粉培养基进行了初步研究。一般认为,玉米籽粒含水量小于14%或储存温度低于10℃可实现玉米的安全储存。然而,真菌生长预测模型在指导玉米种植户调控玉米存储条件、防控真菌污染领域的应用研究缺乏。
为了确保储存玉米的质量、防控真菌及其毒素的污染,需要对储存玉米的真菌污染予以实时监控、定期检测,做到早发现早控制。因此,本研究基于分子检测技术、感官分析和预测生长模型应用,提出了预防控制玉米黄曲霉毒素及主要产毒曲霉(黄曲霉和寄生曲霉)污染的方法,以期为我国散储玉米的黄曲霉毒素污染防控、储存环境关键参数监控、污染风险预警提供技术支撑。
1 材料与方法
1.1 材料
培养基:基础培养基 (glucose minimal medium):葡萄糖10 g/L,硝酸钠6 g/L,磷酸二氢钾1.52 g/L,氯化钾0.52 g/L,硫酸镁0.52 g/L,1 000×微量元素溶液1 mL,琼脂15 g/L,pH 6.5;马铃薯蔗糖琼脂培养基(potato dextrose agar):马铃薯200 g/L,蔗糖20 g/L,琼脂15 g/L;玉米粉培养基(corn extract medium):玉米粉30 g/L,煮沸后双层纱布过滤,用甘油调整培养基所需水分活度(0.98、0.94、0.90、0.86、0.82)[12],琼脂15 g/L。
试剂及仪器:PrimeSTAR Max DNA Polymerase、DL5 000 DNA Marker,宝生物工程 (大连)有限公司;真菌基因组DNA提取试剂盒,北京索莱宝科技有限公司;黄曲霉毒素B1酶联免疫定量检测试剂盒,上海佑隆生物科技有限公司;细胞破碎液:pH 8.0 Tris-HCl 10 mmol/L,Triton X-100 2%,NaCl 100 mmol/L,SDS 1%,pH 8.0 EDTA 1 mmol/L。PCR仪,德国Eppendorf公司;凝胶成像系统,美国Aplegen公司;酶标仪,美国Bio-Rad公司。
1.2 方法
1.2.1 玉米霉变调查和症状观察
2015年和2016年对河北省石家庄市无极县玉米储户进行现场调研,参考玉米储存品质判定标准 (国标GB/T20570-2015),对储存玉米的霉变、鼠害、虫蚀情况进行检测;记载玉米籽粒霉变引起的感官性状变化,包括色泽、质地、触感、气味、完整性等。同时调查玉米存储前霉变粒、破损粒及未熟粒的去除情况,玉米储量、粮堆内发热、鼠咬虫蚀、温度和湿度监控、污染玉米处理等。
1.2.2 样品采集
采集霉变玉米、未霉变玉米作为供试材料。2015年10月-2016年6月从石家庄市无极县的32个玉米储户和12个小型饲料厂随机采集常温储存玉米80份、新收获玉米44份。对玉米储户,将储粮袋的玉米混匀取样;对饲料厂储存库,在距粮堆表面20 cm和底部20 cm处分别取样,中间区段根据高度再取1~2个样。每个样品约1 kg,装入无菌采样袋。样品携带回实验室后,每份样品随机取50 g,经70%乙醇浸泡3 min、无菌双蒸水淋洗、滤纸吸干后,分别装入无菌样品瓶,4℃储存,用于分离曲霉;其余样品经干燥保存,用于测定黄曲霉毒素含量。
1.2.3 黄曲霉毒素B1检测
黄曲霉毒素提取:每个玉米籽粒样品取1 kg,籽粒粉碎后混匀。取500 mg粉碎的样品,加入250 μL甲醇水(70∶30,V/V)萃取液,高速振荡3 min,3 600 r/min离心10 min。上清液用于测定黄曲霉毒素含量。
黄曲霉毒素B1测定:96孔酶标板各标准孔加入50 μL不同浓度的黄曲霉毒素B1标准液,各样品孔加50 μL待测样液;向各孔加50 μL酶标工作液,轻摇混匀,25℃恒温箱孵育10 min;甩干微孔板内液体,加250 μL洗液,静置1 min,倒掉洗液,重复3次,吸水纸拍干;加100 μL显色剂,25℃恒温避光孵育10 min;加终止液100 μL摇匀,450 nm波长下测定吸光度值。黄曲霉毒素B1的检测限为1 μg/kg,样品重复测定3次,取平均值。
1.2.4 真菌孢子悬浮液制备
菌株接种MMG+0.2% YE固体平板,37℃培养2 d; 用5~10 mL无菌水收集孢子,控制悬浮液孢子浓度在1×106~5×106个/mL。
1.2.5 PCR检测
真菌基因组DNA提取:将真菌孢子悬液接入含2 mL MMG液体培养基的试管,接种量为1×105个/mL;试管斜放、37℃静置培养16 h;收集菌丝体,加500 μL细胞破碎液,500 μL酚∶氯仿∶异戊醇 (25∶24∶1)和300 μL 0.5 mm氧化锆/硅玻璃珠,4℃高速均质2 min,离心;水相经无水乙醇沉淀、70%乙醇洗涤,再用pH 8.0 TE溶解。
玉米基因组DNA提取:取0.5 g粉碎的玉米样品,加200 μL溶液A和20 μL RNaseA,100 mg玻璃珠,涡旋振荡30 min;加20 μL蛋白酶K,55℃水浴消化30 min,12 000 r/min离心1 min收集上清液;加200 μL溶液B、200 μL无水乙醇、混匀,转至吸附柱静置2 min,离心弃废液;吸附柱以600 μL漂洗液漂洗2次,室温放置几分钟;吸附柱用20 μL 65℃的洗脱液洗脱,收集洗脱液即基因组DNA。
引物设计:根据黄曲霉 (GenBank登录号为DQ296645.1)、寄生曲霉 (GenBank登录号为AY445513.1)的veA基因序列,经NCBI/Primer-BLAST设计通用引物FUA1+FUA2,产物大小1 875 bp,用以检测黄曲霉毒素主要产生曲霉;根据拟轮枝镰孢 (GenBank登录号为DQ274059.1)和尖镰孢(GenBank登录号为KF745043.1)的veA基因序列,设计通用引物FUF1+FUF2,产物大小913 bp,用以检测玉米生长阶段易污染的镰孢菌。两对引物序列分别为:FUA1:5′-TCATTGCTAGCTGGTCATTATT-TGAT-3′,FUA2:5′-ATTCTCCCGTTGGCTCGTTT-3′;FUF1:5′-AGTGTGGAAGAGGGCAAGGA-3′,FUF2:5′-AAGGGCACGAAGGAGGAATG-3′。
PCR扩增:以真菌的全局性调控因子veA基因为检测靶标。PCR扩增体系为20 μL:2×PrimeSTAR Max Premix 10 μL,各引物1 μL,模板DNA 1 μL,双蒸水加至20 μL。PCR 扩增程序:98℃变性10 s,55℃ 15 s,72℃ 5 min,循环30次;4℃保温。PCR产物进行凝胶电泳:PCR产物5 μL,于1.0%琼脂糖凝胶中电泳约1 h (5 V/cm),凝胶经EB染色,用成像系统观察照相。
1.2.6 污染菌生长模型建立
污染菌生长测定:参照Duran等[17]的方法,在不同水分活度的CEM平板中心处,用5 μL (1×106~5×106个/mL)的孢子悬浮液点板,一定温度和水分活度下培养约20 d。不同培养条件用不同的塑料密封箱,内置500 mL甘油水溶液以保持需要的空气湿度。每日测量菌落直径 (过接种点,在互相垂直的方向测量2次,取平均值y),直到生长最快的菌落接近平板边缘。每个条件设4个平板(4次重复),取平均值。
初级生长模型拟合:借助SPSS 19.0统计软件,用Baranyi & Roberts[18]方程拟合生长数据,建立不同条件下污染菌的初级生长模型;并预测其最大菌落生长速度 (μmax, mm/d)。

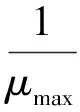
exp(-μmaxλ)-exp(-μmaxt-μmaxλ)]
其中y、y0、ymax分别为菌落直径(mm)、起始直径(mm)、最大直径(mm);μmax最大生长速度(mm/d);λ迟滞期(d);t培养时间(d)。
多项式回归模型构建:通过回归,获得分离菌最大生长速度对玉米水分活度和环境温度的二次多项式回归模型。

生长速度二维等值图:借助Sigma Plot 12.0(Systat Software Inc. Hounslow, London, UK)软件,得出不同玉米水分活度和环境温度下,污染菌的生长速度对数等值图,用于描述玉米水分活度和环境温度对污染菌生长的影响。
2 结果与分析
2.1 储存玉米霉变的感官性状调查
对储存玉米的感官性状进行实地调查。结果表明,真菌污染使玉米籽粒外观、质地、气味发生改变,导致重量变轻、果皮层的致密性和光泽下降 (表1)。玉米霉变的早期症状包括:籽粒表面发生润湿现象、色泽更显鲜亮,粮堆内有潮湿感、发热,有微甜味;然后籽粒硬度与光泽降低、颜色变暗,籽粒搅动声不再清脆。经过大约1周的湿热积累,玉米可能发生霉变,先是胚部变暗、变黑,然后胚部表面、破损粒断面长出白色棉毛状菌丝体,有淡淡霉味;进一步霉变产生肉眼可见的黄绿色、灰绿色、淡粉色的真菌孢子,有霉味、酒味和辛辣味 (图1A)。潮湿天气下,储存玉米易发生虫蚀,甚至形成蛀孔、隧道和玉米碎屑,虫蚀将进一步促进玉米霉变。玉米储户或小饲料厂可通过定期观察储存玉米有无潮润、发热、轻度异味、虫蚀、光泽降低、颜色变暗、毛状物产生等现象,确定玉米有无霉变的趋势或是否已经霉变。
表1储存玉米霉变后的感官性状变化1)
Table1Changesinthesensoryattributesofstoredcorninfectedbyfungi

指标Parameter正常玉米Uninfectedcorn霉变玉米Infectedcorn饱满度Plumpness籽粒饱满饱满度降低、水中漂浮质地Texture籽粒紧密、坚实表面疏松、种皮易脱除色泽Colorandlustre保持固有的色泽、透亮初期颜色鲜亮,然后光泽降低、颜色变暗气味Smell玉米清香味酸味、玉米酒味、霉味或其他异味口感Tastefeeling淡甜味淡苦味、酸味完整性Wholeness籽粒完整,不易发生霉变籽粒不完整,易发生霉变搅动性能Stirringperformance响声清脆,流动性好响声沉闷,有阻力湿热感Wetandhotfeeling未产生湿热感籽粒有潮湿感,粮堆局部发热升温虫害Insectdamage无虫蚀、无虫蛀有蛀孔及碎屑霉变Mildew无初期胚部有白色菌丝,后期产生黄绿、灰绿、淡粉色、黑色孢子,呈粉末状
1) 口感:玉米用开水煮1 h,控去水,咀嚼。 搅动性能:用手搅动玉米发出的声音和感觉。
Taste feeling:Boil the stored corn with water for about one hour and drain the water, then chew to get the mouth feeling. Stirring performance:Sound emitted and feeling when corn is stirred with hands.
2.2 储存玉米黄曲霉毒素污染水平测定
用酶联免疫法检测采集的储存玉米样品的黄曲霉毒素B1污染水平 (表2)。结果表明:部分储存玉米样品的黄曲霉毒素污染严重,最高达到155.6 μg/kg,远远超出国家标准 (20 μg/kg)。一般储户的玉米储量小,检测到黄曲霉毒素的几率低,污染水平也低;小饲料厂的玉米储量较大,储存条件简陋,缺少控制措施,检测到黄曲霉毒素污染的几率高,污染水平也高。因此,要确保玉米源的食品或饲料安全,有条件的饲料厂需定期检测储存玉米的黄曲霉毒素水平,更要采取措施预防控制玉米的黄曲霉毒素污染,确保玉米的黄曲霉毒素污染水平低于20 μg/kg。
表2储存玉米的黄曲霉毒素B1污染水平1)
Table2LevelsofaflatoxinB1inthestoredcornsamplesfromlocalfeedmillsandfarmers

玉米样品Cornsample样品数/个Samplesize阳性率/%Incidencerate黄曲霉毒素B1含量/μg·kg-1AflatoxinB1level未储玉米Unstoredcorn440ND储存玉米Storedcorn饲料厂487539.1±2.6农户322519.4±2.1
1) ND:未检测。
ND:Not detected.
2.3 储存玉米污染菌的PCR检测
分别以黄曲霉、拟轮枝镰孢和新鲜玉米基因组DNA为模板,用引物FUA1/ FUA2+FUF1/FUF2混合物进行PCR,验证设计引物的特异性。电泳图显示(图1B):以黄曲霉基因组DNA为模板的PCR产物约1.9 kb,拟轮枝镰孢基因组DNA为模板的PCR产物约0.9 kb,与设计大小一致;而新鲜玉米基因组DNA为模板没有获得PCR产物。经NCBI/Primer-BLAST对FUA1/FUA2和FUF1/FUF2进行特异性分析,FUA1/FUA2引物与拟轮枝镰孢基因组DNA不能紧密互补,FUF1/FUF2引物与黄曲霉基因组DNA不能紧密互补。证明设计引物具有各自对应基因序列的特异性,可用于目标菌的检测。
从污染严重的玉米样品中分离纯化到表型与黄曲霉一致的菌株。提取分离菌的基因组DNA作为模板进行PCR扩增,PCR产物约1.9 kb,与设计的黄曲霉基因组DNA的PCR产物大小一致;新鲜玉米样品和阴性对照没有扩增到任何条带(图1B)。结果证明污染玉米分离菌株是黄曲霉毒素产生菌,即黄曲霉或寄生曲霉,veA基因可以作为目标基因,用于鉴别玉米是否被黄曲霉或寄生曲霉污染。

图1 污染玉米分离菌的检测Fig.1 Identification of the isolate from the infected corn kernels
2.4 储存玉米污染菌的生长预测模型建立
分离的黄曲霉毒素产生菌(黄曲霉或寄生曲霉)用不同水分活度(0.82、0.86、0.90、0.94、0.98)的CEM培养基,在不同温度(15、20、25、30、35℃)下培养,测定菌落直径,经Baranyi函数拟合获得初级生长模型(图2a),并估测最大直径生长速率μmax。为了反映玉米水分活度及环境温度对污染菌生长速率的影响,对最大菌落生长速率进行多项式拟合,并借助Sigma Plot 12.0绘制污染菌最大生长速度的对数等值线图(图2b)。获得的回归方程如下:

图2表明水分活度(aw)和环境温度(T)协同影响污染菌生长。污染菌生长显著依赖CEM的aw,0.82aw时菌落生长较慢,aw越高菌落生长速度越大;随着T升高,菌落生长加快,30℃时生长最快,然后迅速减慢,最适生长温度是27~32℃;试验条件下,污染菌的最佳生长条件是0.98aw+ 30℃,生长速度为7.2 mm/d。玉米水分活度和环境温度对污染菌的生长影响具有协同性,aw和T交汇点在-0.7等值线下侧,污染菌不生长,在-0.7线上侧污染菌能生长;要确保储存玉米安全,玉米储存参数选择应远离适合污染菌生长的区域。
3 讨论
玉米收获前后易受到各种产毒真菌侵染,生长阶段易感镰孢菌,储存阶段易染曲霉[19]。调查发现,多数玉米种植户能进行较规范的种植管理、晾晒干燥和霉变穗拣出。而玉米储户和小饲料厂对玉米储存重视不够,储藏方式传统、设施简陋,储前多未进行筛分处理,未去除不成熟粒和破损粒,储存中未实施监控管理,使储存玉米更易发生真菌污染。而且,农村储粮存在严重的鼠害损失,预防难度较大。
要减少坏粮风险,确保玉米源食品和饲料安全,需要在玉米储存阶段采取有效措施,预防控制真菌污染[20-21]。玉米储存应选用具有防鼠、防霉、通风降水等功能的新型储粮装具,或设施完备的粮仓;有裂纹或破损的玉米籽粒更易受黄曲霉、寄生曲霉等真菌感染,玉米储存前要进行筛分处理去除破损粒;实施储存管理规范,对储粮仓的卫生进行有效控制,减少交叉污染;定期监控粮温、湿度、虫蚀、霉变、异味。鉴于玉米储户的储存设施和条件差,实施规范管理具有一定的挑战性,不建议储户长期储存玉米。小饲料厂可以用色选机、玉米比重精选机等去除待储玉米的不完善粒;完善基础设施、改善仓储条件,确保储粮仓能通风换气、隔热防潮,保证储存玉米的安全。
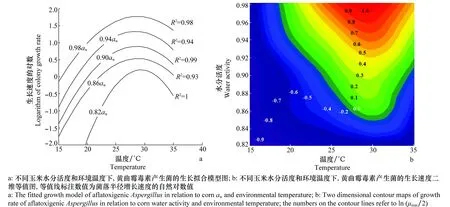
图2 玉米水分活度和环境温度对分离的黄曲霉毒素产生菌生长的综合影响Fig.2 Combined effects of corn water activity and environmental temperature on the growth of isolated aflatoxigenic fungus
调控因子VeA的N末端序列比对显示:主要黄曲霉毒素产生菌(黄曲霉和寄生曲霉)的序列相似性高达99%,拟轮枝镰孢和尖镰孢的序列相似性高达98%,而两类菌的序列相似性仅为54%[9]。根据veA基因的特有保守序列,设计黄曲霉和寄生曲霉PCR检测的特异引物FUA1/FUA2、尖镰孢和拟轮枝镰孢PCR检测的特异引物FUF1/FUF2,对污染玉米分离菌进行PCR检测。结果显示玉米污染菌的PCR产物与黄曲霉的PCR产物大小一致,而且污染玉米样品中检测到了黄曲霉毒素B1,证明从污染玉米样品分离到的污染菌是黄曲霉毒素产生菌(黄曲霉和寄生曲霉)。
产毒真菌污染玉米不一定产生毒素,其最佳生长条件与最适产毒条件不完全一致[22]。但是真菌孢子及菌核的毒素含量都高,说明真菌形态发生与毒素产生呈一定正相关性[23],利于形态发生的环境则应利于其产毒,所以玉米污染菌的生长趋势可用以表征其致毒潜力,控制真菌生长可以有效减少真菌毒素积累。研究证明玉米发生真菌污染不仅取决于玉米籽粒的种类、含水量、破损度等,还与储存条件(如环境温度和湿度)和储存时间相关[2]。鉴于玉米水分活度和环境温度是影响真菌在玉米上定殖发育的关键参数[24],本研究针对黄曲霉毒素产生菌,建立了两参数相关的污染菌生长预测模型,用以评估储存玉米在不同玉米水分活度和环境温度下发生真菌污染的趋势。
污染菌生长预测模型显示:如果玉米储存条件位于-0.7等值线右上侧,则污染菌的孢子能萌发、菌丝可生长;随着储存时间延长,玉米可能发生腐烂变质。河北地区秋玉米收获时,环境温度约20℃,玉米aw>0.84(含水量18%),处于污染菌生长侧。因此,新收获的玉米要及时晾晒至aw<0.84,否则污染菌就可能萌发生长,使玉米霉变。如果玉米储存条件位于-0.7等值线左下侧,污染菌则处于生长的极端胁迫区,其孢子不能萌发、菌丝停止生长。
借助等值图控制储存玉米的aw及环境温度,使黄曲霉毒素主要产生菌生长被抑制,从而实现玉米的安全储存。玉米储库在实施HACCP体系时,用玉米aw或含水量及环境温度作为关键控制参数,借助预测模型建立其控制限值;通过实时监控,预测玉米发生污染的趋势,确定玉米安全储存的时间。玉米散储户都是常温储存,没有温控设施,要确保储存玉米的安全,需根据储存期间的温度变化情况,将玉米干燥至真菌的生长临界aw以下。环境温度较低,玉米aw可稍高些;环境温度较高,玉米aw要低一些。如冬储玉米,环境温度<15℃,则安全aw可高达0.94(含水量≈24%);夏储玉米,环境温度>20℃,则安全aw要降至0.84(含水量≈18%)以下,具体大小根据环境温度决定。借助预测模型防控玉米的真菌污染,要考虑玉米在储前(生长、晾晒、干燥)阶段是否已染菌。玉米污染菌一旦生长代谢,产生湿热并向周围释放,粮堆内产生局部热点,进一步促进污染发生。所以与未污染玉米相比,带菌玉米更易霉变,其含水量和环境温度应控制得更低,并且只能短期储存。
玉米发生霉变引起感官性状变化,通过视觉观察、触觉掂摸、嗅觉闻和味觉尝等分析,观察储存玉米有无表面潮润、发热、光泽降低、颜色变暗、质地疏松、失重、异味、虫蚀、毛状物或孢子产生等现象,作为诊断玉米发生真菌污染的早期症状,初步判断玉米发生霉变的趋势,以利于玉米储户在储存环境多变的情况下,初步评估玉米发生真菌污染的趋势,并及时处理或用作它用,减少经济损失。快速有效地识别可能污染真菌、检测真菌毒素污染水平,需要设备投资大、检测费用高,小型玉米储存企业和农户难以实施。要确保盈利,需根据环境条件变化,定期观察玉米感官性状变化,调整玉米储存时间,减少储粮损失是目前可行的方法。
将来应开发真菌毒素快速检测仪,实现即时检测。虽然黄曲霉毒素主要由黄曲霉A.flavus和寄生曲霉A.parasiticus产生,近年又发现特异曲霉A.nomius、溜曲霉A.tamari等也产生黄曲霉毒素,而且随着分子生物技术不断应用,可能发现更多的黄曲霉毒素产生菌,今后应进一步寻找区分这些菌的实用方法。已知干热胁迫利于高耐旱真菌(如黄曲霉)成为玉米污染优势菌,提高玉米的真菌污染敏感性[13],将来需要进一步了解气候变暖对玉米真菌互作的影响,提高玉米的抗真菌能力,为玉米生产体系的可持续发展提供保障。
[1] Amaike S, Keller N P.Aspergillusflavus[J]. Annual Review of Phytopathology, 2011, 49: 107-133.
[2] Fleurat-Lessard F. Integrated management of the risks of stored grain spoilage by seedborne fungi and contamination by storage mould mycotoxins-An update [J]. Journal of Stored Products Research, 2017, 71: 22-40.
[3] Degola F, Berni E, Dall’Asta C, et al. A multiplex RT-PCR approach to detect aflatoxigenic strains ofAspergillusflavus[J]. Journal of Applied Microbiology, 2007, 103(2): 409-417.
[4] Cruz P, Buttner M P. Development and evaluation of a real-time quantitative PCR assay forAspergillusflavus[J]. Mycologia, 2008, 100(5): 683-690.
[5] Passone M, Rosso L, Ciancio A, et al. Detection and quantification ofAspergillussection Flavi spp. in stored peanuts by real-time PCR ofnor-1 gene, and effects of storage conditions on aflatoxin production [J]. International Journal of Food Microbiology, 2010, 138(3): 276-281.
[6] Lezar S, Barros E. Oligonucleotide microarray for the identification of potential mycotoxigenic fungi [J]. BMC Microbiology, 2010, 10: 87.
[7] Levin R E. PCR detection of aflatoxin producing fungi and its limitations[J]. International Journal of Food Microbiology, 2012, 156(1):1-6.
[8] Priyanka S R, Venkataramana M, Balakrishna K, et al. Development and evaluation of a multiplex PCR assay for simultaneous detection of major mycotoxigenic fungi from cereals [J]. Journal of Food Science and Technology, 2015, 52(1): 486-492.
[9] 刘增然, 张光一, Yu Jae-Hyuk. VeA调控曲霉发育致病的研究进展[J]. 微生物学通报, 2016, 43(3): 655-662.
[10] Chauhan Y S, Wright G C, Rachaputi N C, Modeling climatic risk of aflatoxin contamination in maize [J]. Australian Journal of Experimental Agriculture, 2008, 48(3): 358-366.
[11] Samapundo S, Devlieghere F, Geeraerd A H, et al. Modelling of the individual and combined effects of water activity and temperature on the radial growth ofAspergillusflavusandA.parasiticuson corn [J].Food Microbiology, 2007, 24(5): 517-529.
[12] Astoreca A, Vaamonde G, Dalcero A, et al. Modeling the effect of temperature and water activity ofAspergillusflavusisolates from corn [J]. International Journal of Food Microbiology, 2012, 156(1): 60-67.
[13] Battilani P, Camardo L M, Rossi V, et al. AFLA-maize, a mechanistic model forAspergillusflavusinfection and aflatoxin B1 contamination in maize [J].Computers and Electronics in Agriculture, 2013, 94: 38-46.
[14] 李瑞芳,韩北忠,陈晶瑜,等.黄曲霉生长预测模型的建立及其在玉米储藏中的应用[J].中国粮油学报,2008,23(3):144-147.
[15] 赵立,赵希荣,陈军, 等. 不同含水量玉米粉中黄曲霉的生长预测模型的构建[J]. 食品科技, 2010, 35(11): 44-50.
[16] 岳晓禹,李自刚,郝修振,等.主要生态因子对贮藏玉米中黄曲霉生长影响的模拟[J].农业工程学报,2013,9(18):269-276.
[17] Duran R M, Cary J W, Calvo A M. The role of VeA inAspergillusflavusinfection of peanut, corn and cotton[J]. The Open Mycology Journal, 2009, 3(1): 27-36.
[18] Baranyi J, Roberts T A. A dynamic approach to predicting bacterial growth in food [J]. International Journal of Food Microbiology, 1994, 23(3/4): 277-294.
[19] Dawlal P, Barros E, Marais G J. Evaluation of maize cultivars for their susceptibility towards mycotoxigenic fungi under storage conditions [J].Journal of Stored Products Research, 2012, 48: 114-119.
[20] Suanthiea Y, Cousinb M A, Woloshuk C P. Multiplex real-time PCR for detection and quantification of mycotoxigenicAspergillus,PenicilliumandFusarium[J]. Journal of Stored Products Research, 2009, 45(2): 139-145.
[21] Tannous J, Atoui A, El Khoury A, et al. Development of a real-time PCR assay forPenicilliumexpansumquantification and patulin estimation in apples [J].Food Microbiology, 2015, 50: 28-37.
[22] Bernáldez V, Córdoba J J, Magan N, et al. The influence of ecophysiological factors on growth, aflR gene expression and aflatoxin B1 production by a type strain ofAspergillusflavus[J].LWT-Food Science and Technology,2017,83:283-291.
[23] Calvo A M, Cary J W. Association of fungal secondary metabolism and sclerotial biology [J]. Frontiers in Microbiology, 2016, 6: 62.
[24] Medina A, Magan N. Comparisons of water activity and temperature impacts on growth ofFusariumlangsethiaestrains from northern Europe on oat-based media[J]. International Journal of Food Microbiology, 2010, 142(3): 365-369.
(责任编辑: 田 喆)
DetectionandpreventionofthemainaflatoxigenicAspergilluscontaminationinstoredcorn
Liu Zengran, Zhang Guangyi, Wang Nannan, Xu Man
(CollegeofBioscienceandBioengineering,HebeiUniversityofEconomicsandBusiness,Shijiazhuang050061,China)
Practical methods were developed based on observation of the early signs and symptoms of corn mildew, PCR detection of theAspergillusstrain isolated from the contaminated corn, and establishment of the predictive models for the growth of the isolate under different corn water activities and environmental temperatures. The results indicated that the occurrence of sensory symptoms, such as changes in color and luster, moist feeling over the surface of the corn kernels, and local hot spots in the corn piles, were characterized as the trend of fungal contamination under variable storage conditions. Additionally, PCR assay was carried out using the fungal global regulatorveAas the detective target and a PCR product of the expected size (1.9 kb) was generated, indicating that the isolate isA.flavusorA.parasiticusstrain. Moreover, the predictive models for the growth of the isolate were constructed via fitting the primary Baranyi model to the growth data of the isolate collected under different corn water activities and environmental temperatures, for estimating the maximum colony growth rates of the isolate. The obtained maximum growth rates were then modeled as a function of corn water activity and environmental temperature by using second-order polynomial equation. The developed models indicated that corn water activity and environmental temperature have interactive effects on the growth of the isolate and for corn safety storage, the set critical limits should be away from the growth region. Totally, this research could support the decision-making for corn safety storage, the set and monitoring of the critical limits for corn water activity and environmental temperature, and thus favor to the control of aflatoxin and aflatoxigenicA.flavusorA.parasiticuscontamination in stored corn.
corn; aflatoxin; PCR detection; growth model; sensory change
2017-06-24
2017-07-14
河北省科技计划项目(15225503D);河北经贸大学科研基金项目(2014KYZ05)
* 通信作者 E-mail:liuzengran@163.com
S 435.13
A
10.3969/j.issn.0529-1542.2017.06.007
