DYMEX模型在棉铃虫种群动态中的应用
2017-11-29顾世民MyronZalucki刘永建吕昭智
顾世民, Myron P.Zalucki, 张 豹, 刘永建, 吕昭智
(1. 中国科学院新疆生态与地理研究所, 乌鲁木齐 830011; 2. 中国科学院大学, 北京 100049; 3. 澳大利亚昆士兰大学生物科学学院, 布里斯班 4072; 4. 新疆石河子147团农业科植保站,石河子 832045; 5. 新疆石河子121团农机推广站, 石河子 832066)
DYMEX模型在棉铃虫种群动态中的应用
顾世民1,2, Myron P.Zalucki3, 张 豹4, 刘永建5, 吕昭智1*
(1. 中国科学院新疆生态与地理研究所, 乌鲁木齐 830011; 2. 中国科学院大学, 北京 100049; 3. 澳大利亚昆士兰大学生物科学学院, 布里斯班 4072; 4. 新疆石河子147团农业科植保站,石河子 832045; 5. 新疆石河子121团农机推广站, 石河子 832066)
模型模拟是昆虫种群动态研究的重要内容,DYMEX模型是一种基于同生群概念的机理性模型,能够较真实、全面地模拟多因素影响下的种群动态,便于推广应用。棉铃虫Helicoverpaarmigera自然种群动态受到诸多生态因子的影响,如气候、天敌和田间管理等,过程复杂。本文利用DYMEX 3.0软件建立了棉铃虫种群动态模型,对实验室棉铃虫种群关键生命表参数随温度变化和控制条件下杀虫剂对棉铃虫和天敌的毒杀作用分别进行了模拟;对新疆石河子121团和147团2009-2014年棉铃虫自然种群动态进行了模拟,并比较和分析了模拟结果。结果表明:(1)建立的棉铃虫DYMEX模型,在模拟实验室棉铃虫种群各阶段发育历期、存活率、成虫繁殖和寿命,以及杀虫剂对棉铃虫卵、1~3龄幼虫和天敌的毒杀影响方面,拟合优度R2普遍高于0.6(P<0.05);(2)模拟田间条件下棉铃虫种群的相对发生量和发生期与实际自然种群具有较好的一致性。因此,建立的DYMEX模型,较可靠地模拟、反映了室内控制条件和复杂生境下棉铃虫种群特征和动态,为棉铃虫室内多因素试验结果分析、因素效能分析和复杂条件下发生期和相对发生量的预测预报等方面提供有效帮助,为田间害虫的综合管理、防治提供参考。
棉铃虫; 种群动态; DYMEX模型; 预测预报; 害虫综合管理
棉铃虫Helicoverpaarmigera(Hübner)自然种群受到诸多因素影响,如气候条件[1]、寄主类型、天敌[2]、耕作模式[3]和杀虫剂喷洒等[4],这些因素均对棉铃虫各代种群数量和发生期产生了不同程度的影响。并且,诸因素之间复杂的内在联系和交互过程,严重影响了对不同时期或地区棉铃虫种群动态差异、田间影响因素效能和害虫管理等方面的研究,目前就田间复杂背景下棉铃虫种群动态的模拟也缺少较为综合性的机理模型[5]。
DYMEX 3.0软件正是一种确定性过程的建模外壳[6],是构建昆虫种群动态模型的工具,由澳大利亚联邦科学与工业研究组织(CSIRO)开发并发行推广。该模型基于种群同生群概念,涉及机理类或过程类的问题,集成模型模拟功能(DYMEX Simulator)[7-8],属于模块化的建模过程(DYMEX Builder),是用户友好型的分析系统,为用户提供了图表界面及程序化的建模流程,通过组合和连接各模块(扩展库的选择或用户自定义)创建模型,操作简单,应用性强[9-11]。该模型在昆虫种群动态的机理性模拟方面具有优势[12]。苏战平等[6]利用DYMEX 1.0软件,建立了棉铃虫滞育模型和发育进度模型,预测了第5代棉铃虫种群动态情况并分析了第4代棉铃虫卵的发生期、发生量以及气温对第5代棉铃虫发生的影响。Yonow等[13]建立了昆士兰果蝇Bactrocera(Dacus)tryoniDYMEX模型,模拟澳大利亚东部中纬度区域的昆士兰果蝇长时间序列的种群动态,模拟结果与实际诱集数据有较好的拟合程度。Muthuthantri等[14]利用DYMEX 3.0软件建立热带地区害虫的种群动态模型中发现,引入除气候因素外的关键因素对提高模型的拟合精度至关重要。Li等[15]建立了小菜蛾Plutellaxylostella(L.)DYMEX模型模拟了中国东部诸多地区小菜蛾种群动态,并比较了不同地区气候、作物种植模式、田间管理措施和天敌对种群动态变异的解释程度。还有将DYMEX模型应用于物种物候期和相对发生量的研究中,如豆瓣菜康瘿蚊Contarinianasturtii(Kieffer)(双翅目:瘿蚊科)[16]和微点毛龟甲ParopsisatomariaOlivier[17]等。但目前该软件在基于棉铃虫实验室种群生命表,多因素影响下的自然种群动态模拟应用方面未有报道。
因此,本文利用DYMEX 3.0 软件,基于棉铃虫实验室种群生命表,同时考虑杀虫剂喷洒对棉铃虫和天敌的毒杀作用,以及天敌对棉铃虫的控制作用和温度、光周期、翻耕等对棉铃虫种群动态的影响,构建了棉铃虫DYMEX模型,模拟了新疆石河子121团与147团复杂田间条件下的棉铃虫种群动态,为分析不同因素对棉铃虫种群动态的影响提供有力手段,为田间棉铃虫种群动态研究和管理提供理论依据。
1 研究方法
1.1 棉铃虫DYMEX模型建立
1.1.1 模型创建
模型时间步长。在DYMEX软件中时间模块是默认模块,用户可自定义控制模型运行的时间步长,如步长为1 d、1周或1月,相应的气象数据日期步长和模型各部分参数参考的时间步长与模型中自定义的步长一致。
棉铃虫生命周期。在本研究中,以取食棉花的实验室棉铃虫种群生命表作为生命周期各阶段参数设置的依据,将棉铃虫的生命周期分为5个阶段,分别为:卵、1~3龄幼虫、4~5龄幼虫、蛹和成虫,并考虑蛹的滞育。在各阶段中,考虑温度对生命表参数的影响,由于模型运行的时间步长设置为1 d,使用sine函数描述一天中温度的变化情况,建立每日温度与每日死亡率、发育速率、潜在繁殖力和实际产卵量等生命表参数的函数关系(表1)。
杀虫剂喷洒。在DYMEX模型中可利用事件模块对杀虫剂影响棉铃虫卵和幼虫的过程加以描述。根据实际调查,分别记录121团和147团每年杀虫剂喷洒的日期和用药类型(化学杀虫剂和生物杀虫剂)。在模型中,同一日期下,两地对杀虫剂的喷洒分别有3种情况:A(以喷洒化学杀虫剂为主)、B(以喷洒生物杀虫剂为主)或C(不施用杀虫剂)。对杀虫剂毒杀后的作用以杀虫剂施用后的毒杀衰减函数和对棉铃虫卵、幼虫毒杀率两个方面进行设置[15]。
天敌单位。根据研究区棉铃虫天敌的调查资料,考虑寄生性天敌(天敌单位)对棉铃虫卵和捕食性天敌(天敌单位)对1~3龄幼虫的控制作用。模型中,利用函数模块自定义天敌单位与害虫数量的线性函数关系,并设定寄生性天敌的拟寄生率最高为45%(试验中赤眼蜂属Trichogramma拟寄生率平均为38%~49%[20-23],研究区以赤眼蜂属为主,拟寄生率平均为32.5%~45%);1~3龄幼虫最高捕食率为60%(研究区捕食性天敌对1~3龄幼虫的平均捕食率约为50%~67.5%,平均水平为60.3%)。
1.1.2 模型参数确定
因混沌伪随机序列的相关性对通信系统非常重要,要分析的因素较多,所以下面要对混沌序列的相关性展开具体的分析。
利用已发表的实验室数据对该模型中棉铃虫生命表参数进行估计,得到模型中各项参数的预估计值。根据研究区杀虫剂施用类型,参考已发表文献中,对相应杀虫剂对棉铃虫卵、幼虫和天敌的毒杀试验结果估计模型中虫口减退率的比例,并设置事件模块中杀虫剂对棉铃虫卵和1~3龄幼虫死亡率的影响。
表1棉铃虫种群动态DYEMX模型相关驱动变量和参数
Table1ParametersanddrivingvariablesofpopulationdynamicsofHelicoverpaarmigeraDYMEXmodel

相关过程Relatedprocess参数Parameter诱导因素/驱动变量Inducingfactor/drivingvariable关系式Equation卵[24⁃28]Egg卵死亡率(ME)=ME1+ME2+ME3+ME4温度/每小时气温杀虫剂喷洒/杀虫剂毒杀效应ME1=-0.0047∗T+0.1175,T≤25℃ME2=0.0349∗T-0.8725,T>25℃ME3=0.5∗A,A为化学杀虫剂毒杀效应ME4=0.3∗B,B为生物杀虫剂毒杀效应发育率(Degg)=D1+D2温度/每小时气温D1=0.0214∗T-0.201802,9.43℃≤T≤25℃D2=0.07∗T-1.416802,25℃ 1.1.3 模型结构 根据所选择的模块和建立的模块间关系,棉铃虫DYMEX模型的基本框架如图1所示。棉铃虫生命周期模块包括卵、1~3龄幼虫、4~5龄幼虫、蛹、成虫和成虫产生后代的完整过程。温度对棉铃虫各阶段的存活、发育、虫态转变和成虫繁殖均产生影响;杀虫剂对卵和1~3龄幼虫的影响考虑杀虫剂喷洒的直接影响和其与天敌单位的交互影响。本研究根据已有资料,仅考虑寄生性天敌对卵和捕食性天敌对1~3龄幼虫的控制作用。 图1 棉铃虫DYMEX模型生命周期、天敌及杀虫剂喷洒间关系结构图Fig.1 Life-cycle structure and relationships among life-cycle of Helicoverpa armigera, temperature, photoperiod, natural enemy units and pesticide events in the DYMEX model 1.2 实验室种群模拟的参数初始化 根据实验室温度控制数据,模拟卵、幼虫、蛹的存活率和发育历期,以及成虫的寿命和单雌产卵量随温度的变化情况。变温温度梯度为(L∥D=12 h∥12 h):7℃∥25℃,9℃∥28℃,11℃∥30℃,15℃∥34℃,18℃∥36℃,21℃∥38℃,24℃∥41℃,27℃∥44℃;恒温条件下,设定温度梯度为:12.5、15、17.5、20、25、27.5、30、32.5、35、37.5℃和40℃[27-28]。初始卵量为100粒(模型设定值为100),在分析雌性成虫繁殖力和逐日单雌产卵量方面设定初始雌性成虫的个数为1。根据试验温度环境,在模型中,设定读取的温度为恒温(25±0.5)℃,每次杀虫剂喷洒1次后,记录卵、1~3龄幼虫和天敌单位的数量随时间的变化情况,计算出第1、3、5、7和10 d时的虫口减退率,并与控制试验结果进行比较[31-36]。 1.3 自然种群模拟的参数初始化 1.3.1 研究区概况 研究区位于中国西北地区新疆天山北部典型农业垦区,石河子市121团(85.59°E, 44.83°N)和147团(86.17°E, 44.62°N),地形地貌类似,两地棉花种植区相距约44 km,121团年平均气温和年累积降水量为7.41℃和114 mm,147团分别为8.36℃和159 mm。两地均以棉花种植为主,棉花种植面积比例分别为121团85%以上、147团88%以上,同时辅助作物为小麦、玉米、番茄和蔬菜等,种植方式主要为间作、套种。 1.3.2 种群动态和数据收集 棉铃虫在121团与147团发生代数为3代,即越冬代、一代和二代,9月中下旬棉铃虫三代幼虫(由二代成虫产卵发育)开始滞育,10月底以蛹的形式越冬,次年5月初羽化出现越冬代成虫。因此,根据收集的121团与147团2009-2014年棉铃虫种群资料,明确诱集的起始时间为当年越冬代成虫始见至当年二代成虫末期。田间越冬基数、不同作物种植面积、棉铃虫各代发生程度和发生期以及防治方法、时间等信息,均由121团与147团植保站提供。 1.3.3 参数初始化 根据建立的DYMEX模型,对每年棉铃虫模拟的起始时间、气象数据、棉铃虫初始越冬基数、田间杀虫剂喷洒类型和时间、天敌单位控制棉铃虫卵和幼虫的起始时间等模型参数的设定如表2所示。 1.4 数据分析 模型模拟结果与实际观测结果之间进行拟合优度的检验,利用判定系数R2描述拟合程度,显著性水平为0.05[13]。时空变异分析中,Pearson相关分析确定影响因素与各代棉铃虫数量之间的相关性,利用Pearson相关系数(r)确定相关性程度,显著性水平为0.05[37-38]。Origin 8.0软件进行绘图和拟合优度的检验,SAS 9.21软件进行相关分析。 表2棉铃虫DYMEX模型模拟的变量值初始化设定1) Table2InitializationvaluesofHelicoverpaarmigeraDYMEXmodelinsimulation 模型变量 Variable初始值 Parametervalue时间Time模型模拟起始时间为每年4月1日-10月31日,模拟时间步长为1d气候数据Meteorologicaldata121团和147团各地每年日观测气温数据(最高温和最低温)棉铃虫Life⁃cycle输入Life⁃cycleofHelicoverpaarmigera2009-2014年越冬基数(头/m2):121团:0.021、0.12、0.15、0.15、0.025和0.012147团:0.025、0.15、0.013、0.023、0.015和0.016模型初始虫量为越冬基数换算为约15hm2的蛹量,初始年龄均为0杀虫剂喷洒Pesticidespraying121团:2009-2014年喷洒时间固定,均为5月25日-28日∥6月20日-27日∥7月25日-8月1日。喷洒方式各年分别为:2009(B∥B∥B);2010(B∥B∥B);2011(B∥A∥B∥);2012(B∥A∥B);2013(B∥B∥B);2014(C∥B和A∥B)147团:2009-2014年喷洒时间固定,均为5月25日-28日∥6月25日-7月1日∥7月25日-8月1日。喷洒方式各年各次分别为:2009(C∥A∥A);2010(B和A∥B和A∥A);2011(A∥A∥A∥);2012(A∥A∥A);2013(C∥A∥A∥);2014(C∥A∥A) 1) 表中喷洒方式是指在模型设置中,各地每年每次杀虫剂喷洒有三种选择:A(以喷洒化学杀虫剂为主)、B(以喷洒生物杀虫剂为主)或C(不施用杀虫剂)。如121团2009年的喷洒方式为(B∥B∥B)表示该年三次杀虫剂喷洒均以生物杀虫剂为主。 Spraying measures in the table mean that each time of pesticide spraying has three choices every year in the simulation: A (chemical pesticide), B (biological pesticide) or C (without spraying). For example, the pesticide spraying choice of 121 broadacre farming in 2009 was (B∥B∥B), indicating that the biological pesticide were used in three times. 2.1 实验室种群模拟 2.1.1 不同温度种群生命表参数模拟 由图2可知,对变温条件下棉铃虫卵、1~3龄幼虫、4~5龄幼虫和蛹的发育历期的模拟与试验结果拟合程度较高,R2值分别为0.77、0.81、0.63和0.58,P值均小于0.05;恒温条件下,自卵至蛹的模拟结果与试验结果的拟合程度R2值分别为0.95、0.95、0.97和0.84,P值均小于0.01。在变温为7℃∥25℃和9℃∥28℃的条件下卵和4~5龄幼虫的拟合程度较差。平均温度超过27.5℃时,无论是变温或恒温条件下,蛹的发育历期拟合程度均较差,但在致死高温区(平均温度高于35℃)的模拟较为接近实际情况。 图2 不同温度条件下模拟与实测的棉铃虫卵、幼虫和蛹的发育历期Fig.2 Observed and simulated mean developmental time of egg, larva and pupa of Helicoverpa armigera 通过对棉铃虫卵、1~3龄幼虫、4~5龄幼虫和蛹的存活率的模拟结果与试验结果比较发现(图3),变温条件下的拟合程度R2值分别为0.38、0.73、0.98和0.92,P值均小于0.05;恒温条件下卵的拟合程度R2和P值分别为0.34和0.062,1~3龄幼虫、4~5龄幼虫和蛹的拟合程度R2分别为0.79、0.43和0.93,P值均小于0.05。在对棉铃虫卵和1~3龄幼虫模拟中发现,当平均温度高于25℃时,无论变温或恒温模拟结果均较试验结果高;当平均温度低于20℃时,恒温或变温条件下,模拟结果棉铃虫蛹的存活率也较试验结果高。 图3 不同温度条件下模拟与实测的棉铃虫卵、幼虫和蛹的存活率Fig.3 Observed and simulated survivorship of egg, larva and pupa of Helicoverpa armigera 由图4,不同温度条件下模拟的成虫各生理年龄的单雌产卵量与实际情况较吻合,即能够代表实际单雌产卵量随时间和温度的变化情况。棉铃虫成虫寿命的模拟结果与试验结果比较,在变温条件下拟合优度R2值为0.46,恒温条件下拟合优度R2值为0.48,P值均小于0.05。成虫的寿命在恒、变温的不同温度梯度中,平均温度在15~20℃的模拟结果与试验结果差异较大,平均温度为35℃的恒温条件下,模拟的成虫寿命较试验结果差异较大。 图4 不同温度条件下模拟与实测的成虫平均单雌每日产卵量和寿命Fig.4 Observed and simulated moth longevity and progeny production per female at different temperature 2.1.2 杀虫剂毒杀作用模拟 模拟的杀虫剂毒杀效果与实际发生情况比较发现(表3),化学杀虫剂对棉铃虫卵、1~3龄幼虫和天敌的虫口数量综合影响的拟合程度R2值为0.79,P<0.01;生物杀虫剂对棉铃虫卵和1~3龄幼虫的虫口数量综合影响的拟合程度R2值为0.97,P<0.01。 表3两类杀虫剂对棉铃虫卵、低龄幼虫和天敌种群虫口数量的影响1) Table3Effectsoftwotypesofpesticidesontheabundanceofeggs,1st-3rdinstarlarvaeandnaturalenemies,respectively 用药类型及作用对象Pesticidetypeandtarget虫口减退率/% Rateofabundancedecreasing1d3d5d7d10d化学杀虫剂⁃卵Chemicalpesticide⁃Egg85.2(71.04)91(94.29)---化学杀虫剂⁃1~3龄幼虫Chemicalpesticide⁃1st⁃3rdinstarlarva37.8(33.91)65.93(56.91)56.5(61.76)62.63(66.14)46.7(37.27)化学杀虫剂⁃天敌单位Chemicalpesticide⁃Naturalenemyunit42.8(53.33)68.87(66.67)---生物杀虫剂⁃卵Biologicalpesticide⁃Egg0(0)13.05(16.69)26.8(31.89)--生物杀虫剂⁃1~3龄幼虫Biologicalpesticide⁃1st⁃3rdinstarlarva26.1(27.59)52.3(48.43)-(62.96)60(68.96)66.7(73.85) 1) 表中1 d,3 d,5 d,7 d,10 d表示施药后间隔时间,括号内数据为模拟值。 In the table, 1 d,3 d,5 d,7 d,10 d represent the durations since pesticide spraying events happened, and the values in the bracket are the simulations. 2.2 田间棉铃虫种群动态模拟及其时空变异分析 对121团和147团2009-2014年田间棉铃虫种群动态模拟结果与实际发生情况比较发现,121团2009、2010、2012年第一代和2013年越冬代高峰期较实际情况有延迟现象,其余各年各代拟合均较好;147团各年各代与实际发生情况均较吻合,模拟精度较高(种群数量R2=0.56,P<0.01)。棉铃虫成虫种群发生代数和各代高峰期的总体拟合程度较高。121团2010-2014年越冬代和第二代相对发生量的模拟变化趋势与实际情况较接近;2009年各代和历年第一代的成虫相对发生量变化情况,模拟结果与实际情况差异较大(种群数量R2=0.37,P<0.05)(图6)。147团历年各代棉铃虫成虫相对发生量的变化趋势,除2012年的越冬代外,模拟结果与实际情况基本一致(图7)。总体上,各代成虫的相对发生量随年份的变化趋势,147团模拟结果较121团更接近实际情况(图8)。 图5 121团2009-2014年棉铃虫各代种群数量模拟结果与田间观测结果比较Fig.5 Comparison between simulations and field observations of population abundance of Helicoverpa armigera from 2009 to 2014 in 121 broadacre farming 图6 121团2009-2014年棉铃虫各代种群动态模拟结果与田间数据对比Fig.6 Comparison between simulations and field observations of population dynamics of Helicoverpa armigera from 2009 to 2014 in 121 broadacre farming 图7 147团2009-2014年棉铃虫各代种群数量模拟结果与田间观测结果比较Fig.7 Comparison between simulations and field observations of population abundance of Helicoverpa armigera from 2009 to 2014 in 147 broadacre farming 图8 147团2009-2014年棉铃虫各代种群动态模拟结果与田间数据对比Fig.8 Comparison between simulations and field observations of population dynamics of Helicoverpa armigera from 2009 to 2014 in 147 broadacre farming 参考两地的模拟结果和模型初始化设置,分析各代棉铃虫种群数量与所考虑因素变量之间的相关性(表4)。结果表明,越冬代成虫数量取决于春季调查的越冬基数,受气温影响较小。杀虫剂喷洒对各代棉铃虫成虫种群发生量影响较大。捕食性天敌(天敌单位)较寄生性天敌(天敌单位)的控害作用明显,随棉铃虫代数增加,两类天敌(天敌单位)对棉铃虫的控制作用呈下降趋势。就各因素与棉铃虫各代数量的相关系数来看,棉铃虫种群前一代对后一代的影响均强于任何单一因素对种群数量的影响。 本文对室内不同温度下棉铃虫发育历期和存活率的模拟发现,在低于适温区下界后,拟合程度较差,这可能是由于模型中设置的函数未能较好地反映棉铃虫响应温度变化的过程。在适温区棉铃虫的存活率和发育速率与温度之间呈线性正相关。实际情况中,棉铃虫生命周期各阶段自发育起点温度至适温区下界,温度与死亡率和发育速率的关系是非线性的[27,39]。棉铃虫成虫寿命在平均温度低于20℃和高于35℃时,模拟结果与实际情况不符,表现为模拟的成虫寿命较实际成虫寿命长,这可能是由于构建模型中未考虑低温(13.19~20℃)和高温(≥35℃)对棉铃虫成虫发育生理水平上的影响[40-41],后期在模型优化中需要引入环境因子对昆虫生理变化影响的模块。 对田间棉铃虫种群动态模拟发现,棉铃虫成虫高峰期和发生代数方面拟合均较好,两地部分年份成虫高峰期出现提前或延后现象,一方面可能是由于喷洒杀虫剂的时间未在棉铃虫卵或1~3龄幼虫有效防治期内,因为根据杀虫剂喷洒的调查资料,121团和147团的历年杀虫剂喷洒时间较为固定,但是历年气候条件存在差异,并且全球气候变暖条件下,棉铃虫早发年的频率逐渐增加[42],从2009-2014年,各代棉铃虫的发生期均呈提前趋势;另一方面,121团与147团棉铃虫种群的迁飞或寄主转移的行为主要表现在局部研究区内,并未发现长距离的迁入或迁出情况,因此,该模型并未考虑研究区棉铃虫种群的迁入和迁出,是假设研究区内无外来迁入或研究区内迁出的情况,但是在实际情况中,棉铃虫的种群数量随时间的变化是显著受到其迁飞情况的影响[43]。并且,模型模拟的初始蛹年龄组成也为单一年龄(初始年龄为0),因此各代棉铃虫发生整齐,但是田间条件下棉铃虫种群存在不同的年龄结构组成,或是有来自不同寄主的棉铃虫[44],均会影响棉铃虫各代发生期和高峰期,因此模拟结果与实际种群存在差异。 表4各代棉铃虫成虫数量变异与诸变量间的Pearson相关系数1) Table4PearsoncorrelationcoefficientbetweenadultabundancevariationofHelicoverpaarmigeraandfactors 因素FactorPearson相关系数 PearsoncorrelationcoefficientG0G1G2G3Cli.0.036 0.347∗∗ 0.421∗∗ 0.413∗∗Opupae0.999∗∗0.405∗∗0.322∗∗0.277∗∗Fb0.000-0.417∗∗-0.282∗∗-0.197∗Fbs0.0000.492∗∗0.321∗∗0.214∗Sb0.0000.000-0.279∗∗-0.202∗∗Sbs0.0000.0000.339∗∗0.238∗∗Tb0.0000.0000.000-0.220∗∗Tbs0.0000.0000.0000.263∗∗Pred.0.000-0.325∗∗-0.279∗∗-0.280∗∗Para.0.000-0.212∗∗-0.193∗-0.195∗G01.0000.543∗∗0.366∗∗0.278∗∗G1-1.0000.665∗∗0.474∗∗G2--1.0000.697∗∗G3---1.000 1)*表示P<0.05;**表示P<0.01. Cli.: 不同年份的气候条件(逐日最高温和最低温); Opupae: 越冬基数; Fb和Fbs、Sb和Sbs、Tb and Tbs依次表示使用生物杀虫剂和化学杀虫剂防治第一代、第二代、第三代卵和1~3龄幼虫; Pred.: 捕食性天敌单位; Para.: 寄生性天敌单位; 从G0~G3分别表示越冬代、第一代、第二代成虫和秋季滞育蛹量。 *:P-value less than 0.05;**:P-value less than 0.01. Cli: Climate conditions in different years including daily maximum and minimum temperature; Opupae: abundance of overwintering pupae; Fb, Sb and Tb indicate the first, second and third time using biological pesticide to control the eggs and 1~3 instar larvae; Fbs, Sbs and Tbs indicate the first, second and third time using chemical pesticide to control the eggs and 1~3 instar larvae; Pred.: natural enemy units of predators; Para.: natural enemy units of parasitoid; the abbreviation from G0 to G3 indicate the overwintering, first, second generations and diapause pupae in autumn. 模拟的棉铃虫历年各代成虫发生量变化趋势与实际对比发现,147团较121团更接近实际情况,这主要是由于121团以化学杀虫剂施用为主和棉铃虫越冬基数高,影响了棉铃虫种群各代的发生量[45]。在该模型中,影响棉铃虫成虫发生量变化的因素有温度(对棉铃虫各阶段的死亡率影响)、越冬基数、杀虫剂喷洒和天敌,但根据两地历年调查资料显示,两地气候条件接近、作物种植模式和比例(主要种植作物中棉花和玉米所占比例)类似,121团的天敌数量较147团低,121团棉铃虫的越冬基数和化学杀虫剂的施用显著高于147团。因此,121团模拟的棉铃虫成虫发生量与实际相差较大。 本文建立的DYMEX模型,模拟了棉铃虫种群生命周期中存活率、发育历期、成虫繁殖和成虫寿命在不同温度下的变化过程,以及气温、杀虫剂喷洒和天敌综合影响下的自然种群动态。总体上,模拟结果与棉铃虫实际发生情况具有较高的一致性,建立的模型在种群动态模拟方面具有较好的稳健性,为田间多因素影响下的棉铃虫种群动态研究提供有效手段。 但该模型在不同寄主来源棉铃虫的种群动态[44],寄主间转移[46]和迁飞[47]、种群的密度和年龄结构组成、天敌生命周期[15],以及风速[48]、降雨[49]等生态因子对棉铃虫种群动态的影响方面有待进一步探究,并对模型进行优化,提高模型精度,从而更好地为田间害虫种群动态分析、预测预报和综合管理提供技术辅助。 [1] 张翠英, 刘继敏, 成兆金, 等. 气候变化对鲁西南棉铃虫的影响[J]. 中国棉花, 2008, 35(9): 9-20. [2] 郭文超,白山·哈吉泰,何江,等.新疆北部棉区棉铃虫自然种群生命表的初步研究[J].新疆农业科学,2000(3):113-117. [3] 屈荷丽.棉田主要栽培措施对棉铃虫的影响[D]. 石河子: 石河子大学, 2009. [4] 杨益众,庞雄飞,梁广文. 不同控制条件下棉铃虫自然种群生命表研究[J]. 应用生态学报, 2000, 11(6): 856-860. [5] 高增祥, 徐汝梅, 吴子江, 等. 基于生命表参数的棉铃虫种群动态模拟研究[J]. 昆虫学报, 2005, 48(4): 568-575. [6] 苏战平, 张孝羲, 翟保平. 江苏棉区第五代棉铃虫种群动态的模拟及预测[J]. 昆虫学报, 2002, 45(4): 465-470. [7] Maywald G F, Sutherst R W, Zalucki M P.DYMEX-General modelling in entomology[J]. Pest Management-Future Challenges, 1998(1/2): A325. [8] Parry H R, Aurambout J P, Kriticos D J. Having your cake and eating it: A modelling framework to combine process-based population dynamics and dispersal simulation [C]∥19th International Congress on Modelling and Simulation (Modsim 2011), 2011: 2535-2541. [9] Sutherst R W, Bourne A S.Modelling non-equilibrium distributions of invasive species: a tale of two modelling paradigms[J]. Biological Invasions, 2009, 11(6): 1231-1237. [10] Strauss G. Pest risk analysis ofMetcalfapruinosain Austria[J]. Journal of Pest Science, 2010, 83(4): 381-390. [11] Wyckhuys K A G, Koch R L, Kula R R, et al. Potential exposure of classical biological control agent of the soybean aphid,Aphisglycines, on non-target aphids in North America[J]. Biological Invasions, 2009, 11(4): 857-871. [12] 宋红敏, 张清芬, 韩雪梅, 等. CLIMEX: 预测物种分布区的软件[J]. 昆虫知识, 2004, 41(4): 379-386. [13] Yonow T, Zalucki M P, Sutherst R W. Modelling the population dynamics of the Queensland fruit fly,Bactrocera(Dacus)tryoni: a cohort-based approach incorporating the effects of weather [J]. Ecological Modelling, 2004, 173(1): 9-30. [14] Muthuthantri S, Marlzer D, Zalucki M P, et al. The seasonal phenology ofBactroceratryoni(Froggatt) (Diptera: Tephritidae) in Queensland[J]. Australian Journal of Entomology, 2010, 49(3): 221-233. [15] Li Z, Zalucki M P, Yonow T, et al. Population dynamics and management of diamondback moth (Plutellaxylostella) in China: the relative contributions of climate, natural enemies and cropping patterns [J]. Bulletin of Entomological Research, 2016, 106(2): 197-214. [16] Hallett R H, Goodfellow S A, Weiss R M, et al. MidgEmerge, a new predictive tool, indicates the presence of multiple emergence phenotypes of the overwintered generation of swede midge [J]. Entomologica Experimentalis et Applicata, 2009, 130(1): 81-97. [17] Nahrung H F, Schutze M K, Clarke A R, et al. Thermal requirements, field mortality and population phenology modelling ofParopsisatomariaOlivier, an emergent pest in subtropical hardwood plantations[J]. Forest Ecology and Management, 2008, 255(8/9): 3515-3523. [18] Rebecca H H, Christine A B, Xue Yingen, et al. Incorporating natural enemy units into a dynamic action threshold for the soybean aphid,Aphisglycines(Homoptera: Aphididae)[J]. Pest Management Science, 2014, 70(6): 879-888. [19] 陈元生, 段德康, 陈超, 等. 光周期和温度对棉铃虫发育历期及蛹重的影响[J]. 环境昆虫学报, 2012, 34(4): 407-414. [20] 马德英, 郭慧琳, 刘芳政, 等. 暗黑赤眼蜂防治新疆棉铃虫试验初报[J]. 中国生物防治, 2000, 16(3): 143. [21] 刘万学,万方浩,郭建英,等.人工释放赤眼蜂对棉铃虫的防治作用及相关生态效应[J].昆虫学报,2003,46(3):311-317. [22] 许建军,郭文超,姚举,等.新疆棉区利用赤眼蜂防治棉铃虫田间释放技术研究与应用[J].新疆农业科学,2004,41(5):378-380. [23] Liu Bing, Yang Long, Yang Fan, et al. Landscape diversity enhances parasitism of cotton bollworm (Helicoverpaarmigera) eggs byTrichogrammachilonisin cotton [J]. Biological Control, 2016, 93: 15-23. [24] 吴坤君, 陈玉平, 李明辉. 不同温度下的棉铃虫实验种群生命表[J]. 昆虫学报, 1978, 21(4): 385-392. [25] 吴坤君, 陈玉平, 李明辉. 温度对棉铃虫实验种群生长的影响[J]. 昆虫学报, 1980, 23(4): 358-368. [26] 李超, 李树清, 果保芬. 棉铃虫在变温环境中发育起点温度的研究[J]. 昆虫学报, 1987, 30(3): 253-258. [27] Mironidis G K. Development, survivorship and reproduction ofHelicoverpaarmigera(Lepidoptera: Noctuidae) under fluctuating temperatures[J]. Bulletin of Entomological Research, 2014, 104(6): 751-764. [28] Mironidis G K, Savopoulou S M.Development, survivorship and reproduction ofHelicoverpaarmigera(Lepidoptera: Noctuidae) under constant and alternating temperatures [J]. Environmental Entomology, 2008, 37(1): 16-28. [29] 吴坤君, 龚佩瑜, 阮永明. 用非线性模型估测恒温和变温下棉铃虫蛹的发育率[J]. 昆虫学报, 2009, 52(6): 640-650. [30] 汪郁生, 翟国英, 姜京宇, 等. 棉铃虫成虫群体发育起点及有效积温常数研究[C]∥中国植物保护学会青年工作委员会, 中国农业科学院植物保护研究所, 植物病虫害生物学国家重点实验室. “植物保护21世纪展望”——植物保护21世纪展望暨第三届全国青年植物保护科技工作者学术研讨会文集. 北京: 中国科学技术出版社, 1998: 543-544. [31] 李巧丝, 刘芹轩, 高宗仁, 等. 生物制剂Bt乳剂防治抗性棉铃虫试验示范初报[J]. 河南农业科学, 1994(6): 21. [32] 陈锦绣, 章东方, 陈铠, 等. 生物杀虫剂防治棉铃虫试验研究[J]. 安徽农业科学, 1997, 25(3): 242-251. [33] 彭军, 马艳, 潘登明, 等. 新型杀虫剂对棉铃虫及天敌影响的研究[J]. 中国棉花, 2004, 31(7): 13-14. [34] 张爱平, 张建华, 王相琴. 几种杀虫剂防治棉铃虫药效及对天敌的影响[J]. 新疆农垦科技, 2007(4): 32-33. [35] 韩灵红. 科云NPV防治棉铃虫大田药效示范试验[J]. 农村科技, 2007(5): 37. [36] 刘瑞红, 喻峰华, 张建萍. 石河子地区棉铃虫发生规律及药剂防治技术[J]. 中国农学通报, 2014, 30(7): 292-296. [37] 顾永征,李学珍,牛长缨.神农宫扁角菌蚊幼虫种群分布及其与环境因子的相关性[J].生态学报,2010,30(24):6828-6834. [38] Weaver B, Wuensch K L. SPSS and SAS programs for comparing Pearson correlation and OLS regression coefficients[J]. Behavior Research Methods, 2013, 45(3): 880-895. [39] 时培建. 棉铃虫越冬与发生对全球气候变化的响应[D]. 北京: 中国科学院动物研究所, 2013. [40] Mironidis G K, Savopoulou-Soultani M.Effects of heat shock on survival and reproduction ofHelicoverpaarmigera(Lepidoptera: Noctuidae) adults[J]. Journal of Thermal Biology, 2010, 35(2): 59-69. [41] Reddy G V P, Shi Peijian, Hui Cang, et al. 2015. The seesaw effect of winter temperature change on the recruitment of cotton bollwormsHelicoverpaarmigerathrough mismatched phenology [J].Ecology and Evolution, 2015, 5(23): 5652-5661. [42] Fang Ouyang, Hui Cang, Men Xinyuan, et al. Early eclosion of overwintering cotton bollworm moths from warming temperature accentuates yield loss in wheat [J]. Agricultural, Ecosystems and Environment, 2016, 217: 89-98. [43] Feng Hongqiang, Gould F, Huang Yunxin, et al. Modeling the population dynamics of cotton bollwormHelicoverpaarmigera(Hübner) (Lepidoptera: Noctuidae) over a wide area in northern China [J]. Ecological Modelling, 2010, 211(15): 1819-1830. [44] Ge Feng, Chen Fajun, Parajulee M N, et al. Quantification of diapausing fourth generation and suicidal fifth generation cotton bollworm,Helicoverpaarmigera, in cotton and corn in northern China [J].Entomologia Experimentalis et Applicata, 2005, 116(1): 1-7. [45] Mironidis, G K, Stamopoulos D C, Savopoulou-Soultani M.Overwintering survival and spring emergence ofHelicoverpaarmigera(Lepidoptera: Noctuidae) in Northern Greece [J]. Environmental Entomology, 2010, 39(4): 1068-1084. [46] Ravi K C, Mohan K S, Manjunath T M, et al. Relative abundance ofHelicoverpaarmigera(Lepidoptera: Noctuidae) on different host crops in India and the role of these crops as natural refuge forBacillusthuringiensiscotton [J]. Environmenal Entomology, 2009, 34(1): 59-69. [47] 张娟,马吉宏,徐养诚,等. 从卵巢发育特点揭示新疆地区棉铃虫迁飞习性[J]. 生态学杂志, 2013, 32(6): 1428-1432. [48] Morton R, Tuart L D, Wardhaugh K G. The analysis and standardization of light-trap catches ofHeliothisarmiger(Hübner) andH.punctigerWallengren (Lepidoptera: Noctuidae) [J]. Bulletin of Entomological Research, 1981, 71(2): 207-225. [49] Oertel A, Zalucki M P, Maelzer D A, et al. Size of the first spring generation ofHelicoverpapunctigera(Wallengren) (Lepidoptera: Noctuidae) and winter rain in central Australia[J]. Australia Journal of Entomology, 1999, 38: 99-103. (责任编辑: 田 喆) SimulationmodellingofthepopulationdynamicsofHelicoverpaarmigera(Hübner) (Lepidoptera:Noctuidae)usingDYMEX Gu Shimin1,2, Myron P.Zalucki3, Zhang Bao4, Liu Yongjian5, Lü Zhaozhi1 (1.XinjiangInstituteofEcologyandGeography,ChineseAcademyofSciences,Urumqi830011,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China; 3.SchoolofBiologicalSciences,TheUniversityofQueensland,Brisbane4072,Australia; 4.The147thPlantProtectionStationofAgriculturalDepartmentinXinjiang,Shihezi832045,China; 5.The121thProductionandConstructionCorpsAgriculturalTechnologyExtensionStationinXinjiang,Shihezi832066,China) Simulation modelling can contribute to our understanding of insect population dynamics and pest management. DYMEX model was a kind of mechanism model based on the concept of cohorts, which allowed the model to be more realistic in simulating population dynamics affected by multi-factors and to be popularized. The population dynamics ofHelicoverpaarmigerais influenced by many factors such as climate, natural enemies and agricultural practices, making modeling and simulation of population abundance and phenology difficult. In this study, DYMEX version 3.0 software was used to build a model ofH.armigera. (1) Simulations were consistent with experimental results (theR2were above 0.6 and theP-value were less than 0.05) for cotton bollworm developmental time, survivorship of immature stages and progeny production and longevity of female as influenced by different temperatures and pesticide effects. (2) Simulation of population relative abundance and phenology were consistent with field monitoring data. The DYMEX model ofH.armigeracan be used to study population dynamics under various scenarios and help us analyze lab experimental results, understand the contribution of various factors to population changes and make forecasts of population dynamics and so better serve pest management. Helicoverpaarmigera; population dynamics; DYMEX model; forecast; IPM 2017-02-28 2017-04-01 国家国际科技合作专项(2011DFA33170);兵团科技援疆计划(2014AB009) * 通信作者 E-mail: zhaozhi@ms.xjb.ac.cn S 435.62, S 431.9 A 10.3969/j.issn.0529-1542.2017.06.004

2 结果与分析
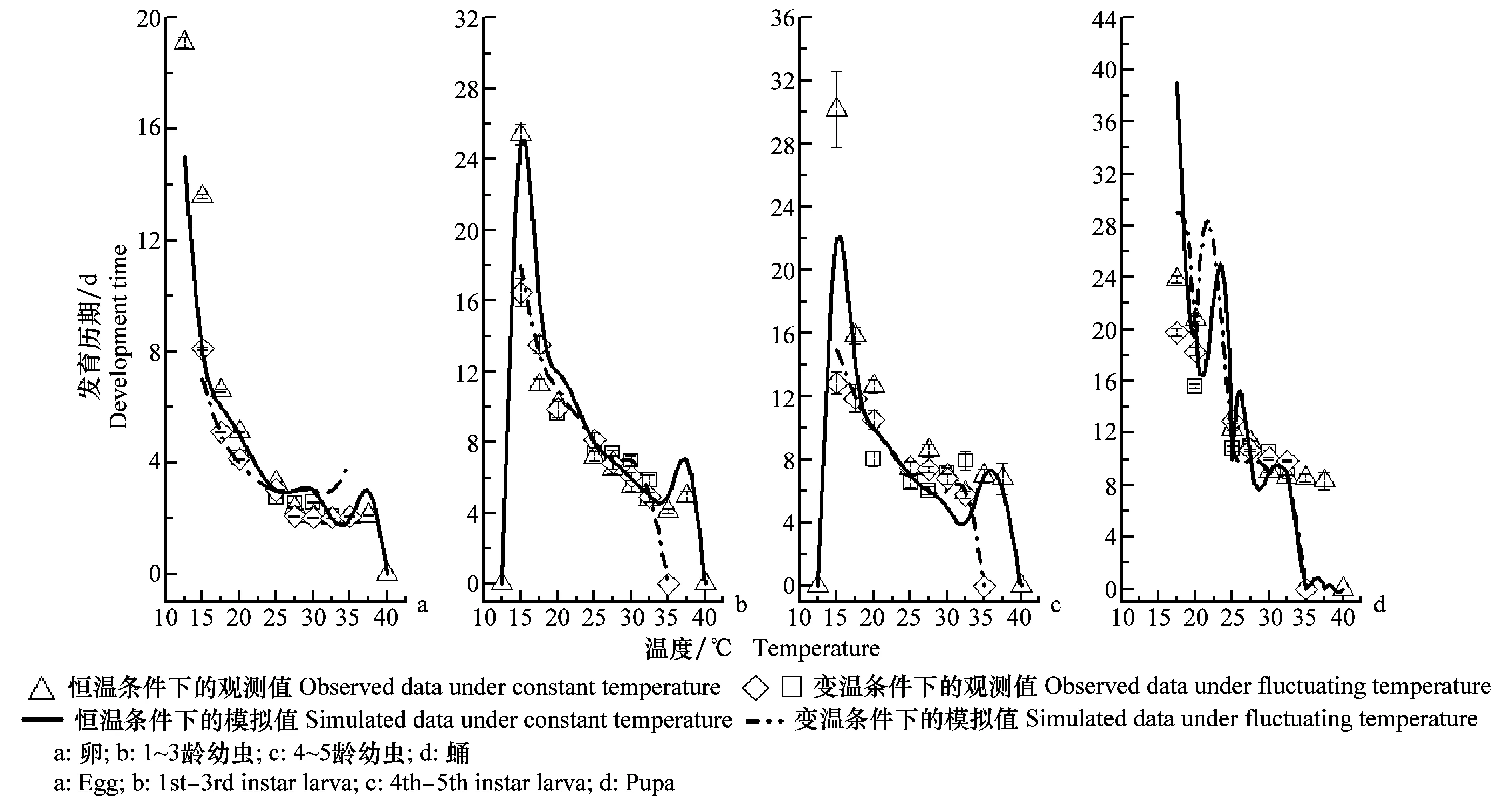
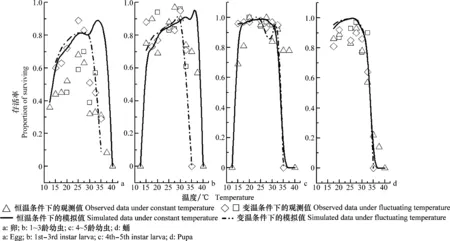
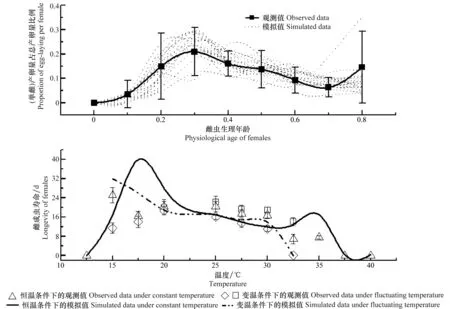

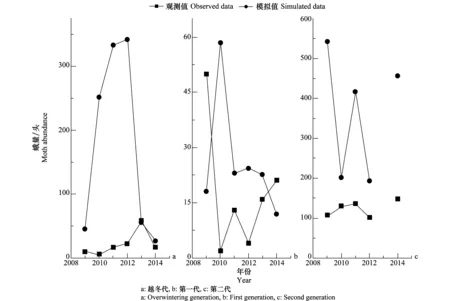



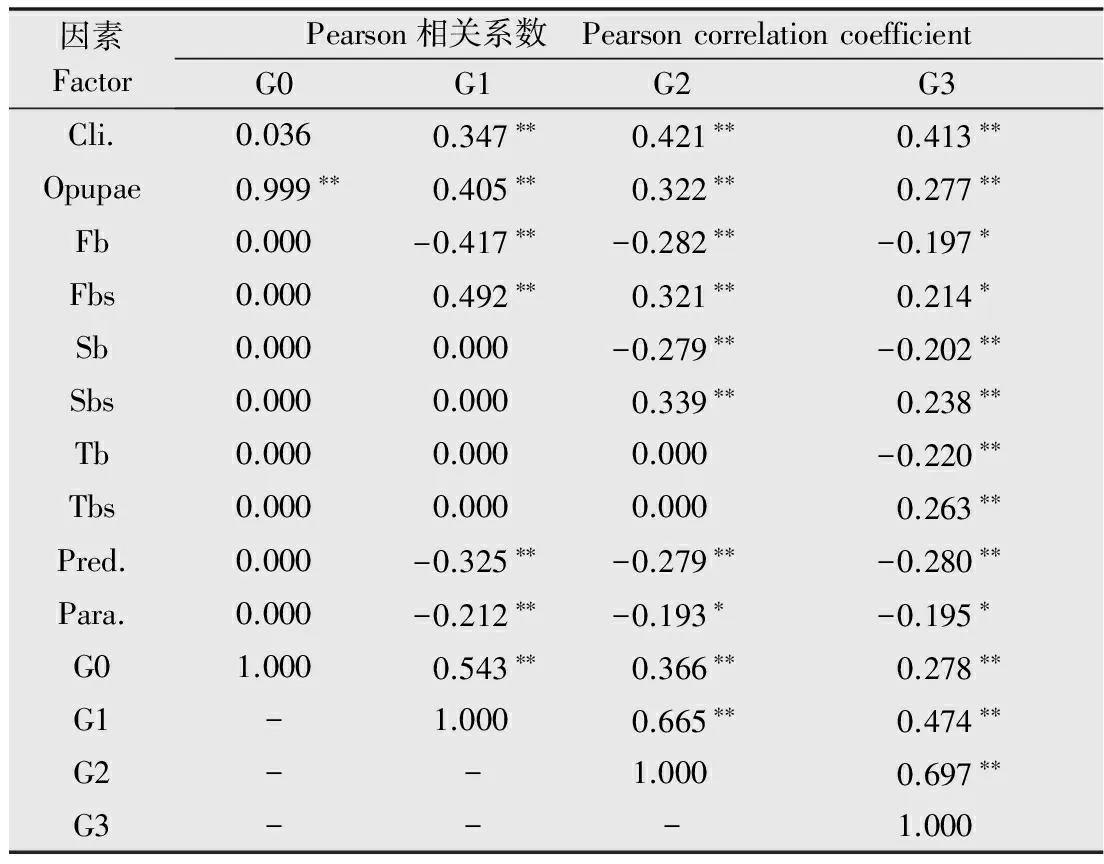
3 讨论与结论