细菌溶解产物胶囊治疗哮喘急性发作患儿的临床观察
2017-11-29唐瑜琦赵德辉孙维佳杨春富齐齐哈尔医学院第一附属医院儿科黑龙江齐齐哈尔604齐齐哈尔医学院第一附属医院肿瘤内科黑龙江齐齐哈尔604
唐瑜琦,赵德辉,孙维佳,杨春富(.齐齐哈尔医学院第一附属医院儿科,黑龙江齐齐哈尔604;.齐齐哈尔医学院第一附属医院肿瘤内科,黑龙江齐齐哈尔 604)
细菌溶解产物胶囊治疗哮喘急性发作患儿的临床观察
唐瑜琦1*,赵德辉2,孙维佳1,杨春富1(1.齐齐哈尔医学院第一附属医院儿科,黑龙江齐齐哈尔161041;2.齐齐哈尔医学院第一附属医院肿瘤内科,黑龙江齐齐哈尔 161041)
目的:探讨细菌溶解产物胶囊治疗哮喘急性发作患儿的临床疗效及对炎症因子、肺功能指标、呼吸力学指标的影响。方法:选取2013年9月-2016年1月我院收治的哮喘急性发作患儿87例,按随机数字表法分为观察组(44例)和对照组(43例)。对照组患儿给予糖皮质激素丙酸倍氯米松气雾剂0.05 mg,tid;观察组患儿在对照组基础上加用细菌溶解产物胶囊3.5 mg,qd。两组患儿疗程均为120 d。观察两组患儿外周血Th1/Th2细胞因子水平[γ干扰素(IFN-γ)、白细胞介素2(IL-2)、IL-4、IL-5、IL-10、IL-13]、肺功能指标[用力肺活量(FVC)、第一秒用力呼气容积(FEV1)、呼气峰流速(PEF)]、呼吸力学指标(平均气道压、呼吸阻力、静态顺应性、平台压测定值)及临床疗效。结果:治疗前,两组患儿Th1/Th2细胞因子、肺功能指标、呼吸力学指标比较,差异均无统计学意义(P>0.05);治疗后,两组患儿IFN-γ、IL-2、IL-10、FVC、FEV1、PEF水平均显著升高,IL-5、IL-13水平均显著降低,对照组患儿IL-4水平显著降低,且观察组患儿IL-2、IL-4、IL-10、FVC、FEV1、PEF水平显著优于对照组,差异均有统计学意义(P<0.05)。观察组患儿的平均气道压、呼吸阻力、平台压测定值均显著低于对照组,静态顺应性显著高于对照组,差异均有统计学意义(P<0.05)。观察组患儿控显率为77.27%,显著高于对照组的55.81%,差异有统计学意义(P<0.05)。结论:细菌溶解产物胶囊治疗哮喘急性发作患儿疗效显著,能够明显减轻患儿气道炎症反应、提高机体免疫水平,从而改善气道呼吸力学参数。
细菌溶解产物胶囊;哮喘;炎症因子;肺功能;呼吸力学
哮喘属于儿科常见的变态性呼吸系统疾病,好发于5~12岁儿童,发病率为0.5%~2%[1]。其可致患者持续咳嗽、喘鸣、呼吸急促及伴发呼吸道高度可逆性应激反应,极大地影响了患儿生活质量[2]。该病主要因T细胞因子介导的免疫答应紊乱所致,而辅助性T细胞1(Th1)/辅助性T细胞2(Th2)失衡能够显著促使病情的发展,因此改善患儿Th1及Th1表达能够达到改善哮喘的目的。细菌溶解产物胶囊常被用于预防和治疗呼吸道反复性感染及慢性炎症[3],并可作为合并用药治疗急性呼吸道感染,能够调节机体免疫系统各类细胞因子表达水平,但关于改善哮喘患儿的Th1/Th2平衡的研究较少。因此,本研究探讨了细菌溶解产物胶囊治疗哮喘急性发作患儿的临床疗效及对Th1/Th2细胞因子、肺功能指标、呼吸力学指标的影响,以期为临床提供参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准[4]:(1)符合2004年中华医学会儿科学分会呼吸学组修订的《儿童哮喘防治常规》中的哮喘急性发作期诊断标准;(2)年龄5~13岁。
排除标准:(1)合并肺结核、肺部支气管畸形、肺部感染、先天性心脏病等疾病的患儿;(2)近期应用抗菌药物、糖皮质激素、免疫抑制剂等药物或患有影响免疫水平疾病的患儿;(3)对本研究治疗药物过敏的患儿;(4)肝肾功能严重障碍的患儿;(5)由于其他原因未能坚持完成疗程的患儿。
1.2 研究对象
选取2013年9月-2016年1月我院儿科收治的哮喘急性发作患儿87例,采用随机数字表法分为观察组(44例)和对照组(43例)。其中,观察组患儿男性26例,女性18例;年龄5~12岁,平均年龄(7.8±2.0)岁;病情程度:轻度9例、中度21例、重度14例;治疗前的平均用力肺活量(FVC)为(1.3±0.5)L。对照组患儿男性23例,女性20例;年龄5~13岁,平均年龄(7.6±1.9)岁;病情程度:轻度11例、中度22例、重度10例;治疗前的平均FVC为(1.4±0.5)L。两组患儿的年龄、性别、病情程度、治疗前平均FVC等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会批准,患儿家属知情同意并签署知情同意书。
1.3 治疗方法
两组患儿均给予常规糖皮质激素治疗(ICS)[5],若合并感染则注射广谱抗菌药物或进行对症治疗。对照组患儿给予丙酸倍氯米松气雾剂(上海上药信谊药厂有限公司,批准文号:国药准字H31020770,规格:每瓶200揿,每揿含丙酸倍氯米松0.05 mg)0.05 mg,tid;观察组患儿在对照组基础上加用细菌溶解产物胶囊(瑞士OM Pharma SA.,注册证号:S20120051,规格:3.5 mg/粒)3.5 mg,qd,每30 d连续服药10 d,停药20 d。两组患儿疗程均为120 d。
1.4 观察指标
(1)比较两组患儿治疗前后外周血Th1/Th2细胞因子:γ干扰素(IFN-γ)、白细胞介素2(IL-2)、IL-4、IL-5、IL-10、IL-13。治疗前后清晨7:00抽取空腹静脉血5 mL分别置于试管内,以转速3 200 r/min、离心半径8 cm离心5 min,取上清液。采用ELISA法检测Th1细胞因子(IFN-γ、IL-2)和Th2 细胞因子(IL-4、IL-5、IL-10和IL-13)水平,检测试剂盒购自上海研卉生物科技有限公司,严格按照试剂盒说明书进行操作。(2)比较两组患儿治疗前后的肺功能指标:FVC、第一秒用力呼气容积(FEV1)、呼气峰流速(PEF)。(3)比较两组患儿治疗后呼吸力学参数指标:平均气道压、呼吸阻力、静态顺应性、平台压。(4)比较两组患儿临床疗效。疗效评价标准[6]——临床控制:哮喘症状完全缓解,即使偶有轻度发作不需用药即可缓解,FEV1(或PEF)增加量>35%,或治疗后FEV1(或PEF)增加≥预计值的80%,PEF昼夜波动率>20%;显效:哮喘发作较治疗前明显减轻,FEV1(或PEF)增加量25%~35%,或治疗后FEV1(或PEF)达到预计值的60%~79%,PEF昼夜波动率>20%,仍需用糖皮质激素或支气管舒张剂;好转:哮喘症状有所减轻,FEV1(或PEF)增加量15%~24%,仍需用糖皮质激素和(或)支气管舒张剂;无效:临床症状和FEV1(或PEF)测定值无改善或反而加重。控显率=(临床控制例数+显效例数)/总例数×100%,总有效率=(临床控制例数+显效例数+好转例数)/总例数×100%。
1.5 统计学方法
2 结果
2.1 两组患儿治疗前后外周血Th1/Th2细胞因子水平比较
治疗前,两组患儿的IFN-γ、IL-2、IL-4、IL-5、IL-10、IL-13水平比较,差异均无统计学意义(P>0.05);治疗后,两组患儿IFN-γ、IL-2、IL-10水平均显著升高,IL-5、IL-13均显著降低,对照组患儿IL-4水平显著降低,且观察组IL-2、IL-4、IL-10水平显著优于对照组,差异均有统计学意义(P<0.05),详见表1。
2.2 两组患儿治疗前后肺功能指标比较
治疗前,两组患儿FVC、FEV1、PEF水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者FVC、FEV1、PEF水平均显著升高,且观察组显著高于对照组,差异均有统计学意义(P<0.05),详见表2。
表1 两组患儿治疗前后外周血Th1/Th2细胞因子水平比较(±s)Tab 1Comparison of peripheral inflammatory factor levels between 2 groups before and after treatment(±s)

表1 两组患儿治疗前后外周血Th1/Th2细胞因子水平比较(±s)Tab 1Comparison of peripheral inflammatory factor levels between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别对照组观察组n t P治疗后4.44±1.05*4.52±0.96*0.709>0.05 43 44 IFN-γ,mg/mL治疗前20.36±9.75 19.81±8.86 0.275>0.05治疗后47.83±12.06*49.27±11.35*0.574>0.05 IL-2,ng/L治疗前1.35±0.52 1.28±0.56 1.047>0.05治疗后3.03±0.87*3.95±0.94*5.289<0.001 IL-4,pg/mL治疗前41.95±12.95 42.67±13.09 0.409>0.05治疗后32.05±10.84 44.08±11.90 7.095<0.001 IL-5,ng/L治疗前77.48±10.37 78.63±9.14 0.309>0.05治疗后18.33±6.75*17.85±5.03*0.785>0.05 IL-10,ng/L治疗前80.40±11.42 79.97±9.14 0.296>0.05治疗后92.09±9.15*98.50±8.09*4.908<0.001 IL-13,ng/L治疗前10.69±2.11 11.08±2.04 1.147>0.05
表2 两组患儿治疗前后肺功能指标比较±s)Tab 2 Comparison of pulmonary function indexes between 2 groups before and aftertreatment(±s)
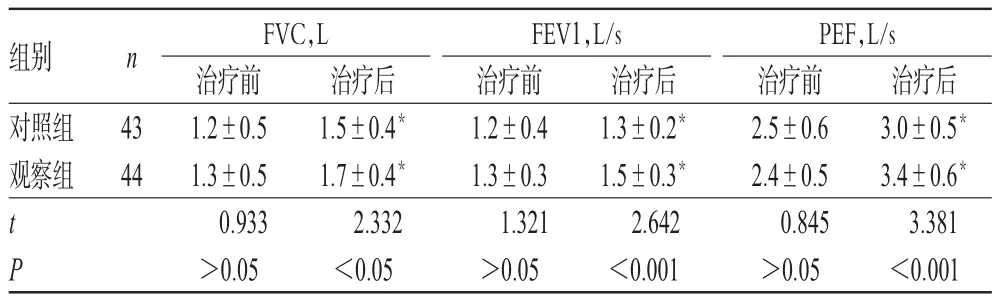
表2 两组患儿治疗前后肺功能指标比较±s)Tab 2 Comparison of pulmonary function indexes between 2 groups before and aftertreatment(±s)
注:与治疗前比较,*P<0.05Note:vs.before treatment,*P<0.05
组别对照组观察组治疗后3.0±0.5*3.4±0.6*3.381<0.001 n 43 44 t P FVC,L治疗前1.2±0.5 1.3±0.5 0.933>0.05治疗后1.5±0.4*1.7±0.4*2.332<0.05 FEV1,L/s治疗前1.2±0.4 1.3±0.3 1.321>0.05治疗后1.3±0.2*1.5±0.3*2.642<0.001 PEF,L/s治疗前2.5±0.6 2.4±0.5 0.845>0.05
2.3 两组患儿治疗后呼吸力学指标比较
治疗后,观察组患儿的平均气道压、呼吸阻力、平台压测定值均显著低于对照组,静态顺应性显著高于对照组,差异均有统计学意义(P<0.05),详见表3(表中,1 mmHg=0.098 kPa)。
表3 两组患儿治疗后呼吸力学指标比较(±s)Tab 3 Changes of respiratory mechanics indexes between 2 groups(s)
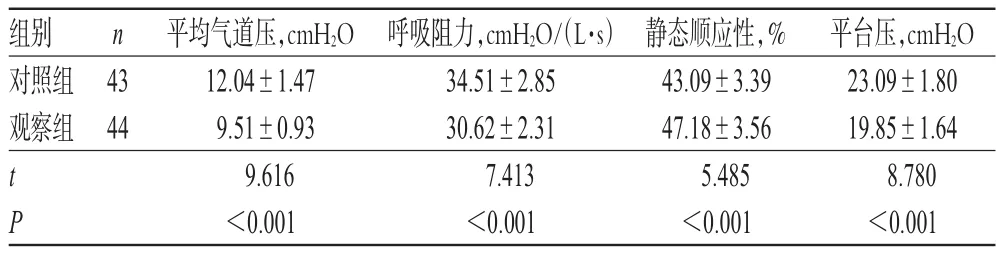
表3 两组患儿治疗后呼吸力学指标比较(±s)Tab 3 Changes of respiratory mechanics indexes between 2 groups(s)
组别对照组观察组n 43 44 t P平均气道压,cmH2O 12.04±1.47 9.51±0.93 9.616<0.001呼吸阻力,cmH2O/(L·s)34.51±2.85 30.62±2.31 7.413<0.001静态顺应性,%43.09±3.39 47.18±3.56 5.485<0.001平台压,cmH2O 23.09±1.80 19.85±1.64 8.780<0.001
2.4 两组患儿临床疗效比较
观察组患儿的控显率为77.27%,显著高于对照组的55.81%,差异有统计学意义(P<0.05);观察组患儿的临床总有效率为95.45%,高于对照组的88.37%,但差异无统计学意义(P>0.05),详见表4。
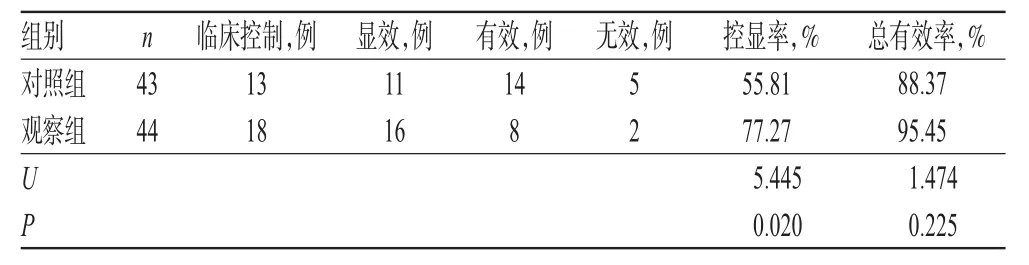
表4 两组患儿临床疗效比较Tab 4 Comparison of clinical efficacies between 2 groups
3 讨论
小儿出现哮喘的概率较高,预后较差,可恶化为急性气道炎症,甚至造成患儿死亡,因此关于哮喘的预防和治疗已经成为儿科研究的热点之一[6]。治疗哮喘的关键是探明其致病机制,诱发哮喘的主要原因为环境因素和遗传因素,但具体的产生机制仍较复杂,受到多因素影响,其中主要包括呼吸道慢性及高反应性炎症反应、急性变态反应、病毒侵袭和基因遗传等[7-8]。
T细胞亚群家族成员中Th1和Th2细胞和哮喘的产生和发展具有相关性。这是因为Th1细胞能够合成、释放IL-2和IFN-γ等细胞因子,诱发细胞毒性作用,影响机体局部炎症免疫功能,产生或抑制迟发性和超敏性炎症[9],调控细胞免疫抗病菌感染机制;Th2细胞能够分泌IL-4、IL-5、IL-10及IL-13等细胞因子,可调控免疫系统内体液免疫[10]。由于Th1与Th2细胞各自合成和释放不同类型的细胞因子,故其所引导机体免疫系统产生抗炎、抗感染及抗癌作用各异。在正常健康的机体内,Th1和Th2细胞间保持动态稳定的平衡状态,使得细胞免疫和体液免疫能够处于相对正常状态[11];而当机体出现哮喘时,可造成Th1/Th2比例失衡,形成变应原,造成患儿机体内细胞因子表达异常性变化,促使外周淋巴细胞和T细胞数量增多,抑制免疫系统功能。
细菌溶解产物胶囊作为一种新型免疫刺激剂,其能够通过口服方式进入患儿体内发挥药效,治疗方式简便。该药由流感嗜血杆菌、肺炎双球菌、肺炎克雷伯菌、臭鼻克雷伯菌、金黄色葡萄球菌、化脓性链球菌、草绿色链球菌、卡他奈瑟菌等8种病原菌提取物合成得到[12],能够激活人体特异及非特异性免疫系统功能运行,并可提高气道黏膜血清分泌免疫球蛋A(SIGA)的合成和释放,同时增加气道血液内高活性肽巨噬细胞数量[13]。细菌溶解产物胶囊可显著促使机体血液内免疫球蛋白A(IgA)表达水平,并将其广泛分布于肠、肺组织细胞,缓解和避免气道感染和炎症反应[14-15],同时对治疗哮喘具有较优疗效,能够降低抗菌药物用药量和缩短患者住院时间,增强机体免疫功能。
本研究结果显示,观察组患儿通过加服细菌溶解产物胶囊后,其IL-2、IL-4、IL-10水平显著高于对照组,可见细菌溶解产物胶囊能够有效促进细胞免疫和体液免疫应答活性上调,加强黏膜源性淋巴免疫能力,使得SIGA表达上升后,间接改善各项细胞因子表达水平;且两组患儿的IFN-γ、IL-2和IL-10表达均显著高于治疗前,IL-5、IL-13表达显著低于治疗前,说明两组患儿治疗均使得变应原特异性应答由Th2转至Thl,促进Thl/Th2细胞平衡恢复正常;但观察组患者治疗后IL-4表达略有增加,而对照组显著降低,说明细菌溶解产物胶囊调节Thl/Th2平衡的效果更优。本研究结果还显示,治疗后观察组患儿的FVC、FEV1、PEF水平和静态顺应性显著高于对照组,而其平均气道压、呼吸阻力、平台压均显著低于对照组,观察组患儿控显率为77.27%,显著高于对照组的55.81%,表明细菌溶解产物胶囊对于哮喘患儿气道呼吸力学参数改善效果更优,可改善其呼吸功能,疗效更佳。
综上所述,细菌溶解产物胶囊治疗哮喘急性发作患儿疗效显著,能够明显减轻患儿气道炎症反应、提高机体免疫水平,从而改善气道呼吸力学参数。但本研究未对两组患儿治疗过程中不良反应情况进行统计,后续研究有待改进。
[1] 陈阳,朱峰,李琪.泛福舒联合布地奈德对支气管哮喘患儿免疫功能的临床研究[J].中国临床药理学杂志,2015,31(6):409-411.
[2] 陶金金,贾春梅.免疫调节剂在哮喘治疗中的作用及研究进展[J].中国小儿急救医学,2015,22(7):494-497.
[3] 石福恒,谢占武.加味定喘汤对支气管哮喘外周血及肺泡灌洗液内嗜酸性粒细胞的影响[J].贵阳中医学院学报,2014,36(2):55-57.
[4] 张红,顾猛.过敏性哮喘患儿血浆IFN-γ与IL-4及粪便双歧杆菌检测及分析[J].国际检验医学杂志,2015,36(3):367-368.
[5] 燕民.不同剂量布地奈德雾化吸入对哮喘儿急性发作疗效影响[J].现代仪器与医疗,2014,7(4):8-11.
[6] 中华医学会儿科学分会呼吸学组.儿童支气管哮喘防治常规:试行[J].中华儿科杂志,2004,42(2):100-106.
[7] 张水林,谷云先,胡建云.细菌溶解产物胶囊对小儿哮喘及血清IL4、IFN-γ、IgE的影响[J].贵阳医学院学报,2014,39(1):54-56.
[8] 胡红.咳嗽变异性哮喘的诊断及治疗进展[J].解放军医学杂志,2014,39(5):361-364.
[9] 陈琪,张亚琼,叶斌,等.布地奈德对支气管哮喘患儿外周血干扰素γ、白细胞介素4和叉状头状螺旋转录因子3的影响[J].中华临床免疫和变态反应杂志,2014,2(3):200-204.
[10] Lauener R,Frei C,Roduit C,et al.Expression of genes related to anti-inflammatory pathways are modified among farmers’children[J].PloS one,2014,9(3):910-917.
[11] Jiang T,Sheng J,Qin Y,et al.Enhanced proliferation and defective activation-induced cell death of CD4+T cells in childhood asthma[J].Asian Pac J Allergy Immunol,2014,32(1):75-83.
[12] Fink C,Otero RD,Paz N,et al.Immune response to Streptococcus pneumoniae in asthma patients:comparison between stable situation and exacerbation[J].Clin Exp Immunol,2013,173(1):92-101.
[13] 张伟.泛福舒辅助治疗儿童支气管哮喘的临床观察[J].中国医药指南,2015,13(13):70-71.
[14] 刘菲,杨峰,王斌.细菌溶解产物胶囊治疗反复呼吸道感染患儿的临床疗效分析[J].中华医院感染学杂志,2015,9(4):942-944.
[15] 栾弘.泛福舒通过TLR4和TLR2介导的ERK1/2/NF-κB通路上调RAW264.7细胞炎症因子的表达[D].武汉:华中科技大学,2014.
Clinical Observation of Bacterial Lysates Capsules in the Treatment of Acute Attack of Asthma in Children
TANG Yuqi1,ZHAO Dehui2,SUN Weijia1,YANG Chunfu1(1.Dept.of Pediatrics,the First Affiliated Hospital of Qiqihar Medical School,Heilongjiang Qiqihar 161041,China;2.Dept.of Oncology,the First Affiliated Hospital of Qiqihar Medical School,Heilongjiang Qiqihar 161041,China)
OBJECTIVE:To investigate the clinical efficacy of Bacterial lysates capsule in the treatment of acute attack of asthma in children,and its effects on inflammatory factors and respiratory mechanics indexes.METHODS:A total of 87 children with acute attack of asthma in our hospital were divided into observation group(44 cases)and control group(43 cases).Control group was given glucocorticoid Beclomethasone dipropionate aerosol 0.05 mg,tid;observation group was additionally given Bacterial lysates capsule 3.5 mg,qd,on the basis of control group.Both groups
120 days of treatment.Peripheral Th1/Th2 cell factor levels(IFN-γ,IL-2,IL-4,IL-5,IL-10,IL-13),lung function indexes(FVC,FEV1,PEF),respiratory mechanics indexes(mean airway pressure,respiratory resistance,static compliance,measured plateau pressure)and clinical efficacies were observed in 2 groups.RESULTS:Before treatment,there was no statistical significance in Th1/Th2 cell factors,lung function indexes or respiratory mechanics indexes between 2 groups(P>0.05);after treatment,the levels of IFN-γ,IL-2,IL-10,FVC,FEV1 and PEF were increased significantly,while the levels of IL-5 and IL-3 were decreased significantly;IL-4 level of control group was decreased significantly;the levels of IL-2,IL-4,IL-10,FVC,FEV1 and PEF in observation group were significantly better than control group,with statistical significance(P<0.05).Mean airway pressure,respiratory resistance and measured plateau pressure of observation group were significantly lower than those of control group,while static compliance was significantly higher than control group,with statistical significance(P<0.05).Response rate of clinical control in observation group was 77.27%,which was significantly higher than 55.81%of control group,with statistical significance(P<0.05).CONCLUSIONS:Bacterial lysates capsule shows significantly therapeutic efficacy for acute attack of asthma,relieves airway inflammation and improves the immunity level of the body so as to improve airway respiratory mechanics parameters.
Bacterial lysates capsule;Asthma;Inflammatory factors;Lung function;Respiratory mechanics
R725.6
A
1001-0408(2017)32-4537-04
DOI10.6039/j.issn.1001-0408.2017.32.20
*副主任医师。研究方向:小儿呼吸系统疾病。电话:0452-6881062。E-mail:tangy9q@sina.com
2017-01-18
2017-07-16)(编辑:黄 欢)
