CYP3A4*18基因多态性与初治晚期NSCLC患者EGFR-TKI疗效及不良反应的相关性分析Δ
2017-11-29程艳芳王艳娜王慧孟玲利巩平石河子大学医学院第一附属医院肿瘤内科新疆石河子832008
程艳芳,王艳娜,王慧,孟玲利,巩平(石河子大学医学院第一附属医院肿瘤内科,新疆石河子832008)
·精准医疗·
CYP3A4*18基因多态性与初治晚期NSCLC患者EGFR-TKI疗效及不良反应的相关性分析Δ
程艳芳*,王艳娜,王慧,孟玲利,巩平#(石河子大学医学院第一附属医院肿瘤内科,新疆石河子832008)
目的:探讨细胞色素P450(CYP)3A4*18基因多态性与初治晚期非小细胞肺癌(NSCLC)患者表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)疗效及不良反应的相关性。方法:选取2013年1月-2016年3月于我院初次接受EGFR-TKI(吉非替尼或厄洛替尼)治疗至疾病进展或无法耐受的晚期NSCLC患者46例,采用聚合酶链反应及直接测序法检测各患者CYP3A4*18基因型,比较各基因型患者的临床疗效、无进展生存期(PFS)和不良反应发生情况。结果:46例患者中CYP3A4*18野生型17例,突变型29例,突变频率为63.0%。CYP3A4*18野生型患者的客观缓解率(ORR)为23.5%,疾病控制率(DCR)为70.6%;突变型患者的ORR为27.6%,DCR为69.0%;各基因型部分缓解、稳定、进展的患者比例以及ORR、DCR比较,差异均无统计学意义(P>0.05)。女性患者的PFS显著长于男性,无吸烟史者的PFS显著长于有吸烟史者,差异均有统计学意义(P<0.05);而患者的年龄、治疗药物、美国东部肿瘤协作组织评分、表皮生长因子受体(EGFR)突变类型、CYP3A4*18基因型等因素与其PFS无关(P>0.05);患者性别和吸烟史是PFS的独立预后因素[比值比分别为3.438、0.205,95%置信区间分别为(1.393,8.488)、(0.088,0.481)]。CYP3A4*18野生型患者发生皮疹的有6例(35.3%),腹泻的有3例(17.6%);突变型患者发生皮疹的有26例(89.7%),腹泻的有15例(51.7%),组间比较差异均有统计学意义(P<0.05);而各基因型患者肝功能损伤和间质性皮炎的发生率比较,差异均无统计学意义(P>0.05)。结论:CYP3A4*18基因多态性可能与初治晚期NSCLC患者EGFR-TKI的疗效无关,但与其不良反应的发生有关,突变型患者更有可能发生皮疹、腹泻等不良反应。
CYP3A4*18基因;多态性;晚期非小细胞肺癌;表皮生长因子受体酪氨酸激酶抑制剂;疗效;不良反应;相关性
相关研究证实,表皮生长因子受体酪氨酸激酶抑制剂(Epidermal growth factor receptor tyrosine kinase inhibitor,EGFR-TKI)已经成为表皮生长因子受体(Epidermal growth factor receptor,EGFR)突变阳性非小细胞肺癌(Non-small cell lung cancer,NSCLC)患者的一线治疗药物,临床有效率可达70%,总生存时间(Overall survival,OS)为2~24个月[1-2]。而对于其疗效的个体差异,目前临床尚无明确的预测指标。已有研究显示,抗肿瘤药物紫杉醇、多西他赛疗效及安全性的差异分别与其代谢酶细胞色素P450(Cytochrome P450,CYP)亚族CYP3A4的多态性有关[3-4];Ruan CJ等[5]发现,EGFR-TKI埃克替尼的代谢酶CYP2C19的多态性也会影响其药动学特征。因此,个体对药物的反应与其代谢酶的作用密切相关,而编码基因的单核苷酸多态性(Single nucleotide polymorphisms,SNPs)则被认为是主要的遗传因素[6]。
CYP3A4酶是临床应用广泛的NSCLC靶向治疗药物EGFR-TKI(吉非替尼和厄洛替尼)的主要代谢酶,已发现其编码基因55个SNPs位点,部分位点影响了CYP3A4酶的表达,导致机体对药物的反应存在个体差异,其中CYP3A4*18 SNPs位点的存在与个体间药物疗效的差异密切相关[7]。本研究在已有文献的基础上,初步探讨了CYP3A4*18基因多态性与NSCLC患者EGFR-TKI疗效及不良反应的相关性,以期为NSCLC患者的个体化治疗提供参考。
1 资料与方法
1.1 研究对象
本研究方案经医院医学伦理委员会审核通过后,选取2013年1月10日-2016年3月30日于我院初次接受EGFR-TKI治疗至疾病进展或无法耐受的晚期NSCLC患者46例。纳入标准:①年龄18~80岁;②经细胞病理学或组织病理学确诊为Ⅳ期NSCLC;③治疗前行EGFR基因检测,为突变阳性,自愿接受EGFR-TKI治疗;④至少有1个可测量或可评估的病灶;⑤能够参加研究和随访;⑥签署知情同意书。排除标准:①既往接收过EGFR-TKI治疗者;②既往或同时合并其他恶性肿瘤者;③合并严重感染或其他严重内科疾病患者。
1.2 材料
1.2.1 仪器 Nano Drop 2000型紫外分光光度仪、Biofuge Primo型高速电动离心机(美国Thermo公司);TC-512型梯度聚合酶链反应(Polymerase chain reaction,PCR)仪(英国Techne公司);SK-1型快速混匀器(江苏省金坛市医疗仪器厂);Gel Doc XR+型凝胶成像系统(美国Bio-Rad公司)。
1.2.2 试剂 血液基因组DNA提取试剂盒[天根生化科技(北京)有限公司,批号:P4129];2×PCR MasterMix(含染料,美国Thermo-fermentas公司,批号:00343740);5×Tris-硼酸电泳缓冲液[TBE Buffer,含445 mmol/L硼酸(Tris-Boric Acid)、10 mmol/L乙二胺四乙酸(EDTA),批号:BB19KA1583];CYP3A4*18基因上、下游引物[生工生物工程(上海)股份有限公司];琼脂糖(西班牙Biowest Agarose公司);0.5 μg/mL溴化乙锭(北京博迈德生物公司)。
1.3 治疗方法
所有患者均口服吉非替尼片(瑞典AstraZenecaAB,注册证号:国药准字J20100014,规格:250 mg)250 mg,qd或厄洛替尼片(英国Roche Registration Ltd.,注册证号:国药准字J20120060,规格:150 mg)150 mg,qd,直至疾病进展或无法耐受不良反应而停药。
1.4 基因型检测
1.4.1 标本采集 46例患者均在治疗前抽取外周静脉血2 mL,置于EDTA抗凝管中,于4℃冰箱中短暂存放后,再置于-80℃超低温冰箱中贮存,备用。
1.4.2 外周血DNA提取 采用血液基因组DNA提取试剂盒提取患者的DNA,具体步骤参照试剂盒说明书。1.4.3 PCR反应及测序 采用PCR及直接测序法对患者基因型进行检测。参考文献[8]设计引物,上游引物为5′-AAATGTCTTTCCTCTCCTTTCAGC-3′,下游引物为5′-AGCCTTCCTACATAGAGTCAGTG-3′。反应体系包括DNA模板2 μL,上、下游引物(浓度均为10 μmol/L)各1 μL,2×PCR MasterMix(含染料)25 μL、去离子水21 μL,共50 μL。同时设置空白对照孔,每个样本均设置复孔。PCR反应条件为94℃预变性10 min,94℃变性40 s,55 ℃退火45 s,72 ℃延伸35 s,共35个循环;72 ℃再延伸10 min。产物置于-20℃冰箱中保存。产物于92 V电压条件下经琼脂糖凝胶[含0.5 μg/mL溴化乙锭、TBE Buffer和2%琼脂糖]电泳50 min后,置于凝胶成像系统中观察结果。将所得PCR产物送至北京六合华大基因科技公司、采用直接测序法测定DNA序列。
1.5 疗效评价
采用实体瘤疗效评价标准(Response evaluation criteria in solid tumors,RECIST)1.1进行评价[9]——完全缓解(Complete response,CR):所有肿瘤病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周;部分缓解(Partialres ponse,PR):肿瘤最长径和与之垂直的短径之和(长径总和)至少缩小30%,至少维持4周;进展(Progressive disease,PD):肿瘤长径总和至少增加20%或出现1个及以上的新病灶;稳定(Stable disease,SD):肿瘤长径总和缩小未达PR,或增大未达PD。客观缓解率(Objective response rate,ORR)=(CR+PR)/患者总数×100%,疾病控制率(Disease control rate,DCR)=(CR+PR+SD)/患者总数×100%。
1.6 随访及生存分析
采用门诊及电话方式进行随访,末次随访时间为2016年8月1日。汇总患者的临床特征、疗效及不良反应,并记录其无进展生存期(Progression-free survival,PFS)。其中,PFS定义为患者自接受EGFR-TKI治疗之日起至疾病进展、死亡或发生不可耐受的不良反应为止的时间。对于至随访截止日期仍未发生疾病进展的受试患者,作截尾数据处理。
1.7 不良反应评价
参照2009年美国国家癌症研究所(National Cancer Institute,NCI)制定的常见不良反应术语标准(Common Terminology Criteria for Adverse Events,CTCAE)4.0[10]进行评价。不良反应是指在接受正常剂量的药物治疗时出现的有害或与用药目的无关的反应,CTCAE将不良反应的严重程度分为Ⅰ~Ⅳ度——Ⅰ度:轻度,通常无症状,无需治疗;Ⅱ度:中度,有临床症状,但不损害日常生活与活动;Ⅲ度:较严重的不良反应,可造成不良后果,需外科手术或住院治疗;Ⅳ度:可能对生命构成威胁,往往可致残;Ⅳ度:死亡。
1.8 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以±s表示,单因素分析采用Kaplan-Meier法和Log-rank检验,多因素分析采用Cox回归;计数资料以例数或率表示,采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 测序结果
测序结果显示,CYP3A4*18野生型(碱基序列为CCA)患者第10号外显子上第27位碱基为C,而突变型(碱基序列为CA)患者该位点的碱基C发生缺失突变,详见图1。
2.2 基因型分布
46例患者中,CYP3A4*18野生型患者17例,突变型患者29例,其基因突变频率为63.0%。
2.3 各基因型患者一般资料比较
各基因型患者的性别、年龄、治疗药物、吸烟史、美国东部肿瘤协作组织(Eastern Cooperative Oncology Group,EGOG)评分[11]、EGFR基因突变类型等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。
2.4 各基因型患者临床疗效比较
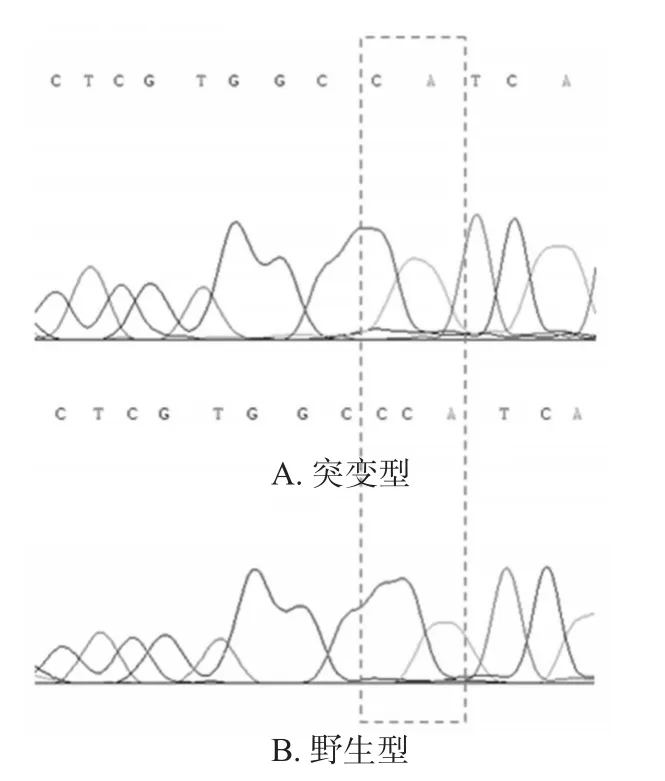
图1 CYP3A4*18基因测序结果Fig 1 Gene testing result of CYP3A4*18
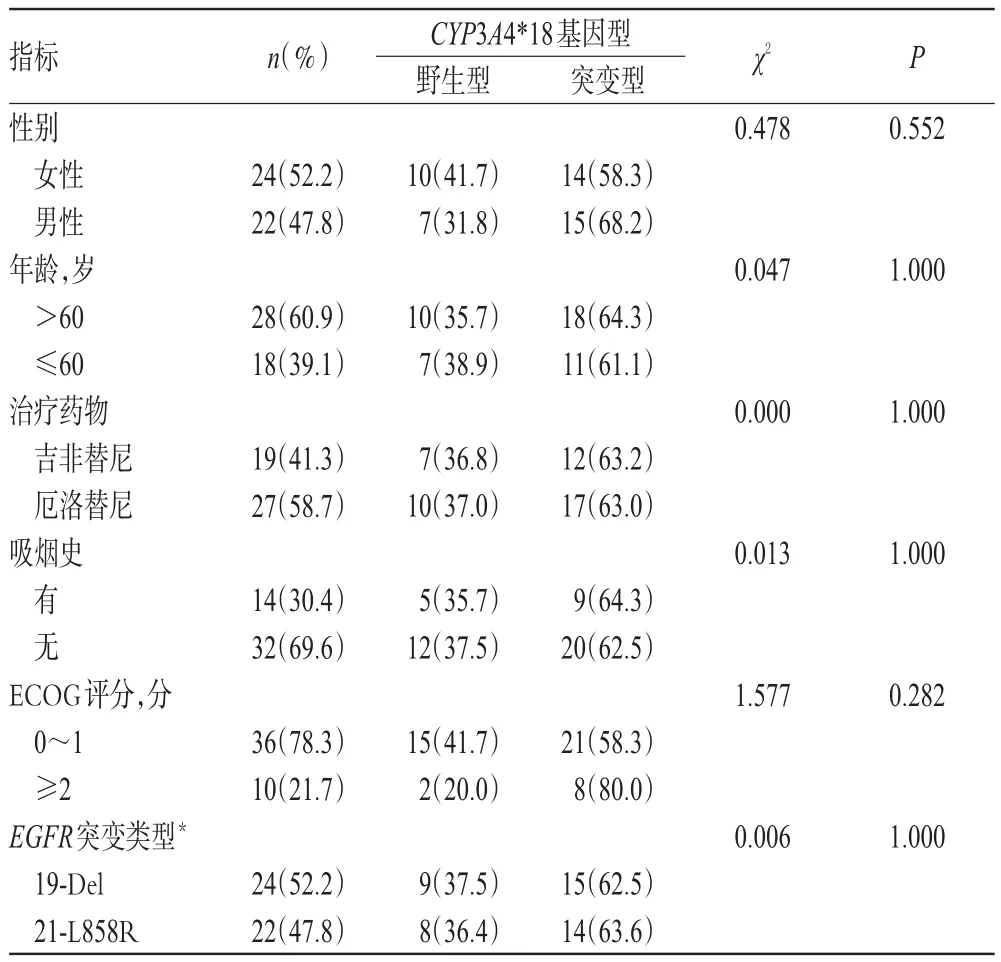
表1 各基因型患者一般资料比较[例(%%)]Tab 1 Comparison of general information of patients among different genotypes[case(%%)]
17例CYP3A4*18野生型患者中,PR、SD、PD患者分别为4、8、5例,无CR患者,ORR为23.5%,DCR为70.6%;29例突变型患者中,PR、SD、PD患者分别为8、12、9例,无CR患者,ORR为27.6%,DCR为69.0%。各基因型PR、SD、PD的患者比例以及ORR、DCR比较,差异均无统计学意义(P>0.05),详见表2。
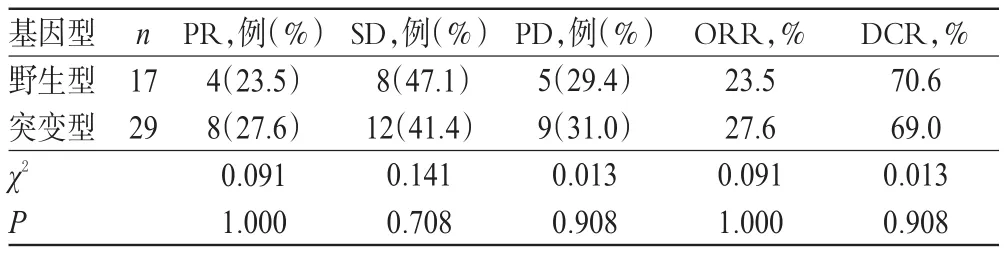
表2 各基因型患者临床疗效比较Tab 2 Comparison of clinical efficacies among different genotypes
2.5 单因素分析
共8例患者为截尾数据,其余38例患者的平均PFS为(6.5±3.3)个月。单因素分析结果显示,女性患者的PFS长于男性,无吸烟史者的PFS长于有吸烟史者,差异均有统计学意义(P<0.05);而患者的年龄、治疗药物、ECOG评分、EGFR突变类型、CYP3A4*18基因型与其PFS无关(P>0.05),详见表3。
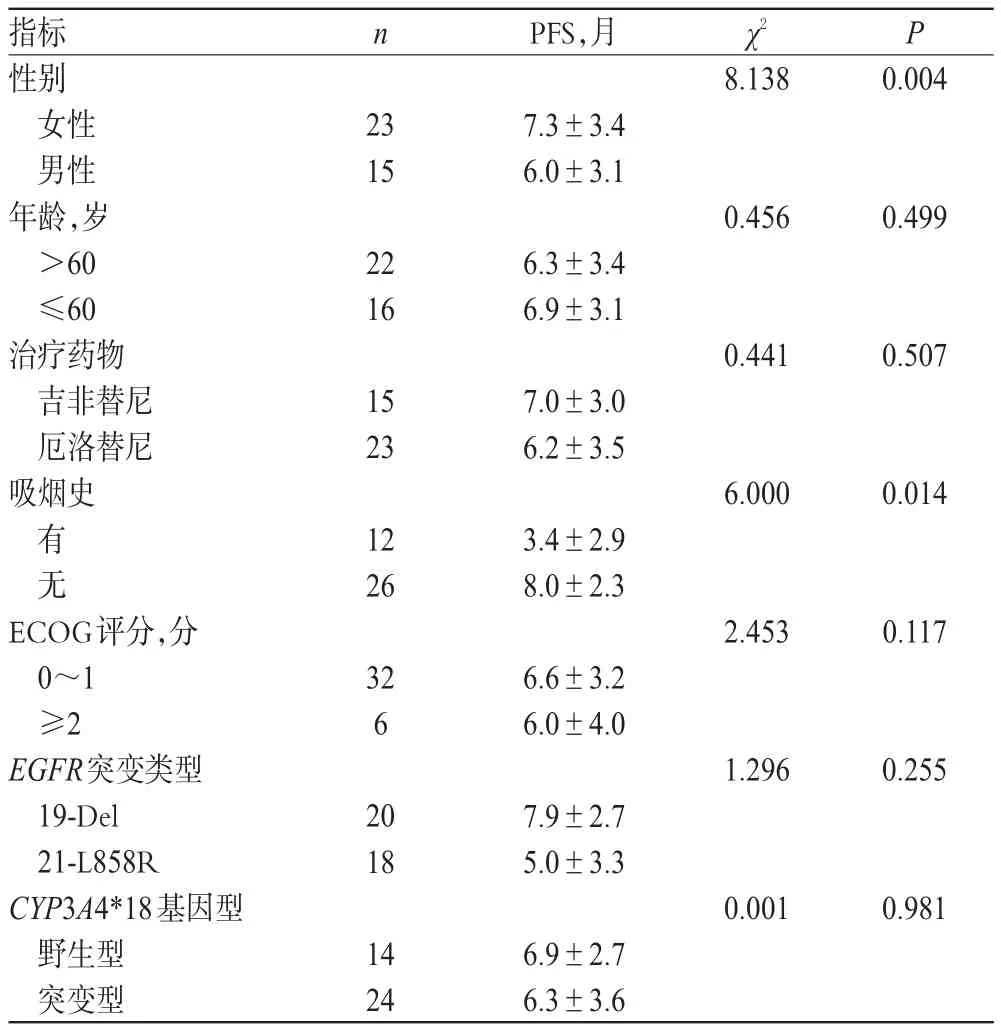
表3 单因素分析结果Tab 3 Results of univariate analysis
2.6 多因素分析
多因素分析结果显示,患者的性别(P=0.007)、吸烟史(P<0.001)是PFS的独立预后因素[比值比(Odds ratio,OR)分别为 3.438、0.205,95%置信区间(Confidence interval,CI)分 别 为(1.393,8.488)、(0.088,0.481)],而年龄、治疗药物、ECOG评分、EGFR突变类型和CYP3A4*18基因型均不是PFS的独立预后因素(P>0.05),详见表4。
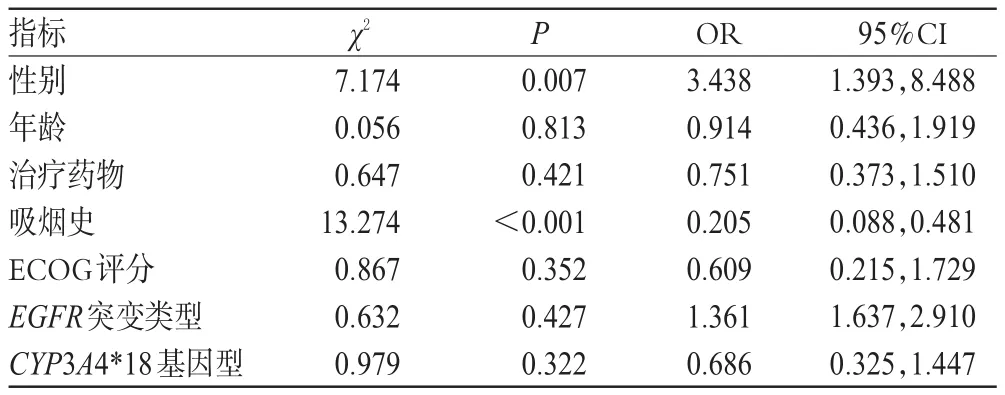
表4 多因素分析结果Tab 4 Results of multi-factor analysis
2.7 不良反应
接受吉非替尼或厄洛替尼治疗的NSCLC患者的主要不良反应为皮疹和腹泻,此外还包括肝功能损伤、间质性肺炎等[12]。CYP3A4*18野生型患者发生皮疹的有6例(35.3%),腹泻的有3例(17.6%);突变型患者发生皮疹的有26例(89.7%),腹泻的有15例(51.7%),组间比较差异均有统计学意义(P<0.05)。各基因型患者肝功能损伤和间质性皮炎的发生率比较,差异均无统计学意义(P>0.05),详见表5。
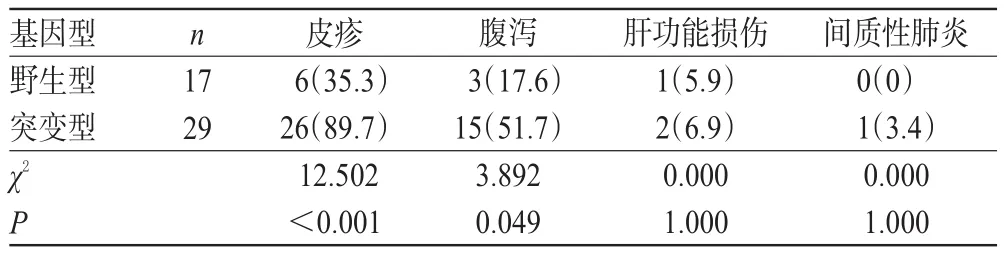
表5 各基因患者不良反应发生情况比较[例(%%)]Tab 5 Comparison of the occurrence of ADR among different genotypes[case(%%)]
3 讨论
肺癌是目前世界上发病率和病死率最高的恶性肿瘤,5年生存率仅为16.8%,其中约85%为NSCLC,且多数确诊时已进展至晚期[13]。与NSCLC发生发展密切相关的基因研究中,EGFR基因是了解最多、研究最广泛的一个靶点。其编码的EGFR蛋白属于酪氨酸激酶家族的跨膜蛋白受体,通过与其配体相结合激活蛋白激酶功能,促使酪氨酸残基磷酸化,通过Ras/Raf/MEK/ERK-MAPK及PI3K/Akt/mTOR通路进行信号转导,激活细胞内一系列的生化反应,诱导肿瘤细胞发生增殖、侵袭与转移[14]。在NSCLC患者中,EGFR基因出现扩增、突变、表达上调等活性失控状态,且85%~90%为19-Del和21-L858R突变[15]。EGFR-TKI的作用机制是与EGFR蛋白的腺苷三磷酸位点相结合,阻断下游信号转导,从而抑制肿瘤生长,促进其凋亡。因此,EGFR基因的阳性突变是EGFR-TKI治疗有效的原因[16]。虽然EGFR-TKI广泛用于晚期NSCLC患者的一线治疗,但疗效的个体差异显著。现有研究显示,亚裔、女性、腺癌、不吸烟的患者为EGFR-TKI治疗的优势人群,而其他导致个体差异的原因尚在后续研究中[17]。
代谢酶CYP3A4是第一代EGFR-TKI药物吉非替尼和厄洛替尼的主要代谢酶,是CYP家族的重要组成部分,广泛存在于人体的肝、脑、肾、肺、淋巴细胞及内皮等器官、组织中,约占肝脏CYP酶总含量的30%[18-19]。超过50%的药物经其代谢,且约85%CYP3A4酶表达的个体差异是由遗传因素引起的[19-20]。SNPs是指基因组序列中超过1%的单核苷酸发生变异,这种遗传变异可导致产物氨基酸及基因表达水平的改变[21]。越来越多的证据表明,SNPs的存在可造成不同个体对同一种药物的敏感性不同[22]。因此,通过检测相关基因序列探索遗传因素SNPs与药物敏感性的相关性,对探讨药物个体差异的原因,提高临床疗效,预测、预防不良反应的发生具有重要的临床意义。故在此基础上,本研究对CYP3A4*18基因的SNPs与EGFR-TKI疗效及不良反应的相关性进行了初步探讨。
本研究发现,CYP3A4*18突变型是其第10号外显子第27位碱基C发生缺失突变,导致氨基酸残基由谷氨酰胺转化为天冬氨酸,进而改变了多肽链的氨基酸种类及序列,与Yang JW等[8]的研究一致。46例患者中,CYP3A4*18基因突变型患者有29例,突变频率为63.0%,高于既往研究结果(39.6%~45.2%)[23-24],其具体原因还有待进一步研究。
本研究对CYP3A4*18基因型对EGFR-TKI疗效的影响进行了探讨。结果显示,CYP3A4*18各基因型患者ORR、DCR比较,差异均无统计学意义(P分别为1.000、0.908),提示CYP3A4*18基因SNPs可能与EGFR-TKI的疗效无关,与文献[25]的结果一致,可能与CYP3A4各基因型对吉非替尼药物暴露水平并无较大影响有关[25]。在对受试患者PFS的考察中发现,有8例患者为截尾数据,其占比(17.4%)不超过70%,表明本研究数据结果可靠[26]。单因素分析结果显示,女性患者的PFS长于男性(P=0.004),不吸烟者的PFS长于吸烟者(P=0.014);多因素分析结果显示,患者性别(P=0.007)、吸烟史(P<0.001)为PFS的独立预后因素,而年龄、治疗药物、ECOG评分、EGFR突变类型、CYP3A4*18基因型等因素与其PFS无关,本研究结果与IPASS临床研究所示的女性、不吸烟患者EGFR-TKI疗效较好的结果类似[27]。Lee CK等[28]的研究表明,吸烟后摄入厄洛替尼,可导致体内药物暴露程度明显降低,但这种代谢因素是否为导致PFS差异的真正原因,是否有其他因素的参与都有待进一步确定;女性患者对EGFR-TKI的获益曾归因于其EGFR突变率的上升,但仍有必要进行进一步的研究[29]。
本研究考察了各基因型患者不良反应的发生情况。结果显示,CYP3A4*18基因型与不良反应具有相关性,且CYP3A4*18突变型患者更易发生皮疹或腹泻症状。EGFR-TKI引起皮疹和腹泻的机制尚不明确,但可能由于该类药物可促使上皮细胞释放细胞因子等物质,进而致使中性粒细胞等炎症细胞浸润,导致皮疹病变的发生,而腹泻的发生率与皮疹的严重程度具有一定的相关性[30]。因此,在应用EGFR-TKI之前检测患者代谢酶的基因突变类型对预测、预防不良反应的发生具有一定的临床意义。
综上所述,CYP3A4*18基因SNPs有可能成为预测EGFR-TKI不良反应的分子标志物,但未发现其与EGRF-TKI疗效之间的相关性。由于本研究样本量较小,可能导致结果存在一定的偏倚,故有待进一步扩大样本量以深入探讨EGFR-TKI致不良反应的分子机制,为NSCLC患者个体化用药的针对性、高效性及安全性提供参考。
[1] Cataldo VD,Gibbons DL,Pérez-Soler R,et al.Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J].N Engl J Med,2011,364(10):947-955.
[2] Rosell R,Moran T,Queralt C,et al.Screening for epidermal growth facter receptor mutation in lung cancer[J].N Engl J Med,2009,361(10):958-967.
[3] Kus T,Aktas G,Kalender ME,et al.Polymorphism of CYP3A4 and ABCB1 genes increase the risk of neuropathy in breast cancer patients treated with paclitaxel and docetaxel[J].Onco Targets Ther,2016,doi:10.2147/OTT.S106574.
[4] Duran I,Hagen C,Arranz JÁ,et al.SNPs associated with activity and toxicity of cabazitaxel in patients with advanced urothelial cellcarcinoma[J].Pharmacogenomics,2016,17(5):463-471.
[5] Ruan CJ,Liu DY,Jiang J,et al.Effect of the CYP2C19 genotype on the pharmacokinetics of icotinib in healthy male volunteers[J].Eur J Clin Pharmacol,2012,68(12):1677-1680.
[6] 董章利,汪国香,方向明.细胞色素酶CYP3A4基因多态性研究进展[J].国际麻醉学与复苏杂志,2012,33(10):705-709.
[7]Maekawa K,Harakawa N,Yoshimura T,et al.CYP3A4*16 and CYP3A4*18 alleles found in East Asians exhibit differential catalytic activities for seven CYP3A4 substrate drugs[J].Drug Metab Dispos,2010,38(12):2100-2104.
[8] Yang JW,Meng Y,Su Y,et al.Trial of the correlation between cytochrome oxidase CYP3A4 with the susceptibility of paclitaxel-based regimen for advanced gastric cancer[J].Chinese-German J Clin Oncol,2014,13(10):451-456.
[9] Eisenhauer EA,Thersasse P,Bogaerts J,et al.New respongse evaluation criteria in solid tumours:revised RECIST guideline:version 1.1[J].Eur J Cancer,2009,45(2):228-247.
[10] National Cancer Institute.Common Terminology Criteria for Adverse Events(CTCAE):v4.0[EB/OL].(2009-05-28)[2017-03-11].https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm.
[11] 体能状态评分ECOG评分法[J/CD].中华普通外科学文献:电子版,2012,6(6):64.
[12] Shi Y,Zhang L,Liu X,et al.Icotinib versus gefitinib in previously treated advanced non-small-cell lung cancer(ICOGEN):a randomised,double-blind phase 3 non-inferiority trial[J].Lancet Oncol,2013,14(10):953-961.
[13] Jotte RM,Spigel DR.Advances in molecular-based personalized non-small-cell lung cancer therapy targeting epidermal growth factor receptor and mechanisms of resistance[J].Cancer Med,2015,4(11):1621-1632.
[14] Olayioye MA,Neve RM,Lane HA,et al.The ErbB signaling network:receptor heterodimerization in development and cancer[J].EMBO J,2000,19(13):3159-3167.
[15] Rosell R,Carcereny E,Gervais R,et al.Erlotinib versus standard chemotherapy as first-line treatment for European patientswith advanced EGFR mutation-positive non-small-cell lung cancer(EURTAC):a multicentre,open-label,randomized phase 3 trial[J].Lancet Oncology,2012,13(3):239-246.
[16] Paez JG,Jänne PA,Lee JC,et al.EGFR mutations in lung cancer:correlation with clinical response to gefitinib therapy[J].Science,2004,304(5676):1497-1500.
[17] Sárosi V,Balikó Z,Smuk G,et al.The frequency of EGFR mutation in lung adenocarcinoma and the efficacy of tyrosine kinase inhibitor therapy in a Hungarian cohort of patients[J].Pathol Oncol Res,2016,22(4):755-761.
[18] 丁珏芳,钟大放.小分子酪氨酸激酶抑制剂的临床药动学研究进展[J].药学学报,2013,48(7):1080-1090.
[19] Liu YT,Hao HP,Liu CX,et al.Drugs as CYP3A probes,inducers,and inhibitors[J].Drug Metab Rev,2007,39(4):699-721.
[20] Özdemir V,Kalow W,Tang BK,et al.Evaluation of the genetic component of variability in CYP3A4 activity:a repeated drug administration method[J].Pharmacogenetics,2000,10(5):373-388.
[21] 刘志强,蔡琳.miRNA相关SNPs与肺癌遗传易感性关系的研究进展[J].肿瘤防治研究,2016,43(12):1090-1094.
[22] 蒋刈,戴朴,韩东一.单核苷酸多态性在人类基因组学发展中的应用[J].中华耳科学杂志,2017,15(2):239-244.
[23] 杨建伟,苏颖,陈增,等.CYP3A4基因多态性与晚期胃癌患者接受紫杉醇/奥沙利铂多线化疗、放疗周期数及不良反应的相关性[J].临床与病理杂志,2014,34(1):22-28.
[24] 周鹏,张璇,杨叶雅.汉族患者CYP3A4*18基因多态性与阿哌利唑血药浓度及不良反应的相关性[J].中国药房,2014,25(28):2618-2620.
[25] Kobayashi H,Sato K,Niioka T,et al.Relationship among gefitinib exposure,polymorphisms of its metabolizing enzymes and transporters,and side effects in Japanese patients with none small-cell lung cancer[J].Clin Lung Cancer,2015,16(4):274-281.
[26] 陈雯,陈昂,夏英华,等.样本量及删失率对生存分析模型有效性和偏倚性的影响[J].中国卫生统计,2013,30(1):5-8.
[27] Reck M.A major step towards individualized therapy of lung cancer with gefitinib:the IPASS trial and beyond[J].Expert Rev Anticancer Ther,2010,10(6):955-965.
[28] Lee CK,Wu YL,Ding PN,et al.Impact of specific epidermal growth factor receptor(EGFR)mutations and clinical characteristics on outcomes after treatment with EGFR tyrosine kinase inhibitors versus chemotherapy in EGFR-mutant lung cancer:a meta-analysis[J].J Clin Oncol,2006,33(17):1958-1965.
[29] Shigematsu H,Lin L,Takahashi T,et al.Clinical and biological features associated with epidermal growth factor receptor gene mutations in lung cancers[J].J Natl Cancer Inst,2005,97(5):339-346.
[30] 支修益.表皮生长因子受体酪氨酸激酶抑制剂治疗非小细胞肺癌相关不良反应研究进展[J].药物不良反应杂志,2013,15(3):152-156.
Relationship Analysis of CYP3A4*18 Gene Polymorphism with Therapeutic Efficacy and ADR of EGFR-TKI in Advanced NSCLC Patients Receiving Primary Treatment
CHENG Yanfang,WANG Yanna,WANG Hui,MENG Lingli,GONG Ping(Dept.of Oncology,the First Affiliated Hospital of Shihezi University School of Medicine,Xinjiang Shihezi 832008,China)
OBJECTIVE:To investigate the relationship of Cytochrome P450(CYP)3A4*18 gene polymorphism with therapeutic efficacy and ADR of epidermal growth factor receptor tyrosine kinase inhibitor(EGFR-TKI) in non-small cell lung cancer(NSCLC)patients receiving primary treatment.METHODS:A total of 46 advanced NSCLC patients receiving primary EGFR-TKI(gefitinib or erlotinib)treatment until disease progression or intolerance were selected from our hospital during Jan.2013-Mar.2016,and(gefitinib of erlotinib)treatment until disease progression or intolerance.CYP3A4*18 genotype was detected by PCR and direct sequencing.Clinical efficacies,progression-free survival(PFS)and the occurrence of ADR were compared among different genotypes.RESULTS:Among 46 patients,there were 17 cases of CYP3A4*18 wild-type and 29 cases of CYP3A4*18 mutation-type,with mutation frequency of 63.0%.The objective response rate(ORR)of CYP3A4*18 wild-type patients was 23.5%,and disease control rate(DCR)of them was 70.6%.For CYP3A4*18 mutation-type patients,ORR and DCR were 27.6%and 69.0%.There was no statistical significance in the proportion of patients with partial response,stable disease or progressive disease,ORR or DCR among different genotypes(P>0.05).PFS of female patients were significantly longer than male patients;those of patients without smoking history were significantly longer than those with smoking history,with statistical significance(P<0.05).There was no correlation between patients’age,therapy drugs,Eastern Oncology Collaboration scores,EGFR mutation types,CYP3A4*18 genotypes and PFS(P>0.05).Patients’gender and smoking history were independent prognostic factors for PFS[odds ratios were 3.438,0.205,95%CI were(1.393,8.488),(0.088,0.481)].Among CYP3A4*18 wild-type patients,6 patients suffered from rash(35.3%)and 3 diarrhea(17.6%).Among mutation-type patients,26 patients suffered from rash(89.7%)and 15 diarrhea(51.7%),with statistical significance(P<0.05).There was no statistical significance in the incidence of liver function injury and interstitial dermatitis among differentgenotypes (P>0.05).CONCLUSIONS:CYP3A4*18 gene polymorphism may be not associated withtherapeutic efficacy of EGFR-TKI in advanced NSCLC patients receiving primary treatment,but it is correlated with the occurrence of ADR.Mutation type patients are more likely to suffered from rash,diarrhea and other ADR.
CYP3A4*18 gene;Polymorphism;Advanced non-small cell lung cancer;Epidermal growth factor receptor tyrosine kinase inhibitor;ADR;Relationship
R734.2
A
1001-0408(2017)32-4465-06
DOI10.6039/j.issn.1001-0408.2017.32.01
国家自然科学基金资助项目(No.81560381);吴阶平医学基金会临床科研专项资助基金课题(No.320.6750.14269)
*硕士研究生。研究方向:肿瘤化疗与生物免疫治疗。电话:0993-2812389。E-mail:chengyanfang01@163.com
#通信作者:主任医师,教授,博士。研究方向:肿瘤化疗与生物免疫治疗。电话:0993-2812389。E-mail:gongp832000@163.com
2016-11-22
2017-09-15)(编辑:张元媛)
