斑马鱼肿瘤异种移植模型在抗癌药敏感性评价中的应用
2017-11-29劳乔聪徐懿乔金凡茂陈嘉晟汤敏佳朱晓宇郑高利宣尧仙李春启
劳乔聪,徐懿乔,金凡茂,陈嘉晟,汤敏佳,徐 雷,朱晓宇,郑高利,宣尧仙,李春启*
(1.杭州环特生物科技股份有限公司,杭州 310012; 2.浙江省人用物品安全性评价技术研究重点实验室早期评价基地,杭州 310012; 3.浙江省医学科学院安全性评价研究中心,杭州 310013)
斑马鱼肿瘤异种移植模型在抗癌药敏感性评价中的应用
劳乔聪1,2,徐懿乔1,金凡茂1,陈嘉晟1,汤敏佳1,徐 雷1,朱晓宇1,2,郑高利3,宣尧仙3,李春启1,2*
(1.杭州环特生物科技股份有限公司,杭州 310012; 2.浙江省人用物品安全性评价技术研究重点实验室早期评价基地,杭州 310012; 3.浙江省医学科学院安全性评价研究中心,杭州 310013)
目的应用人类肺癌、胃癌和肝癌细胞斑马鱼异种移植模型,分别评价5种临床常用抗癌药的体内敏感性。方法分别建立斑马鱼肺癌A549、胃癌SGC-7901和肝癌HepG2异种移植模型,顺铂、紫杉醇、长春瑞滨、恩度和贝伐单抗设计3个剂量分别处理斑马鱼肺癌A549移植模型,紫杉醇、伊立替康、羟基脲、顺铂和5-氟尿嘧啶(5-fluorouracil,5-FU)设计3个浓度或剂量分别处理斑马鱼胃癌SGC-7901移植模型,阿霉素、吉西他滨、羟基脲、顺铂和5-氟尿嘧啶设计3个浓度或剂量分别处理斑马鱼肝癌HepG2移植模型。实验结束后,使用荧光显微镜进行体内肿瘤定量图像分析,计算药物对斑马鱼体内肿瘤生长抑制率,通过与模型对照组相比,分析是否具有统计学意义。结果受试的抗肿瘤药物在斑马鱼肿瘤异种移植模型中均有效,并且基本都呈剂量依赖性。在抗肺癌A549药敏试验中,药效从高到低分别为贝伐单抗(65%)>顺铂(55%)>长春瑞滨(40%)>恩度(39%)>紫杉醇(27%);在抗胃癌SGC-7901药敏试验中,药效从高到底分别为羟基脲(46%)>5-FU(31%)=伊立替康(31%)>紫杉醇(26%)>顺铂(24%);在抗肝癌HepG2药敏试验中,药效从高到底分别为顺铂(64%)>羟基脲(56%)>吉西他滨(46%)>阿霉素(45%)>5-FU(38%)。结论斑马鱼肿瘤异种移植模型适合用于抗癌药体内药敏试验。
斑马鱼;肿瘤移植;抗癌药;体内药敏试验;药效比较
世界上每年都会出现大量新的抗肿瘤候选物,大量的人力物力不断地投入到抗肿瘤药物的开发中,然而,每年都有大量的抗肿瘤药物在前期的开发中给科学家带来希望,但在后期的临床研究中被证明是无效的,由此造成的时间、金钱、精力成本巨大[1]。因此,寻找一种在药物开发早期便能够迅速、准确、高效评价抗肿瘤候选物药效的方法非常必要。
斑马鱼作为一种重要的模式生物,早期主要应用于发育遗传学研究[2-4]和有毒物质的检测[5-11]。近些年来,斑马鱼在各类药物的药效评价方面也起到了越来越重要的作用[12-19]。斑马鱼作为一种整体的活体动物模型,在药物评价方面,具备药物在体内吸收、分布、代谢、排泄的完整过程,并且由于其本身的物理特性,斑马鱼又具有类似体外细胞、分子生物学手段快速、高效、经济的优势,是细胞等体外试验模型过渡到鼠科等哺乳动物模型中的一个优势动物模型,在药物的临床前研究阶段有较高应用价值。
斑马鱼肿瘤异种移植模型是抗肿瘤药物研发中一种新兴的实验技术[20],广泛应用于抗肿瘤药物的早期筛选实验[21, 22],但并未见关于使用该模型专门评价已上市药物药敏性的报道。因此,本研究以斑马鱼肿瘤移植为动物模型,验证临床常用的抗肿瘤药物在该模型上的药敏性,旨在探索斑马鱼肿瘤异种移植模型是否能够准确评价抗肿瘤药物的效果,为该模型应用于抗癌药物的研发提供实验依据。
1 材料和方法
1.1实验动物
野生型AB品系斑马鱼,源于自然成对交配繁殖,由杭州环特生物科技股份有限公司养鱼中心[SYXK(浙)2012-0171]繁殖提供。年龄为受精后2 d(2 dpf),每实验组为30尾。实验用斑马鱼饲养于28℃水温的专门水族箱,饲养用水的水质为:每1 L反渗透水中加入200 mg速溶海盐,电导率为480~510 μS/cm,pH为6.9~7.2,硬度为53.7~71.6 mg/L CaCO3。饲养管理符合国际AAALAC认证的要求。
1.2主要试剂与仪器
解剖显微镜(SMZ645,Nikon公司);6孔板(Nest Biotech);精密电子天平(CP214,奥豪斯);显微注射仪(IM-300,Narishige,Japan);拉针仪(PC-10,Narishige);电动聚焦连续变倍荧光显微镜(AZ100,Nikon公司);恩度由山东先声麦得津生物制药有限公司生产,批号为201505012;紫杉醇由阿拉丁试剂(上海)有限公司生产,批号为45076;阿霉素由阿拉丁试剂(上海)有限公司生产,批号为25316-40-9;贝伐单抗由罗氏公司公司生产,批号为H0126805;顺铂由阿拉丁试剂(上海)有限公司生产,批号为k1520124。
1.3实验方法
1.3.1 细胞培养及标记
人肺癌A549细胞株、胃癌SGC-7901细胞株和肝癌HepG2细胞株均从美国ATCC购买,均使用含10%胎牛血清的DMEM完全培养基,在37℃恒温培养箱中培养,CO2浓度为5%。肿瘤细胞培养至对数生长期,用胰酶消化收集细胞,使用CM-Dil进行标记。
1.3.2 斑马鱼肿瘤异种移植模型的建立
将标记好的细胞进行细胞计数,调整浓度为3 × 107个细胞/mL,使用显微注射仪将细胞注射至2 dpf斑马鱼卵黄囊内,注射体积10 nL,每尾斑马鱼约注射300个细胞。注射细胞后的斑马鱼放置35℃恒温生化培养箱培养,24 h后在荧光显微镜下筛选荧光量一致的斑马鱼,按实验设计进行分组,每组30尾斑马鱼。
1.3.3 药物处理
根据临床用药相对应的方式,临床口服药物对应斑马鱼水溶给药,临床静脉注射药物对应斑马鱼静脉注射给药。通过浓度摸索实验,得到各抗癌药物在斑马鱼上的最大耐受剂量(maximum tolerated dose,MTD)或浓度(maximum tolerated concentration,MTC)。在体内药敏试验中,各药物均选择3个剂量或浓度进行实验,分别为MTD/4、MTD/2和MTD,MTC/4、MTC/2和MTC。
抗非小细胞肺癌A549细胞药敏试验组别和剂量设置见表1。抗胃癌SGC-7901细胞药敏试验组别和剂量设置见表2。抗肝癌HepG2细胞药敏试验组别和剂量设置见表3。
移植肿瘤的斑马鱼,不加任何药物处理的为模型对照组。
1.3.4 荧光拍照及数据采集
抗癌药物处理至5 dpf时,每个实验组随机选择10尾斑马鱼在荧光显微镜下进行观察、拍照并保存图片。利用尼康NIS-Elements D 3.10高级图像处理软件进行图像分析,计算癌细胞相对荧光强度总和(S),定量评价各抗癌药物对斑马鱼体内肿瘤生长的抑制作用。肿瘤抑制作用计算公式如下:
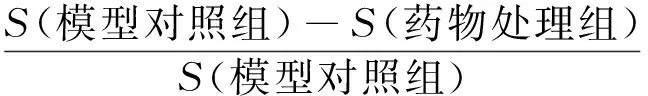
1.4统计学方法
统计学分析采用方差分析和Dunnett’st检验,与模型对照组相比较P< 0.05为差异有显著性。

表1 抗非小细胞肺癌A549细胞药敏试验组别和剂量(ng每尾斑马鱼)
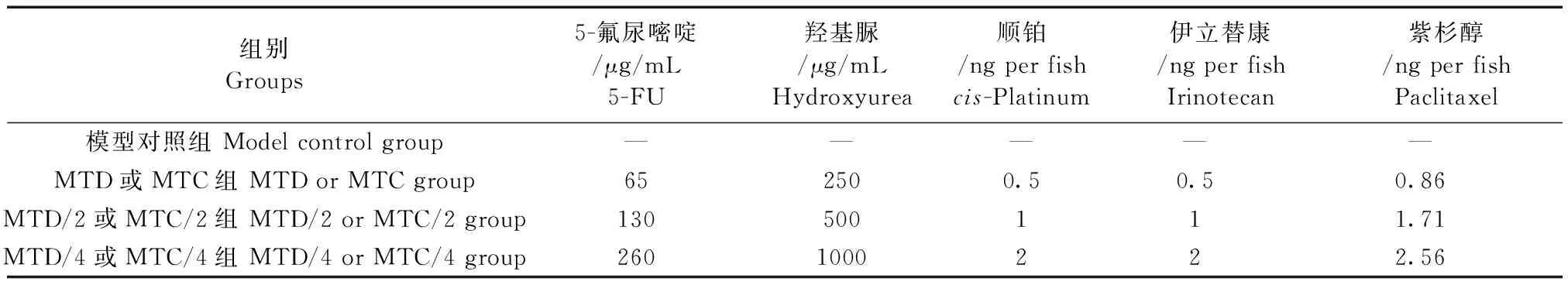
表2 抗胃癌SGC-7901细胞药敏试验组别和剂量

表3 抗肝癌HepG2细胞药敏试验组别和剂量
2 结果
2.1抗非小细胞肺癌A549细胞的药敏
抗非小细胞肺癌A549细胞药敏试验结果如表4和图1所示。其中,抗肺癌A549细胞药敏试验中,贝伐单抗在剂量为每尾斑马鱼100、200和400 ng时,肿瘤生长抑制率分别为4%、57%和65%,与模型对照组比较分别为P> 0.5,P< 0.001和P< 0.001,当贝伐单抗在剂量为每尾斑马鱼200和400 ng时对肺癌A549细胞有显著的抑制作用。顺铂在剂量为每尾斑马鱼0.5、1和2 ng时,肿瘤生长抑制率分别为34%、35%和55%,与模型对照组比较,均对肺癌A549细胞有显著的抑制作用。恩度在剂量为每尾斑马鱼20、40和80 ng时,肿瘤生长抑制率分别为11%、12%和39%,与模型对照组比较,当在剂量为每尾斑马鱼80 ng时对肺癌A549细胞有显著的抑制作用。紫杉醇在剂量为每尾斑马鱼0.86、1.71和2.56 ng时,肿瘤生长抑制率分别为24%、25%和27%,与模型对照组比较,均对肺癌A549细胞有显著的抑制作用。长春瑞滨在剂量为每尾斑马鱼0.125、0.25和0.5 ng时,肿瘤生长抑制率分别为28%、40%和40%,与模型对照组比较,均对肺癌A549细胞有显著的抑制作用。可见,抗肺癌A549药效从高到低的药物分别为贝伐单抗(65%)>顺铂(55%)>长春瑞滨(40%)>恩度(39%)>紫杉醇(27%)。
2.2抗胃癌SGC-7901细胞的药敏
抗胃癌SGC-7901细胞药敏试验结果如表5和图2所示。其中,抗胃癌SGC-7901细胞药敏试验中,5-FU在浓度为65、130和260 μg/mL时,肿瘤生长抑制率分别为31%、29%和29%,与模型对照组比较,均对胃癌SGC-7901细胞有显著的抑制作用。羟基脲在浓度为250、500和1000 μg/mL时,肿瘤生长抑制率分别为29%、31%和46%,与模型对照组比较,均对胃癌SGC-7901细胞有显著的抑制作用。顺铂在剂量为每尾斑马鱼0.5、1和2 ng时,肿瘤生长抑制率分别为5%、5%和24%,与模型对照组比较,当顺铂在剂量为每尾斑马鱼2 ng时对胃癌SGC-7901细胞有显著的抑制作用。伊立替康在剂量为每尾斑马鱼0.5、1和2 ng时,肿瘤生长抑制率分别为4%、31%和30%,与模型对照组比较分别为P> 0.5,P< 0.001和P< 0.001,当伊立替康在剂量为每尾斑马鱼1和2 ng时对胃癌SGC-7901细胞有显著的抑制作用。紫杉醇在剂量为每尾斑马鱼0.86、1.71和2.56 ng时,肿瘤生长抑制率分别为3%、25%和26%,与模型对照组比较分别为P> 0.5,P< 0.05和P< 0.05,当紫杉醇在剂量为每尾斑马鱼1.71和2.56 ng时对胃癌SGC-7901细胞有显著的抑制作用。

表4 药物对斑马鱼非小细胞肺癌A549细胞移植模型的肿瘤生长抑制率(n=10)Tab.4 Tumor growth inhibition rates of tested drugs in the zebrafish xenotransplantation model of A549 non-small-cell lung cancer cells
注:与模型对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the model control group,*P< 0.05,**P< 0.01,***P< 0.001.
可见,抗胃癌SGC-7901药效从高到低的药物分别为羟基脲(46%)>5-FU(31%)=伊立替康(31%)>紫杉醇(26%)>顺铂(24%)。
2.3抗肝癌HepG2细胞的药敏
抗肝癌HepG2细胞药敏试验结果如表6和图3所示。其中,抗肝癌HepG2细胞药敏试验中,阿霉素在剂量为每尾斑马鱼0.5、1和2 ng时,肿瘤生长抑制率分别为17%、42%和45%,与模型对照组比较分别为P> 0.5,P< 0.001和P< 0.001,当阿霉素在剂量为每尾斑马鱼1和2 ng时对肝癌HepG2细胞有显著的抑制作用。吉西他滨在剂量为每尾斑马鱼5、10和20 ng时,肿瘤生长抑制率分别为46%、45%和46%,与模型对照组比较,均对肝癌HepG2细胞有显著的抑制作用。羟基脲在浓度为125、250和500 μg/mL时,肿瘤生长抑制率分别为33%、56%和40%,与模型对照组比较,均对肝癌HepG2细胞有显著的抑制作用。顺铂在剂量为每尾斑马鱼0.5、1和2 ng时,肿瘤生长抑制率分别为45%、50%和64%,与模型对照组比较,均对肝癌HepG2细胞有显著的抑制作用。5-FU在浓度为65、130和260 μg/mL时,肿瘤生长抑制率分别为15%、33%和38%,与模型对照组比较分别为P> 0.5,P< 0.01和P< 0.01,当5-FU在浓度为130和260 μg/mL时对肝癌HepG2细胞有显著的抑制作用。可见,抗肝癌HepG2药效从高到低的药物分别为顺铂(64%)>羟基脲(56%)>吉西他滨(46%)>阿霉素(45%)> 5-FU(38%)。

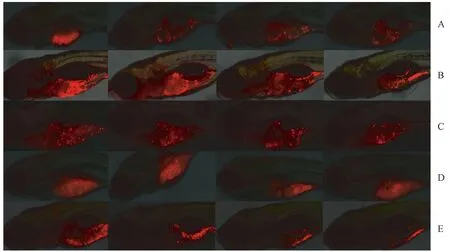
注:图中红色为CM-Dil标记的肿瘤细胞,红色荧光越多,表示肿瘤细胞数量越多。A:贝伐单抗,从左到右分别为模型对照组,每尾斑马鱼100、200、400 ng剂量组;B:顺铂,从左到右分别为模型对照组,每尾斑马鱼0.5、1、2 ng剂量组;C:恩度,从左到右分别为模型对照组,每尾斑马鱼20、40、80 ng剂量组;D:紫杉醇,从左到右分别为模型对照组,每尾斑马鱼0.86、1.71、2.56 ng剂量组;E:长春瑞滨,从左到右分别为模型对照组,每尾斑马鱼0.125、0.25、0.5 ng剂量组。图1 药物对斑马鱼非小细胞肺癌A549细胞移植模型肿瘤生长抑制现象的显微荧光图像Note. Red fluorescence indicates the CM-Dil labeled tumor cells. The more red fluorescence, the more tumor cells. A: Bevacizumab, from left to right: model control group, 100, 200 and 400 ng per fish; B: cis-Platinum, from left to right: model control, 0.5, 1 and 2 ng per fish; C: Endostar, from left to right: model control, 20, 40 and 80 ng per fish; D: Paclitaxel, from left to right: model control, 0.86, 1.71 and 2.56 ng per fish; E: Vinorelbine, from left to right: model control, 0.125, 0.25 and 0.5 ng per fish.Fig.1 Fluorescence microscopic images showing the inhibition of tumor growth induced by different drugs in zebrafish xenotransplantation models of A549 non-small-cell lung cancer cells
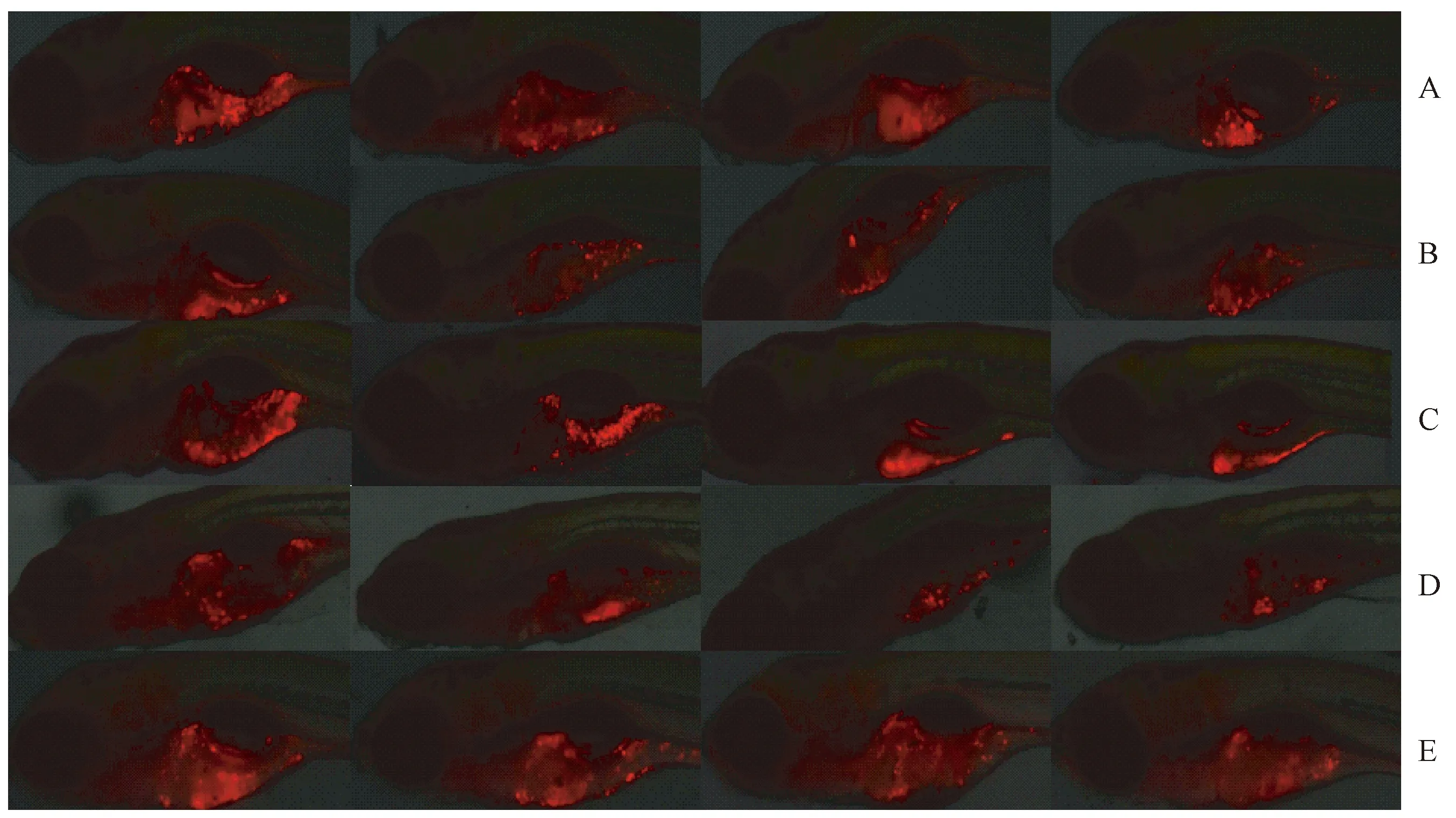
注:图中红色为CM-Dil标记的肿瘤细胞,红色荧光越多,表示肿瘤细胞数量越多。A:5-FU,从左到右分别为模型对照组,65、130、260 μg/mL浓度组(每尾斑马鱼10 nL);B:羟基脲,从左到右分别为模型对照组,250、500、1000 μg/mL浓度组(每尾斑马鱼10 nL);C:顺铂,从左到右分别为模型对照组,每尾斑马鱼0.5、1、2 ng剂量组;D:伊立替康,从左到右分别为模型对照组,每尾斑马鱼0.5、1、2 ng剂量组;E:紫杉醇,从左到右分别为模型对照组,每尾斑马鱼0.86、1.71、2.56 ng剂量组。图2 药物对斑马鱼胃癌SGC-7901细胞移植模型肿瘤生长抑制现象的显微荧光图像Note. Red fluorescence indicates the CM-Dil labeled tumor cells. The more red fluorescence, the more tumor cells. A: 5-FU, from left to right: model control group, 65, 130 and 260 μg/mL (10 nL per fish); B: Hydroxyurea, from left to right: model control, 250, 500 and 1000 μg/mL (10 nL per fish); C: cis-Platinum, from left to right: model control, 0.5, 1 and 2 ng per fish; D: Irinotecan, from left to right: model control, 0.5, 1 and 2 ng per fish; E: Paclitaxel, from left to right: model control, 0.86, 1.71 and 2.56 ng per fish.Fig.2 Fluorescence microscopic image showing the inhibitory effect of drugs on tumor growth in the zebrafish xenotransplantation model of SGC-7901 stomach cancer cells

药物Drugs剂量或浓度Doseorconcentration肿瘤生长抑制率(%)Tumorgrowthinhibitionrates模型对照Modelcontrol—05-氟尿嘧啶5-FU65μg/mL31***130μg/mL29***260μg/mL29***羟基脲Hydroxyurea250μg/mL29**500μg/mL31**1000μg/mL46***顺铂cis-Platinum0.5ngperfish51ngperfish52ngperfish24*伊立替康Irinotecan0.5ngperfish41ngperfish31***2ngperfish30***紫杉醇Paclitaxel0.86ngperfish31.71ngperfish25*2.56ngperfish26*
注:与模型对照组相比,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the model control group,*P< 0.05,**P< 0.01,***P< 0.001.

表6 药物对斑马鱼肝癌HepG2细胞移植模型的肿瘤生长抑制率(n=10)Tab.6 Tumor growth inhibition rates of different drugs in the zebrafish xenotransplantation model of HepG2 liver cancer cells
注:与模型对照组相比,**P< 0.01,***P< 0.001。
Note. Compared with the model control group,**P< 0.01,***P< 0.001.
注:图中红色为CM-Dil标记的肿瘤细胞,红色荧光越多,表示肿瘤细胞数量越多。A:阿霉素,从左到右分别为模型对照组,每尾斑马鱼0.5、1、2.5 ng剂量组;B:吉西他滨,从左到右分别为模型对照组,每尾斑马鱼5、10、20 ng剂量组;C:羟基脲,从左到右分别为模型对照组,125、250、500 μg/mL浓度组(每尾斑马鱼10 nL);D:顺铂,从左到右分别为模型对照组,每尾斑马鱼0.5、1、2 ng剂量组;E:5-FU,从左到右分别为模型对照组,65、130、260 μg/mL浓度组(每尾斑马鱼10 nL)。图3 药物对斑马鱼肝癌HepG2细胞移植模型肿瘤生长抑制现象的显微荧光图像Note. Red fluorescence indicates the CM-Dil labeled tumor cells. The more red fluorescence, the more tumor cells. A: Adriamycin, from left to right: model control group, 0.5, 1 and 2.5 ng per fish; B: Gemcitabine, from left to right: model control, 5, 10 and 20 ng per fish; C: Hydroxyurea, from left to right: model control, 125, 250 and 500 μg/mL (10 nL per fish); D: cis-Platinum, from left to right: model control, 0.5, 1 and 2 ng per fish; E: 5-FU, from left to right: model control, 65, 130 and 260 μg/mL (10 nL per fish).Fig.3 Fluorescence microscopic images showing the inhibition of tumor growth induced by different drugs in the zebrafish xenotransplantation model of the HepG2 liver cancer cells
3 讨论
抗癌药敏感性评价实验包括体外细胞实验和动物体内实验。体外抗癌实验缺乏体内吸收、分布、代谢、排泄等过程,易产生假阳性结果。体内主要以小鼠为实验动物,评价药物的体内抗癌活性[23, 24],然而小鼠作为肿瘤移植的载体,也有其固有的缺陷,如需要免疫抑制品系的特殊小鼠、所需移植的肿瘤细胞数量要求多、实验造模周期长、需要不断的传代以满足实验样本数量的需求、无法对肿瘤进展情况进行成像显示等[25]。斑马鱼肿瘤异种移植模型本身具有极大的优势且克服了小鼠的许多不足之处[26, 27]:斑马鱼与人类基因的同源性高达85%,且许多有关肿瘤的信号通路都与人类相似,并且与人类一样,其自身也能够自发得癌[28];斑马鱼幼鱼阶段适应性免疫功能不全,易于肿瘤异种移植[29];斑马鱼幼鱼个体小,通体透明,能够方便地对体内肿瘤细胞进行显微镜观察和拍照等。
本研究选取三类人群中常见的肿瘤类型作为测试疾病对象,以临床上每类肿瘤对应的常规化疗药物作为测试的药物对象,以斑马鱼肿瘤异种移植模型作为检测的生物模型,目的在于评价斑马鱼肿瘤异种移植模型是否能够准确评价抗癌药物的药敏性。本研究结果证实,在临床上效果显著的抗非小细胞肺癌药物、抗胃癌药物、抗肝癌药物,在斑马鱼肿瘤异种模型上同样能体现出其抑制癌细胞生长的效果,且明显具有剂量依赖效应。本实验结果也表明,在斑马鱼肿瘤异种移植模型中,就抗肿瘤药物对特定肿瘤的治疗效果来看,各类抗肿瘤药物的抗肿瘤效果是有优劣之分的。比如,在本实验研究中发现,顺铂的抗小细胞肺癌和肝癌效果优于其他大多数抗癌药的;而顺铂的抗抗胃癌效果相对于其他抗癌药是比较弱的;又如5-FU在抗胃癌方面是优于其他多数抗癌药的,而在抗肝癌的方面的疗效是弱于其他抗癌药的。
对于理化性质和作用机制各异的抗癌药物,本实验根据临床上的服用方式,相应地给予斑马鱼口服(水溶)给药或者静脉注射给药。结果证实,这些药物在斑马鱼体内不仅都体现出了良好的抗肿瘤效果,而且结果与临床用药基本一致。这提示我们,斑马鱼肿瘤异种移植模型是一类可靠的、灵敏的、能够在体内测定药物抗癌效用的动物模型。基于斑马鱼自身的物理特性优势及对抗肿瘤药物的药敏性,斑马鱼肿瘤异种移植模型是一类非常有应用前景的抗肿瘤动物模型,我们预测未来该模型将会在抗肿瘤药物的新药研发、老药再评价、药物联用组方筛选、耐药测试乃至人源的肿瘤移植-精准医疗中获得更加广泛的应用。
[1] 吴慧, 高柳滨. 全球抗肿瘤药物研发报告(2015) [J]. 药学进展, 2015, 34(3): 227-234.
[2] He JH, Gao JM, Huang CJ, et al. Zebrafish models for assessing developmental and reproductive toxicity [J]. Neurotoxicol Teratol, 2014, 42: 35-42.
[3] Chen JB, Gao HW, Zhang YL, et al. Developmental toxicity of diclofenac and elucidation of gene regulation in zebrafish (Danio rerio) [J]. Sci Rep, 2014, 4: 4841.
[4] 许冰洁, 张立将, 李春启, 等. 斑马鱼胚胎评价5种药物的发育毒性与模型验证 [J]. 中国药理学通报, 2016, 32(1): 74-79.
[5] 陈汝家, 朱俊靖, 周盛梅, 等. 斑马鱼模型在药物毒性与安全性评价中的应用 [J]. 毒理学杂志, 2012, 26(3): 224-228.
[6] 兰小红, 朱晓宇, 张勇, 等. 以斑马鱼模型评价6种药物的神经毒性 [J]. 实验动物科学, 2016, 33(5): 28-32.
[7] 郭胜亚, 朱晓宇, 廖文瀚, 等. 斑马鱼模型评价5种中药肝脏毒性 [J]. 实验动物科学, 2016, 33(5): 21-27.
[8] 梁锦锋, 朱勇, 张洪瑶, 等. 斑马鱼模型在药物研发早期肾脏毒性中的应用研究 [J]. 中国比较医学杂志, 2016, 26(9): 30-35.
[9] Zhu JJ, Xu YQ, He JH, et al. Human cardiotoxic drugs delivered by soaking and microinjection induce cardiovascular toxicity in zebrafish [J]. J Appl Toxicol, 2014, 34(2): 139-148.
[10] Xu H, Dong X, Zhang Z, et al. Assessment of immunotoxicity of dibutyl phthalate using live zebrafish embryos [J]. Fish Shellfish Immunol, 2015, 45(2): 286-292.
[11] 张洪瑶, 贾飞, 钱璟, 等. 以斑马鱼为模型评价酒石酸长春瑞滨注射用乳剂与水针剂的毒性 [J]. 中国新药杂志, 2016, 25(24): 2773-2779.
[12] 郭殿武, 周娟, 唐礼可, 等. 斑马鱼高血脂模型在山青之片质量控制中的应用研究 [J]. 中国药品标准, 2013, 14(4): 255-259.
[13] Zhou J, Xu YQ, Guo SY, et al. Rapid analysis of hypolipidemic drugs in a live zebrafish assay [J]. J Pharmacol Toxicol Methods, 2015, 72: 47-52.
[14] Zhou J, Guo SY, Zhang Y, et al. Human prokinetic drugs promote gastrointestinal motility in zebrafish [J]. Neurogastroenterol Motil, 2014, 26(4): 589-595.
[15] 张勇, 朱晓宇, 郭胜亚, 等. 苯肼诱发建立斑马鱼血栓模型的方法 [J]. 实验动物与比较医学, 2015, 35(1): 27-31.
[16] Zhu XY, Liu HC, Guo SY, et al. A zebrafish thrombosis model for assessing antithrombotic drugs [J]. Zebrafish, 2016, 13(4): 335-344.
[17] 李晓稳, 佟玲, 李东翔, 等. 斑马鱼神经元损伤模型在养血清脑颗粒质量控制中的应用分析 [J]. 中国实验方剂学杂志, 2016, 22(9): 1-4.
[18] 朱晓宇, 刘洪翠, 俞航萍, 等. 神香苏合丸防治心血管疾病的实验研究 [J]. 浙江理工大学学报, 2016, 35(4): 630-635.
[19] Yang R, Lao QC, Yu HP, et al. Tween-80 and impurity induce anaphylactoid reaction in zebrafish [J]. J Appl Toxicol, 2015, 35(3): 295-301.
[20] Lee LM, Seftor EA, Bonde G, et al. The fate of human malignant melanoma cells transplanted into zebrafish embryos: assessment of migration and cell division in the absence of tumor formation [J]. Dev Dyn, 2005, 233(4): 1560-1570.
[21] 黄志军, 兰小红, 赵刚, 等. 小金胶囊对斑马鱼移植瘤的抗肿瘤作用 [J]. 中成药, 2016, 38(9): 1902-1906.
[22] Zhu XY, Xia B, Liu HC, et al. Closantel suppresses angiogenesis and cancer growth in zebrafish models [J]. Assay Drug Dev Technol, 2016, 14(5): 282-290.
[23] Sharpless NE, Depinho RA. The mighty mouse: genetically engineered mouse models in cancer drug development [J]. Nat Rev Drug Discov, 2006, 5(9): 741-754.
[24] Cariati M, Marlow R, Dontu G. Xenotransplantation of breast cancers [J]. Methods Mol Biol, 2011, 731: 471-482.
[25] Wertman J, Veinotte CJ, Dellaire G, et al. The zebrafish xenograft platform: evolution of a novel cancer model and preclinical screening tool [J]. Adv Exp Med Biol, 2016, 916: 289-314.
[26] Zhang B, Xuan C, Ji Y, et al. Zebrafish xenotransplantation as a tool forinvivocancer study [J]. Fam Cancer, 2015, 14(3): 487-493.
[27] Schartl M. Beyond the zebrafish: diverse fish species for modeling human disease [J]. Dis Model Mech, 2014, 7(2): 181-192.
[28] Stern HM, Zon LI. Cancer genetics and drug discovery in the zebrafish [J]. Nat Rev Cancer, 2003, 3(7): 533-539.
[29] Veinotte CJ, Dellaire G, Berman JN. Hooking the big one: the potential of zebrafish xenotransplantation to reform cancer drug screening in the genomic era [J]. Dis Model Mech, 2014, 7(7): 745-754.
Applicationsofzebrafishxenotransplantationmodelsforinvivoevaluationofanticancerdrugsensitivitytest
LAO Qiao-cong1,2, XU Yi-qiao1, JIN Fan-mao1, CHEN Jia-sheng1, TANG Min-jia1, XU Lei1, ZHU Xiao-yu1,2, Zheng Gao-li3, Xuan Yao-xian3, LI Chun-qi1,2 *
(1.Hangzhou Hunter Biotechnology, Inc, Hangzhou 310012, China; 2.Early Evaluation Base of Zhejiang Key Laboratory of Safety Evaluation Technology for Human-Used Items, Hangzhou 310012; 3.Center of Safety Evaluation, Zhejiang Academy of Medical Sciences, Hangzhou 310013)
ObjectiveTo evaluate the sensitivity to 5 clinically commonly used anticancer drugsinvivousing the zebrafish xenotransplantation models of human lung cancer, stomach cancer, and liver cancer cells, respectively.MethodsZebrafish xenotransplantation models of A549 lung cancer cells, SGC-7901 stomach cancer cells and HepG2 liver cancer cells were established. The xenograft models of A549 cells were treated with three different doses ofcis-platinum, paclitaxel, vinorelbine, endostar and bevacizumab, respectively. The SGC-7901 model was treated with three concentrations or doses of paclitaxel, irinotecan, hydroxyurea,cis-platinum and 5-fluorouracil, respectively. And the HepG2 model was treated with three concentrations or doses of adriamycin, gemcitabine, hydroxyurea,cis-platinum and 5-fluorouracil. The tumors were analyzed and quantifiedinvivoby fluorescence microscopy, and the inhibition rates of tumor growth with each drug were calculated and compared with the model control group for statistical significance.ResultsAll of the tested anticancer drugs showed inhibitory effect on tumor cells in the zebrafish xenograft models with statistical significance in a dose-dependent manner. During the drug sensitivity test, the inhibition rate of bevacizumab on A549 lung cancer cells decreased in the order (65%) >cis-platinum (55%) > vinorelbine (40%) > endostar (39%) > paclitaxel (27%). As for the SGC-7901 stomach cancer cells, the tumor growth inhibition rate decreased in the order hydroxyurea (46%) > 5-FU (31%)=irinotecan (31%) > paclitaxel (26%) >cis-platinum (24%). And the therapeutic effect ofcis-platinum on the HepG2 liver cancer cells decreased in the order (64%) > hydroxyurea (56%) > gemcitabine (46%) > adriamycin (45%) > 5-FU (38%).ConclusionsZebrafish xenotransplantation models of cancer cells are suitable forinvivosensitivity test of anticancer drugs.
Zebrafish; Tumor xenotransplantation; Anticancer drugs;invivodrug sensitivity test; Pharmacodynamics
浙江省科技重大专项(编号:2014C03009)。
劳乔聪(1983 -),男,硕士,研究方向:药理毒理学研究。E-mail: lqc@zhunter.com
李春启(1963 -),男,博士,教授,研究方向:药理毒理学研究。E-mail: jackli@zhunter.com
R-33
A
1671-7856(2017) 11-0024-08
10.3969.j.issn.1671-7856. 2017.11.006
2017-03-27
