高效液相色谱法测定金丝桃属两种药用植物中金丝桃苷的含量※
2017-11-28胡蕊艳王晓桐孟令锴
胡蕊艳 王晓桐 李 洁 孟令锴
高效液相色谱法测定金丝桃属两种药用植物中金丝桃苷的含量※
胡蕊艳1王晓桐1李 洁2孟令锴3
目的建立测定两种金丝桃属药用植物乌腺金丝桃、长柱金丝桃中金丝桃苷的高效液相色谱分析方法。方法采用高效液相色谱法,色谱柱为ZorbaxSB-C18柱,流动相为甲醇:乙腈:0.025 mol/L磷酸(10:20:70),流速1.0 ml/min,检测波长 358 nm,柱温 30 ℃。结果金丝桃苷在 0.0062~0.0622 mg范围内,进样量与色谱峰面积呈良好线性关系(r=0.9991);平均回收率为96.41%,RSD=1.27%。结论该法操作简便、准确、稳定性及重复性好,可用于对长柱金丝桃和乌腺金丝桃中金丝桃苷的含量测定。
长柱金丝桃;乌腺金丝桃;金丝桃苷;高效液相色谱法;含量测定
金丝桃属(Hypericum.L.)植物全世界约有400余种,我国有55种,8亚种。黑龙江省分布的金丝桃属植物有两种,分别为乌腺金丝桃(H.attenuatumChoisy.)和长柱金丝桃(Hypericum.ascyron L.)。近年来,研究表明该属植物的一些种类含有黄酮类、双蒽酮衍生物等化合物,具有抗病毒、抗抑郁的活性[1-2],其含有的金丝桃素对禽流感病毒(H9亚型)有抑制作用,目前已得到医药界的广泛关注[3]。该属植物含有的黄酮醇、黄烷醇类化合物,尤其金丝桃苷也是该属植物的主要活性成分之一。本实验采用高效液相色谱法(HPLC)对黑龙江省野生金丝桃属长柱金丝桃、乌腺金丝桃药材中金丝桃苷成分进行含量测定并比较分析,为合理开发黑龙江省金丝桃属药用资源提供参考依据。
1 仪器与试药
1.1 仪器高效液相色谱仪(Agilent1100);超声波清洗器(TCQ-250);紫外-可见分光光度计(UV7501);电子天平(BP211D)。
1.2 试药金丝桃苷对照品(购于中国药品生物制品检定所,批号:111521-200305);乙腈、甲醇为色谱纯,实验用水为自制双蒸水,其余实验试剂为分析纯。乌腺金丝桃、长柱金丝桃采收于2016年4—10月,采收地及采收期见表 1,经牡丹江医学院药学院吴兆华教授鉴定。
2 方法与结果
2.1 对最大吸收波长的选择取实验用金丝桃苷对照品溶液进行光谱扫描,实验表明对照品溶液在358 nm波长处有最大吸收,分离效果良好,干扰少,因此,选择检测波长为358 nm。

表1 实验样品的采收地及采收期
2.2 流动相的选择试用多种溶剂系统,最终确定以甲醇:乙腈:0.025 mol/L磷酸(10:20:70)为流动相时金丝桃苷分离效果好,保留时间适宜。
2.3 色谱条件色谱柱:Zorbax SB-C18柱(5 μm,250 mm×4.6 mm),流动相:甲醇:乙腈:0.025 mol/L磷酸(10:20:70),流速1.0 ml/min,检测波长为363 nm,柱温:30 ℃。在此条件下,金丝桃苷能与其他成分很好分开,金丝桃苷的保留时间为5.5 min。色谱图见1-3。

图1 对照品高效液相色谱图(1为金丝桃苷)
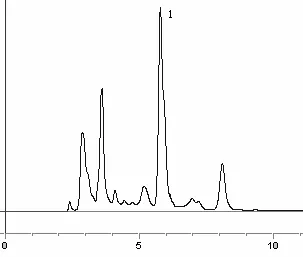
图2 乌腺金丝桃样品高效液相色谱图(1为金丝桃苷)
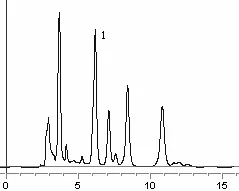
图3 长柱金丝桃样品高效液相色谱图(1为金丝桃苷)
2.4 实验药材中金丝桃苷的提取方法选择取乌腺金丝桃花期药材4份,每份约0.5 g。分别采用甲醇、乙醇两种溶剂,采用超声提取法进行试验比较,确定提取方法。结果见表2。

表2 提取方法对比结果
2.5 金丝桃苷的HPLC测定
2.5.1 对照品溶液的制备精密称取金丝桃苷对照品适量,加甲醇溶解于10 ml容量瓶中,制成0.0622 mg/ml的对照品储备液。
2.5.2 标准曲线的绘制精密吸取上述储备液1.0、2.5、5.0、6.0、7.5、10.0 ml于10 ml量瓶中,加甲醇稀释,进样,按2.3项下色谱条件测定,以对照品浓度(mg/ml)为横坐标,峰面积值为纵坐标,绘制标准曲线。得回归方程:Y=228 38x+66.812,r=0.9991,表明金丝桃苷在0.0062~0.0622 mg范围内线性关系良好。
2.5.3 方法学考察
2.5.3.1 精密度实验精密吸取对照品储备液10 μl,进样6次,金丝桃苷峰面积RSD=0.54%。结果见表3。

表3 精密度实验结果
2.5.3.2 稳定性实验取对照品溶液(0.0497 mg/ml)10 μl,分别于0、1、2、4、8 h各进样1次,测得金丝桃苷峰面积值RSD=0.94%,表明对照品溶液在8 h内稳定。结果见表4。
2.5.3.3 重现性实验取同时期乌腺金丝桃样品平行5份(0.4970 g、0.4959 g、0.4975 g、0.4911 g、0.4991 g),照样品测定方法测定,结果药材含量分别为0.8491%、0.8457%、0.8501%、0.8910%、0.8540%。RSD=2.18%。结果见表5。

表4 稳定性实验结果
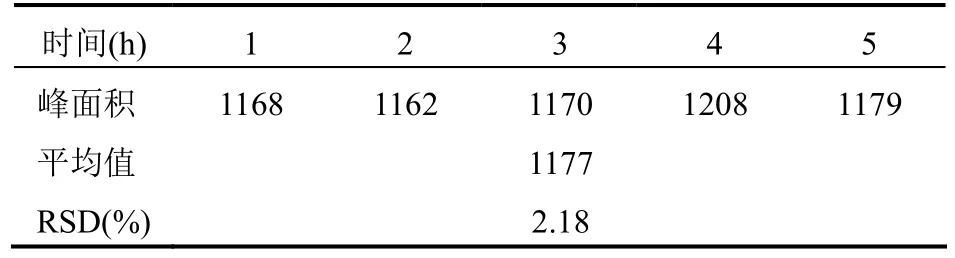
表5 重现性实验结果
2.5.3.4 加样回收率实验精密称取乌腺金丝桃药材(含量已测知),分别精密加入金丝桃苷对照品溶液,按照2.5.4项下样品制备与测定方法,进行平行实验 6组。得到金丝桃苷回收率为 96.41%,RSD=1.27%。结果见表6。

表6 金丝桃苷回收率测定结果
2.5.4 药材含量测定取药材0.5 g,置于量瓶中,加甲醇适量,超声处理30 min后,放冷,稀释至刻度,摇均,过滤,弃去初滤液,取续滤液经微孔滤膜(0.45 μm)滤过,即得供试品溶液。精密吸取供试品溶液10 μl,注入色谱仪,记录峰面积,计算含量。测定结果见表7。
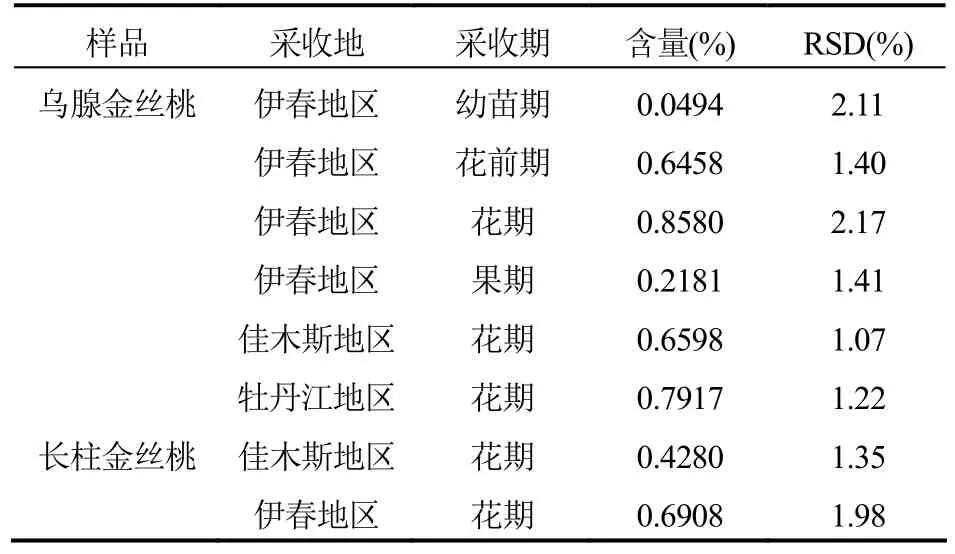
表7 不同产地、不同采收期药材中的金丝桃苷含量(n=6)
3 讨论
本实验样品分别在甲醇、乙醇中分别超声提取30 min、60 min,含量测定结果表明,甲醇超声提取60 min时金丝桃苷含量最高,与其他提取条件下金丝桃苷含量相差不大,金丝桃苷可在30 min内较好地溶解,且发现甲醇为溶剂的供试品溶液峰形较好,重现性高,故实验采用甲醇为提取溶剂,超声30 min提取;黄酮苷类成分在高效液相测定时易拖尾,流动相加入酸时可抑制拖尾[4]。曾选用流动相为甲醇:0.025 mol/L磷酸(70:30)、甲醇:0.025 mol/L磷酸(50:50)、甲醇:0.025 mol/L磷酸(40:60),峰形对称性不好,峰较宽,分离度低,而后经过反复实验发现,加入一定量的乙腈后,有了改善峰形,提高了分离度,最终确定流动相为甲醇:乙腈:0.025 mol/L磷酸(10:20:70),经多次、多批样品的测定,系统具有良好的重现性和稳定性。
在本实验过程中同时进行了长柱金丝桃的实验方法考察,因其方法与乌腺金丝桃一致,故只在文中表述了一种,在此条件下可以提取完全,对其他共存成分无影响。根据文献报道,长柱金丝桃中金丝桃苷含量最高的时期为花期[5],因而选取花期为特征性指标进行含量测定。
4 结论
通过对不同采收地的长柱金丝桃、乌腺金丝桃样品中金丝桃苷的含量测定结果表明:伊春地区乌腺金丝桃样品中金丝桃苷的含量高于牡丹江地区、高于佳木斯地区。伊春地区长柱金丝桃样品中金丝桃苷的含量高于佳木斯地区。由此可以初步推断,野生金丝桃属植物生长环境的不同,其金丝桃苷的含量存在一定的差异。因此,在人工栽培金丝桃属植物时应考虑其生长环境如温度、土壤等因素,选择适合的栽培区域。同时,通过对不同采收时期的乌腺金丝桃样品中金丝桃苷含量测定,表明花期乌腺金丝桃样品中金丝桃苷的含量高于花前期、高于果期、高于幼苗期,由此可以建议乌腺金丝桃的最佳采收期为花期。
[1] 宋馨,祝建,吕洪飞.金丝桃属植物研究进展[J].西北植物学报,2005,25(4):844-849.
[2] Linfang Huang,Shilin Chen.Hypericin in hypericum: chemistry,botanical sources and biological activities[J].Journal of Chinese Pharmaceutical Sciences,2012,21(5):388-400.
[3] 韦兰萍,陈建新,何子华,等.金丝桃素体外抗H9N2亚型禽流感病毒活性研究[J].动物医学研究进展,2010,31(12):68-72.
[4] 黄琪,贾鹏晖,肖曦晨,等.HPLC 法分析比较亳州知母须根和主根中芒果苷和知母皂苷B-Ⅱ的含量[J].中医药临床杂志,2016,28(12):1773-1776.
[5] 毛晶磊,王文凯.不同采收期及药用部位的长柱金丝桃中有效成分的含量变化[J].中南药学,2012,10(8):594-597.
10.12010/j.issn.1673-5846.2017.11.008
1牡丹江医学院药学院2013级,黑龙江牡丹江 157011
2牡丹江医学院附属红旗医院血液科,黑龙江牡丹江 157011
3牡丹江医学院天然药物化学与生药学教研室,黑龙江牡丹江 157011
黑龙江省黑龙江省大学生创新创业训练计划项目(编号:201610229052);牡丹江医学院大学生科研项目(编号:201641)
作者简历:胡蕊艳(1994-),本科学历。E-mail:1442874067@qq.com
孟令锴(1980-),硕士学位,讲师。主要研究方向为生药鉴定及品质评价。E-mail:mlk720@163.com
