反射式共聚焦激光扫描显微镜检测毛囊蠕形螨感染的临床应用
2017-11-28于维恒孙文启丁惠玲
陈 蕾 高 峰 于维恒 孙文启 丁惠玲
·论著·
反射式共聚焦激光扫描显微镜检测毛囊蠕形螨感染的临床应用
陈 蕾 高 峰 于维恒 孙文启 丁惠玲
目的探讨反射式共聚焦激光扫描显微镜(RCM)在毛囊蠕形螨检测中的临床应用。方法对临床52例酒渣鼻患者采用挤压法、标准化皮肤表层取材法(SSSB)及RCM进行毛囊蠕形螨检测,并对其阳性率、高螨密度检出率(蠕形螨≥5个/cm2)及单位面积内毛囊蠕形螨平均密度进行对比分析。结果挤压法、标准化皮肤表层取材法(SSSB)及RCM法的阳性率分别为69.23%、78.85%、100%。单位面积内毛囊蠕形螨平均密度分别为8.21±6.45、16.22±13.12、410.8±203.2。结论RCM法在毛囊蠕形螨检测中是一种更为敏感、准确、简便的方法。
反射式共聚焦激光扫描显微镜; 标准化皮肤表层取材法; 挤压法; 毛囊蠕形螨
酒渣鼻(玫瑰痤疮)是一种慢性炎症性皮肤病,其特征性表现为面中部为主的一过性或持久性红斑、毛细血管扩张、可有丘疹或脓疱,严重者可以出现鼻赘或眼部损害。毛囊蠕形螨的大量繁殖是酒渣鼻发病的一个重要因素[1]。临床用于检测毛囊蠕形螨的方法主要是显微镜下镜检,取材方法包括透明胶带法、挤压法及标准化皮肤表层取材法(standardized skin surface biopsy,SSSB),有研究表明SSSB法在高螨密度检出率上优于挤压法[2]。反射式共聚焦激光扫描显微镜(Reflectance confocal microscopy,RCM)是一种实时、动态、无创性皮肤检测设备,目前已广泛用于皮肤肿瘤[3-5]和色素性皮肤疾病[6,7]诊疗,显示出较高临床应用价值。Sattler等发现可将FCM用于毛囊蠕形螨的检测和计数[8],但未与前述几种方法进行对照研究。为更好地探讨RCM在毛囊蠕形螨检测中的临床应用及意义,我们开展了本项研究。
1 研究对象
2015年6月至2016年12月来我科就诊的52例酒渣鼻患者,男28例,女24例;面部皮肤正常成年人50名,男25名,女25名。本研究经医院伦理委员会批准,均经患者知情同意。所有患者符合美国国家酒渣鼻协会专委会的标准[9],均有对称性面颊红斑、丘疹,且1月内未经任何系统和局部治疗。排除标准:寻常痤疮、脂溢性皮炎、糖皮质激素依赖性皮炎、红斑狼疮;待检皮损区有皮肤破损者;妊娠、哺乳者。
2 实验方法
2.1 取材 选取面颊部红斑相对严重部位。①RCM法[2]:仪器设备为VivaScope 1500(VivaScope 1500,Lucid Inc,Rochester,NY,USA),清洁待检区域皮肤,矿物油做介质,将皮损置于贴片中央位置,由浅至深进行扫描,在观察到毛囊蠕形螨的深度利用Vivablock进行平扫,对1 cm2区域内毛囊蠕形螨进行计数;②在同一区域进行SSSB法检测[10]:在显微镜载玻片上用防水笔画出1 cm2的标准区域,内滴1滴Dron alpha AA超能胶(珠海有限公司),然后粘在待检皮损上,待胶水干后(大约1 min)取下,在所取的样品上滴加1~2滴浸润油使样品透明化,盖上盖玻片;③挤压法[11]:在类似皮疹区域标记1 cm2区域,在该区域使用挤压环轻轻挤压后再用刀片刮取皮肤表面皮屑及皮脂,涂于载玻片上,滴加1~2滴浸润油,加盖盖玻片。
2.2 镜检及计数 直接于光镜下计数SSSB法及挤压法所获毛囊蠕形螨数量(个数/cm2),发现成虫或虫卵记为阳性,≥5个/cm2为高螨密度。RCM法可直接于所获图像上进行计数。同时,对50名年龄、性别与实验组无统计学差异的正常人用RCM法进行面部毛囊蠕形螨的检测。待检区域统一选择右侧面颊部1 cm2区域。分别对10 mm2面积内毛囊蠕形螨平均密度、单个受累毛囊内蠕形螨数量进行统计计数,并与实验组进行对照。
2.3 统计学方法 所有统计数据均应用SPSS 17.0软件进行分析,三种方法毛囊蠕形螨阳性率和高螨密度检出率比较采用配对χ2检验;毛囊蠕形螨数量比较采用配对t检验,P≤0.05为有统计学意义。
3 结果
本研究实验组涉及酒渣鼻患者52例(男28,女24),对照组为面部正常皮肤人群50名(男25,女25),患者组平均年龄为(40.5±11.6)岁,对照组为(40.7±10.5)岁,两组在年龄与性别上均无统计学差异。挤压法光镜下毛囊蠕形螨体细长呈蠕虫状,乳白色,半透明,颚体宽,肢细,足粗短(图1);SSSB法镜下毛囊蠕形螨表现为毛囊内单个或簇集的透明、纺锤形结构(图2);RCM下毛囊蠕形螨纵切面为蠕虫状,头部闪亮,体部暗(图3a),当RCM平面垂直毛囊时,毛囊蠕形螨表现为膨大的毛囊内簇集的、闪亮的、圆形或锥形灰色结构,周围有透明环,直径大约4~8 μm(图3b)。据我们观察,在距表皮10~90 μm的深度扫描均能获得较为满意的不同深度毛囊蠕形螨图像。单个毛囊内毛囊虫数量最多可达10条(图3c)。
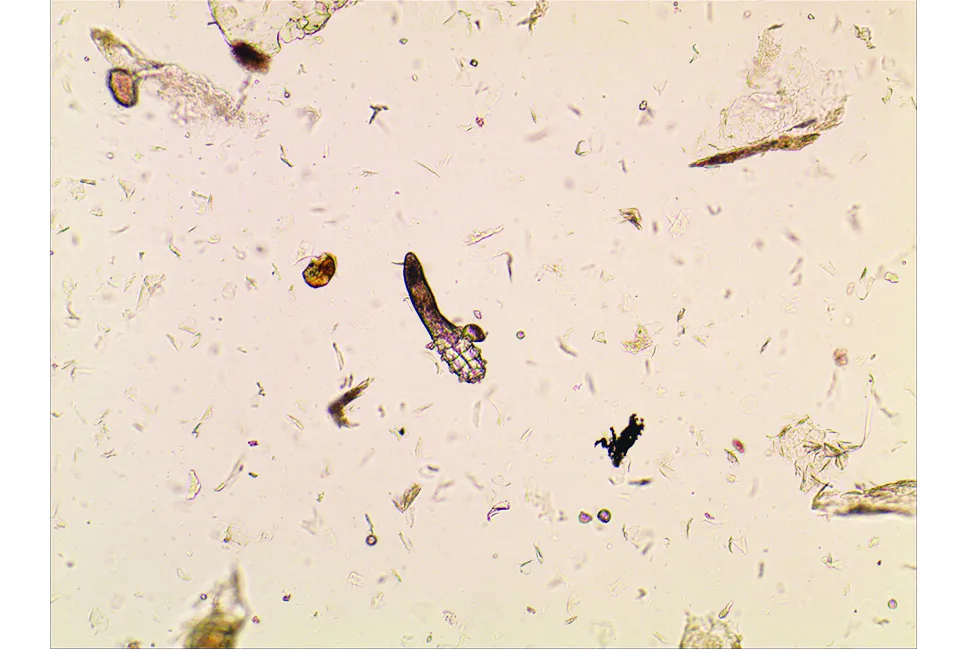
图1 挤压法光镜下毛囊蠕形螨体细长呈蠕虫状,乳白色,半透明,颚体宽,肢细,足粗短
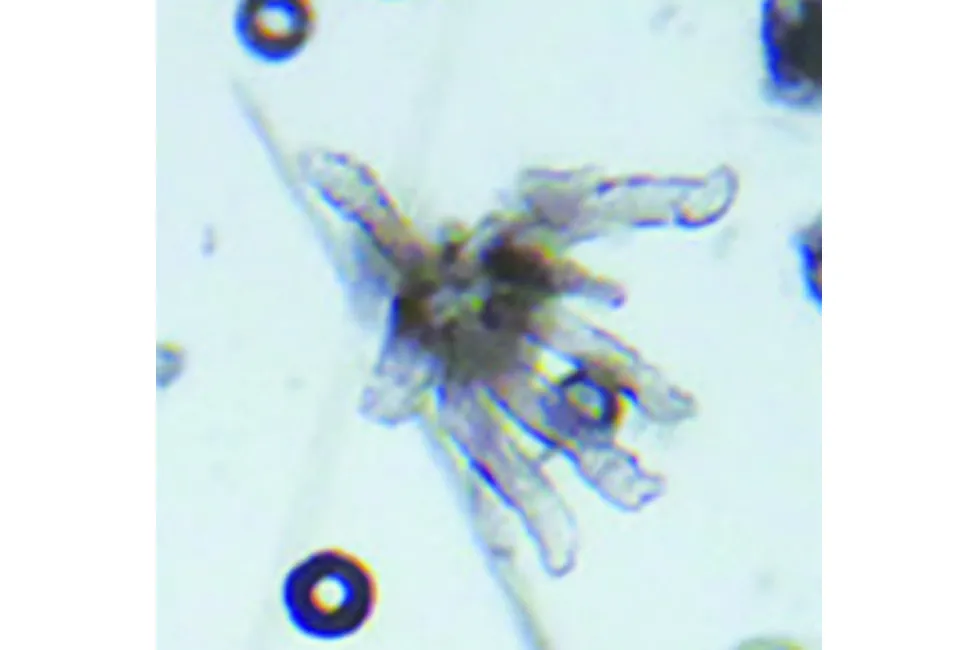
图2 SSSB法镜下毛囊蠕形螨表现为毛囊内单个或簇集的透明、纺锤形结构
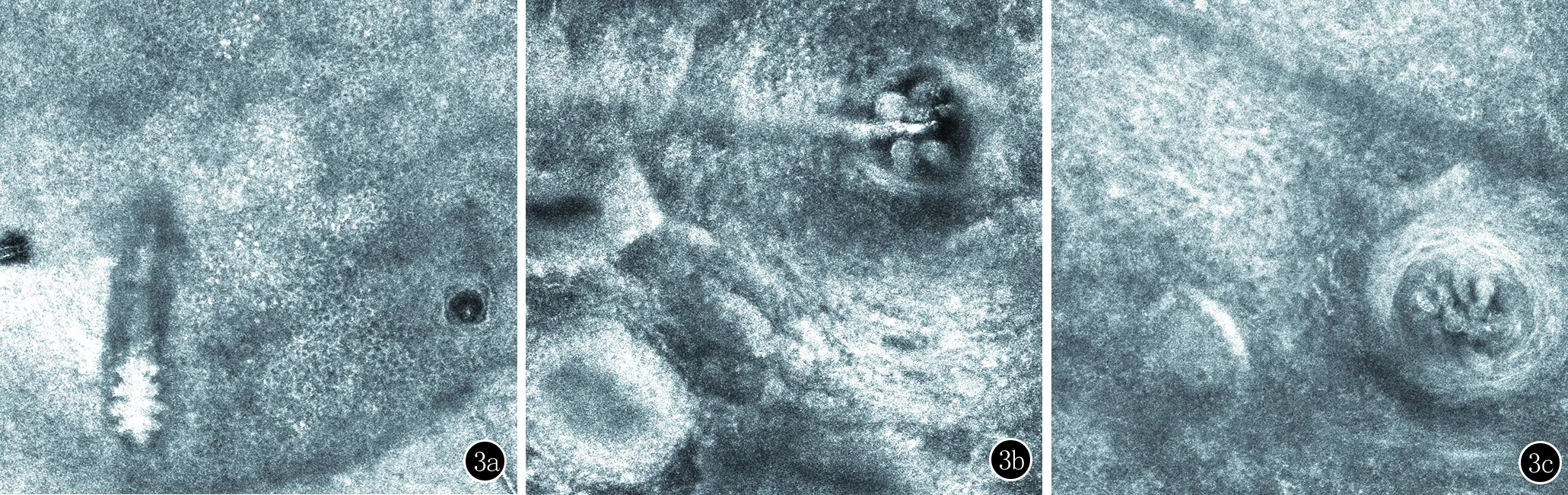
3a:RCM下毛囊蠕形螨纵切面为蠕虫状,头部闪亮,体部暗;3b:RCM下毛囊蠕形螨横切面表现为膨大的毛囊内簇集的、闪亮的、圆形或锥形灰色结构,周围有透明环,直径大约4~8 μm;3c:单个毛囊内毛囊虫数量最多可达10条
图3 RCM下不同切面毛囊蠕形螨图像
分别用三种方法对52例酒渣鼻患者进行毛囊蠕形螨检测,RCM法阳性52例(100%),SSSB法阳性41例(78.85%),挤压法阳性36例(69.23%),三种方法阳性率有统计学差异(Plt;0.05)。RCM法的高螨密度检出率为100%(52例),SSSB法76.92%(40例),挤压法55.77%(29例),三种方法两两比较均有统计学差异(Plt;0.001)。RCM法检测的单位面积内毛囊蠕形螨平均密度为410.8±203.2,SSSB法16.22±13.12,挤压法8.21±6.45,三种方法两两比较均有统计学差异(Plt;0.001)。
同时,本实验将50名面部正常皮肤人群作为对照组,用FCM法进行了毛囊蠕形螨检测。结果发现,10 mm2面积内实验组蠕形螨均数为41.1±20.3,对照组为5.12±5.40(Plt;0.001);实验组单个受累毛囊内蠕形螨平均数量3.85±0.62,对照组0.79±0.82(Plt;0.001)。实验组单个受累毛囊蠕形螨数量一般1~4条,而对照组lt;2条。
4 讨论
寄生于人体皮肤的蠕形螨有两种,毛囊蠕形螨和皮脂蠕形螨,它们寄生于毛囊皮脂腺单位,以皮脂腺分泌的营养物质为生。毛囊蠕形螨一般寄生于毛囊漏斗部,而皮脂蠕形螨寄生于皮脂腺或者毛囊的深部。正常中年人或者老年人蠕形螨的寄生率几乎为100%,当然,螨密度很低。当蠕形螨移居至皮肤表面或者数量明显增多时就可成为致病因素。已知与毛囊蠕形螨感染相关的疾病,见表1[12,13]。

表1 蠕形螨感染相关疾病
虽然毛囊蠕形螨与多种皮肤病相关,但其具体病理机制尚不完全清楚。1971年,Marks和Dawber首次描述了皮肤表层取材法用于检测毛囊蠕形螨[14],后来由Forton和Seys进一步发展,该技术是使用氰基丙烯酸酯凝胶获取角质层及毛囊内容物以进行镜检。Forton等推荐螨密度≥5个/cm2作为蠕形螨相关疾病的诊断标准,并认为本方法是检测蠕形螨密度最有效的方法[15]。国内临床检查毛囊蠕形螨主要采用挤压法直接镜检,是一种无创、方便、有效的方法。在镜检阳性率上,挤压法与SSSB法无统计学差异,但在高螨密度检出率上,后者优于前者[2]。而螨密度是决定其是否为致病因素的重要标准,故SSSB法较之挤压法更为敏感和准确。
RCM可以实现表皮和真皮浅层细胞水平的实时成像,为皮肤科临床提供了一种在体无创检查手段,其在黑素细胞肿瘤及色素性皮肤病的检查中具有特殊意义,且随着RCM技术的开展,其应用亦越来越广泛。近年来国内外大量研究也表明,诸如银屑病、扁平苔藓、急性接触性皮炎和脂溢性皮炎等炎症性皮肤病均具有一些独特的RCM图像特征,可在一定程度上替代组织病理学检查,用于这类疾病的鉴别诊断和疗效观察[16-19]。酒渣鼻是临床常见的一种慢性炎症性皮肤病,毛囊蠕形螨与其发病密切相关。Longo和Slutsky用VivaScope1500对毛囊蠕形螨进行了检测,近期有研究对酒渣鼻患者毛囊蠕性感染情况用此法进行了检测评估[20,21]。本研究以此为基础,对上述三种毛囊蠕形螨的检测方法进行了对比分析。
本研究中,RCM检测发现的单位面积(1 cm2)内毛囊蠕形螨平均密度为410.8±203.2,与以往有关研究报道的数据略有差异[8,22],不排除与实验对象病种的选择及疾病不同时期有关。如前所述,原发性毛囊蠕形螨病与继发性毛囊蠕形螨病在蠕形螨检出率及数量上会存在一定差异。Forton用SSSB法检测发现蠕形螨病与丘疹脓疱期酒渣鼻患者的蠕形螨个数分别为61/cm2和36/cm2[23],这也解释了本研究与既往研究所报道的结果差异。
另外,本研究通过实验组与对照组结果比较发现,实验组单位面积内蠕形螨均数为41.1±20.3,对照组为5.12±5.40(Plt;0.001)。既往SSSB法指出,毛囊蠕形螨数量≥5个/cm2为高螨密度,可参考作为致病因素,但由于RCM能更精准的对毛囊蠕形螨数量进行检测,其敏感性强于SSSB法,故当应用RCM法进行毛囊蠕形螨的检测时,究竟何种密度可作为致病因素参考,尚需进一步大量本研究。
本研究综合三种毛囊蠕形螨的检测方法,对其阳性率、高螨密度检出率及蠕形螨数量进行对比分析,结果发现,RCM法在毛囊蠕形螨检测中是一种更为敏感、准确、简便的方法。其一,RCM实时光学截面每层厚度小于5 μm,最大穿透深度250~300 μm,涵盖表皮层、真皮乳头层及浅表血管丛,基本覆盖毛囊蠕形螨生存的解剖深度;水平分辨率为0.5~1 μm,故横向扫描全面;而挤压法及SSSB法不能避免取材不尽的人为误差,且如果皮疹区角化过度、毛囊较深,就会因取样层次表浅而致结果受影响。其二,RCM法不需要像挤压法及SSSB法一样有轻度挤压或黏贴的不适、需要枯燥的取样等待时间,完全避免了氰基丙烯酸酯凝胶基质过敏的可能性及创伤的痛苦,且具有检查的可重复性,极大提高舒适度及准确性。再者,挤压法及SSSB法检测毛囊蠕形螨或多或少都对检测区域皮肤有所改变,而RCM可以做到在真实的生存环境下对毛囊蠕形螨进行观察。
当然,RCM法只能观察毛囊蠕形螨,皮脂腺蠕形螨一般寄居在皮脂腺附近,由于扫描深度限制通过RCM较难发现;RCM目前还不能检测评估毛囊蠕形螨生活阶段不同所呈现的形态差异。随着技术改进及发展,相信RCM的应用将越来越广泛。
[1] Holmes AD. Potential role of microorganisms in the pathogenesis of rosacea[J]. J Am Acad Dermatol,2013,69(6):1025-1032.
[2] 李婷,陈向明,张海清,等.标准化皮肤表层取材法用于酒渣鼻患者皮肤毛囊蠕形螨镜检[J].中华皮肤科杂志,2015,48(7):503-504.
[3] Pellacani G, Scope A, Farnetani F, et al. Towards an in vivomorphologic classification of melanocytic nevi[J]. J Eur Acad Dermatol Venereol,2013,10:422-424.
[4] Prodinger C, Tatarski R, Laimer M, et al. Large congenital nevusspilus-improved follow-up through the use of in vivo reflectanceconfocal microsacopy[J]. Dermatol Pract Concept,2013,3:55-58.
[5] Longo C, Lallas A, Kyrgidis A, et al. Classifying distinct basal cell carcinoma subtype by means of dermatoscopy and reflectance confocal microscopy[J]. J Am Acad Dermatol,2014,71(4):716-724.
[6] 刘华绪,林燕,陈学超,等.白癜风及其它色素减退性皮肤病的RCM图像特点[J].中国麻风皮肤病杂志,2012,28(3):192-196.
[7] Liu H, Lin Y, Nie X, et al. Histological classification of melasmawith reflectance confocal microscopy: a pilot study in chinesepatients[J]. Skin Research Technology,2011,17(4):398-403.
[8] Sattler EC, Maier T, Hoffmann VS, et al. Noninvasive in vivo detection and quantification of demodex mites by confocal laser scanning microscopy[J]. Br J Dermatol,2012,167:1042-1047.
[9] Wilkin J,Dahl M, Detmar M,et al. Standard grading system for rosacea: report of the national rosacea society expert committee on the classification and staging of roascea[J]. J Am Acad Dermatol,2004,50(6):907-912.
[10] Forton F,Seys B, Marchal JL,et al. Demodex folliculorum and topical treatment: acaricidal action evaluated by standardized skin surface biopsy[J]. Br J Deematol,1998,138(3):461-466.
[11] 商继科,许淑珍,姜桂艳,等.1103例健康人群及面部皮肤疾病患者蠕形螨调查分析[J].实用皮肤病学杂志,2010,3(1):13-15.
[12] Moravvej H, Dehghan-Mangabadi M,Abbsian MR, et al. Association of rosaceae with demodicosis[J]. Arch Iran Med,2007,10(2):199-203.
[13] Hsu CK, Hsu MML, Lee JYY. Demodicosis: a clinicopathological study[J]. J Am Acad Dermatol,2009,60(3):453-462.
[14] Marks R, Dawber RP. Skin surfacebiopsy: an improved technique for the examination of the horny layer[J]. Br J Dermatol,1971,84:117-123.
[15] Askin U, Seckin D. Comparison of the two techniques for measurement of the density of demodex folliculorum: standardized skin surface biopsy and direct microscopic examination[J]. Br J Dermatol,2010,162:1124-1126.
[16] Zhong LS, Wei ZP, Liu YQ. Sensitivity and specificity of munro microabscess detected by reflectance confocal microscopy in the diagnosis of psoriasis vulgaris[J]. J Dermatol,2012,39(3):282-283.
[17] 权晟,魏志平,刘彦群,等.扁平苔藓的共聚焦激光扫描显微镜影像特征[J].临床皮肤科杂志,2012,41(8):461-462.
[18] Meinke MC, Richter H, Kleemann A, et al. Characterization of atopic skin and the effect of a hyperforin-rich cream by laser scanning microsaopy[J]. J Biomed Opt,2015,20(5):051013.
[19] 江文才,袁超.反射式共聚焦显微镜在炎症性皮肤病诊疗中的作用[J].中国麻风皮肤病杂志,2017,33(5):312-316.
[20] Longo C, Pellacani G, Ricci C, et al. In vivo detection of demodex folliculorum by means of confocal microscopy[J]. Br J Dermatol,2012,166:690-692.
[21] Slutsky JB, Rabinovitz H, Grichnik JM, et al. Reflectance confocal microscopic features of dermatophytes, scabies, and demodex[J]. Arch Dermatol,2011,147:1008.
[22] Turgut Erdemir A, Gurel MS, Koku Aksu AE, et al. Reflectance confocal microscopy vs. standardized skin surface biopsy for measuring the density of demodex mites[J]. Skin Res Technol,2014,20(4):435-439.
[23] Forton F, Germaux MA, Brasseur T, et al. Demodicosis and rosacea: epidemiology and significance in daily dermatologic practice[J]. J Am Acad Dermatol,2005,52(1):74-87.
(收稿:2017-07-03 修回:2017-08-17)
Clinicalapplicationofreflectanceconfocalmicroscopyformonitoringthedensityofdemodexmites
CHENLei,GAOFeng,YUWeiheng,SUNWenqi,DINGHuiling.
WeifangInstitudeofDermatology,ShandongWeifang261061,China
CHENLei,E-mail:cl_cp@126.com
Objective: To determine the role of reflectance confocal microscopy (RCM) for monitoring the density of demodex mites.MethodsThe positivity rate, high number of mites (≥5 mites /cm2) and mean number of mites per 10 mm2of demodex mites in 52 patients with rosacea were detected by extrusion method, standardized skin surface biopsy (SSSB) and RCM respectively.ResultsThe positivity rates of extrusion method, SSSB and RCM were 69.23%, 78.85% and 100% and the mean number of mites per 10 mm2was 8.21±6.45, 16.22±13.12 and 410.8±203.2.ConclusionRCM is more sensitive and simple for the detection of demodex mites in the patients with rosacea.
reflectance confocal microscopy; standardized skin surface biopsy; extrusion method; demodex mites
潍坊市皮肤病防治所,山东潍坊,261061
陈蕾,E-mail:cl_cp@126.com
