组胺受体H4R对过敏性紫癜患儿体内树突状细胞的调节作用
2017-11-28蒋瑾瑾
雷 蕾 蒋瑾瑾 顾 军
·论著·
组胺受体H4R对过敏性紫癜患儿体内树突状细胞的调节作用
雷 蕾1蒋瑾瑾1顾 军2
目的明确组胺受体H4R对过敏性紫癜(HSP)患儿体内树突状细胞(dentritic cells, DC)的调节作用。方法1.流式细胞仪检测126例HSP急性期、112例缓解期患者及94名健康对照外周血单核细胞(PBMC)中DC标志性分子CD80及CD86的表达情况;2.体外活化和诱导得到DC,分为组胺组,组胺+H4R拮抗剂组和PBS对照组,Western blot 检测组胺、H4R蛋白和人磷酸化信号传导子及转录激活子1(p-STAT1)的表达,酶联免疫吸附试验检测趋化因子CCL17、CXCL16表达水平。结果1.HSP患者PBMC中CD86的表达明显高于健康对照组(Plt;0.01)。急性期组CD80的表达低于缓解期组及健康对照组(Plt;0.01),而缓解期组及健康对照组之间无显著性差异(Pgt;0.05);2.组胺+H4R拮抗剂组p-STAT1和H4R的蛋白及趋化因子CXCL16和CCL17水平明显低于组胺组。结论组胺受体H4R可能通过促进DC的趋化因子CXCL16/CCL17的表达,激活JAK/STAT通路,引起HSP的发生发展。
过敏性紫癜; 树突状细胞
树突状细胞(dendritic cell,DC)是一类专职抗原提呈细胞,它是能激活初始T淋巴细胞,启动免疫应答的唯一一种提呈细胞,还可进一步影响Th细胞分化以及极化。有研究发现过敏性紫癜(HSP)患儿的DC对Th细胞调控的三条途径即抗原特异性信号、协调刺激信号和分化或极化信号均出现了异常[1]。说明其在HSP的发病与发展中起着关键性的作用,以DC细胞为主的免疫细胞调控异常引起了Thl/Th2细胞功能失衡,应当是HSP发病的最主要原因之一。另有研究发现DC表面可表达H4R,活化后可以调控Th细胞的分化,另外H4R还可以抑制DC生成IL-12p70[2],上调朗格汉斯细胞表达CCL17 and CCL22[3]等多种细胞因子,相应的影响Th细胞向Th2型迁移[4,5]。
本课题组前期研究已发现组胺受体H4R参与了HSP的急性期的炎症反应,通过对不同临床表型的HSP进行比较,发现肾脏受累的HSP患儿外周血H4R的表达要高于单纯皮肤组及无肾脏受累的混合组[6],在本研究我们将进一步观察DC上组胺受体,细胞趋化因子的表达情况,探讨H4R可能通过何种途径对下游的细胞因子的信号转导途径进行调控。
1 研究对象
HSP急性期组:收集在上海长海医院就诊的126例病程在1周内的首次发病患者,经家长知情同意后,纳入HSP急性期组,(男60例,女66例),年龄为2.5~20岁,平均(9.85±4.73)岁。均为病程在1周内的首次发病,所有患者在入院前1个月内确保未使用任何抗过敏药物或免疫抑制剂;患儿在采血前24 h未使用任何药物。
HSP缓解期组:HSP急性期组的患儿经过规范的临床治疗后各种急性期临床表现已消失、实验室检验各项指标恢复正常,满足上述标准的HSP患儿纳入HSP恢复期组,共有112例,其中男52例,女60例,年龄为3.5~14.5岁,平均(7.48±3.85)岁。
健康对照组:均为同一时间段来我科儿保门诊体检的健康儿童,共94名。其中男52名,女42名,年龄为3.8~10.5岁,平均(6.52±1.86)岁,年龄、性别与HSP组匹配。
2 实验试剂与设备
FACS Calibur型流式细胞分析仪(美国BD公司);PBS 磷酸盐缓冲液(上海基尔顿生物有限公司);淋巴细胞分离液(上海基尔顿生物科技);Human CXCL16/CCL17 ELISA试剂盒,CD80,CD86单克隆抗体(Biotnt公司);P-STAT1单克隆抗(abcom公司);RPMI 1640(上海生工);rhGM-CSF(Peprotech公司);rhIL-4(Biovision公司);JNJ-7777120(MCE公司)。
3 实验方法
3.1 流式细胞仪FCM检测外周血单个核细胞表面共刺激分子表达情况 采集HSP急性期,缓解期及健康对照组患儿外周血后,分离PBMC。将PBS悬浮的1 mL待测细胞以1x106加人FCM专用管中。在FCM专用管中加入PE标记的鼠抗人单克隆抗体CD80,CD86各20 μL,并设空白对照。避光孵育,4℃,30 min,10 min摇一次,再用PBS洗涤2次,重悬细胞后上机检测。
3.2 树突状细胞的体外诱导及培养 DC诱导培养:采集健康志愿者血浆,采用淋巴细胞分离液密度梯度离心法制备PBMC,将分离出的PBMC用不含细胞因子RPMI 1640培养液制备成细胞悬液。于24孔培养板在37℃、5% CO2培养箱孵育3 h,用37℃预热的1640培养液洗板1次,获得贴壁的单个核细胞。再加入含细胞因子的RPMI 1640完全培养液l mL。同样在37℃、5% CO2下孵育的培养箱中。通过显微镜观察细胞生长情况。隔日半量换液并添加细胞因子以保证培养液中细胞因子终浓度不变。培养至第6天时进行分组:1.PBS对照组;2.组胺组(1×10-5mmol/mL);3.组胺(1×10-5mmol/mL)+H4R受体拮抗剂(1×10-5mmol/mL)。第8天时收集悬浮细胞及细胞上清以备检测H4R、CXCL16和CCL17的表达。
3.3 Western blot检测组胺及其抗体干预后外周血单个核细胞上H4R的蛋白的表达 前期收集细胞悬液,加入蛋白裂解液并进行收集蛋白样品,加入SDS-PAGE凝胶,经电泳,转膜,封闭后,加入稀释好的兔抗H4R抗体孵育2 h,洗膜后加入二抗羊抗兔工作液孵育1 h,洗涤后显色,进行蛋白检测。
3.4 酶联免疫吸附试验检测CCL17、CXCL16蛋白含量 50 mM的碳酸盐缓冲液加入前期收集的上清液,调整抗原浓度为10~20 μg/mL,加以100 μL/每孔的量到酶标板,4℃条件下放置过夜。次日用PBS洗涤3次,加入150 μL 1% BSA在37℃条件下封闭1 h。PBS洗涤3次后,在每孔加入100 μL按照不同倍比稀释度的血清,同时加入对照样品,37℃条件下孵育2 h。PBS洗涤5次后,加入100 μL稀释后的HRP标记的二抗,在37℃条件下孵育1 h。PBS洗涤5次,加入显色剂反应20 min,酶标仪上读取A405吸收值。
4 结果
4.1 HSP患者外周血单个核细胞中的CD80,CD86的表达情况 首先通过用流式细胞术检测了各组受试者PBMC中CD80/CD86表达变化,见图1。急性期组和缓解期组患者外周血单个核细胞CD86的表达均明显高于健康对照组,差异具有统计学意义(Plt;0.01),且急性期组患者升高的程度更大。急性期组CD80的表达低于缓解期组及健康对照组,差异有统计学意义(Plt;0.01)。
4.2 组胺受体拮抗剂对DC表达H4R、p-STAT1、CCL17及CXCL16的影响
4.2.1 形态学观察 在培养早期,可看见细胞成圆形或类圆形。培养至3~4天时,细胞逐渐聚集,呈集落样生长,并且部分细胞可观察到突起,培养至7~8天时,细胞分散生长,并可见明显树枝样突起(图2)。
4.2.2 DC上H4R、p-STAT1、CCL17及CXCL16的表达情况 加入组胺刺激后,DC的p-STAT1和H4R的蛋白表达增高(图3),分泌的趋化因子CXCL16和CCL17增多,明显高于对照组(Plt;0.01,图4);而加入H4R阻断剂JNJ7777120后,以上分子表达量均明显回落。
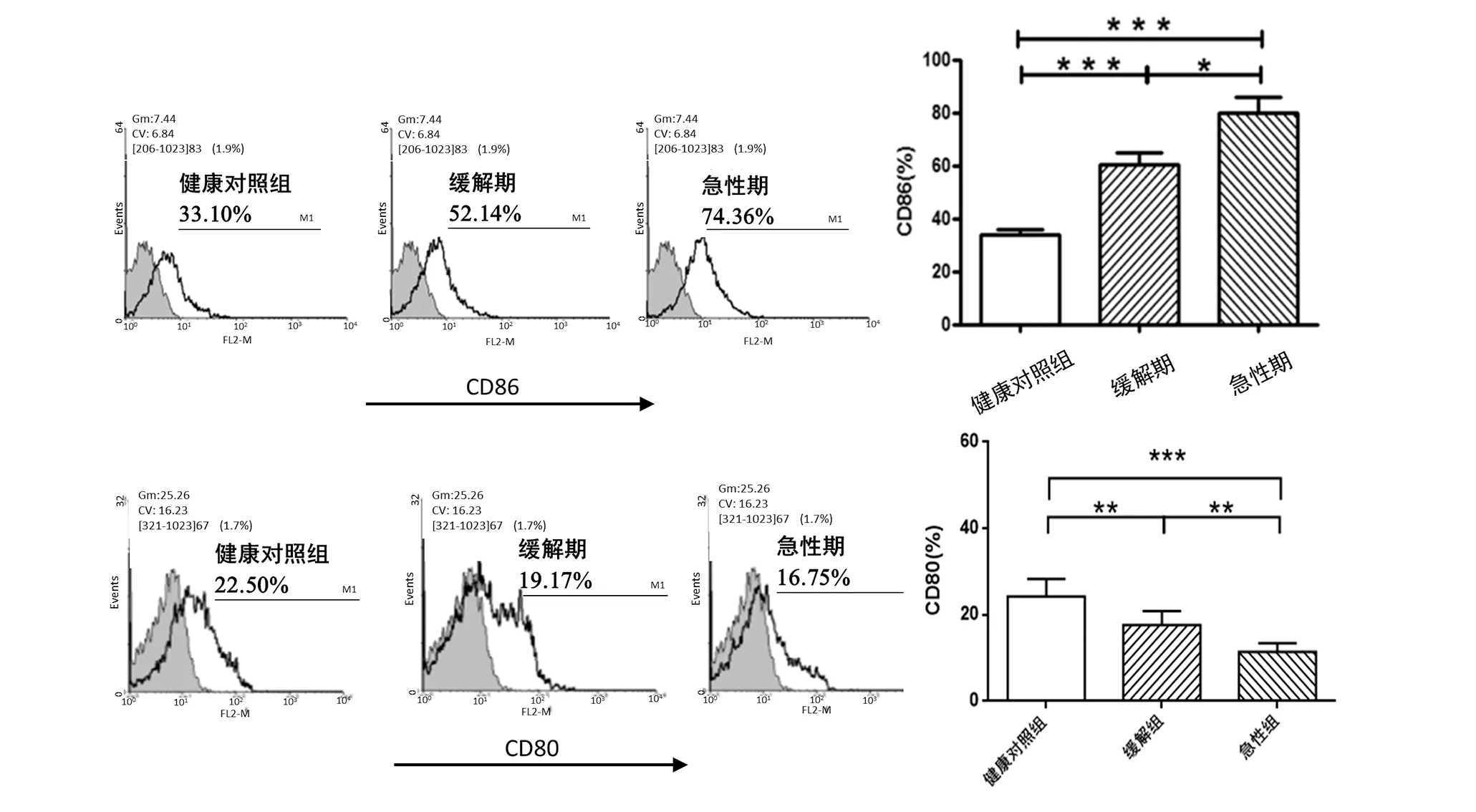
图1 各组受试者PBMC中CD86及CD80的表达
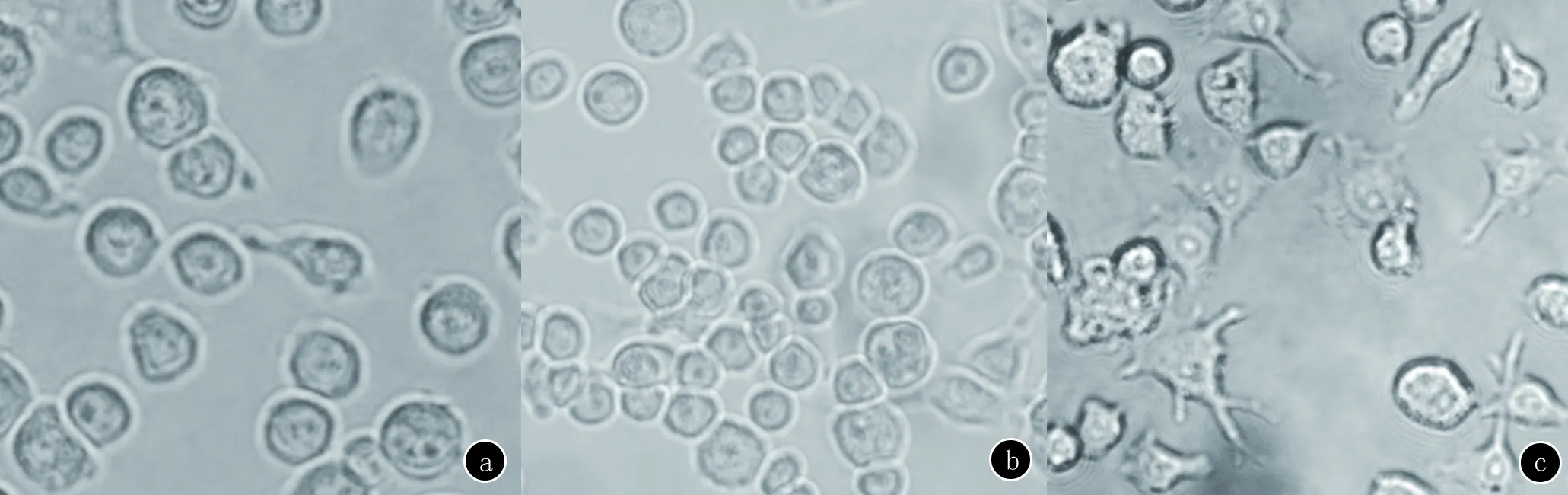
a:培养早期;b:培养3~4天时;c:培养7~8天时
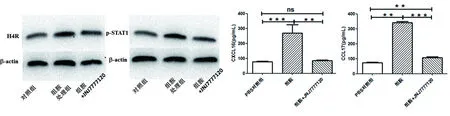
图3 刺激后DC的H4R和p-STAT1的表达变化 图4 DC培养上清中的CXCL16和CCL17的表达变化
4 讨论
Th1功能低下,Th2优势活化是目前公认的HSP的病理基础。而Th细胞是根据抗原提呈细胞提供的不同的信号分子而进一步活化,分化的。CD80(B7-1),CD86(B7-2)分子作为免疫调控中重要的共刺激分子,可刺激T细胞活化,而活化的T细胞可促进B细胞进一步分泌大量免疫球蛋白,影响Th1/Th2平衡。其中DC作为最主要的抗原提呈细胞,是唯一能够作用于na ïve T细胞的细胞,从而激发获得性免疫应答的一类抗原提呈细胞,是联系固有免疫与获得性免疫的枢纽,在免疫应答的诱导中占有独特的地位[7]。同时也是最主要表达这两种分子的细胞之一。有研究发现哮喘小鼠骨髓细胞表面CD86表达明显升高,使其抗原提呈功能明显增强,T细胞过度活化,尤其主要是向Th2类细胞过度活化[8]。另有研究者[9]对T细胞进行体外T细胞分化分析,发现抗CD80(B7-1)单克降抗体使MBP特异性T细胞向Th2分化,而抗CD86(B7-2)单克隆抗体使之向Thl分化,因此CD80(B7-1)可刺激Thl生成,而CD86(B7-2)则可协同刺激Th2生成。
本研究首先通过用流式细胞术检测了各组受试者PBMC中CD80和CD86表达变化,发现急性期组和缓解期组患者外周血单个核细胞CD86的表达均明显高于健康对照组。而急性期组CD80的表达低于缓解期组及健康对照组。说明HSP患者体内的DC出现了异常活化,呈现Th2亢进状态。如前所述,DC表面的H4R活化后可调控Th细胞的分化,影响Th细胞向Th2型迁移。因此我们进一步通过体外分组培养DC进行观察。分别加入组胺,组胺+H4R受体拮抗剂JNJ7777120进行诱导,结果发现加入组胺刺激后,DC的p-STAT1和H4R的蛋白表达增高,分泌的趋化因子CXCL16和CCL17增多,明显高于空白对照组(Plt;0.01);而加入H4R阻断剂JNJ7777120后,以上分子表达量均明显回落,尤其是CXCL16的表达与空白对照组无明显差异。
综上所述,DC在HSP患者体内呈异常活化状态,在体外经组胺刺激后其表面的H4R表达升高,分泌趋化因子增多,而加入H4R拮抗剂后表达水平明显回落。我们考虑组胺受体H4R可能通过促进DC的趋化因子CXCL16/CCL17的表达,激活JAK/STAT通路,引起或加重HSP的发生发展。
[1] 陶红,李秋,王莉.过敏性紫癜发病中树突状细胞与T 辅助细胞分化失衡的关系[J].第三军医大学学报,2010,32(7):677-679.
[2] Gutzmer R. Histamine H4 receptor stimulation suppresses IL-12p70 production and mediates chemotaxis in human monocyte-derived dendritic cells[J]. J Immunol,2005,174(9):5224-5232.
[3] Miyano K, Matsushita S, Tsuchida T, et al. Inhibitory effect of a histamine 4 receptor antagonist on CCL17 and CCL22 production by monocyte-derived Langerhans cells in patients with atopic dermatitis[J]. J Dermatol,2016,43(9):1024-1029.
[4] Dunford PJ. The histamine H4 receptor mediates allergic airway inflammation by regulating the activation of CD4+ T cells[J]. J Immunol,2006,176(11):7062-7070.
[5] Morgan RK. Histamine 4 receptor activation induces recruitment of FoxP3+ T cells and inhibits allergic asthma in a murine model[J]. J Immunol,2007,178(12):8081-8089.
[6] 雷蕾,蒋瑾瑾,周霖,等.组胺H4受体在过敏性紫癜患者外周血及肾脏组织中的表达[J].中国中西医结合皮肤性病学杂志,2016,15(3):133-135.
[7] Iwasaki A, Medzhitov R. Control of adaptive immunity by the innate immune system[J]. Nat Immunol,2015,16(4):343-353.
[8] Brzostek J, Gascoigne NR, Rybakin V. Cell Type-Specific regulation of immunological synapse dynamics by B7 ligand recognition[J]. Front Immunol,2016,7:24.
[9] Kuchroo VK, Das MP, Bmwn JA, el al. B7-1 and B7-2 costimulatory molecules activate dJffemntially the Thl/Th2 developmental pathways:Application to autoimmune deseasetherapy[J]. Cell,1995,80(5):707-718.
(收稿:2017-06-26 修回:2017-07-26)
RegulatoryeffectofH4RondendriticcellinchildrenwithHenoch-Schönleinpurpura
LEILei1,JIANGJinjin1,GUJun2.
1.DepartmentofPediatrics,ChanghaiHospitalAffiliatedtotheSecondMilitaryMedicalUniversity,Shanghai200433,China; 2.DepartmentofDermatologyandVenereology,ChanghaiHospitalAffiliatedtotheSecondMilitaryMedicalUniversity,Shanghai200433,China
GUJun,E-mail:gujun79@163.com
Objective: To determine the regulatory effect of histamine 4 receptor (H4R) on dendritic cells (DC) in children with Henoch-Schönlein purpura (HSP).MethodsThe expression levels of CD80 and CD86 in PBMC from 126 patients at acute stage, 112 at remission stage and 94 healthy controls were detected by flow cytometer. The DC was isolated and divided into the histamine group, histamine+H4R antagonist group and PBS control group. The levels of H4R and P-STAT1 proteins on DC were detected by Western blot and the levels of CCL17and CXCL16 were detected by ELISA.ResultsThe level of CD86 from the patients with HSP was higher than that in healthy controls, with a significant difference (Plt;0.01), while the level of CD80 was lower in the patients at acute stage than that in the patients at remission stage and healthy controls (Plt;0.01). The difference in the level of CD 80 between the patients at remission stage and healthy controls was not significant. The level of H4R and P-STAT1 proteins, CXCL16 and CCL17 on DC in the histamine+H4R antagonist group were lower than those in histamine group.ConclusionH4R is associated with the onset and development of HSP, which may go through up-regulating the levels of CXCL16 and CCL17 and activating the JAK/STAT pathway.
Henoch-Schönlein purpura; dendritic cell
1第二军医大学附属长海医院儿科,上海,200433 2第二军医大学附属长海医院皮肤性病科,上海,200433
顾军,E-mail:gujun79@163.com
