混合溶液酸碱性的解题技巧
2017-11-24王谦谦石家庄二中实验学校河北石家庄051430
王谦谦(石家庄二中实验学校,河北 石家庄 051430)
混合溶液酸碱性的解题技巧
王谦谦(石家庄二中实验学校,河北 石家庄 051430)
25℃时,酸碱的PH之和为14(即PHA+PHB=14),若等体积混合,则关于混合溶液的酸碱性符合“谁弱显谁性,都强显中性”;若要求混合溶液显中性,则关于酸碱的体积符合“谁强体积大,都强一般大”。
PH值;混合溶液的酸碱性;电离平衡;强电解质;弱电解质
弱电解质的电离平衡与盐类水解部分是新课程的重点,难度较大。我把“酸碱等体积混合后溶液酸碱性的判断”和“酸碱混合后溶液显中性,酸碱体积的比较”的习题进行对照归纳,把解题的规律和技巧归纳成口诀,化繁为简。
1 酸碱等体积混合后溶液酸碱性的判断
我们由例题出发,梳理解题思路,归纳技巧口诀。
【例1】25℃时下列酸碱的PH之和为14,则酸碱等体积混合后,溶液显酸性的是( )
A.HCl和NaOH B.HCl和NH3·H2O
C.CH3COOH和NaOH D.H2SO4和NaOH
答案为C
由常规解题思路出发:
A.①设HCl的PH值为A,则C(H+)=10-Amol/L
HCl=H++Cl-
10-A10-A
则C(HCl)=10-Amol/L
②设NaOH的PH值为B,且A+B=14,那么C(OH-)=10-(14B)mol/L=10-Amol/L
NaOH=Na++OH-
10-A10-A
则C(NaOH)=10-Amol/L
可知,HCl和NaOH物质的量浓度相等,体积相等,则物质的量相等。
HCl+NaOH=NaCl+H2O
HCl和NaOH物质的量之比为1:1,由化学方程式可知,恰好中和,生成NaCl溶液,显中性——归纳为“都强显中性”。
B.①同上,C(HCl)=10-Amol/L。
②设 NH3·H2O的PH 值为 B,同理 C(OH-)=10-Amol/L,但NH3·H2O是弱电解质,微弱电离:

>>10-A10-A
所以C(NH3·H2O)>>10-Amol/L,等体积混合,NH3·H2O的物质的量比HCl大很多。
HCl+NH3·H2O=NH4Cl+H2O
由化学方程式可知,反应后生成少量NH4Cl(水解显酸性),但同时剩余大量NH3·H2O,所以混合溶液显碱性——归纳为“强酸弱碱混合,谁弱显谁性”。
C.①同上,C(NaOH)=10-Amol/L。
②设CH3COOH的PH值为A,同理C(H+)=10-Amol/L,但CH3COOH是弱电解质,微弱电离:
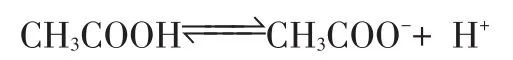
>>10-A10-A
所以C(CH3COOH)>>10-Amol/L,等体积混合,CH3COOH的物质的量比NaOH大很多。
CH3COOH+NaOH=CH3COONa+H2O
由化学方程式可知,反应后生成少量CH3COONa(水解显碱性),但同时剩余大量CH3COOH,所以混合溶液显酸性——归纳为“弱酸强碱混合,谁弱显谁性”。
D.①设H2SO4的PH值为A,C(H+)=10-Amol/L
H2SO4=2H++SO42-
0.5×10-A10-A
则C(H2SO4)=0.5×10-Amol/L
②同上,C(NaOH)=10-Amol/L
因此NaOH的物质的量浓度是H2SO4物质的量浓度的2倍,体积相等,则NaOH的物质的量是H2SO4的物质的量的2倍。
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4和NaOH 物质的量之比为1:2,由化学方程式可知,恰好中和,生成Na2SO4溶液,显中性——归纳为“都强显中性”,而与酸或碱的元数无关。
【总结】:25℃时,酸碱的PH之和为14(即PHA+PHB=14),等体积混合,

2 酸碱混合后溶液显中性,酸碱体积的比较
【例2】25℃时,下列酸碱的PH之和都是14,要求混合后溶液显中性,则下列关于酸碱的体积大小的说法正确的是( )
A.V(HCl) <V(NaOH) B.V(HCl) >V(NH3·H2O)
C.V(CH3COOH)>V(NaOH) D.V(H2SO4)=V(NaOH)
答案为BD
这道题可以借鉴例1的结论,即先假设每组物质都是等体积混合,根据刚总结的口诀,得出混合溶液的酸碱性,再根据最终要达到混合溶液显中性的目的,进行相应酸或碱的添加。
A.先假设HCl和NaOH等体积混合,根据例1的口诀,都强显中性,则混合溶液显中性。
假设成立,即HCl和NaOH需要等体积混合。A错误。
小结:强酸强碱混合时,酸碱的体积符合都强一般大。
B.同样先假设HCl和NH3·H2O等体积混合,根据例1的口诀,谁弱显谁性,则混合溶液显碱性,要想最终溶液为中性,还需要添加酸,则V(HCl)>V(NH3·H2O)。B正确。
小结:强酸弱碱混合时,酸碱的体积符合谁强体积大。
C.如果CH3COOH和NaOH等体积混合,谁弱显谁性,则混合溶液显酸性,若最终溶液为中性,还需要添加碱,则V(CH3COOH)<V(NaOH)。C错误。
小结:弱酸强碱混合时,酸碱的体积也符合谁强体积大。
D.按题意H2SO4和NaOH等体积混合,都强显中性,则混合溶液显中性。D正确。
小结:强酸强碱混合时,酸碱的体积也符合都强一般大,而与酸碱的元数无关。
【总结】:25℃时,酸碱的PH之和为14(即PHA+PHB=14),且要求混合后溶液显中性,

3 口诀归纳,化繁为简
例1和例2这类题型如果借助口诀,既做得快又做得对。对于后进生来说尤其管用。两类题型总结如下:

在化学学习中,勤于归纳,勤于思考,有利于题目的清晰
