西藏3种野生牧草苗期对干旱胁迫的响应
2017-11-23张卫红刘大林苗彦军闫天芳蔺永和徐雅梅
张卫红,刘大林,苗彦军,闫天芳,蔺永和,徐雅梅,*
1 扬州大学动物科学与技术学院, 扬州 225009 2 西藏农牧学院, 林芝 860000 3 兰州大学草地农业科技学院, 兰州 730000
西藏3种野生牧草苗期对干旱胁迫的响应
张卫红1,2,刘大林1,苗彦军2,闫天芳1,蔺永和3,徐雅梅2,*
1 扬州大学动物科学与技术学院, 扬州 225009 2 西藏农牧学院, 林芝 860000 3 兰州大学草地农业科技学院, 兰州 730000
通过气候培养箱盆栽试验,探究了干旱胁迫对西藏3种野生牧草(赖草(Leymussecalinus)、垂穗披碱草(Elymusnutans)和老芒麦(Elymussibircus))苗期生长特性和生理指标的影响,并对其抗旱能力进行综合评价,旨在为选育抗旱性强的优良牧草种质资源和人工草地建植提供科学理论依据。研究发现,随着干旱胁迫时间的增加,土壤相对含水量呈现先快速下降后缓慢下降的变化趋势,种植不同牧草的土壤含水量变化值也不相同。3种野生牧草幼苗的株高变化量、植株含水量和叶绿素(Chl)含量均随干旱胁迫时间的增加而呈现下降趋势;植物体内游离脯氨酸(Pro)含量、丙二醛(MDA)含量和超氧化物歧化酶(SOD)活性均表现为随着干旱胁迫时间增加而增大;可溶性糖含量均表现为随干旱胁迫时间的增加呈现先减小后增大的变化趋势:干旱胁迫第5天的可溶性糖含量最低,但老芒麦干旱胁迫第20天时的可溶性糖含量仍低于对照;垂穗披碱草可溶性蛋白含量随着干旱胁迫时间的延长而增加,老芒麦和赖草体内可溶性蛋白含量呈现先减小后增大的变化趋势,老芒麦在干旱胁迫第10天时可溶性蛋白含量最低,而干旱胁迫第5天时赖草体内可溶性蛋白含量最低。用隶属函数法对干旱胁迫下3种野生牧草苗期8个指标进行综合评价,其抗旱性强弱顺序依次为:赖草>垂穗披碱草>老芒麦。结果表明3种牧草中赖草的抗旱能力最强,适合在西藏干旱地区种植;但由于赖草有性繁殖能力较低,而垂穗披碱草有性繁殖能力较强,可以作为西藏干旱、半干旱地区生态恢复的首选草种。
野生牧草;干旱胁迫;生长性状;生理特征;抗旱性评价
作为我国五大牧区之首,西藏具有广阔的天然草地面积;作为青藏高原的主体,西藏具有“世界第三极”之称。西藏的气候特点是平均海拔4000 m以上,日照充足,蒸发量大,气候类型复杂多样。其中寒冷、干旱是西藏地区最为明显的气候特征[1- 2]。而干旱对草地生态的影响最大[3],严重的限制了草地生产力[4]。即使在青藏高原的某同一区域,水分充足的地方其天然草地长势明显优于缺水区的地方。干旱环境往往会影响植物的蒸腾、水势、吸收和新陈代谢,以及酶促反应、休眠和生长发育,从而降低植物生产力。近年来,干旱致使西藏草地退化加重,草畜矛盾尖锐,严重制约着当地农牧民的经济收入和草地畜牧业的可持续发展[1- 2, 5]。科技工作者在引种过程中发现,在青藏高原严酷的生长环境下,国内外许多品种在西藏无法完成生命周期或无法安全越冬;苗期是研究植物对逆境胁迫最敏感时期[6];从这个角度来说,了解干旱胁迫下西藏乡土植物苗期抗旱性特征,对其抗旱能力进行综合评价具有十分重要的意义。
草地植物在长期适应西藏独特的自然环境条件下形成了独特的植被体系和丰富的种质资源[7]。其中赖草(Leymussecalinus)、垂穗披碱草(Elymusnutans)和老芒麦(Elymussibircus)是西藏天然草地重要的乡土植物,具有营养价值高、适口性好和适应性强等诸多优良特性,在西藏畜牧业生产和生态恢复治理中具有十分广阔的应用前景[8- 10]。目前干旱是制约西藏天然草地牧草生长发育的一个重要因素[11]。因此,如何提高当地乡土植物的抗旱性,培育抗旱性强的优良牧草种质,最大限度地提高草地的经济价值成为西藏草牧业发展面临的一大难题。鉴于此,本研究在前人研究的基础上,对采集于西藏本地的3种野生牧草进行了不同干旱胁迫下苗期各项生长特性和生理指标的变化研究,并对其抗旱能力进行综合评价,旨在为选育抗旱性强的优良牧草种质和人工草地建植提供科学理论依据。
1 材料与方法
1.1 试验材料
试验材料为采集于西藏地区的3种野生牧草种子,依次为垂穗披碱草(Elymusnutans)、老芒麦(Elymussibircus)和赖草(Leymussecalinus)(表1)。

表1 试验材料编号与来源
按照材料名称的前两个字母的大写加序号的方式进行编号
1.2 试验方法
试验于2016年4月开始在西藏农牧学院高寒草地实验室进行。材料培养采用盆栽法。花盆内直径为30 cm,深25 cm。土壤采集于西藏农牧学院草业科学教学实习基地,土壤为砂质土,pH值为5.77,有机质为10.87 g/kg,全氮含量为1.05 g/kg,水解性氮为0.16 g/kg,速效钾为41.60 mg/kg,速效磷为19.67 mg/kg,田间最大持水量为28.17%。去除土壤中的石子、枯枝落叶和植物根茎,并将其置于105℃的烘箱中烘5 h。待自然冷却后在每千克土壤中添加尿素10 g,混合均匀后在每个花盆中加入10 kg土壤。3种牧草分别播种于花盆内,行距1 cm,播深1.5 cm。该实验设5次重复。将花盆放入人工智能气候培养箱中进行培养,温度为15/25℃,12 h光照,12 h黑暗处理。待苗长出2片叶子时进行间苗,保证每盆200株幼苗。为了保证每盆在间苗后有200株幼苗,预先进行发芽率试验,测得垂穗披碱草发芽率为88.33%,老芒麦发芽率为84.00%,赖草发芽率为43.17%。待牧草长到三片叶片时,对所有花盆正常浇水,并采样一次,然后将其放入培养箱中,不再进行浇水。然后每隔5 d采样一次,干旱处理到20 d为止。样品迅速用锡纸包裹,液氮迅速冷冻后,放入-80℃低温冰箱保存[12]。然后分别测其各项植株形态指标,株高测15株,测植株含水量时5株植株一组,3次重复。
1.3 测量指标与方法
土壤含水量和植株含水量采用烘干法。植株株高变化用精确到0.1 cm的直尺测量。游离脯氨酸采用茚三酮法[13]。叶绿素采用95%酒精浸泡法测定[14]。丙二醛采用硫代巴比妥酸法[15]。可溶性糖采用苯酚法[15]。可溶性蛋白采用考马斯亮蓝染色法[15]。超氧化物歧化酶采用氮蓝四唑光化还原法[15]。上述所有指标均设3次重复。
1.4 抗旱性评价方法
抗旱性评价采用隶属函数法[16],以3种野生牧草在不同干旱胁迫下的的株高、含水量、游离脯氨酸、叶绿素、丙二醛、可溶性糖、可溶性蛋白和超氧化物歧化酶等作为指标进行综合评价。计算公式为:
D1(Xi)=(Xi-Xmin)/(Xmax-Xmin)
式中,Xi表示第i个指标值,Xmax表示所有品种第i个指标的最大值,Xmin表示所有品种第i个指标的最小值。若所测指标与植物的耐旱性呈负相关,则用反隶属函数计算其抗旱隶属函数值。
D2(Xi)=1-(Xi-Xmin)/(Xmax-Xmin)
根据3种野生牧草各指标的具体隶属函数值,计算出平均值后进行比较,平均值越大表示该牧草的抗旱性越强[17]。
1.5 数据处理
采用Excel 2013和SPSS 19.0进行数据处理和分析,并用SPSS 19.0中的非线性回归对植物生长进行方程拟合。
2 结果与分析
2.1 不同干旱胁迫时期土壤含水量的变化
随着干旱胁迫时间的增加,土壤相对含水量呈现先迅速下降后逐渐降低的变化趋势(表2)。在干旱胁迫初期,土壤相对含水量下降速率较大,干旱胁迫5 d之后,土壤相对含水量下降速率随着干旱胁迫时间的增加而逐渐减少。同时研究发现,在干旱胁迫时期,种植不同种类牧草的土壤相对含水量变化之间存在着显著性差异(P<0.05)。干旱胁迫处理15 d以后,3种野生牧草的幼苗出现不同程度的萎蔫现象,尤其在叶尖部位出现不同程度的干枯现象,老芒麦首先出现,垂穗披碱草次之,赖草最后。
2.2 干旱胁迫对幼苗株高的影响
逆境往往会对植物的形态特征造成一定的影响,由表3可知,干旱胁迫对3种野生牧草苗期株高的没有显著影响(P> 0.05)。但随着土壤相对含水量的降低和干旱胁迫时间的增加,3种野生牧草幼苗的株高变化量和平均生长速率呈现下降趋势,干旱胁迫越严重,平均生长速率(平均生长速率=(后一测量时的平均株高-前一测量时的平均株高)/5)下降速度越快。干旱胁迫20 d时,老芒麦株高变化值最小,为14.24 cm;赖草株高增加量最大,为23.82 cm;垂穗披碱草株高增加了18.22 cm,介于两者之间。对3种野生牧草在干旱胁迫下的株高变化进行数学计算模拟[18],其干旱胁迫阶段的生长方程依次为:y(CS1)=28.41/(1+1.97 Be-0.184t),y(LM2)=24.76/(1+1.79 Be-0.150t),y(LC3)=35.47/(1+2.57 Be-0.178 t),其中y表示株高,t表示生长时间。由上述公式可知,垂穗披碱草拐点处的株高为14.20 cm,老芒麦拐点处的株高为12.38 cm,赖草拐点处的株高为17.73 cm。
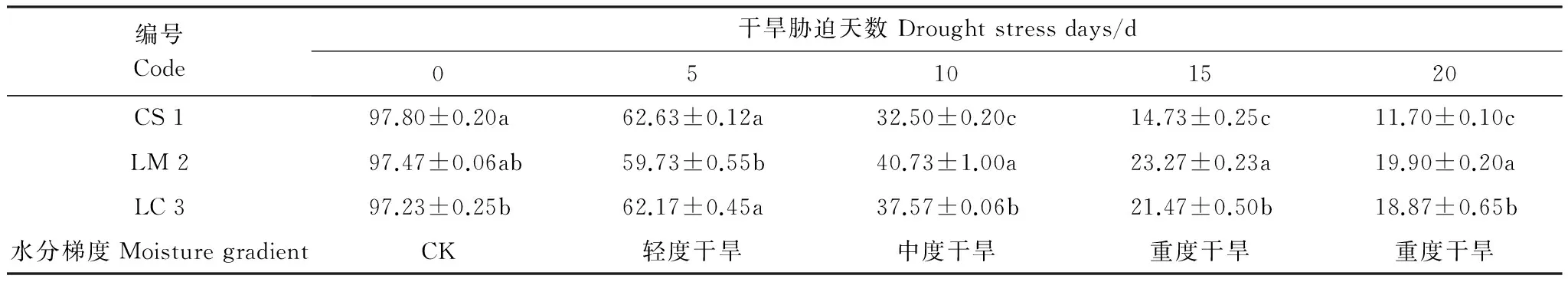
表2 干旱胁迫各时期土壤含水量变化/%
表中数据为平均值±标准差。同列不同字母表示存在显著差异,相同字母表示不存在差异(P<0.05)

表3 干旱胁迫各时期株高变化/cm
2.3 干旱胁迫对幼苗含水量的影响
植株含水量是表示干旱胁迫时植株体内水分亏缺程度的一个重要指标。研究发现,随着干旱程度的加重,3种野生牧草的含水量均随着干旱胁迫天数的增加而减少,且存在显著性差异(表4)。与对照相比,轻度干旱胁迫下牧草含水量变化值小于中度和重度干旱胁迫下牧草含水量的变化值。3种野生牧草在无干旱胁迫时的含水量由高到低依次为:老芒麦>赖草>垂穗披碱草,而干旱胁迫至20 d时,则为:赖草>垂穗披碱草>老芒麦。由此可知,不同种类的牧草在干旱胁迫时,其体内的水分亏损程度也不相同。

表4 干旱胁迫各时期牧草含水量变化/%
2.4 干旱胁迫对游离脯氨酸(Pro)含量的影响
脯氨酸是植物在受到干旱胁迫时表现较为敏感的一种渗透调节物质,其含量与抗旱性能成正相关[19- 21],从而可以通过植物体内脯氨酸含量来了解该植物抗旱能力。研究发现3种野生牧草幼苗受到干旱胁迫时,均表现为随着干旱程度的加剧,植物体内的脯氨酸也随之增加。其中赖草的增幅最大,垂穗披碱草的次之,老芒麦的最小。干旱胁迫为第5—10天阶段,增幅最大。同一干旱胁迫阶段,不同牧草体内脯氨酸含量也不相同。无干旱胁迫(CK)时,老芒麦中的脯氨酸含量最高,垂穗披碱草和赖草之间不存在显著性差异。干旱胁迫至第5天则赖草的脯氨酸含量最高,老芒麦次之,垂穗披碱草最小,存在显著性差异。然而,干旱胁迫至10 d之后,均表现为赖草的脯氨酸含量最高,垂穗披碱草次之,老芒麦最小,且存在显著性差异(P< 0.05)。

表5 干旱胁迫各时期游离脯氨酸(Pro)含量/(μg/g)
2.5 干旱胁迫对叶绿素(Chl)含量的影响
3种野生牧草的叶绿素含量随着干旱胁迫时间的增加而呈现下降趋势(表6)。同时,在相同干旱胁迫下,3种野生牧草间的叶绿素含量存在显著性差异(P< 0.05),赖草>垂穗披碱草>老芒麦。随着干旱胁迫时间的增加,3种野生牧草体内叶绿素含量变化值也不相同,其中赖草体内叶绿素含量下降值最大,叶绿素含量下降了12.64 mg/g,老芒麦减少了8.66 mg/g,垂穗披碱草减少了9.99 mg/g,介于两者之间。
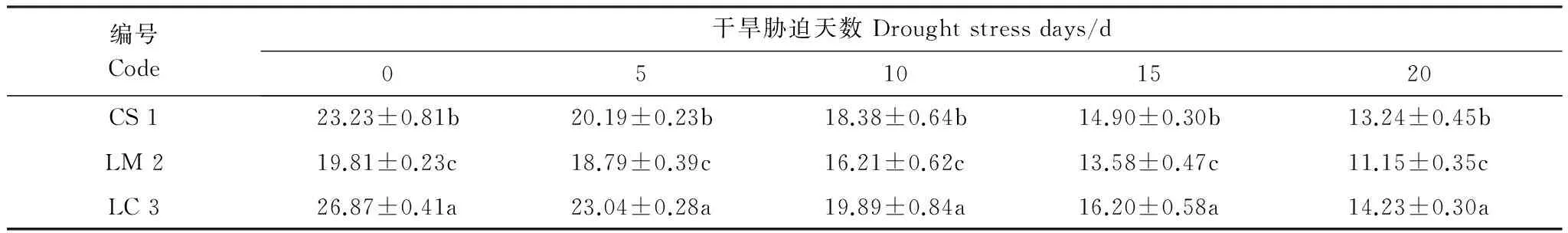
表6 干旱胁迫各时期叶绿素含量/(mg/g)
2.6 干旱胁迫对丙二醛(MDA)含量的影响
研究发现,3种野生牧草的MDA含量均随着干旱胁迫的加剧而增加(表7),其中老芒麦的MDA含量增加幅度最大,增加了39.65 nmol/g;垂穗披碱草次之,为35.01 nmol/g;赖草的增加值最小,为30.43 nmol/g。3种野生牧草的MDA含量升高速度呈现先慢后快的变化趋势。干旱胁迫初期MDA含量增加比较缓慢,干旱胁迫至5 d以后,3种野生牧草的MDA含量均发生较大幅度的增加。干旱天数相同条件下,3种野生牧草的MDA含量变化也不尽相同,对照组老芒麦的MDA含量最高,垂穗披碱草次之,但两者之间不存在显著性差异(P> 0.05);赖草中MDA含量最少,且与前两者之间存在着显著性差异。干旱胁迫至第5 天时垂穗披碱草的MDA含量最高,老芒麦次之,赖草最小,三者间均存在着显著性差异。然而,干旱胁迫至10 d之后,均表现为赖草的MDA含量最少,垂穗披碱草次之,老芒麦最大,三者间均存在着显著性差异。
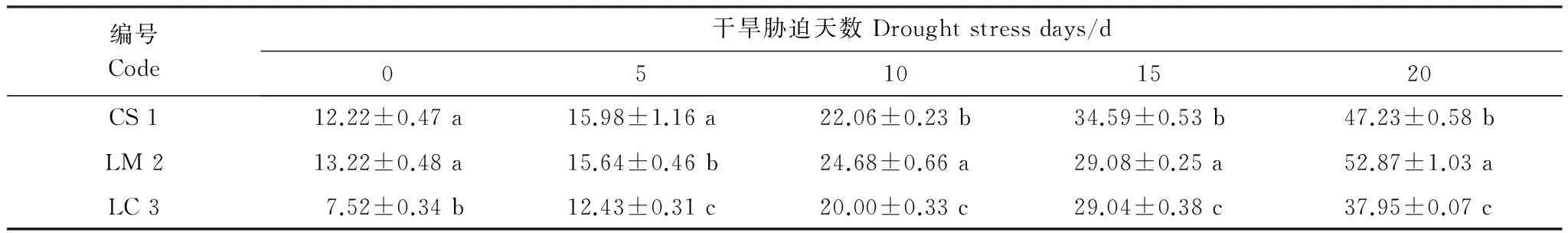
表7 干旱胁迫各时期丙二醛(MDA)含量/(nmol/g)
2.7 干旱胁迫对可溶性糖(SS)含量的影响
可溶性糖是植物在逆境生长环境下体内积累的渗透调节物质,可提高植株幼苗的吸水能力及降低叶片的渗透势。可溶性糖也是合成其他有机溶质的碳架和能量来源,同时在细胞内无机离子浓度高时起保护酶类的作用[22]。本研究结果表明,干旱胁迫处理后,3种野生牧草苗期可溶性糖含量随干旱胁迫时间的增加整体呈现先减小后增大的变化趋势(表8)。轻度干旱胁迫下3种野生牧草体内可溶性糖含量均最低,但老芒麦干旱胁迫第20天时的可溶性糖含量仍低于对照。无干旱胁迫时,老芒麦体内可溶性糖含量最高,垂穗披碱草最低,且三者之间存在显著性差异(P< 0.05)。轻度干旱和中度干旱胁迫下,3种野生牧草体内可溶性糖含量无显著性差异。重度干旱胁迫下,15 d时垂穗披碱草体内可溶性糖含量最高,老芒麦最低,三者之间存在显著性差异。20 d时垂穗披碱草体内可溶性糖含量最高,赖草次之,两者之间无显著性差异;老芒麦体内可溶性糖含量最低,与前两者之间存在显著性差异(P< 0.05)。

表8 干旱胁迫各时期可溶性糖(SS)含量/(mg/g)
2.8 干旱胁迫对可溶性蛋白(SP)含量的影响
植物体内的可溶性蛋白大多数是参与各种代谢的酶类,测其含量是了解植物体总代谢的一个重要生理生化指标。研究发现,垂穗披碱草可溶性蛋白含量呈现随着干旱胁迫时间的延长而增加。老芒麦和赖草体内可溶性蛋白含量呈现先减小后增大的变化趋势,老芒麦在干旱胁迫第10天时可溶性蛋白含量最低,而干旱胁迫第5天时赖草体内可溶性蛋白含量最低(表9)。同时在不同干旱胁迫阶段,植物体内可溶性蛋白含量呈现不同的变化规律。干旱胁迫初期(CK),老芒麦体内可溶性蛋白含量最高;轻度干旱胁迫时,垂穗披碱草体内可溶性蛋白含量最高,赖草最低;中度干旱时,赖草赖草体内可溶性蛋白含量最高,垂穗披碱草最低。干旱胁迫20 d时的可溶性蛋白含量变化规律与此一致。

表9 干旱胁迫各时期牧草可溶性蛋白(SP)含量/(μg/g)
2.9 干旱胁迫对超氧化物歧化酶(SOD)活性的影响
3种野生牧草SOD活性均随着干旱胁迫时间的增加而呈现先缓慢增加后快速增加的变化趋势。对照组赖草体内SOD活性最强,与其他2种体内SOD活性之间存在着显著性差异(P< 0.05);垂穗披碱草的SOD活性次之,老芒麦最低,两者之间无显著性差异(P> 0.05)。干旱胁迫处理后,3种牧草体内SOD活性均表现为赖草最高,老芒麦最低,垂穗披碱草介于两者之间,且三者之间均存在显著性差异(P< 0.05)。
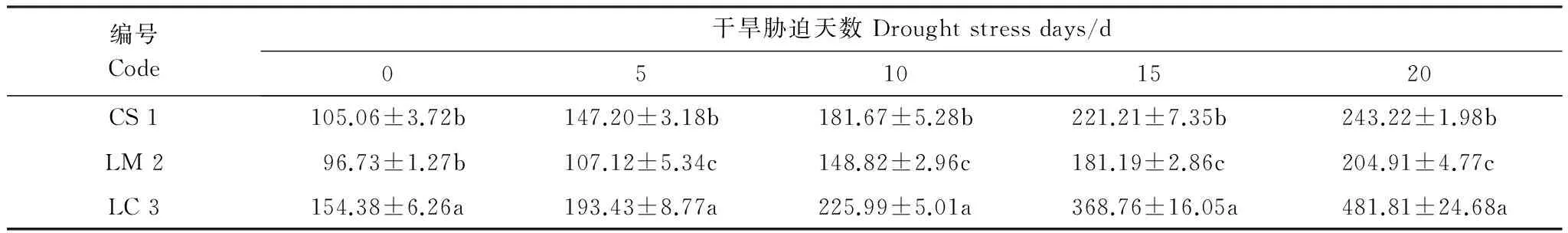
表10 干旱胁迫各时期超氧化物歧化酶(SOD)活性/(U/g)
2.10 抗旱性评价
采用隶属函数法对上述3种野生牧草苗期在干旱胁迫下的8个指标进行综合分析,由表11可知,赖草隶属函数平均值最大,为0.54,是3种野生牧草中抗旱性最强的。老芒麦隶属函数平均值最小,为0.35,抗旱性最弱。垂穗披碱草隶属函数平均值介于两者之间。3种野生牧草抗旱性强弱顺序依次为:赖草>垂穗披碱草>老芒麦。
3 讨论
土壤水分是植物生长的一个重要因素,对于作物的生理活动起着至关重要的作用[23]。因此,土壤相对含水量是反应干旱胁迫情况的一个重要指标。进行土壤相对水分含量的测定可以及时解田间土壤的实际含水状况,以便于及时进行灌溉,保墒和排水,以保证植物的正常生长;同时在实验中可以作为干旱胁迫分析计算的基础,以便于研究不同田间含水量对干旱胁迫下植物各种指标的影响。实验发现干旱胁迫处理初期,土壤含水量快速下降,而到后期下降速率减缓,可能是初期土壤水分由土壤扩散和植物蒸腾共同使水分快速散失[24]。同时研究发现,不同牧草植物对土壤水分的消耗也不相同。该结果表明了不同牧草植物对土壤蓄水保水能力具有一定的影响。
干旱胁迫对植物的影响主要体现在植株蒸腾、高度和含水量,以及对植物细胞活性、器官和组织功能等方面[5]。据研究表明,超氧化物歧化酶具有抗过氧化作用,其含量的升高能有效地清除活性氧,阻抑膜脂过氧化,从而对植物细胞进行保护作用[25]。但本研究发现,超氧化物歧化酶活性升高的过程中丙二醛含量也在升高,可溶性蛋白质含量和可溶性糖含量整体上呈先减小后增大的变化趋势。其原因可能是植物细胞只有在严格控制ROS的产生和清除的基础上,才能避免植物发生过氧化作用,但干旱胁迫会扰乱过氧化清除和产生之间的平衡,从而导致植物体内丙二醛含量升高,蛋白质和核酸受到损害[26- 27]。蛋白质和核酸受到损害后导致植物生长速率减缓。但在此过程中植物也为了适应在干旱环境下生长,便通过提高游离脯氨酸、可溶性糖和可溶性蛋白含量以及SOD活性来进行自我调节[28- 30]。但由于遗传背景不同,不同牧草在干旱胁迫下各项指标表现出不同的响应规律[10, 19, 31]。
可溶性糖和可溶性蛋白是植物重要的渗透调节物质[32]。可溶性糖可以使植物细胞脱水后保持其基本结构,减少植物在干旱胁迫下受到的损害,提高植物的抗旱性[32-33]。研究发现,3种野生牧草中可溶性糖含量均表现为随干旱胁迫时间的增加呈现先减小后增大的变化趋势,可能是因为干旱初期植物为了适应逆境环境,消耗一部分可溶性糖进行植物体内的代谢调节或者可溶性糖的合成受到了抑制[34],故植物体内可溶性糖含量减少。同时为了抵御干旱胁迫,体内积累大量可溶性糖,以减少逆境环境对植物的危害。同理,老芒麦和赖草的可溶性蛋白含量呈现先减小后增大的变化趋势。但垂穗披碱草可溶性蛋白含量呈现随着干旱胁迫天数的增加而增加,这已经在披碱草属牧草抗旱性研究中的到验证[35]。
受到干旱胁迫后,3种野生牧草幼苗的株高变化量、植株含水量和叶绿素含量均随干旱胁迫时间的增加呈现下降趋势。可能是为了减轻干旱胁迫造成的伤害,植物通过提高游离脯氨酸含量进行渗透调节,以从外界继续吸水分来维持膨压[5];在此过程中导致叶绿素降解或者叶绿素合成受阻[36],从而使植物体光合作用受到抑制,导致植物生长受到抑制。但也有研究证明,叶绿体、线粒体和质膜上发生的电子传递过程不可避免地产生 ROS,ROS与脂肪酸发生过氧化反应,从而导致细胞体内MDA含量升高[37- 38]。MDA含量的升高过程中,过氧化反应是否也导致了叶绿体中叶绿素合成受阻或者被降解,尚待进一步研究。
4 结论
通过用隶属函数法对干旱胁迫下3种野生牧草苗期8个指标进行综合评价,研究表明在这3种牧草中,赖草的抗旱性最好,披碱草次之,老芒麦较差。赖草具有强壮的根茎和迅速的分蘖繁殖能力,其在生态恢复过程中易形成单优群落;但赖草没有作为西藏干旱、半干旱地区生态恢复的首选草种,主要原因是赖草发芽率低,有性繁殖能力较差[40-41],在草地生态恢复的过程中,不易迅速形成地面覆盖层,生态恢复见效慢;而垂穗披碱草种子发芽率高,有性繁殖能力强,能够迅速形成地表覆盖层,且其抗旱性略次于赖草,所以披碱草可以作为西藏干旱、半干旱地区生态恢复的首选草种。
[1] 刘晓学, 冯柯, 严杜建, 吴晨晨, 赵宝玉. 西藏天然草原有毒植物危害与防控技术研究进展. 中国草地学报, 2015, 37(3): 104- 110.
[2] 张宪洲, 何永涛, 沈振西, 王景升, 余成群, 张扬建, 石培礼, 付刚, 朱军涛. 西藏地区可持续发展面临的主要生态环境问题及对策. 中国科学院院刊, 2015, 30(3): 306- 312.
[3] 王先明. 西藏农业自然条件与资源特点. 西藏科技, 1994, (3): 36- 52.
[4] 朱宝文, 李周藏, 祁如英, 贾迎春, 谢卫东. 兴海县草地生态现状及成因分析. 草业科学, 2004, 24(4): 88- 92.
[5] 曲涛, 南志标. 作物和牧草对干旱胁迫的响应及机理研究进展. 草业学报, 2008, 17(2): 126- 135.
[6] 孟祥浩, 刘义国, 张玉梅, 张洪生, 穆平, 林琪. 不同小麦品种苗期抗氧化特性及根系活力对盐胁迫的响应. 麦类作物学报, 2015, 35(8): 1168- 1175.
[7] 田玉强, 高琼, 张智才, 张勇, 朱锴. 青藏高原高寒草地植物光合与土壤呼吸研究进展. 生态环境学报, 2009, 18(2): 711- 721.
[8] 赵玉宇, 黄德君, 毛祝新, 聂斌, 傅华. 青藏高原地区不同垂穗披碱草居群营养品质研究. 草业学报, 2013, 22(1): 38- 45.
[9] 叶煜辉, 江明锋, 陈艳, 杨满业. 赖草属植物的抗逆性研究进展与应用前景. 生物学杂志, 2009, 26(4): 54- 57.
[10] 鄢家俊, 白史且, 常丹, 游明鸿, 张昌兵, 李达旭. 青藏高原老芒麦种质遗传多样性的SSR分析. 中国农学通报, 2010, 26(9): 26- 33.
[11] 赵雪雁, 万文玉, 王伟军. 近50年气候变化对青藏高原牧草生产潜力及物候期的影响. 中国生态农业学报, 2016, 24(4): 532- 543.
[12] 吕优伟, 贺佳圆, 白小明, 董沁, 雷娅伟. 9个野生早熟禾对低温胁迫的生理响应及苗期抗寒性评价. 草地学报, 2014, 22(2): 326- 333.
[13] 刘新. 植物生理学实验指导. 北京: 中国农业出版社, 2015.
[14] 王晓飞, 李志洪, 袁家萍, 付进. 玉米品种冠层NDVI与叶绿素的关系. 中国农学通报, 2010, 26(16): 175- 179.
[15] 张立军, 樊金娟. 植物生理学实验教程. 北京: 中国农业大学出版社, 2007.
[16] 郭郁频, 米福贵, 闰利军, 任永霞, 吕世杰, 伏兵哲. 不同早熟禾品种对干旱胁迫的生理响应及抗旱性评价. 草业学报, 2014, 23(4): 220- 228.
[17] 贾学静, 董立花, 丁春邦, 李旭, 袁明. 干旱胁迫对金心吊兰叶片活性氧及其清除系统的影响. 草业学报, 2013, 22(5): 248- 255.
[18] Xu H L, Xu Q C, Qin F F, Liu Q M, Lin S. Grain yield and leaf photosynthesis in transplanted winter wheat. Journal of Food, Agriculture & Environment, 2011, 9(2): 328- 334.
[19] 潘昕, 邱权, 李吉跃, 王军辉, 何茜, 苏艳, 马建伟, 杜坤. 干旱胁迫对青藏高原6种植物生理指标的影响. 生态学报, 2014, 34(13): 3558- 3567.
[20] 李波, 贾秀峰, 自庆武, 唐宇红. 干旱胁迫对苜蓿脯氨酸累积的影响. 植物研究, 2003, 23(2): 189- 191.
[21] Verbruggen N, Hermans C. Proline accumulation in plants: a review. Amino Acids, 2008, 35(4): 753- 759.
[22] 杨月娟, 周华坤, 王文颖, 殷恒霞, 姚步青, 余欣超, 赵新全, 王发刚. 盐胁迫对垂穗披碱草幼苗生理指标的影响. 兰州大学学报: 自然科学版, 2014, 50(1): 101- 106.
[23] 李炎, 王丹. 不同土壤水分测定方法的比较研究. 安徽农业科学, 2010, 38(17): 9110- 9112.
[24] 杜利霞, 董宽虎, 乔志宏, 韩汝旦, 娄世杰. NaCl胁迫对赖草幼苗生理特性的影响. 草原与草坪, 2013, 33(1): 1- 4, 10- 10.
[25] 孙位, 潘远智, 覃琳岚. GA3和CEPA对香水百合开花期光合生理和抗氧化酶活性的影响及其花期响应研究. 草业学报, 2015, 24(8): 73- 84.
[26] 张梦如, 杨玉梅, 成蕴秀, 周滔, 段晓艳, 龚明, 邹竹荣. 植物活性氧的产生及其作用和危害. 西北植物学报, 2014, 34(9): 1916- 1926.
[27] Xu H L, Xu Q C, Qin F F, Tian C M, Wang R. Applications of xerophytophysiology in plant production-tomato fruit yield and quality improved by restricted irrigations in soil-based greenhouses. ActaHortic.2011.893.111.
[28] 万里强, 石永红, 李向林, 何峰, 贾亚雄. PEG胁迫下3个多年生黑麦草品种抗性生理研究. 草地学报, 2009, 17(4): 440- 444.
[29] 何玮, 蒋安, 王琳, 张健, 秦晓鹏, 徐远东. PEG干旱胁迫对红三叶抗性生理生化指标的影响研究. 中国农学通报, 2013, 29(5): 5- 10.
[30] 穆怀彬, 伏兵哲, 德英. PEG- 6000胁迫下10个苜蓿品种幼苗期抗旱性比较. 草业科学, 2011, 28(10): 1809- 1814.
[31] 单长卷, 韩蕊莲, 梁宗锁. 干旱胁迫下黄土高原4种乡土禾草抗氧化特性. 生态学报, 2012, 32(4): 1174- 1184.
[32] 安玉艳, 梁宗锁. 植物应对干旱胁迫的阶段性策略. 应用生态学报, 2012, 23(10): 2907- 2915.
[33] 王飒, 周琦, 祝遵凌. 干旱胁迫对欧洲鹅耳枥幼苗生理生化特征的影响. 西北植物学报, 2013, 33(12): 2459- 2466.
[34] 董沁, 鲁存海, 白小明, 贺佳圆, 雷娅伟, 吕优伟. 野生早熟禾(PoaL.)对模拟干旱的生理响应. 中国沙漠, 2013, 33(6): 1743- 1749.
[35] 祁娟, 徐柱, 马玉宝, 王海清, 李临杭. 披碱草属六种野生牧草苗期抗旱胁迫的生理变化. 中国草地学报, 2008, 30(5): 18- 24.
[36] 曲东, 邵丽丽, 王保莉, 周莉娜. 干旱胁迫下硫对玉米叶绿素及MDA含量的影响. 干旱地区农业研究, 2004, 22(2): 91- 94.
[37] Zhu J K. Abiotic stress signaling and responses in plants. Cell, 2016, 167(2): 313- 324.
[38] Chan H L, Yokawa K, Kim W Y, Song C P. Editorial: ROS regulation during plant abiotic stress response. Frontiers in Plant Science, 2016, 7: 1536.
[39] 王志泰, 马瑞, 马彦军, 李毅. 利用隶属函数法分析胡枝子抗旱性. 干旱区资源与环境, 2013, 27(9): 119- 123.
[40] 刘晓妮, 李刚, 赵祥, 张宾宾, 刘碧荣, 董宽虎, 王永新, 任国华. 放牧对赖草群落生物量及植物多样性的影响. 草地学报, 2014, 22(5): 942- 948.
[41] 易津, 李青丰, 田瑞华. 赖草属牧草种子休眠与植物激素调控. 草地学报, 1997, 5(2): 93- 100.
DroughtstressresponsesoftheseedlingsofthreewildforagesinTibet
ZHANG Weihong1,2, LIU Dalin1, MIAO Yanjun2, YAN Tianfang1, LIN Yonghe3, XU Yamei2,*
1CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China2TibetAgriculturalandAnimalHusbandryCollege,Nyingchi860000,China3CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730000,China
In the present study, the effects of drought stress on seedling growth and physiology of three wild forages (Leymussecalinus,Elymusnutans, andE.sibiricus) in Tibet were investigated using pot experiments in a climate incubator. The drought resistance of the three forages was evaluated. One of the objectives of this study was to contribute to the breeding of drought-tolerant forage germplasm. The results showed that with increased drought stress, the relative water content of the soil decreased rapidly initially, and then slowly, and varied among different species. The average growth rate, plant water content, and leaf chlorophyll content decreased, but the proline content, MDA content, and SOD activity of the plants increased, as drought stress was prolonged. Moreover, the soluble sugar content of the plants decreased initially, and then increased as drought stress was prolonged. Briefly, the soluble sugar minimum values of all the plants occurred at day 5 after drought stress treatment, but soluble sugar content ofE.sibiricuswas still lower than that of the control after 20 days of drought stress treatment. The soluble protein content ofE.nutansincreased as drought stress was prolonged, but the soluble protein content ofL.secalinusandE.sibiricusdecreased initially and then increased with the duration of drought stress. The soluble protein contents ofE.sibiricuswere the lowest during the first 10 days of drought stress, whereas the soluble protein contents ofL.secalinuswere at the minimum level during the first 5 days of drought stress. By using the eight indicators for the three wild forage seedlings under drought stress, we performed a comprehensive evaluation of drought tolerance of the three wild forage seedlings with subordinate function and indicated the order of drought tolerance asL.secalinus>E.nutans>E.sibiricus. Therefore, the drought resistance ofL.secalinuswas the strongest, and it was suitable for planting in the arid regions of Tibet, butL.secalinusandE.nutanswith lower sexual reproduction rates were suitable grass species for ecological restoration in arid and semi-arid areas in Tibet.
wild forages; drought stress; growth traits; physiological characteristics; drought assessment
国家重点研发计划项目(2016YFC0502002);西藏自治区科技厅重点项目(2015ZDKJZC01- 8);西藏大学农牧学院“雪域英才工程”支持项目(2015XYB03)
2016- 09- 02; < class="emphasis_bold">网络出版日期
日期:2017- 07- 11
*通讯作者Corresponding author.E-mail: 670003231@qq.com
10.5846/stxb201609021789
张卫红,刘大林,苗彦军,闫天芳,蔺永和,徐雅梅.西藏3种野生牧草苗期对干旱胁迫的响应.生态学报,2017,37(21):7277- 7285.
Zhang W H, Liu D L, Miao Y J, Yan T F, Lin Y H, Xu Y M.Drought stress responses of the seedlings of three wild forages in Tibet.Acta Ecologica Sinica,2017,37(21):7277- 7285.
