肝癌小鼠模型中调节性T细胞对树突状细胞的作用
2017-11-21杜勇黄智铭林秀清陈新
杜勇,黄智铭,林秀清,陈新
(温州医科大学附属第一医院,浙江 温州 325015,1.儿科;2.消化内科)
肝癌小鼠模型中调节性T细胞对树突状细胞的作用
杜勇1,黄智铭2,林秀清2,陈新2
(温州医科大学附属第一医院,浙江 温州 325015,1.儿科;2.消化内科)
目的:构建BALB/c小鼠原位肝癌模型,分离肿瘤小鼠体内的CD4+CD25+调节性T细胞(Tregs)和树突状细胞(DC),研究Tregs对DC功能的影响.方法:采用肝癌细胞悬液直接接种BALB/c小鼠肝脏建立原位肝癌模型.模型制作成功后25 d处死动物,无菌取出脾脏,用免疫磁珠分选法分离纯化肝癌小鼠脾脏中的Tregs、CD4+CD25-效应T细胞和DC.Tregs和效应T细胞共培养,CCK8法检测Tregs对效应T细胞增殖情况的影响.DC和Tregs直接接触共培养,用流式细胞仪检测DC表面协同刺激分子CD80/CD86表达的变化,ELISA法检测培养上清液中TNF-α、IL-12的分泌.结果:成功构建了小鼠原位肝癌模型,并分离出高纯度的Tregs、效应T细胞和DC.Tregs在体外能抑制CD4+CD25-效应T细胞的增殖.DC和Tregs共培养时,Tregs会下调DC表面协同刺激分子CD80/CD86的表达,并抑制DC分泌IL-12和TNF-α.结论:肝癌小鼠模型中Tregs能抑制DC的功能,从而抑制机体的抗肿瘤免疫,针对Tregs进行肿瘤免疫治疗是肿瘤治疗的新策略.
肝肿瘤;CD4+CD25+调节性T细胞;树突状细胞;免疫抑制;小鼠
原发性肝癌是世界上最常见的恶性肿瘤之一,传统的治疗手段效果不佳,预后差.树突状细胞(dentritic cells,DC)疫苗可以有效地提呈肿瘤相关性抗原,激发宿主体内产生特异性抗肿瘤细胞的免疫,故成为近年来肿瘤治疗的研究热点[1].然而机体的肿瘤免疫抑制微环境与肿瘤免疫耐受及逃逸不利于免疫效应细胞发挥有效的抗肿瘤免疫.CD4+CD25+调节性T细胞(Tregs)在肝癌患者外周血和肿瘤微环境中表达增加,可能与肿瘤免疫逃逸有关[2].为此,本研究通过建立小鼠原位肝癌模型,研究Tregs对DC功能的影响,探讨肿瘤小鼠体内Tregs抑制抗肿瘤免疫反应的作用及机制.
1 材料和方法
1.1 材料
1.1.1 动物:6~8周龄的SPF级雄性BALB/C小鼠30只,体质量18~20 g,购自上海斯莱克实验动物有限公司,生产许可证号:SCXK(沪)2012-0002,饲养于温州医科大学实验动物中心SPF级实验室.所有动物实验均获本校伦理委员会及实验动物委员会批准.
1.1.2 细胞株:鼠源性H22腹水型肝癌细胞株购自武汉中国典型培养物保藏中心.
1.1.3 主要试剂及仪器:FITC rat anti-mouse CD4及同型对照FITC rat IgG2b购自美国BD公司;FITC rat anti-mouse CD80及同型对照FITC rat IgG2b、PE rat anti-mouse CD86及同型对照PE rat IgG2b、PE rat anti-mouse CD25及同型对照PE rat IgG2b购自美国eBscience公司;小鼠CD4+CD25+T细胞磁珠分选试剂盒及小鼠CD11C免疫磁珠分选试剂盒购自德国Miltenyi公司;CCK8试剂盒购自日本同仁化学研究所;TNF-α、IL-12 ELISA试剂盒购自德国IBL公司;流式细胞仪购自美国BD公司;光学显微镜购自日本Nikon公司.
1.2 方法
1.2.1 动物模型的制备:小鼠原位肝癌模型建立的具体步骤参照张海英等[3]的造模法.从液氮中取出冻存的肝癌细胞,常规复苏后,培养基调整细胞浓度为1X107个/mL,用1 mL BD注射器直接注入小鼠腹腔0.1 mL.8~9 d后无菌抽出癌性腹水,洗涤2次后计数,调整细胞浓度为106个/mL,造模备用.4%水合氯醛腹腔麻醉小鼠(100 mg/μL),麻醉后,取仰卧位,四肢固定于手术台上,备皮,酒精消毒后,于腹正中线剑突下作一长约0.8 cm的纵行切口,湿纱布垫于切口下方,轻压双侧肋弓,挤出肝左叶,暴露肝脏,用1 mL BD注射器针头与肝脏成30°角方向斜刺入肝实质后,缓慢注入10 μL肝癌细胞悬液(104个细胞);退出针头,压迫止血,轻轻将肝脏送回腹腔,依次缝合肌肉皮肤,关闭腹腔.术后继续饲养,自由饮水进食.
1.2.2 组织病理学检查:25 d左右,肝癌小鼠模型建造成功.小鼠精神萎靡,活动迟缓,大量腹水形成.解剖时可见肝脏表面有灰白色,质偏硬,大小在0.5~1.0 cm范围内的块状癌组织.取出癌组织,甲醇溶液固定,常规石蜡包埋,切片,HE染色,在光学显微镜下行组织学观察.
1.2.3 Tregs的免疫磁珠分选:无菌条件下取出肝癌小鼠脾脏,剪碎,用注射器针芯研磨脾组织后,通过200目钢网过滤,收集流出的单细胞悬液,制备脾单个核细胞悬液.严格按照Miltenyi的Tregs分离说明书,经过阴性及阳性分选后,获得纯化的Tregs和CD4+CD25-效应T细胞.按照Miltenyi的DC分离说明书进行操作,从脾单个核细胞悬液中分离获得DC.通过流式细胞仪检测分选出的Tregs、CD4+CD25-效应T细胞和DC的纯度.分别收集分选后的细胞,培养基洗涤,用于后续培养.用台盼蓝检测分选出的细胞的存活率,显微镜下观察死亡细胞被染成明显的蓝色,活细胞拒染呈无色透明状,计算分选出的活细胞率均大于95%.
1.2.4 CCK8检测增殖抑制试验:Tregs(2X104,8X104)和CD4+CD25-效应T细胞(8X104/孔)按1:4和1:1的比例混合培养在96孔板中,同时设对照组和空白孔,每组设5个复孔,每孔加0.5 μg ConA,至终浓度为2.5 μg/mL,用含血清和双抗的培养基每孔补足至200 μL,放于37 ℃和5% CO2培养箱中培养72 h,结束前4 h每孔加10 μL CCK8,用酶标仪测570 nm处OD值.
1.2.5 Tregs和DC的共培养:分选出的Tregs和DC(5X105)以0:1、1:1的比例直接接触共培养24 h后,加入脂多糖至终浓度为1 µg/mL,并设相应的对照孔,继续培养24 h,收集培养后的细胞并分离DC,流式细胞仪检测CD80/CD86的表达;ELISA法检测培养上清液中TNF-α、IL-12的表达.
1.3 统计学处理方法 采用SPSS18.0统计软件进行分析.计量资料用表示.进行正态性检验,符合正态性分布,2组间比较用t检验;非正态分布的数据,2组间比较用Mann-Whitney U检验.P<0.05为差异具有统计学意义.
2 结果
2.1 肝癌荷瘤小鼠模型建立 解剖肝脏表面可见直径0.5~1.0 cm大小的灰白色质地偏硬的癌组织包块,癌组织常规石蜡包埋、切片、HE染色.光学显微镜下观察到肝脏失去正常结构,坏死明显,癌细胞呈多角形或圆形,排列成巢而无间质成分,排列紊乱,细胞大小不一,异形性明显,见图1.
2.2 Tregs和CD4+CD25-效应T细胞的分离结果 肝癌小鼠脾脏单个核细胞按照Miltenyi的Tregs分离说明书经过免疫磁珠阴性分选和阳性分选后,分别获得Tregs和CD4+CD25-效应T细胞.肝癌小鼠脾脏单个核细胞按照Miltenyi的DC分离说明书进行操作,获得DC.流式细胞仪检测Tregs纯度>90%,CD4+CD25-效应T细胞纯度>90%,DC纯度>90%;见图2-4.

图1 肝癌组织标本及病理学检查结果
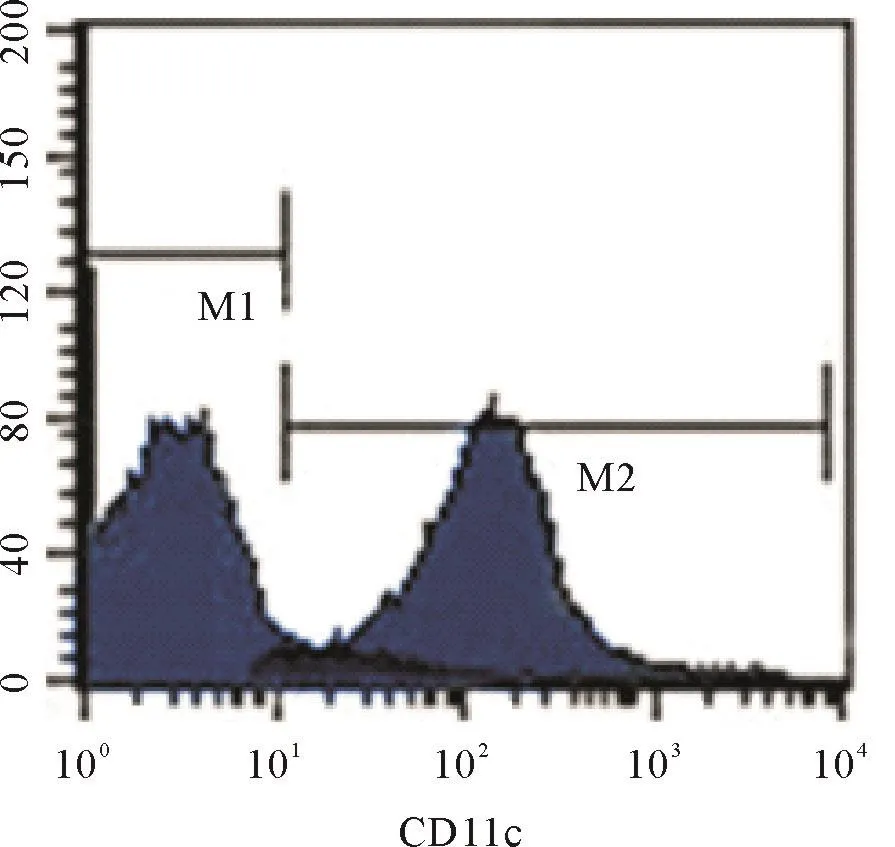
图2 免疫磁珠分选后DC的纯度
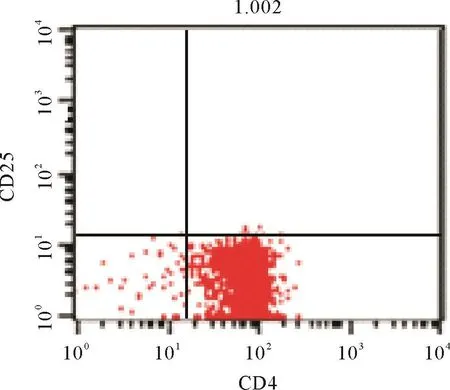
图3 免疫磁珠分选后CD4+CD25-效应T细胞的纯度
2.3 CCK8检测Tregs抑制CD4+CD25-效应T细胞的增殖 当Tregs与CD4+CD25-效应T细胞比为1:4混合共培养时,抑制率为23.61%.当Tregs与CD4+CD25-效应T细胞比为1:1混合共培养时,抑制率为53.95%,CD4+CD25-效应T细胞孔OD值为(1.28±0.09),Tregs与CD4+CD25-效应T细胞比为1:1混合共培养时,OD值为(0.82±0.03),2组间差异具有统计学意义(t=10.616,P<0.05).纯化的Tregs对CD4+CD25-效应T细胞的增殖有明显的抑制作用,见图5.

图4 免疫磁珠分选后Tregs的纯度

图5 Tregs和CD4+CD25-效应T细胞1:1共培养时,Tregs对CD4+CD25-效应T细胞增殖的影响
2.4 分选纯化后的各组形态DC 分为3组,DC单独培养(DC组);DC单独培养经LPS刺激活化(DC+LPS组);DC与Tregs直接接触共培养24 h后,再经LPS(1 μg/mL)刺激活化(DC+Tregs+LPS组).光学显微镜下DC和Tregs各细胞形态,见图6.
2.5 Tregs抑制DC表面协同刺激分子的表达及细胞因子的分泌 LPS刺激活化的DC表达高水平的协同刺激分子CD80/CD86,并分泌大量的免疫调节介质TNF-α和IL-12,当Tregs和DC共培养时,Tregs会抑制DC表面协同刺激分子的表达和细胞因子的分泌.当Tregs和DC以1:1比例直接接触共培养后,共培养组DC表面CD80的表达明显低于DC+LPS组中DC表面CD80的表达,差异具有统计学意义(209.4±25.8 vs.859.4±47.0,t=27.104,P<0.05);共培养组DC表面CD86的表达明显低于DC+LPS组中DC表面CD86的表达,差异具有统计学意义(312.0±40.1 vs.1 083.4±68.6,t=21.707,P<0.05),见图7.Treg和DC共培养组上清液中TNF-α的表达明显低于DC+LPS组中TNF-α的表达,差异具有统计学意义(275.4±19.7 vs. 578.0±49.2,t=12.781,P<0.05);共培养组上清液中IL-12的表达明显低于DC+LPS组中IL-12的表达,差异具有统计学意义(163.4±11.5 vs.411.2±29.1,t=17.686,P<0.05),见图8.

图6 光学显微镜下的DC和Tregs

图7 流式细胞仪检测DC细胞表面协同刺激分子CD80/CD86的表达
3 讨论
Tregs在维持机体的免疫耐受中发挥重要的作用,能抑制CD4+Th细胞、CD8+细胞毒性T细胞、自然杀伤性细胞等免疫细胞的功能.近年来研究发现,Tregs除了在自身免疫性疾病、哮喘、感染等方面发挥着作用,在肿瘤免疫方面也起着重要的作用,在胃癌、肝癌等多种肿瘤患者体内均有增多,其数量的增多预示癌症患者的预后变差[4-5],而去除Tregs可以增强机体的抗肿瘤免疫[6]. 在肝癌小鼠模型中,靶向药物索菲尼通过抑制Tregs的增殖和诱导其凋亡,从而产生有效的抗肿瘤免疫应答[7].在III期临床试验肿瘤患者中,通过ipilimumab单抗阻断CTLA-4可达到治疗效果[8].肿瘤免疫是以细胞免疫为主的免疫反应,肿瘤浸润淋巴细胞是宿主抗肿瘤免疫反应的重要途径之一.研究发现,在肿瘤微环境中虽然有大量的淋巴细胞浸润,但广泛的淋巴细胞浸润并没有控制肿瘤的发生及生长,提示肿瘤局部免疫监视和控制的失败.肿瘤细胞可以通过扩增或招募Tregs,抑制机体对肿瘤的免疫作用. Tregs可通过一系列的机制抑制机体的免疫功能,包括依赖抑制性细胞因子的途径、溶解细胞的途径、破坏细胞代谢的途径和调节抗原提呈细胞功能的途径[9-10].

图8 Tregs和DC直接接触共培养后上清液中TNF-α和IL-12的表达
DC是已知的体内抗原提呈功能最为强大的抗原呈递细胞,是连接固有免疫和获得性免疫的桥梁,在肿瘤免疫中起到十分重要的作用.在抗原提呈过程中,活化的DC会表达高水平的CD80/CD86,分泌大量的免疫调节介质TNF-α和IL-12来激活初始和记忆性T细胞,诱导抗原特异性CTL活化和增殖,从而杀伤肿瘤细胞.以DC为基础制备的DC肿瘤疫苗,可诱发机体产生较强的抗肿瘤免疫应答能力,在临床免疫治疗试验中显示出一定的治疗效果.但肿瘤患者体内常常存在DC数量的减少和功能的缺陷.在大鼠肝癌模型中,Tregs表达增高,而DC存在功能障碍.
本研究发现Treg和效应T细胞共培养时,Tregs能显著抑制CD4+CD25-效应T细胞的增殖,且抑制率随Tregs浓度的增大而增大.当Tregs与DC直接接触共培养时,Tregs可通过下调DC表面的CD80/CD86协同刺激分子,降低抗原提呈细胞活化T细胞的能力,并通过抑制DC TNF-α和IL-12的分泌,抑制T细胞的活化.
[1] ANGUILLE S, SMITS E L, LION E, et al. Clinical use of dendritic cells for cancer therapy[J]. Lancet Oncol, 2014,15(7): e257-e267.
[2] PEDROZA-GONZALEZ A, VERHOEF C, IJZERMANS J N, et al. Activated tumor infiltrating CD4+ regulatory T cells restrain antitumor immunity in patients with primary or metastatic liver cancer[J]. Hepatology, 2013, 57(1): 183-194.
[3] 张海英, 李艳茹, 王健君, 等. 小鼠原位移植性肝癌模型的建立及生物学特性[J]. 吉林大学学报(医学版), 2009, 35: 5-8.
[4] 蒋卫平, 丁茂文, 朱亚非, 等. 实时荧光定量RT-PCR检测人外周血单个核细胞中FOXP3 mRNA的表达[J]. 温州医学院学报, 2009, 39(6): 595-598.
[5] 陈坛辀, 金瑞放, 黄智铭, 等. CD4+CD25+Foxp3调节性T细胞在人幽门螺杆菌感染后胃黏膜中的表达[J]. 温州医学院学报, 2011, 41(2): 149-152.
[6] YANG P, LI Q J, FENG Y, et al. TGF-β-miR-34a-CCL22 signaling-induced Treg cell recruitment promotes venous metastases of HBV-positive hepatocellular carcinoma[J].Cancer Cell, 2012, 22(3): 291-303.
[7] CHEN M L, YAN B S, LU W C, et al. Sorafenib relieves cell-intrinsic and cell-extrinsic inhibitions of effector T cells in tumor microenvironment to augment antitumor immunity[J]. Int J Cancer, 2014, 134(2): 319-331.
[8] BLANK C U, ENK A. Therapeutic use of anti-CTLA-4 antibodies[J]. Int Immunol, 2015, 27(1): 3-10.
[9] YI Y, HE H W, WANG J X, et al. The functional impairment of HCC-infiltrating γδ T cells, partially mediated by regulatory T cells in a TGFβ- and IL-10-dependent manner[J]. J Hepatol, 2013, 58(5): 977-983.
[10] ROTHSTEIN D M, CAMIRAND G. New insights into the mechanisms of Treg function[J]. Curr Opin Organ Transplant, 2015, 20(4): 376-384.
(本文编辑:吴彬)
The influence of regulatory T cells on dendritic cells in mice with hepatocellular carcinoma
DU Yong1,HUANG Zhiming2, LIN Xiuqing2, CHEN Xin2.
1.Department of Pediatrics, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Gastroenterology and Hepatology, the First Affiliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To investigate how CD4+CD25+regulatory T cells (Tregs)impacted on dendritic cells which were separated from BALB/c mice with hepatocellular carcinoma.Methods:BALB/c mice with hepatocellular carcinoma were established in laboratory. Twenty-five days after the models, the tumor-bearing mice were sacrificed and fresh spleen tissues were separated. Tregs, CD4+CD25-T cells and dendritic cells were separated from the mice's spleen and purified by immuno-magnetic beads according to the manufacturers' instructions. Tregs were co-cultured with CD4+CD25-T cells and the proliferation experiment was measured with CCK8. Tregs were directly co-cultured with dendritic cells and then the expression of CD80/CD86 on dendritic cells was detected by flow cytometry. The levels of TNF-α and IL-12 in supernatants were detected by ELISA.Results:We successfully established the tumor model of hepatocellular carcinoma and obtained high purity of Tregs, CD4+CD25-T cells and dendritic cells. Tregs could suppress the proliferation of CD4+CD25-T cells in vitro. Tregs could down-regulate the expression of CD80/CD86 on dendritic cells and inhibit the expression of TNF-α and IL-12.Conclusion:Tregs play an important role in the establishment and persistence of tumor immune suppression. Tregs can inhibit the function of dendritic cells in tumor-bearing mice. So Tregs may be a promising therapeutic target for cancer.
hepatocellular carcinoma; CD4+CD25+regulatory T cells; dendritic cells; immunosuppression;mice
R392
A
10.3969/j.issn.2095-9400.2017.10.004
2017-03-14
浙江省自然科学基金资助项目(Y2090660).
杜勇(1986-),女,浙江温州人,住院医师,硕士.
黄智铭,主任医师,Email:wfyhzm@163.com.
