解淀粉芽孢杆菌TWC2发酵条件的优化
2017-11-20梁艳琼黄兴吴伟怀李锐郑金龙习金根贺春萍易克贤
梁艳琼 ,黄兴 ,吴伟怀 ,2,李锐 ,郑金龙 ,习金根 ,贺春萍 *,易克贤 *
(1.中国热带农业科学院环境与植物保护研究所/农业部热带农林有害生物入侵监测与控制重点开放实验室/海南省热带农业有害生物检测监控重点实验室,海口571101;2.农业部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地—海南省热带作物栽培生理学重点实验室/农业部儋州热带作物科学观测实验站,海南儋州571737)
解淀粉芽孢杆菌TWC2发酵条件的优化
梁艳琼1,黄兴1,吴伟怀1,2,李锐1,郑金龙1,习金根1,贺春萍1*,易克贤1*
(1.中国热带农业科学院环境与植物保护研究所/农业部热带农林有害生物入侵监测与控制重点开放实验室/海南省热带农业有害生物检测监控重点实验室,海口571101;2.农业部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地—海南省热带作物栽培生理学重点实验室/农业部儋州热带作物科学观测实验站,海南儋州571737)
为了提高解淀粉芽孢杆菌Bacillus amyloliquefaciens TWC2菌株活性代谢物质的产量,以菌体生物量和发酵液拮抗甘蔗赤腐病菌(Colletotrichum falcatum Went.)活性为指标,采用单因素和正交试验的方法对TWC2菌株发酵培养基成分和发酵条件进行优化。结果表明,TWC2菌株最佳发酵培养基组成为:5 g/L麦芽糖,10 g/L果糖,10 g/L蛋白胨,10 g/L酵母浸出粉,1 g/L CaCl2。最适发酵条件为:培养温度34℃,摇床转速200 r/min,发酵起始pH 6.0~6.5,接种量7%,装液量40 mL/250 mL,发酵时间为48 h。在最佳发酵培养基和培养条件下,发酵液抑制甘蔗赤腐病菌的能力较优化前提高了39.91%。
解淀粉芽孢杆菌;发酵条件优化;甘蔗赤腐病菌
随着化学药剂的长期大量使用,病原菌的抗药性日渐突显,给环境安全和人类健康带来严重危害。因此亟待寻求环境友好、安全有效的病害防治方法。利用微生物及其代谢产物控制病原菌来防治植物病害日益受到人们的关注和重视。芽孢杆菌属(Bacillus spp.)是土壤和植物微生态的优势种群,通过分泌抗生物质和生长竞争在防治植物病害方面发挥多种有益作用[1]。解淀粉芽孢杆菌Bacillus amyloliquefaciens是一种与枯草芽孢杆菌Bacillus subtilis亲缘性很高的细菌,在其自身的生长过程中可以产生一系列的代谢产物,这些代谢产物使得解淀粉芽孢杆菌具有广泛地抑制真菌和细菌的活性作用[2]。目前对芽孢杆菌的发酵培养基及其发酵条件的研究报道较多。不同培养基组分及发酵条件对微生物的生长繁殖和抑菌活性物质的产生有很大的影响[3]。陈敏等通过比较解淀粉芽孢杆菌SC1150菌株发酵液对香蕉枯萎病菌4号生理小种的抑菌活性,对解淀粉芽孢杆菌SC1150菌株液体发酵条件进行了优化研究,优化后SC1150菌株对香蕉枯萎病菌4号生理小种的抑菌圈直径达到28.33 mm[3]。张荣胜等通过Plackett-Burman试验设计及Box-Behnken设计的响应曲面法对影响生防菌株Lx-11发酵培养基和培养条件进行了优化[4]。卢彩鸽等运用Minitab软件,通过Box-Benhnken试验及响应面分析相结合的方法对解淀粉芽胞杆菌MH71产抗菌物质的发酵培养基配方和摇瓶发酵条件进行了优化,在最佳培养基和培养条件下,菌株MH71的活菌数达到了2.1×109CFU/mL,芽孢数为1.2×109CFU/mL,同时对番茄灰霉病菌的抑菌能力较优化前提高了37.4%[5]。
目前,微生物农药大多是以活菌制剂为主,发酵工艺不稳定和活菌数不高是研究和生产中常见问题,因此生防菌株的发酵工艺是决定其能否被开发为生物农药的关键因子[6]。本实验室前期从台湾草叶片上筛选到1株对甘蔗赤腐病菌有较强拮抗作用的菌株TWC2,抗菌谱测定发现该菌株对香蕉黑星病菌、橡胶树炭疽病菌、柱花草炭疽病菌、芒果炭疽病菌、甘蔗环斑病菌、王草茎点霉叶斑病菌、西瓜枯萎病菌等均有较好的抑制效果,并通过菌落形态观察、生理生化特性分析和16S rDNA序列鉴定,确定该菌株为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。为了进一步提高其生防效果、降低发酵成本、开发应用价值,本研究以甘蔗赤腐病菌为指示菌,以提高其抗菌活性物质产量为目的,优化TWC2菌株的发酵条件,为后期的推广应用、抑菌物质的提纯和产业化提供科学依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 解淀粉芽孢杆菌(B.amyloliquefaciens)TWC2,从健康台湾草植株叶片中分离获得;甘蔗赤腐病菌SL120-2,由中国热带农业科学院环境与植物保护研究所鉴定保存。
1.1.2 培养基 LB培养基:胰蛋白胨10 g,酵母浸出粉5 g,NaCl 10 g,蒸馏水1000 mL。
NA培养基:蛋白胨10 g,葡萄糖2.5 g,牛肉浸膏3 g,pH值7.2~7.4,蒸馏水1000 mL。
BPY 培养基:葡萄糖 5g,蛋白胨 1 g,牛肉膏 5 g,酵母膏 5 g,NaCl 5 g,pH 7.0,蒸馏水 1000 mL。
NYBD培养基:牛肉浸膏8 g,酵母浸膏5 g,葡萄糖10 g,蒸馏水1000 mL。
YPG 培养基:酵母膏 10 g,蛋白胨 20 g,葡萄糖 20 g,pH 7.0,蒸馏水 1000 mL。
基础发酵培养基:葡萄糖 10 g,蛋白胨 10 g,KH2PO40.2 g,MgSO40.2 g,pH 7.0,蒸馏水 1000 mL。
YSP培养基:酵母浸膏 5 g,蔗糖 20 g,蛋白胨 10 g,pH 7.0,蒸馏水 1000 mL。
初始发酵培养基:牛肉膏3 g,蛋白胨5 g,葡萄糖10 g,蒸馏水1000 mL。
1.2 方法
1.2.1 种子菌液制备 挑取一个活化的TWC2菌株单菌落于液体种子培养基中,30℃、180 r/min条件下培养12~16 h,此时菌量约为108CFU/mL,作为种子菌液。
1.2.2 菌株生长曲线的测定 将种子液以1%接种量接种于LB培养基,在上述培养条件下,分别于培养后0~36 h取样,采用紫外可见分光光度计在600 nm处测定OD值,以时间为横坐标、OD值为纵坐标,做出在不同培养时间下菌株菌量变化的生长曲线。
1.2.3 初始发酵培养基的筛选 将TWC2种子液接入LB液体培养基中,180 r/min振荡培养24 h,按照1%的接种量分别接入以下几种培养基:LB培养基、NA培养基、BPY培养基、初始发酵培养基、NYBD培养基、YPG培养基、基础发酵培养基和YSP培养基中,以OD600和发酵液抑菌活性为指标,检测菌株最适培养基。
1.2.4 发酵培养基营养成分的单因素筛选 选取发酵后OD600值最高和抑菌活性最强的发酵培养基作为初始发酵培养基,进行培养基成分优化。
最佳碳源:分别以含量为1%(W/V)的木糖、蔗糖、可溶性淀粉、果糖、甘露醇、麦芽糖、乳糖、淀粉、山梨醇9种碳源替换初始发酵培养基中的葡萄糖,其他成分不变,以葡萄糖和不加碳源为对照。三角瓶中的装液量为 100 mL/250 mL,按1%的接种量接种培养种子液,于180 r/min、30℃条件下摇培48 h。每个处理做3个重复。
最佳氮源筛选:分别以含量为1%(W/V)的酵母浸出粉、麸皮、牛肉浸膏、蛋白胨+酵母浸出粉(1∶1)、蛋白胨+酵母浸出粉+氯化铵(2∶2∶1)、蛋白胨+酵母浸出粉+硝酸铵(2∶2∶1)、尿素、氯化铵、硝酸铵 9 种氮源替换初始发酵培养基中的蛋白胨,以蛋白胨和不加氮源为对照。其它发酵条件同上。
无机盐的筛选:在基础培养液中分别添加0.5%的磷酸二氢钾、硫酸镁、硫酸锰、硫酸铁、氯化钠、氯化钙、硫酸锌、不加无机盐,其他条件同上,每处理3次重复。
多因素正交试验:以单因子试验筛选出的最佳碳源、氮源、无机盐为变异因素,采用L16(45)正交表进行培养基优化试验,确定培养基各成分的最佳配比。
1.2.5 菌株发酵条件的优化 以优化后的培养基为发酵培养基,对TWC2菌株装液量、接种量、初始pH值、发酵时间、转速及温度等发酵条件进行优化。在 250 mL的三角瓶中,分别装入 20、40、60、80、100、120、140和160 mL发酵培养液;接种量分别设为装液量的1%、3%、5%、7%和9%;将培养基初始pH值分别设为4.0、5.0、5.5、6.0、6.5、7.0、7.5、8.0、9.0 和 10.0;发酵时间分别调为 12、24、36、48、60、72、96 和 120 h;转速分别调为120、160、180、200 和 220 r/min;温度分别调为 10、15、20、24、26、28、30、32、34、37 和 40℃。 每处理 3 次重复,其他发酵条件同1.2.4。测定OD600和抑菌活性。
1.3 测定方法[2,7]
1.3.1 菌体生物量 将菌株TWC2发酵液用0.85%生理盐水稀释5倍,用紫外分光光度计(波长600 nm)测定发酵液,以0.85%生理盐水为对照。以光密度值OD600为标准判断菌体生物量,OD600值大表示菌体量多,OD600值小表示菌体量少。
1.3.2 发酵液抑菌活性 采用杯碟法检测,刮取在PDA培养基上培养5 d的甘蔗赤腐病菌孢子,配制成浓度为107个孢子/mL的悬浮液。取1 mL该菌悬液加入到99 mL预冷至50℃左右的PDA培养基中,充分混匀后倒平板。凝结后均匀放置无菌牛津杯,加入30 μL菌株TWC2上清液。根据菌落生长情况,3~5 d测量抑菌圈的直径。
1.4 数据统计与分析
采用软件SAS 9.0对数据进行差异显著性和相关性分析,用Microsoft Excel软件作图并进行分析。
2 结果与分析
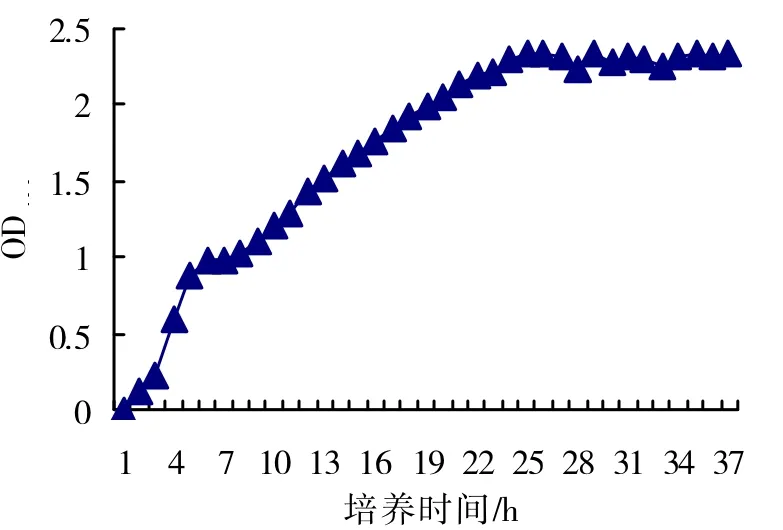
图1 TWC2菌株生长曲线
2.1 TWC2菌株生长曲线的测定
每隔1 h取TWC2培养液,用紫外分光光度计测定其OD600,连续测定36 h得出一系列的OD数值,将这些数值做成细菌生长曲线图(图1)。在0~24 h处于对数生长期,菌体生长力旺盛,菌体浓度迅速增大,这个时期TWC2以几何级数极快增长,24 h时OD600最大值为2.335;24~36 h TWC2进入稳定期,生长菌群总数处于平坦阶段,OD600值在2.100~2.400之间波动。考虑到菌体浓度和发酵成本,选取培养24 h的TWC2菌液作为最佳接种时间的种子液。
2.2 最佳初始发酵培养基的筛选
对8种培养基进行筛选,结果表明基础发酵培养基效果较好,OD600及抑菌圈直径高于其他培养基,菌体生物量达到0.265,抑菌圈直径为3.249 cm(见图2),因此选择基础发酵培养基为最佳初始发酵培养基。

图2 不同培养基对TWC2菌株发酵的影响

图3 不同碳源对TWC2菌株发酵的影响
2.3 发酵培养基营养成分的单因素筛选
2.3.1 碳源的筛选 碳源的单因素筛选结果如图3所示,当碳源为麦芽糖时,菌株发酵液菌体生物量最大,为0.812,其后菌量大小依次为葡萄糖>乳糖>山梨醇>木糖>淀粉>甘露醇>果糖>可溶性淀粉>蔗糖;从抑菌圈直径上来看,果糖的抑菌圈直径为4.373cm,其次分别是葡萄糖>蔗糖>可溶性淀粉>乳糖>山梨醇>甘露醇>木糖>淀粉。综合菌体生物量和抑菌圈直径,选择麦芽糖和果糖为复合碳源。
2.3.2 氮源的筛选 氮源筛选试验表明,当氮源为蛋白胨+酵母浸出粉(1∶1)时,TWC2菌株的OD600值和抑菌圈直径均最高,分别达到0.433,4.730cm。其次氮源为蛋白胨+酵母浸出粉+氯化铵(2∶2∶1)、麸皮、牛肉浸膏、蛋白胨+酵母浸出粉+硝酸铵(2∶2∶1)、酵母浸出粉和蛋白胨时,TWC2菌株的OD600值和抑菌圈直径也较高,但当氮源为尿素、氯化铵、硝酸铵时,OD600值和抑菌圈直径最低,均为0(结果见图4)。因此,选用蛋白胨+酵母浸出粉(1∶1)作为优化培养基的氮源。
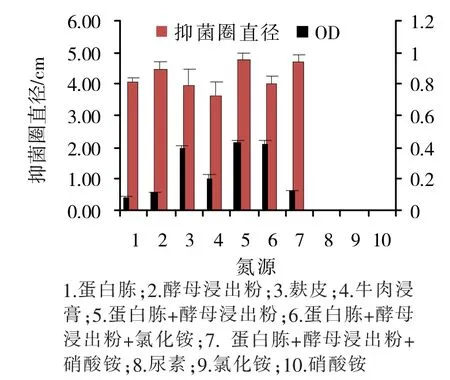
图4 不同氮源对TWC2菌株发酵的影响

图5 不同无机盐对TWC2菌株发酵的影响
2.3.3 无机盐的筛选 与对照不添加无机盐的培养基相比,当添加CaCl2培养基的菌体生物量和抑菌圈直径均显著增加,分别为2.224和3.586 cm。当无机盐为硫酸镁、硫酸锰、氯化钠时,其抑菌圈直径与对照相比较,差异不显著;而OD600值差异显著,其大小依次为:硫酸锰>硫酸镁>不添加无机盐(对照)>氯化钠。当无机盐为磷酸二氢钾时,抑菌圈直径和OD600值较对照降低,且差异显著。添加 FeSO4和ZnSO4的培养基,TWC2菌株不生长,说明这两种无机盐强烈抑制TWC2的生长。因此选用CaCl2作为优化培养基的最佳无机盐。
2.3.4 正交试验优化培养基配比 根据上述碳源、氮源和无机盐的筛选结果,通过正交实验设计,选用5因素4水平L16(45)正交表确定各组分的最佳配比,以确定适宜TWC2菌株生长和产抗菌物质的优化培养基的最佳组合。通过正交实验设计对筛选到的最佳碳源、氮源和无机盐进行优化,结合TWC2抑菌活性,最终确定TWC2的最优培养基。其组分含量为:0.5%麦芽糖,1%果糖,1%蛋白胨,1% 酵母浸出粉,0.1%CaCl2。
2.4 培养条件的优化
2.4.1 初始pH值对TWC2菌株发酵的影响 TWC2菌株在pH 5.0~9.0时均可生长,其中在pH 6.0~8.0时菌株生长量较高,pH 7.0~9.0时,菌株生长量略微降低。发酵液活性方面,在pH值6.0~6.5活性最高。在pH值小于4.0或者大于10.0均不利于菌株的生长及抑菌物质的产生。在pH 6.0~6.5时菌体生长量和发酵液活性均达到最佳值。因此,发酵培养基的初始pH值以6.0~6.5为宜(见图6)。
2.4.2 温度对TWC2菌株发酵的影响 分别在不同温度下进行发酵,结果表明该菌株在10~40℃均能生长,差异显著,其中在温度范围为30~37℃,菌株菌体生长量较高,在发酵液活性方面,34℃时发酵液显示出较强的抑菌活性,抑菌圈直径达到4.745 cm(见图7)。综合上述因素,最佳发酵温度为34℃。

图6 不同初始pH值对TWC2菌株发酵的影响

图7 不同温度对TWC2菌株发酵的影响
2.4.3 发酵时间对TWC2菌株发酵的影响 发酵时间对TWC2菌株发酵试验表明,在培养12~48 h时,菌体生长量呈上增的趋势;在48~72 h,随着时间的延长,菌体生长量呈下降趋势,在60~96 h,菌体生长量维持在一个稳定并且较高的水平,在96~120 h,菌体生长量呈下降趋势。在发酵液活性方面,在12~48 h,随着时间的增加,发酵液活性逐渐增强,并在48 h时到达最大值;在48~96 h时,发酵液活性降低并维持在一个水平上,在96~120 h,发酵液活性降低(见图8)。综合以上结果,48 h为TWC2菌株最佳发酵时间。
2.4.4 接种量对TWC2菌株发酵的影响 不同接种量对菌株发酵影响的试验结果表明(见图9),接种量在1%~9%范围内菌株TWC2的发酵液均具有一定的抑菌活性,且差异不显著;而菌体生物量随着接种量增加呈先增加后降低的趋势,当接种量为7%时,菌体生物量达到最大,接种量超过7%后,菌体生物量降低,可能是由于发酵液中营养成分被过度消耗而形成的,因此,选用7%为最佳接种量。
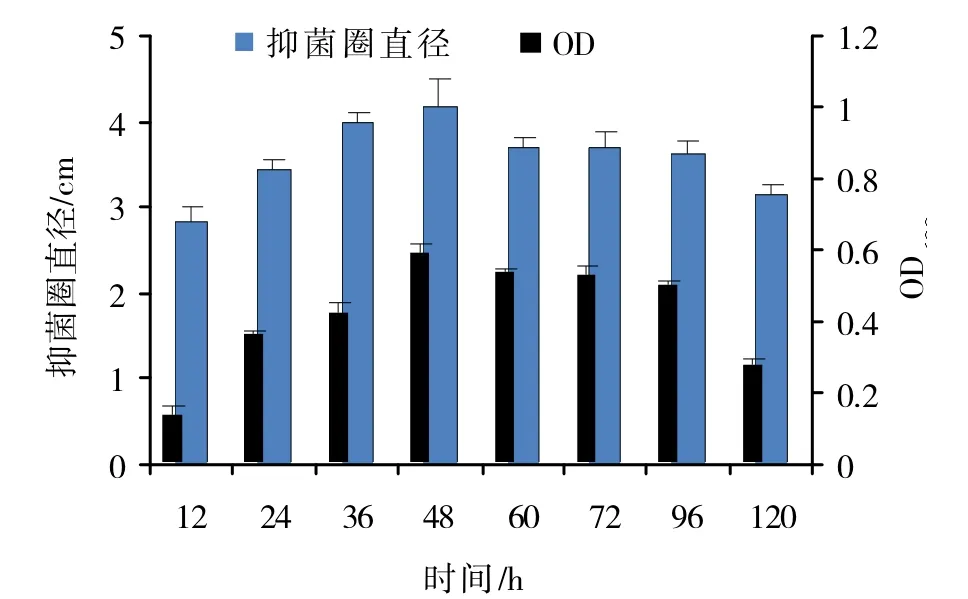
图8 不同发酵时间对TWC2菌株发酵的影响

图9 不同接种量对TWC2菌株发酵的影响
2.4.5 转速对TWC2菌株发酵的影响 在转速为120~200 r/min,菌体生物量和发酵液抑菌活性随着转速的增加而逐渐增加,并且在转速为200 r/min时达到最大值,而转速超过200 r/min时菌体生物量和活性物质均降低。转速较高或者较低都会影响TWC2菌体生长和抑菌活性物质的产生,可能是TWC2属于好氧菌,而好氧菌通过调节转速从而达到溶氧的目的,进而会提高抑菌活性物质产量;转速太低,不利于菌体生长;而转速过高时,会破坏菌体的结构,进而抑制了活性物质的产生。因此,选用200 r/min为最佳转速(见图10)。
2.4.6 装液量对TWC2菌株发酵的影响 对发酵培养基装液量进行试验(见图11),结果发现当装液量为40 mL/250 mL时菌体生物量和抑菌活性物质产量最大,而当装液量超过40 mL/250 mL时,菌体生物量和活性物质产量均降低,可能随着装液量的增加,发酵过程中溶氧量不足,不利于菌体生长,从而影响活性物质的产量。因此选用40 mL/250 mL为最佳装液量。

图10 不同转速对TWC2菌株发酵的影响

图11 不同装液量对TWC2菌株发酵的影响
2.5 优化前后活性比较
优化前后试验对比发现,基础发酵培养基菌株发酵液的抑菌圈直径为2.23 cm、OD600为0.979,优化后分别提高到了3.12 cm,OD600达到1.422,即抑菌活性和菌体生物量较优化前分别提高了39.91%和45.25%。
3 讨论
发酵培养液不仅是生防菌株生长繁殖所需营养物质的基本条件,而且也是其合成代谢产物的基础。它既要满足生防菌株能够快速生长繁殖至一定的菌体浓度,又要使菌株迅速合成代谢产物。因此发酵培养液的组分(碳源、氮源、无机盐等营养成分)和培养条件(如温度,培养液的酸碱度,培养时间,通气量和接种量等)对菌株生长及活性物质产生是至关重要的,这些因素既相互促进亦相互制约[8-13]。郭龙涛[6]等采用单因素试验和正交试验,确定内生解淀粉芽孢杆菌TB2最佳培养基组分为:玉米淀粉1.0%、豆粉1.0%、(NH4)2SO40.5%、MgSO4·7H2O 0.1%、FeSO4·7H2O 0.03%、K2HPO4·3H2O 0.02%、KH2PO40.01%;培养条件为初始 pH 值为 7.5,温度35℃,接种量3%,装液量50 mL/250 mL三角瓶,摇床转速200 r/min,发酵周期22~26 h。魏娇洋[14]等发现内生解淀粉芽孢杆菌X-278培养基各组分的最佳配比为:葡萄糖1.5%、花生饼粉2%、硫酸铵0.5%、碳酸钙0.1%、硫酸镁0.5%、氯化钠0.5%;最佳发酵培养条件为初始pH7.0,培养温度34℃,转速180 r/min,种龄为24h,装液量150mL/500 mL三角瓶,接种量2%,发酵时间为72h。上述报道表明了不同来源的同种菌株对营养需求不同,每个菌株都有其自身独特的营养需求。因此,对微生物发酵培养基组成和发酵条件的优化是获得最佳生产效率和经济效益的基础。
本研究结果表明,最适该菌株菌体生长和产生抑菌物质的发酵培养基配方为:5 g/L麦芽糖,10 g/L果糖,10 g/L蛋白胨,10 g/L酵母浸出粉,1 g/L CaCl2;最适发酵条件为:培养温度34℃,摇床转速200 r/min,发酵初始pH 6.0~6.5,接种量7%,装液量40 mL/250 mL,发酵时间为48 h。在不同培养基组分和培养条件下,TWC2菌株生长量和产生抑菌物质产量的变化不完全一致。在发酵过程中,TWC2菌株在初始pH 4、pH 11的培养基中无法生长,在pH 6.0~6.5生长和抑菌效果均最佳,表明了TWC2菌株适宜在偏酸性的环境中生长,过酸过碱均不利其生长,这与Zhao[15]等、李娟[16]等研究一致。转速、装液量与菌体生物量、抑菌效果呈相关性,不同转速、不同的装液量导致不同溶氧条件,通过提高溶解氧可以加速TWC2的生长,从而缩短时间,加快、加大产生抑菌物质。
本研究只在摇床条件下对TWC2菌株的发酵培养基组成和发酵条件进行了初步研究,这些参数有待于在产业化生产过程中进一步验证,从而为该菌株应用于甘蔗赤腐病的生物防治提供理论依据。
[1]张文芝,王云鹏,刘红霞,等.蜡质芽孢杆菌AR156发酵培养基及发酵条件的优化[J].微生物学通报,2010,37(6):803-810.
[2]洪鹏,安国栋,胡美英,等.解淀粉芽孢杆菌HF-01发酵条件优化[J].中国生物防治学报,2013,29(4):569-578.
[3]陈敏,郭旭文,李春远,等.解淀粉芽孢杆菌SC1150的抑菌活性及其液体发酵条件的优化[J].生态科学,2015,34(3):7-12.
[4]张荣胜,梁雪杰,刘永锋,等.解淀粉芽胞杆菌Lx-11生物发酵工艺优化[J].中国生物防治学报,2013,29(2):254-262.
[5]卢彩鸽,董红平,张殿朋,等.解淀粉芽胞杆菌MH71摇瓶发酵培养基及发酵条件优化[J].中国生物防治学报,2015,31(3):369-377.
[6]郭龙涛,邱思鑫,蔡学清,等.内生解淀粉芽孢杆菌TB2液体发酵条件的研究[J].热带作物学报,2010,31(2):259-264.
[7]沈萍,范秀容,李广武.微生物学实验(第三版)[M].北京:高等教育出版社,2003,111.
[8]臧超群,安福涛,刘长远,等.生防细菌 SY286 发酵条件优化[J].中国农学通报,2015,31(25):157-163.
[9]Zhang W B,He X L,Liu H N,et a1.Statistical optimization of culture conditions for milk-clotting enzyme production by Bacillus amyloliquefaciens using wheat bran agro-industry waste[J].Indian Journal of Microbiology,2013,53(4):492-495.
[10]梁春浩,臧超群,安福涛,等.葡萄霜霉病菌拮抗放线菌PY-1发酵条件优化[J].中国生物防治学报,2015,31(6):921-929.
[11]Akpa E,Jacques P,Wathelet B,et al.Influence of culture conditions on lipopeptide production by Bacillus subtilis[J].Applied Biochemistry and Biotechnology,2001,91/93(1/9):551-561.
[12]Rahman MS,Ano T,Shoda M.Second stage production of iturin A by induced germination of Bacillus subtilis RB14[J].Journal of Biotechnology,2006,125(4):513-515.
[13]Stephan D,Da Silva A P M,Bisutti I L.Optimization of a freeze-drying process for the biocontrol agent Pseudomonas spp.and its influence on viability,storability and efficacy[J].Biological Control,2016,94:74-81.
[14]魏娇洋,冯龙,李亚宁,等.内生解淀粉芽孢杆菌X-278发酵条件的优化[J].北方园艺,2014(5):106-110.
[15]Zhao J,Zhao P,Quan C,et al.Comparative proteomic analysis of antagonistic Bacillus amyloliquefaciens Q-426 cultivated under different pH conditions[J].Biotechnology and Applied Biochemistry,2015,62 (4):574-581.
[16]李娟,夏凯丽,王远宏,等.解淀粉芽孢杆菌LJ1摇瓶发酵条件优化[J].生物技术通报,2015,31(12):214-220.
Optimizing Fermentation Condition for Bacillus amyloliquefaciens TWC2
LIANG Yan-qiong1,HUANG xing1,WU Wei-huai1,2,LI Rui1,ZHENG Jin-long1,XI Jin-gen1,HE Chun-ping1*,YI Ke-xian1*
(1.Environment and Plant Protection Institute,CATAS/Key Laboratory for Monitoring and Control of Tropical Agricultural and Forest Invasive Alien Pests,Ministry of Agriculture/Hainan Key Laboratory for Detection and Control of Tropical Agricultural Pests,Haikou 571101,Hainan;2.Opening Project Fund of Key Laboratory of Rubber Biology and Genetic Resource Utilization,Ministry of Agriculture/State Key Laboratory Breeding Base of Cultivation&Physiology for Tropical Crops/Danzhou Investigation&Experiment Station of Tropical Crops,Ministry of Agriculture,Danzhou 571737,Hainan)
To investigate the best condition of biomass of fermentation broth of Bacillus amyloliquefaciens strain TWC2 and increase the antagonistic substance productivity against Colletotrichum falcatum,the single factor experiments and orthogonal experiments were adopted to optimize the liquid fermentation medium and fermentation condition.The results showed that the optimum medium was maltose 5 g/L,fructose 10 g/L,peptone 10 g/L,yeast extract 10 g/L and CaCl21 g/L.The optimum fermentation conditions were temperature 34℃,rotation speed 200 r/min,initial pH value 6.0~6.5,inoculation rate 7%,medium capacity 40 mL/250 mL and fermentation for 48 h.Inhibitory activity of strain TWC2 fermentation solution increased 39.91%under the best optimal medium and culture conditions.
Bacillus amyloliquefaciens;fermentation condition optimization;Colletotrichum falcatum
S435.661
A
1007-2624(2017)06-0017-06
10.13570/j.cnki.scc.2017.06.005
2017-06-06
资金项目:国家天然橡胶产业技术体系病虫害防控专家岗位项目(CARS-34-GW8);中央级公益性科研院所基本科研业务费专项资助项目(2014hzs1J013;2015hzs1J014);中国热带农业科学院橡胶研究所省部重点实验室/科学观测实验站开放课题(RRI-KLOF201506)。
梁艳琼(1985-),女,助理研究员,研究方向:植物病理学。
贺春萍,E-mail:hechunppp@163.com;易克贤,E-mail:yikexian@126.com
