酵母水解物对凡纳滨对虾生长性能、肠道形态和血清非特异性免疫酶活性的影响
2017-11-17马红娜周歧存宋宏斌
熊 家 袁 野 陆 游 马红娜 周歧存* 梁 超 宋宏斌 邹 青
(1.宁波大学海洋学院鱼类营养研究室,宁波 315211;2.广东海纳川生物科技股份有限公司,广州 510275)
酵母水解物对凡纳滨对虾生长性能、肠道形态和血清非特异性免疫酶活性的影响
熊 家1袁 野1陆 游1马红娜1周歧存1*梁 超2宋宏斌2邹 青2
(1.宁波大学海洋学院鱼类营养研究室,宁波 315211;2.广东海纳川生物科技股份有限公司,广州 510275)
本试验旨在研究饲料中添加不同水平酵母水解物对凡纳滨对虾生长性能、肠道形态和血清非特异性免疫酶活性的影响。选择初始体重为(0.41±0.01) g的凡纳滨对虾幼虾640尾,随机分为4组(每组4个重复,每个重复40尾),酵母水解物的添加水平分别为0(对照组)、0.5%、1.0%、2.0%,共配制出4种等氮(42%粗蛋白质)等脂(8%粗脂肪)的试验饲料。进行为期8周的养殖试验。结果表明:1)各添加组的成活率、增重率和特定生长率与对照组相比,差异不显著(P>0.05)。1.0%添加组增重率和特定生长率显著高于2.0%添加组(P<0.05),而饲料系数显著低于2.0%添加组(P<0.05)。1.0%添加组肝体比显著高于对照组(P<0.05),各组肥满度没有显著性差异(P>0.05)。2)饲料中添加不同水平酵母水解物对全虾以及肌肉的干物质、粗蛋白质、粗脂肪和粗灰分含量无显著性影响(P>0.05)。3)酵母水解物对肠道的皱襞宽度、微绒毛高度和上皮细胞高度影响不显著(P>0.05)。而2.0%添加组的肠道皱襞高度显著高于0.5%添加组(P<0.05)。4)与对照组相比,添加1.0%的酵母水解物显著提高了血清酚氧化酶(PO)和溶菌酶(LZM)活性(P<0.05),且一氧化氮合成酶(NOS)活性也在1.0%添加组达最大值。综上所述,在饲料中添加1.0%的酵母水解物能提高凡纳滨对虾的血清非特异性免疫酶活性,同时对生长性能和肠道形态健康不会产生负面影响。
酵母水解物;凡纳滨对虾;生长性能;肠道形态;免疫酶
凡纳滨对虾(Litopenaeusvannamei,L.vannamei),也称南美白对虾,原产于南太平洋沿岸的暖水水域,是一种具有较高经济价值的养殖品种,其营养丰富,肉质鲜美,深受消费者的喜爱。但因其养殖规模的扩大以及养殖水域污染较为严重,使对虾抗病力下降,感染疾病的几率上升,存活率降低[1],导致养殖过程中抗生素等化学品滥用,这不仅存在耐药性和抗生素残留的问题,而且还会造成水体污染等一系列环境问题[2]。所以寻求抗生素替代品对凡纳滨对虾的养殖意义重大,而且受到越来越多学者的关注。其中,酵母水解物(yeast hydrolysate)作为一种新型的饲料添加剂是抗生素的有效替代物之一。

1 材料与方法
1.1饲料配方与制作
酵母水解物由广东海纳川生物科技股份有限
公司提供,营养水平如下:粗蛋白质56.5%,粗脂肪0.50%,粗灰分7.10%,水分4.38%,氨基酸态氮2.32%,甘露寡糖6.75%,核酸14.0%,核苷酸5.12%。
本试验在基础饲料中添加不同水平的酵母水解物,添加水平分别为0(对照组)、0.5%、1.0%、2.0%,配制成4种等氮等脂的试验饲料。试验饲料组成及营养水平见表1。按照表1将各种固态原料粉碎后过80目筛,按配方比例准确称重,并混合均匀,其中维生素和矿物质等微量原料采用逐级扩大法混合,用双螺杆挤条机压制成粒径为1.0~1.5 mm的饲料,90 ℃烘箱中熟化30 min后自然风干,将饲料密封后放入-20 ℃冰箱中保存待用。

表1 试验饲料组成及营养水平(风干基础)
1)每千克维生素预混料含有 One kg of vitamin premix contained the following:VA 5 000 IU,VB160 g,VB250 g,VB120.1 g,VD32 000 IU,VE 100 IU,VK 60 g,肌醇 inositol 200 g,烟酸 nicotinic acid 100 g,生物素 biotin 6 g,叶酸 folic acid 10 g,维生素C磷酸盐 VC phosphate 0.3 g,吡哆醇 pyridoxine 60 g。
2)每千克矿物质预混料含有 One kg of mineral premix contained the following:C10H22N2O4S2Co 5.0 g, CuSO4·5H2O 10.204 1 g, KCl (99.5%) 191.62 g, FeC6H5O7·5H2O 6.8571 g,MnSO4·H2O 6.289 3 g, KI (0.99%) 1.7034 g, NaCl (99.5%) 76.69 g, MgSO4·7H2O (99%) 614.48 g, C6H10CaO6·5H2O (99.5%) 77.83 g, ZnSO4·7H2O 9.275 4 g, Na2SeO30.5 g。
3)营养水平为实测值。Nutrient levels were measured values.
1.2试验动物养殖管理
试验所用凡纳滨对虾虾苗购自广东恒兴集团虾苗厂,于广东恒兴863基地进行为期8周的养殖试验。试验前先将所需虾苗于1 000 L玻璃钢桶中暂养2周,以暂养料(粗蛋白质含量42%,粗脂肪含量8%)饱食投喂。正式试验前24 h停止投喂,挑选规格一致的健康幼虾640尾,初始体重为(0.40±0.01) g,试验共设置4组,每组4个重复,随机分配于16个300 L的玻璃钢桶中,每个养殖桶饲养40尾对虾。根据不同生长阶段确定投饵量,并按体重的8%~10%投喂,每天分4次投喂,早晚的投喂量占总投饵量的60%~70%。分别在07:00、11:00、17:00和21:00进行投喂,并根据当日对虾的进食情况和天气情况调整具体投喂量。养殖期8周。试验用水为经沙滤、沉淀后的海水,前期每2天换水100 L,中后期每天换水200 L,连续充氧,每天记录水温、盐度、溶解氧浓度及pH。试验期间水温26~30 ℃,pH 8.0~8.2,盐度28~32,溶解氧浓度>6 mg/L,氨氮浓度≤0.05 mg/L。
1.3样品采集及分析
养殖试验结束后饥饿24 h,对每个桶的对虾进行计数、称重,用于计算成活率、增重率和特定生长率等生长性能指标。每桶随机取5尾虾,单独量体长、称体重,剥离肝胰腺称重后放入冻存管,肝胰腺重量、体长和体重数据用于计算肝体比和肥满度等形态学指标。每桶随机取8尾虾,4尾全虾,4尾剥去虾壳取肌肉,并保存于-20 ℃冰箱,用于对虾营养成分分析。随机从每个桶中挑选4尾虾并取其完整肠道,混样于2 mL盛有4%多聚甲醛固定液的离心管中固定,用于肠道形态指标分析。每桶取10尾虾于第5步足基部血窦取血,盛于1.5 mL离心管中于4 ℃冰箱放置过夜后,5 000 r/min离心10 min,取上清液分装至PCR管置于-80 ℃冰箱用于血清非特异性免疫酶活性分析。
参照AOAC(1995)[14]中的方法,饲料、全虾及肌肉干物质含量采用105 ℃常压干燥法测定,粗蛋白质含量采用蛋白质测定仪(Leco,FB-528)测定,粗脂肪含量采用脂肪测定仪(OPSIS,SX-360)测定,粗灰分含量采用550 ℃马弗炉灼烧法测定。制备对虾肠道组织切片,采用苏木精-伊红
(HE)染液染色,中性树胶封片,在光学显微镜(Olympus,DP-72)下观察并测量对虾肠道的皱襞高宽、微绒毛高度和上皮细胞高度。对虾血清酚氧化酶(PO)、一氧化氮合成酶(NOS)和溶菌酶(LZM)的活性采用南京建成生物工程研究所的试剂盒经全波长酶标仪(Thermo,Multiskan GO-1510)测定。
1.4计算公式
成活率(%)=100×终末尾数/初始尾数;增重率(%)=100×(终末均重-
初始均重)/初始均重;特定生长率(%/d)=100×(ln终末均重-
ln初始均重)/试验天数;饲料系数=摄食饲料干重/(终末总重-
初始总重);蛋白质效率=(终末体重-初始体重)/
摄入饲料蛋白质总量;肝体比(%)=100×
肝胰腺重/虾体重;肥满度(g/cm3)=100×体重/体长3。
1.5数据统计与分析
2 结 果
2.1饲料中添加酵母水解物对凡纳滨对虾生长性能和饲料利用的影响
由表2可知,各添加组的成活率、增重率和特定生长率与对照组相比,没有显著性差异(P>0.05)。虽然各组成活率没有显著性差异(P>0.05),但随着酵母水解物添加水平的增加,成活率呈先升高后下降趋势,且在0.5%添加组达最大值90.00%。1.0%添加组的增重率和特定生长率显著高于2.0%添加组(P<0.05),而饲料系数显著低于2.0%添加组(P<0.05),同时1.0%添加组的蛋白质效率略高于其他各组,但差异不显著(P>0.05)。饲料中添加1.0%的酵母水解物时,肝体比显著高于对照组(P<0.05),但各组肥满度没有显著性影响(P>0.05)。
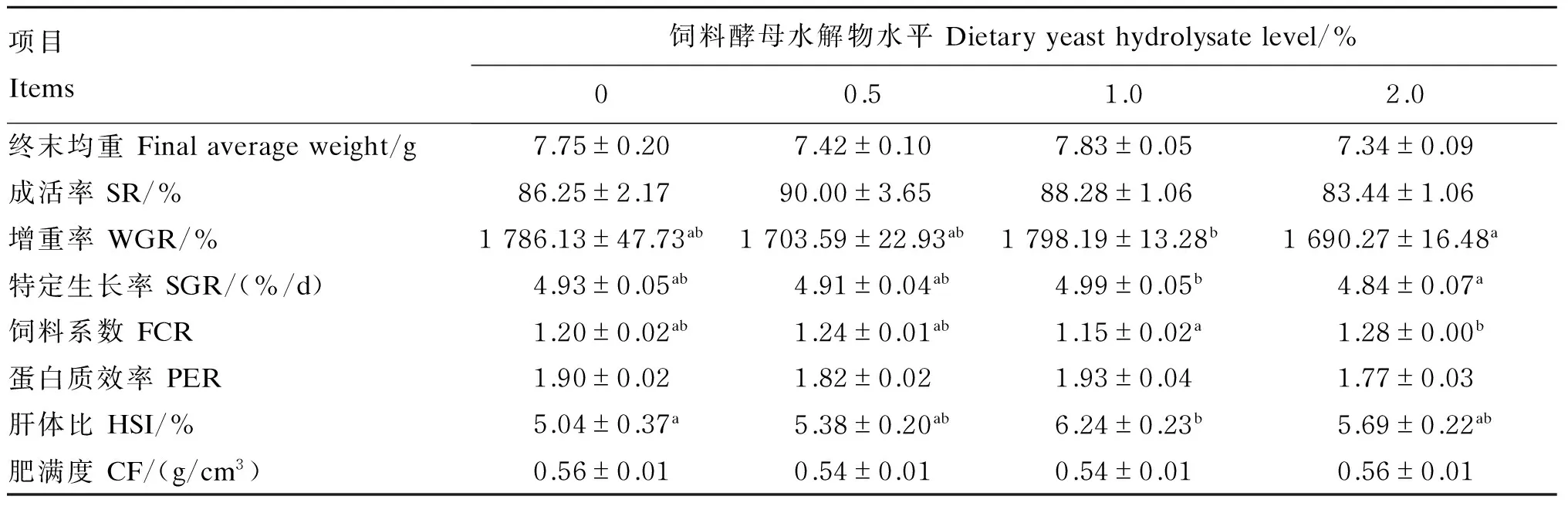
表2 饲料中添加酵母水解物对凡纳滨对虾生长性能和饲料利用的影响
同行数据肩标不同小写字母表示差异显著(P<0.05)。下表同。
Values in the same row with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2饲料中添加酵母水解物对凡纳滨对虾营养成分的影响
由表3可知,饲料中添加不同水平酵母水解物对全虾以及肌肉的干物质、粗蛋白质、粗脂肪和粗灰分含量均无显著性影响(P>0.05)。
2.3饲料中添加酵母水解物对凡纳滨对虾肠道形态的影响
由表4可知,2.0%添加组的肠道皱襞高度显著高于0.5%添加组(P<0.05)。各组肠道的皱襞宽度、微绒毛高度和上皮细胞高度均无显著性差
异(P>0.05),但随着饲料中酵母水解物添加水平的增加,肠道皱襞宽度和上皮细胞高度均呈先降低后上升的趋势,2.0%添加组在数值上高于对照组。
2.4饲料中添加酵母水解物对凡纳滨对虾血清非特异性免疫酶活性的影响
由表5可知,1.0%添加组血清的PO和LZM活性显著高于对照组(P<0.05),而其NOS活性显著高于0.5%添加组(P<0.05)。

表3 饲料中添加酵母水解物对凡纳滨对虾全虾和肌肉营养成分的影响

表4 饲料中添加酵母水解物对凡纳滨对虾肠道形态的影响

表5 饲料中添加酵母水解物对凡纳滨对虾血清非特异性免疫酶活性的影响
3 讨 论
3.1饲料中添加酵母水解物对凡纳滨对虾生长性能和饲料利用的影响
有研究表明,酵母水解物中含有丰富的氨基酸、核酸及甘露寡糖等营养物质,可以通过维护肠道健康,促进其对饲料营养物质的消化吸收,从而提高水产动物的生长性能和饲料利用[15]。有研究表明,饲料中添加适量的酵母水解物能够显著提高草鱼(Ctenopharyngodonidellus)[16]、异育银鲫(Carassiusauratusgibelio)[17]和加州鲈鱼(Micropterussalmoides)[18]水产动物的增重率和特定生长率,并显著降低饲料系数。本试验中,添加1.0%的酵母水解物没有对凡纳滨对虾的增重率、特定生长率和饲料系数产生显著影响,这表明1.0%的酵母水解物并不会降低对虾的生长性能和饲料利用。这与迟淑艳等[19]在研究酵母水解物替代鱼粉对凡纳滨对虾影响上的结果一致,其试验结果得出饲料中添加5%酵母水解物替代16.67%的鱼粉时,对凡纳滨对虾的增重率、特定生长率、成活率和饲料系数不会产生显著性影响。郭小云等[20]报道出酵母水解物对早期断奶仔猪生长性能也无明显优势。李自金等[21]研究发现,酵母培养物对草鱼的增重率和饲料系数无显著影响。不同试验导致结果差异的原因可能是酵母水解物添加水平的不同,或者是试验饲料蛋白质来源以及蛋白质含量的不同。另一个重要原因可能是酵母菌株的来源、酵母水解物的生产工艺和营养成分的不同。本试验结果表明,1.0%的酵母水解物不会影响对虾的生长性能,但当酵母水解物添加水平超过一定量时,对虾的增重和蛋白质效率有下降趋势,而饲料系数上升,这表明过量的酵母水解物可能会影响凡纳滨对虾的生长性能。这与何远法等[22]对酵母培养物的研究结果类似,这可能是由于添加过量的酵母水解物导致饲料中非淀粉多糖增加,抗营养作用加剧,从而抑制了动物的正常消化功能,影响了凡纳滨对虾对饲料中营养物质的吸收,造成维持机体生长所需的能量减少[23],具体原因有待进一步考证。同样的结果出现在崔敏等[24]的研究中,该研究表明饲料中较高比例的生物饲料酵母替代鱼粉会降低大菱鲆(Scophthalmusmaximus)的生长性能,干扰其脂肪和蛋白质的代谢。在本试验中,1.0%添加组的对虾肝体比显著高于对照组,在迟淑艳等[19]的试验中也表示饲料中添加2.5%和5.0%酵母水解物组的肝体比显著高于对照组。本试验结果发现,饲料中添加酵母水解物对全虾和肌肉的干物质、粗蛋白质、粗脂肪和粗灰分含量均无显著影响,这与粟雄高[25]在研究酵母培养物对凡纳滨对虾营养成分影响的结果类似,说明饲料中添加酵母水解物不会影响凡纳滨对虾体成分。综上所述,本试验条件下,饲料中添加1.0%的酵母水解物不会对凡纳滨对虾的生长和饲料利用产生显著影响,但高水平酵母水解物的添加可能会对其生长产生负面效果,这需要更深入的研究探讨。
3.2饲料中添加酵母水解物对凡纳滨对虾肠道形态的影响
肠道是水产动物营养物质消化吸收的主要场所,肠道的生长发育状况直接影响机体对营养物质的消化吸收,而肠道的形态结构指标可以在一定程度上反映肠道是否健康[26]。有研究表明,酵母水解物对早期断奶仔猪[20]和肉鸡[27]的肠道黏膜形态有一定影响,促进肠道生长和健康。而在本试验中,各组凡纳滨对虾肠道的皱襞宽度、微绒毛高度和上皮细胞高度均无显著性差异,但酵母水解物添加水平为2.0%时,对虾肠道皱襞宽度和上皮细胞高度有上升趋势。此外,酵母水解物含有丰富的核苷酸(5.12%),有研究报道在饲料中补充一定含量的核苷酸,可以保护肠道,改善肠道的形态结构和发育,从而促进机体对营养物质的消化吸收[28-29]。苗新等[30]在大黄鱼(Pseudosciaenacrocea)上的研究结果显示,当核苷酸添加水平为150 mg/kg时,不同程度地提高了肠道皱襞高度。许丹丹等[31]试验也指出,添加0.1~0.8 g/kg的酵母核苷酸可以显著提高对虾皱襞厚度。朱天和等[32]的研究表明,在无鱼粉饲料中添加核苷酸可以显著提高鲤鱼的肠绒毛高度和上皮细胞高度。而本试验中,酵母水解物的添加对凡纳滨对虾肠道的皱襞宽度、微绒毛高度和上皮细胞高度无显著性影响,但有上升趋势,这可能与酵母水解物添加水平较低而不足以补充肠道所需的核苷酸有关。酵母水解物对凡纳滨对虾肠道形态影响的具体机制还需深入研究。
3.3饲料中添加酵母水解物对凡纳滨对虾血清非特异性免疫酶活性的影响
血清PO、NOS和LZM的活性是对虾非特异性免疫力指标,一定程度上反映了机体的免疫能力,在对虾机体的免疫和防御中占有重要的地位[33]。PO在甲壳动物中以酶原的形式存在,PO原激活系统是一种重要的免疫识别和免疫防御系统,在抵抗外来病原物质入侵中起着关键作用,是衡量机体免疫能力的重要指标[34-35]。NOS在生物机体免疫中的作用近来得到了学者的广泛关注,经催化可以产生一氧化氮(NO),NO除具有已知的神经传导、松弛平滑肌等功能外,还具有抗菌、抗寄生虫、抗病毒和调节多种免疫活性物质等作用,影响着机体的免疫功能[36]。LZM广泛存在于甲壳动物血细胞和体液中,能水解革兰氏阳性细菌的细胞壁中黏肽的乙酰氨基多糖,并使之裂解、释放出来,形成一个水解酶体系,并防止它们入侵,从而担负起机体的免疫防御功能,是生物体内重要的非特异性免疫的指标之一[37]。柳茜等[38]研究发现,1%~2%的酵母水解物可提高大菱鲆幼鱼的血清LZM和NOS活性。王武刚等[39]研究表明,用酵母提取物替代饲料15%的鱼粉可以使凡纳滨对虾血清的LZM活性显著提高。在迟淑艳等[19]的试验中,饲料中添加2.5%~7.5%的酵母水解物能在一定程度上提升对虾的非特异性免疫能力,其血清PO、NOS和LZM的活性均高于鱼粉对照组,这说明一定量的酵母水解物可以使机体处于较高的免疫防御水平。在何远法等[22]对酵母培养物的研究结果中也显示,饲料中添加0.3%、0.5%或1.0%的酵母培养物可显著提高对虾血清的LZM和PO活性以及肝胰腺的LZM活性,进而提示饲料中添加0.3%~0.5%的酵母培养物可显著提高凡纳滨对虾的非特异性免疫力。在本试验中也表现出类似的效果,1.0%的添加组的血清PO、NOS和LZM活性均高于对照组,这表明饲料中添加1.0%的酵母水解物能提高对虾的血清非特异性免疫酶活性,提示相对于对照组,摄食一定量的酵母水解物可以使机体处于较高的免疫防御水平。
本研究中凡纳滨对虾非特异性免疫酶活性的提升还可能与酵母水解物中含有丰富的β-葡聚糖、甘露寡糖和核苷酸等功能性物质有关。刘立鹤等[40]指出,酵母水解物粉状或膏状产品中均含有17%~30%的β-葡聚糖和甘露寡糖,这对于改善肠道微生态、增强水产动物的非特异性免疫能力具有重要的作用。同时也有研究表明β-葡聚糖和甘露寡糖在提高免疫能力的同时并不会影响机体对其消化利用的效果[11,41]。一些学者研究证明,酵母核苷酸能提高凡纳滨对虾[33]、真鲷(Pagrusmajor)[42]、美国红鱼(Sciaenopsocellatus)[28]、异育银鲫[43]和罗非鱼(Oreochromisniloticus)[44]的非特异性免疫能力,与本试验的结果一致。Sajeevan等[45]表明核苷酸作为水产动物的免疫增强剂,在提高机体免疫功能方面具有重要意义,但核苷酸在甲壳类动物体内的非特异性免疫机制尚不清楚。
4 结 论
在饲料中添加1.0%的酵母水解物能提高凡纳滨对虾的血清非特异性免疫酶活性,同时对生长性能和肠道形态健康不会产生负面影响。
[1] THITAMADEE S,PRACHUMWAT A,SRISALA J,et al.Review of current disease threats for cultivated penaeid shrimp in Asia[J].Aquaculture,2016,452:69-87.
[2] MUROGA K.Viral and bacterial diseases of marine fish and shellfish in Japanese hatcheries[J].Aquaculture,2001,202(1/2):23-44.
[3] FERREIRA I M P L V O,PINHO O,VIEIRA E,et al.Brewer’sSaccharomycesyeastbiomass:characteristics and potential applications[J].Trends in Food Science & Technology,2010,21(2):77-84.
[4] VAN HEUGTEN E,FUNDERBURKE D W,DORTON K L.Growth performance,nutrient digestibility,and fecal microflora in weanling pigs fed live yeast[J].Journal of Animal Science,2003,81(4):1004-1012.
[5] NOCEK J E,HOLT M G,OPPY J.Effects of supplementation with yeast culture and enzymatically hydrolyzed yeast on performance of early lactation dairy cattle[J].Journal of Dairy Science,2011,94(8):4046-4056.
[6] YU H H,HAN F,XUE M,et al.Efficacy and tolerance of yeast cell wall as an immunostimulant in the diet of Japanese seabass (Lateolabraxjaponicus)[J].Aquaculture,2014,432:217-224.
[7] GOPALAKANNAN A,ARUL V.Enhancement of the innate immune system and disease-resistant activity inCyprinuscarpioby oral administration of β-glucan and whole cell yeast[J].Aquaculture Research,2010,41(6):884-892.
[8] WELKER T L,LIM C,YILDIRIM-AKSOY M,et al.Immune response and resistance to stress andEdwardsiellaictalurichallenge in channel catfish,Ictaluruspunctatus,fed diets containing commercial whole-cell yeast or yeast subcomponents[J].Journal of the World Aquaculture Society,2007,38(1):24-35.

[11] MESHRAM S J,MURTHY H S,ALI H,et al.Effect of dietary β-glucan on immune response and disease resistance againstAeromonashydrophilain giant freshwater prawn,Macrobrachiumrosenbergii(de Man.1879)[J].Aquaculture International,2015,23(2):439-447.
[12] SUBRAMANIAN M,ALIKUNHI N M,KANDASAMY K.Immunostimulatory effect of mangrove-derived marine yeasts inPenaeusmonodon[J].Aquaculture Research,2014,45(3):389-396.
[13] BURGENTS J E,BURNETT K G,BURNETT L E.Disease resistance of Pacific white shrimp,Litopenaeusvannamei,following the dietary administration of a yeast culture food supplement[J].Aquaculture,2004,231(1/2/3/4):1-8.
[14] AOAC.Official methods of analysis of AOAC international[M].16th ed.Arlington:Association of Analytical Chemist,Inc.,1995.
[15] 杨凡,易建华,聂琴,等.酵母水解物在水产饲料中的应用[J].中国饲料,2016(16):41-43.
[16] 迟淑艳,聂琴,黄吴文,等.凡纳滨对虾饲料中酵母水解物替代鱼粉适宜比例的研究[J].水生生物学报,2016,40(4):728-735.
[17] 郭小云,吴信,谢春艳,等.酵母水解物对早期断奶仔猪生长性能、血清生理生化指标和激素水平以及肠道黏膜形态的影响[J].饲料工业,2015,36(8):61-64.
[18] 李自金,邱波,童运彬,等.啤酒酵母取代鱼粉在草鱼上的应用[J].饲料工业,2009,30(20):25-26.
[19] 曾本和,向枭,杨文娇,等.酵母水解物对草鱼生长性能和体成分的影响[J].饲料工业, 2015,36(16):16-19.
[20] 杨凡,陈昌福,易建华,等.酵母水解物对异育银鲫生长和免疫性能的影响[J].饲料工业,2015,36(4):60-64.
[21] 曾本和,杨文娇,吴振,等.酵母水解物对加州鲈幼鱼生长性能及免疫酶指标的影响[J].饲料工业,2016,37(14):11-15.
[22] 何远法,郁欢欢,迟淑艳,等.酵母培养物对凡纳滨对虾生长性能、非特异性免疫力和抗病力的影响[J].动物营养学报,2016,28(12):4063-4072.
[23] 邱燕.三种微生态制剂对草鱼(Ctenopharyngodonidellus)生长性能、生理机能及肠道黏膜的影响[D].硕士学位论文.苏州:苏州大学,2010.
[24] 崔敏,郭冉,夏辉.生物饲料酵母替代鱼粉对大菱鲆的影响[J].饲料研究,2011(5):65-68.
[25] 粟雄高.柠檬酸和微生态制剂对凡纳滨对虾生长、消化酶活性和免疫性能的影响[D].硕士学位论文.上海:上海海洋大学,2012.
[26] 杨洪森,戴晋军.酵母核苷酸对动物肠道的保护及在猪生产中的应用[J].国外畜牧学:猪与禽,2012,32(1):83-85.
[27] 贺淼,黄鑫,戴晋军,等.两种不同类型酵母水解物对肉鸡生长性能、肠黏膜形态的影响[J].饲料工业,2015,36(16):60-63.
[28] CHENG Z Y,BUENTELLO A,GATLIN D M.Dietary nucleotides influence immune responses and intestinal morphology of red drumSciaenopsocellatus[J].Fish & Shellfish Immunology,2011,30(1):143-147.
[29] TSUJINAKA T,KISHIBUCHI M,IIJIMA S,et al.Nucleotides and intestine[J].Journal of Parenteral and Enteral Nutrition,1999,23(5S):S74-S77.
[30] 苗新,曹娟娟,徐玮,等.核苷酸对大黄鱼生长性能、肠道形态和抗氧化能力的影响[J].水产学报,2014,38(8):1140-1148.
[31] 许丹丹,曹俊明,黄燕华,等.饲料中添加核苷酸对凡纳滨对虾幼虾生长、肠道形态及抗氧化酶活力的影响[J].中国水产科学,2011,18(5):1115-1124.
[32] 朱天和,吉红,王丽宏,等.酵母核苷酸对鲤鱼生长性能、生化指标和肠道发育的影响[J].饲料研究,2010(9):1-4.
[33] GUO J P,GUO B Y,ZHANG H L,et al.Effects of nucleotides on growth performance,immune response,disease resistance and intestinal morphology in shrimpLitopenaeusvannameifed with a low fish meal diet[J].Aquaculture International,2016,24(4):1007-1023.
[34] MENG F,ZHANG Y,KONG J,et al.The research review of prophenoloxidase activating system in crustacean[J].Oceanologia et Limnologia Sinica,1999,30(1):110-116.
[35] 杨留冰,潘鲁青.注射磷脂酰丝氨酸对凡纳滨对虾血蓝蛋白合成、酚氧化酶活性的影响[J].水产学报,2013,37(9):1378-1388.
[36] 姜国建,于仁诚,王云峰,等.中国明对虾(Fenneropenaeuschinensis)血细胞中一氧化氮合成酶的鉴定及其在白斑综合症病毒感染过程中的变化[J].海洋与湖沼,2004,35(4):342-350.
[37] ELLIS A E.Immunity to bacteria in fish[J].Fish & Shellfish Immunology,1999,9(4):291-308.
[38] 柳茜,杨文娇,吴振,等.酵母水解物对大菱鲆幼鱼非特异性免疫及抗应激能力的影响[J].饲料工业,2015,36(18):33-37.
[39] 王武刚.酵母提取物替代鱼粉在凡纳滨对虾饲料中的应用研究[D].硕士学位论文.上海:上海海洋大学,2012.
[40] 刘立鹤,姚娟,李彪,等.酵母源生物饲料在水产养殖中的应用[J].国外畜牧学-猪与禽,2011,31(2):31-32.
[41] MURTHY H S,LI P,LAWRENCE A L,et al.Dietary β-glucan and nucleotide effects on growth,survival and immune responses of pacific white shrimp,Litopenaeusvannamei[J].Journal of Applied Aquaculture,2009,21(3):160-168.
[42] HOSSAIN M S,KOSHIO S,ISHIKAWA M,et al.Dietary nucleotide administration influence growth,immune responses and oxidative stress resistance of juvenile red sea bream (Pagrusmajor)[J].Aquaculture,2016,455:41-49.
[43] 魏文志,罗方妮,杨成,等.酵母核苷酸对异育银鲫生长和免疫酶活性的影响[J].淡水渔业,2007,37(4):57-60.

[45] SAJEEVAN T P,PHILIP R,SINGH I S B.Immunostimulatory effect of a marine yeastCandidasakeS165 inFenneropenaeusindicus[J].Aquaculture,2006,257(1/2/3/4):150-155.
*Corresponding author, professor, E-mail: zhouqicun@nbu.edu.cn
EffectsofYeastHydrolysateonGrowthPerformance,IntestinalMorphologyandSerumNonspecificImmuneEnzymeActivitiesofLitopenaeusvannamei
XIONG Jia1YUAN Ye1LU You1MA Hongna1ZHOU Qicun1*LIANG Chao2SONG Hongbin2ZOU Qing2
(1.LaboratoryofFishNutrition,SchoolofMarineSciences,NingboUniversity,Ningbo315211,China; 2.GuangdongHinabiotechCo.,Ltd.,Guangzhou510275,China)
This experiment was conducted to estimate the effects of dietary supplemental levels of yeast hydrolysate on growth performance, intestinal morphology and serum nonspecific immune enzyme activities ofLitopenaeusvannamei. A total of 640 juvenileLitopenaeusvannameiwith an initial average body weight of (0.40±0.01) g were randomly divided into four groups with four replicates and 40Litopenaeusvannameiper replicate. Four isonitrogenous and isolipidic practical diets (42% crude protein and 8% crude lipid) were prepared by adding 0 (control group) , 0.5%, 1.0% and 2.0% yeast hydrolysate in a basal diet, respectively. The experiment lasted for 8 weeks. The results showed as follows: 1) there were no significant differences in survival rate (SR), weight gain rate (WGR) and specific growth rate (SGR) between experimental groups and control group (P>0.05). 1.0% supplemental group had significantly higher WGR and SGR than 2.0% supplemental group (P<0.05), and significantly lower feed conversion ratio (FCR) than 2.0% supplemental group (P<0.05). Hepatopancreas somatic index (HSI) in 1.0% supplemental group was significantly higher than that in control group (P<0.05), but condition factor (CF) was not significantly affected by yeast hydrolysate supplementation (P>0.05). 2) Dietary supplemental level of yeast hydrolysate had no significant influences on dry matter, crude protein, crude lipid and ash contents of whole shrimp and shrimp muscle (P>0.05). 3) Fold width, microvillus height and enterocyte height of shrimp intestine were not significantly affected by dietary supplementation of yeast hydrolysate (P>0.05). 2.0% supplemental group had a significantly higher fold height in intestine than in 0.5% supplemental group (P<0.05). 4) Compared with control group, serum activities of phenoloxidase (PO) and lysozyme (LZM) of shrimp were significantly increased by dietary supplementation of 1.0% yeast hydrolysate (P<0.05), and serum nitric oxidesynthase (NOS) activity reached the maximum in 1.0% supplemental group. In conclusion, dietary supplementation of 1.0% yeast hydrolysate can significantly increase serum nonspecific immune enzyme activities ofLitopenaeusvannamei, and will not exert negatively affect growth performance and intestinal morphology health ofLitopenaeusvannamei.[ChineseJournalofAnimalNutrition,2017,29(11):4207-4215]
yeast hydrolysate;Litopenaeusvannamei; growth performance; intestinal morphology; immune enzyme
10.3969/j.issn.1006-267x.2017.11.045
S968.22
A
1006-267X(2017)11-4207-09
2017-04-10
国家自然科学基金项目(41476125)
熊 家(1994—),女,江西瑞金人,硕士研究生,从事水生动物营养与饲料研究。E-mail: 460212581@qq.com
*通信作者:周歧存,教授,博士生导师,E-mail: zhouqicun@nbu.edu.cn
(责任编辑 王智航)
