海洋牧场溶解氧生态模型初探
2017-11-17李培良范开国顾艳镇
孟 鑫 ,王 冬 ,李培良 ,范开国 ,顾艳镇 *
(1.中国海洋大学 海洋与大气学院,山东 青岛 266100;2.交通运输部北海航海保障中心天津海事测绘中心 天津300202;3.中国人民解放军91039部队,北京 102401)
海洋牧场溶解氧生态模型初探
孟 鑫1,王 冬2,李培良1,范开国3,顾艳镇1*
(1.中国海洋大学 海洋与大气学院,山东 青岛 266100;2.交通运输部北海航海保障中心天津海事测绘中心 天津300202;3.中国人民解放军91039部队,北京 102401)
文中利用黄海沿岸威海小石岛海洋牧场2016年6-11月份和荣成西霞口海洋牧场2016年6-10月份海洋牧场海底观测网实时高频温、盐、深、溶解氧、叶绿素浓度等水环境数据对牧场的海底环境进行季节变化分析和日变化分析,并利用自由水域假设建立溶解氧生态模型,对两个牧场的生态系统新陈代谢参数进行计算并分析,得到其GPP,R和NEP的月变化趋势,并结合实测溶解氧数据和海底视频,对生态系统稳定性较差的西霞口海洋牧场进行合理建议。研究还发现对于这两个浅水动物养殖型海洋牧场,物理过程对溶解氧变化的贡献和生物过程相当。
溶解氧;海洋牧场;新陈代谢;初级生产力
海水中的溶解氧是衡量海气相互作用、水质和海洋初级生产力的重要标志,过高或者过低的溶解氧浓度水平都会危害水生生物的生活[1]。海洋中的溶解氧主要来源于两个过程:氧气通过海气界面进入海水属于物理过程;水生植物光合作用释放的氧气属于生物过程。
山东省2015年全面启动海洋牧场观测网项目,在全国率先建立以海洋牧场区水质和水动力环境监测为核心的海洋牧场观测网,从而实现海洋牧场生态环境的长期连续监控,获得海洋环境要素实时高频数据[2-3]。
另一方面,随着资源环境问题的日益突出,海洋牧场建设面临着从经济型向生态型的转变发展。本文通过学习国内外科学理论的基础上对海洋牧场溶解氧参数进行分析和初步模型计算,以此来度量水体营养状态和生态系统承载力,为海洋牧场科学管理和决策提供技术依据,推动海洋牧场建设的可持续、健康发展;同时提出可行的改进技术,为以后的研究工作提供思路。
1 数据与方法
1.1 牧场环境数据
海洋牧场实时高分辨率水动力环境参数水温、盐度、深度等数据以及水质参数溶解氧浓度、叶绿素浓度均来自于山东省海洋牧场观测网项目。
温度、盐度、深度数据来自于海底观测平台搭载的TRDI CTD-NH温盐深仪。测量温度精度±0.005℃,分辨率0.000 1℃、盐度精度0.000 3 S/m,分辨率0.000 01 S/m、压力精度为全量程0.1%,分辨率0.002%。溶解氧浓度数据来自于海底观测平台搭载的SBE43式溶解氧传感器。测量量程为120%饱和度,测量精度是饱和度的±2%。叶绿素浓度数据来自于海底观测平台搭载的SCF叶绿素荧光计。其最小检测量为0.02 μg/L,测量精度0.003 μg/L,量程为 150 μg/L。观测平台另搭载ROS C600海底高清彩色摄像机完成水下环境的视频连续观测,该系统辅助探头还包括水下灯和腐蚀在线监测仪。数据观测时间分辨率均为1 min/次,本文视处理情况取10 min平均或1 h平均来计算。
1.2 实时风速数据
海表面10 m实时风场数据从威海市气象台站获得。风速风向以每小时的数据分辨率导出,另附日最大风速、日极大风速。根据海洋牧场地理位置,本文选取威海站、成头山站的数据做分析,其地理位置如图1所示。
1.3 辅助数据
高精度岸线数据来自GSHHG(Global Selfconsistent,Hierarchical,High-resolution Geography Database)Version 2.3.6.。
高精度水深数据来自GEBCO_2014(General Bathymetric Chart of the Oceans General Bathymetric Chart of the Oceans),分辨率 1/120°。
海洋牧场界址坐标来自山东省海洋与渔业厅《关于莱州湾东部等15处海洋生态修复项目可行性研究报告的批复》附件。本文选取的两个牧场其具体信息如图1、表1所示,两个牧场白天阳光均可到达海底深度,监测视频截取如图2。
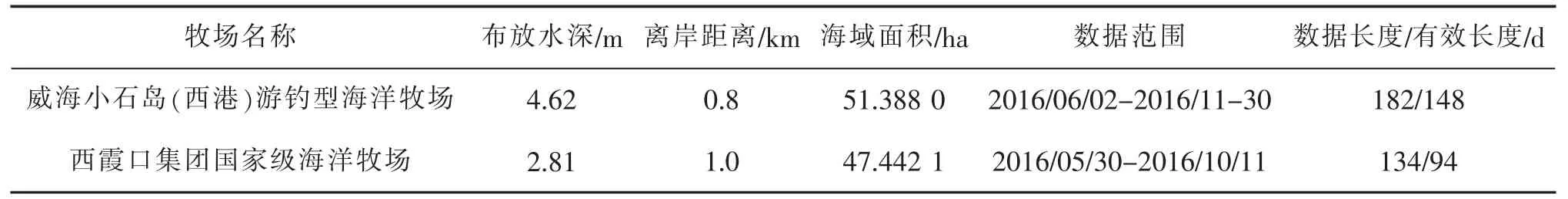
表1 研究牧场概况一览表
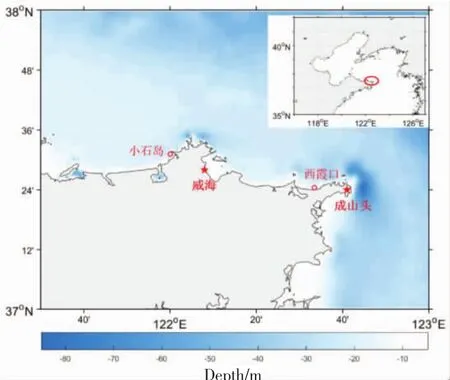
图1 海洋牧场及气象台站地理位置示意图

图2 各海洋牧场日夜视频截取(a.夜间、b.日间)
1.4 自由水域理论
Sargent和Austin于1949年首次利用氧浓度的昼夜变化计算出一个珊瑚礁系的生产率和呼吸率。Odum(1956)首次提出昼夜变化的“自由水域(Free-Water)”理论的概念和计算方法来计算生态系统参数并分析水体营养状态[4]。“自由水域”法和过去用来计算新陈代谢的光/暗瓶培养等方法相比有显著的优势,自Odum后这种方法开始广泛被用于各种水生生态系统的研究[5-8,15-19]。
根据自由水域的假定,海水中溶解氧浓度的变化可以由下式表示:
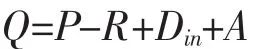
式中:Q为单位面积的溶解氧变率;P为单位面积的总初级生产力(GPP)变率;R为单位面积的呼吸率;Din为单位时间单位面积的混合扩散导致的海气交换;A为小扰动(可忽略)。
本文所研究的海洋牧场观测系统布放深度均较浅,且夏季观测到的最高水温也能达到25℃及以上,这与渤黄海夏季表层水温相一致,证明混合可到达水底;此外秋冬季节混合作用可以直达海底,故研究区域满足其假设条件。
1.5 对海气交换项Din的处理
气体的海气交换表达式如下[13]:
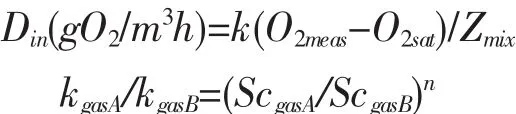
式中:O2meas为实测溶解氧浓度值;O2sat为该时刻海水温度、盐度、压强条件下的饱和溶解氧浓度,本文饱和溶解氧浓度公式采取国家标准海洋调查规范 GB 12763.4-2007-5.7.3(3)式[9]并根据 USGS NO.81.11[10]进行气压订正;Zmix表示混合层深度,本文所研究的海洋牧场上下混合均一,故Zmix一项由水深代替;k为气体交换速度项,单位一般为cm/h或m/h。指数n值的确定决定于海气交换界面是自由界面(取-1/2)还是固定界面(取-2/3),本文研究取值-1/2。施密特数由Wanninkhof(1992)运用最小平方法原理拟合其和温度的经验常数求得[11]。对牧场海表面风速的概率统计显示各有近30%的风速低于3 m/s和大于6 m/s,且日极大风速能达16 m/s,经计算比对图4各试验测量值及经验曲线后选定k600=(2.07+0.215U101.7)/100,k600=(0.266±0.019)U102的线性均值[12-13]作为本文k600计算值。

图4 常用风速/气体交换速度经验公式及著名风速试验值[13]
1.6 日夜光照时间长度的计算
根 据 Iqbal(1983)An Introduction to Solar Radiation一书所述[14],由牧场所在位置的纬度和日期(DOY)计算可得一天中的光照时长(h),由图5知,夏至时牧场所在位置光照时长能长达14.5 h。
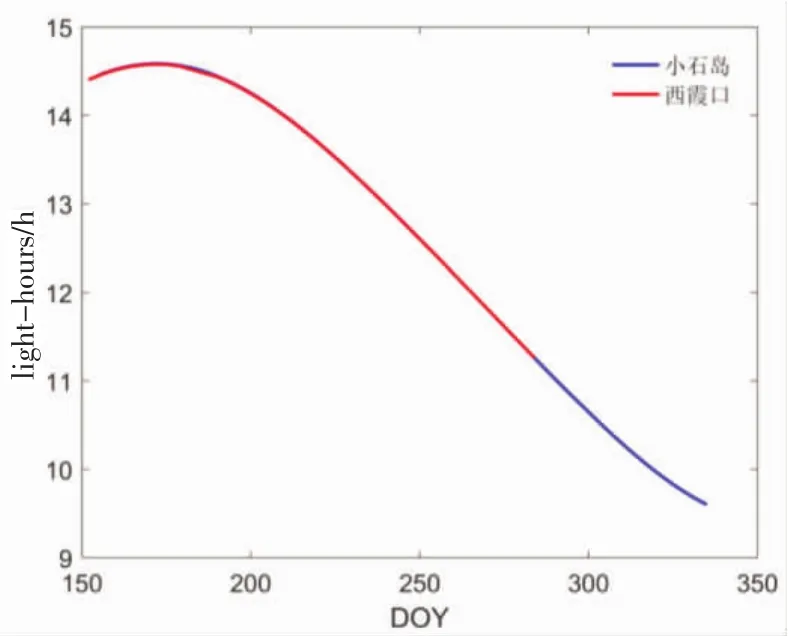
图5 本文各研究牧场每日光照时长随日期的变化
1.7 生态模型的建立
对于一天中的日照时段,其计算公式为

对于夜晚,其计算公式为
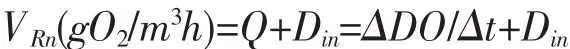
式中:VNEPd表示白天的每小时净生态系统生产力速率;VRn表示夜晚的每小时呼吸率。
总初级生产力(gross primary productivity,GPP)指植物生产的有机碳量,它包括初级生产者自身呼吸作用所消耗的能量,而净初级生产力是扣除其自身呼吸剩下的生产总量。由于在测定生产量时很难将微小型初级生产者、消费者、分解者区别开,难于计算初级生产者自身的净生产量,故引入净生态系统生产力(net ecosystem productivity,NEP)这一概念,它表示从总初级生产力中扣除植物和异养生物呼吸量(Respiration,R)之后的生产量。
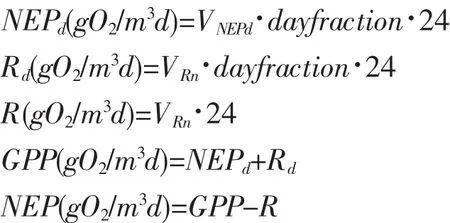
计算得该牧场的新陈代谢生态参数[15]:总初级生产力GPP、呼吸率R和净生态系统生产力NEP。
2 结果与讨论
2.1 海洋环境要素的变化特征
从夏到秋,牧场内水温经历了先升高后降低的过程,同时实测溶解氧浓度先降低后升高。受夏季入海径流增大和降水增多的影响,两牧场海水盐度均略有降低,但保持较大的稳定性。饱和溶解氧浓度跟海水的物理状态有关,随着温度的显著升高,牧场海水饱和溶解氧浓度也有所降低,之后海水温度降低,饱和溶解氧浓度随之升高。夏秋交替,海面南风消退,北风逐渐强盛。
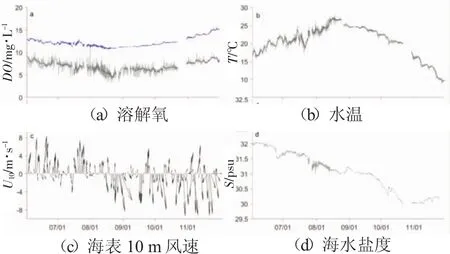
图6 小石岛海洋牧场各参数随时间变化曲线
图6为小石岛海洋牧场各项参数随时间变化曲线。水环境数据取1 h平均;风速为日平均;a,b中叠加黑色线为日平均;a中叠加蓝色线为饱和溶解氧浓度Osat。
随着温度升高和水生生物生命过程的活跃,小石岛海洋牧场溶解氧浓度在8月20号降至日均最低4.8 mg/L,在7月31日出现溶解氧日最大浓度差5.8 mg/L。同时,海水温度从观测初始的17℃逐渐升高,最高至27℃,水温高于25℃的时间可维持半月,此时期与溶解氧浓度最低值时期相一致。秋季开始后溶解氧浓度日变幅已不如夏季显著,其值开始缓慢上升,在11月末达到9 mg/L,此时海水温度降至10℃左右。
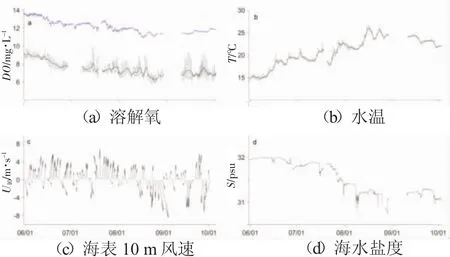
图7 西霞口海洋牧场各参数随时间变化曲线。
图7所示为西霞口海洋牧场各参数随时间变化曲线。水环境数据取1 h平均;风速为日平均;a,b中叠加黑色线为日平均;a中叠加蓝色线为饱和溶解氧浓度Osat。
西霞口海洋牧场海水温度从5月底的日均15℃升温到26℃,在八月中旬达到年日均最高温后缓慢降低,在10月中上旬降至20℃。受海水温盐影响饱和溶解氧浓度也逐渐降低。由图7可知,6月份到8月份溶解氧浓度逐渐降低,从日均9 mg/L降至6.3 mg/L,9月末维持在7 mg/L左右。
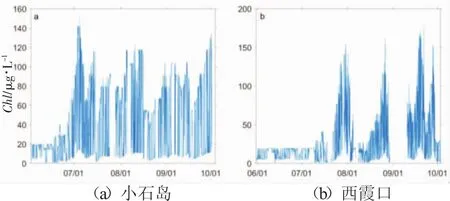
图8 海洋牧场叶绿素随时间分布图(空白部分为缺测)
分析溶解氧浓度在夏季降低并维持的原因有二:首先随着气候变化温度升高,海水本身对于氧气的溶解能力随之降低;其次,小石岛海洋牧场和西霞口海洋牧场的叶绿素浓度分别从7月初和7月中旬开始暴增(图8),这是水生植物(生活在沿岸浅海域中的有根植物和水体上层的浮游植物)开始大量繁殖的标志,然而叶绿素日较差也随之增大,这说明适宜的温度不仅为浮游植物提供了优越的生存环境,也适合浮游动物的繁殖和生长,牧场内养殖作物一方面对水生植物的牧食导致叶绿素的较大变化,一方面呼吸作用消耗的溶解氧大于水生植物光合作用制造的溶解氧量,所以溶解氧浓度降低。而随着秋季结束,水温降低,一方面其氧气溶解度随之升高,另一方面过冷的环境条件不再适合水生生物的生存繁殖,虽然用于光合作用的植物叶绿素会减少,光合作用强度减弱,但水生动物即将进入冬眠模式,其生物量的大大减少更减少了呼吸作用的耗氧量,相比之下溶解氧浓度会升高。
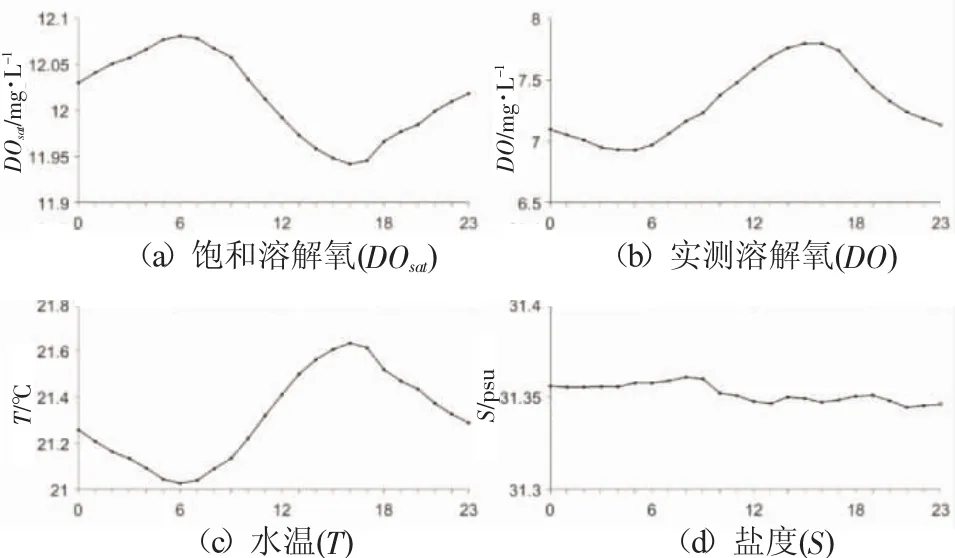
图9 西霞口海洋牧场夏季参数的日变化
观测数据也很好地显示了溶解氧浓度的日变化特征。以西霞口海洋牧场134 d的数据进行平均处理为例,可看到饱和溶解氧、实测溶解氧、温度、盐度日变化特征,见图9。溶解氧浓度日变化变幅约为0.9 mg/L,氧饱和度日变化仅为0.14 mg/L。研究牧场的溶解氧饱和百分比最大可达83%(2016-09-14 16:00 9.45 mg/L),最小至 50%(2016-08-24 4:00)。
海水温度在每天的清晨6时达到一天中的最小值,日出后随着太阳辐射的增强,海水吸收辐射能量,在午后3时温度达到最高,之后太阳辐射减弱,空气温度小于海水温度,海水失热,温度降低。饱和溶解氧浓度受海水温度的直接影响,故其呈现变化周期与海水温度一致的反相变化,在每日海水温度最低时最高,在每日海水温度最高时最低。实测溶解氧浓度明显的日周期变化表现在每天清晨4、5点达到一天中的最小值,然后逐渐升高至午后3点达到一天中的最大值,随即降低。
实测溶解氧浓度并未呈现与温度变化周期一致的反相变化,这是因为,日出之前水生生物的呼吸作用一直消耗氧气,故日出之前会逐渐降低,日出之后光合作用开始制造氧气释放到水体中补充呼吸作用的消耗,随着太阳辐射增强,光合作用制造氧气的速度也在一定范围内随之增大,故午后3时左右溶解氧浓度达到一天中的最大值。实测溶解氧的这一与温度同步的同相变化周期显示出在光照适宜,生物繁多的海区中,影响溶解氧浓度变化的生物过程占主导。海水盐度日变化变幅极其微小,在0.02 psu以内。
2.2 溶解氧生态模型计算结果及其分析
鉴于较深层水体其溶解氧日变化过程会受到更多物理过程的影响[7],本文用1 h平均的溶解氧浓度进行计算生态参数,以滤去高频物理过程的影响。
小石岛海洋牧场月均总初级生产力GPP在9月份达到最大值2.337±0.970 gO2/m3d,之后逐渐减小,到11月时仅有均0.681 gO2/m3d,这是因为11月时温度迅速降低至10℃,光照时长也大大减少,环境条件已不能让水生植物保持夏季一样的生命力,总初级生产力变得相对较弱。GPP在7月略有下降,这应该是浮游动物牧食的结果,浮游动物由于适宜的温度条件和丰盛的食物来源开始繁殖,其对水生植物的牧食使水生植物量有所减少,故7月略有降低。持续适宜的环境条件作用下,水生植物和动物的生物量达到动态平衡,故8、9月份GPP依然很高,水生植物生长依然茂盛。呼吸量在8月最大(3.382±2.261 gO2/m3d),这与该牧场 8月份出现溶解氧浓度最小值相一致,之后呼吸量逐渐降低,但在11月仍保持日均1.762 gO2/m3d的水平,这是因为随着太阳辐射强度减弱,温度下降,环境条件虽已不适合水生植物大量繁殖,但经由夏季和秋季繁衍的动物,已发育成熟进入待捕捞时期,故该牧场11月份呼吸量仍较大。虽然GPP和R在观测时间内变化较大,但净生态系统生产力维持较稳定的水平,其值在-1 gO2/m3d左右波动。这证明了该海区生态系统的稳定性。
由GPP/R示意图可知,该牧场处于轻微异养状态,生物量较大。夏季总初级生产力较高,呼吸率也较高,最大值都可以达到7 gO2/m3d,且变幅也比秋季大,这是夏季水生生物大量繁殖的结果。
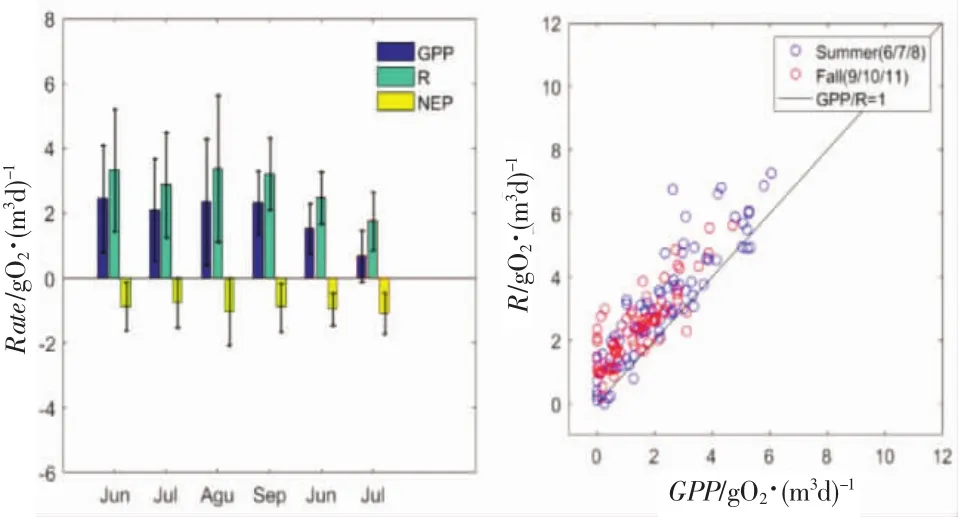
图10 小石岛海洋牧场生态系统新陈代谢速率
西霞口海洋牧场在观测时间段内GPP逐渐升高,但增幅不大,9月份最高1.724±1.475 gO2/m3d。R值呈逐渐升高的趋势,但在8月份例外,结合其叶绿素浓度变化可以推测,水生植物繁殖速度速度慢于动物的摄食速度,导致水生植物急剧减少,进而影响了水生动物的正常生长,经过一段时间后才恢复平衡,故在8月GPP增大的情况下呼吸量有所减少。NEP的值波动较大,虽然8月NEP负值情况最小但这并不意味着健康的牧场状态。9月负值最大,达-2.777±1.932 gO2/m3d。

图11 西霞口海洋牧场生态系统新陈代谢参数月变化

表2 物理过程和生物过程对溶解氧浓度变化贡献率
由于溶解氧浓度的变化由物理过程和生物过程两个过程共同参与,因此分析其各自对溶解氧浓度变化的贡献率,发现两个牧场中物理过程和生物过程的作用相当,鉴于海水溶解氧浓度持续处于不饱和状态,水生植物光合作用产生的氧气不足以支撑生态系统内部的呼吸作用消耗,故物理过程的贡献率较大一些。
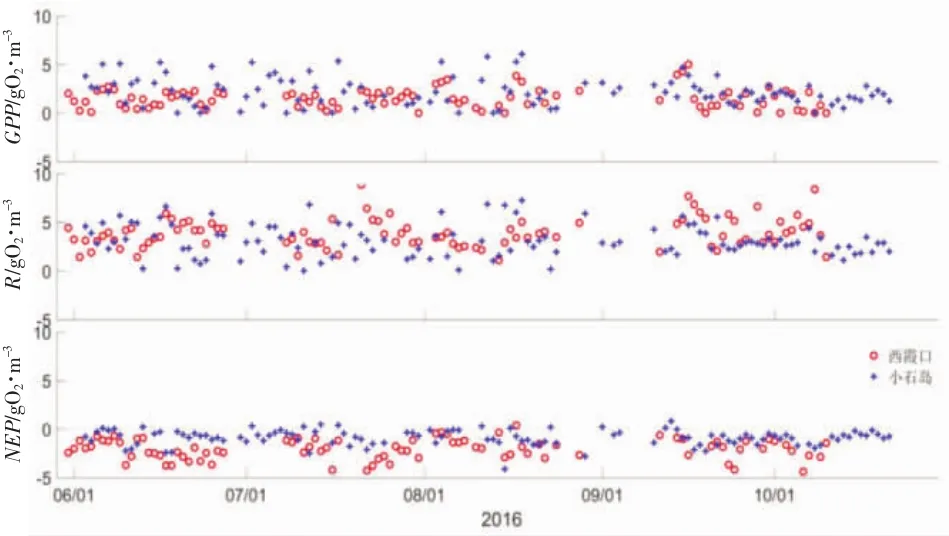
图12 两牧场生态参数随月份变化示意图
综合来看,在夏季(6~8月份),小石岛海洋牧场的总初级生产力高于西霞口海洋牧场,步入秋季(9~10月份)后基本相当,均有所降低。夏季两牧场呼吸量相当,但秋季时小石岛海洋牧场呼吸量有所减少,而西霞口仍保持夏季相当的强度,这与两牧场的养殖作物种类有关。总体来看,虽然溶解氧饱和百分比上西霞口海洋牧场略高于小石岛,但西霞口海洋牧场的异养状态要比小石岛海洋牧场严重。这两个海洋牧场都是生物量较大的海洋牧场,水生植物繁殖并进行光合作用是总初级生产力增高的根本原因,大量的养殖作物(鱼、虾、贝、海参等)在夏秋季节繁殖生长消耗大量氧气导致呼吸率很高,他们对水生植物的牧食作用又减缓了GPP的增长。因此在这类牧场,R值代表了该牧场养殖作物量的大小,NEP负值的绝对值大小代表了生态系统稳定性的强弱。
根据以上分析,可以给出的建议是针对西霞口海洋牧场可以引入适当藻类或人工投饵措施增加养殖作物的食物来源,或者在以后的放种时适当减少其动物量,以减少NEP负值的波动性预示的动物生长繁殖受到食物来源的限制现象。
3 总结与展望
本文对两个海洋牧场的水环境参数进行日变化分析和季节变化分析,并建立生态模型对新陈代谢参数进行计算,发现不同海洋牧场的参数差别较大。
随着春季向夏季的过渡,太阳辐射增强,温度逐渐升高,水生生物开始大量繁殖,溶解氧浓度受这两个因素的影响逐渐降低。而随着秋季的到来,太阳辐射逐渐减弱,昼短夜长,海水温度降低,牧场海区内生物量逐渐下降,溶解氧浓度略有升高。夏秋时期由于陆地径流流量增大和降水的原因,牧场海区内盐度有所下降,但总体保持相当大的稳定性。
夏秋季节牧场海区内溶解氧浓度受生命过程的影响呈现显著的日变化特征,即与温度同相位的日变化:在每日凌晨达到最低,午后2~3时达到最高。
牧场在夏秋季节溶解氧浓度较低时生命过程较为活跃,此时海水温度较高,适宜水生生生物的生长繁殖。小石岛海洋牧场和西霞口海洋牧场均在在9月份达到GPP最大值,分别为2.337±0.970 gO2/m3d,1.724±1.475 gO2/m3d。小石岛海洋牧场呼吸量在8月最大(3.382±2.261 gO2/m3d),NEP在-1 gO2/m3d左右波动较小,这证明了该海区生态系统的稳定性。西霞口海洋牧场呼吸量在9月最大,值4.501±1.790 gO2/m3d,其NEP一直为负值但波动较大,表明其生态系统稳定性较弱。对两个牧场来说,牧场海区内溶解氧一直处于不饱和状态,物理过程对溶解氧浓度变化的贡献和生物过程相当。
限于数据的观测长度,未能对海洋牧场相关参数进行长期季节性的变化分析;关于自由水域法溶解氧浓度生态模型在海洋牧场中的应用,本文仅考虑了较浅水域(真光层)的情况,而多数牧场的海底观测平台日间光照情况较差,本模型的改进应用应继续考量;此外,可以考虑引入光合有效辐射参数,这样就可以对每日的溶解氧浓度变化进行反演模拟,以得到更精细的牧场生态参数数据,拓宽海洋牧场的研究,使模型实用性更强。
[1]李冠国.范振刚.海洋生态学[M].北京:高等教育出版社,2011.
[2]杨红生.我国海洋牧场建设回顾与展望[J].水产学报,2016,07:1133-1140.
[3]李本龙.近海有缆观测系统的设计与实现[D].青岛:中国海洋大学,2015.
[4]OdumH T.Primaryproduction in flowingwaters[J].Limnology&Oceanography,1956,1(2):102-117.
[5]Staehr P A,Testa J M,Kemp WM,et al.The metabolismofaquatic ecosystems:history,applications,and future challenges[J].Aquatic Sciences,2012,74(1):15-29.
[6]KempWM,BoyntonWR.Influenceofbiologicalandphysicalprocessesondissolvedoxygendynamicsinanestuarinesystem:Implications for measurement ofcommunitymetabolisma[J].Estuarine&Coastal Marine Science,1980,11(4):407-431.
[7]ColosoJ J,Cole J J,Hanson P C,et al.Depth-integrated,continuous estimates ofmetabolismin a clear-water.[J].Canadian Journal of Fisheries&Aquatic Sciences,2008,65(4):712-722.
[8]CaffreyJ M.Production,respiration and net ecosystemmetabolismin U.S.estuaries.[J].Environmental Monitoring&Assessment,2003,81(1-3):207-219.
[9]国家海洋局908专项办公室编.海洋化学调查技术规程[M].北京:海洋出版社.2006.
[10]USGS (United States Geological Survey).Water quality:New tables of dissolved oxygensaturation values[M].Amend.Qual.Water Tech.Memo,1981,81,11-15.
[11]WanninkhofR.Relationship between wind speed and gas exchange over the ocean[J].Journal of Geophysical Research Atmospheres,1992,97(6):351-362.
[12]Cole J J,Caraco N F.Atmospheric exchange of carbon dioxide in a low-wind oligotrophic lake measured by the addition of SF6[J].Limnology&Oceanography,1998,43(4):647-656.
[13]HoDT,LawCS,Smith MJ,et al.Measurements ofair-sea gas exchange at high wind speeds in the Southern Ocean:Implications for global parameterizations[J].Geophysical Research Letters,2006,33(16):382-385.
[14]Iqbal M,Valnicek B.An Introduction toSolar Radiation[M].Academic Press,1983.
[15]CaffreyJ M.Factors controllingnet ecosystemmetabolismin U.S.estuaries[J].Estuaries and Coasts,2004,27(1):90-101.
[16]Staehr P A,Bade D,Bogert MC V D,et al.Lake metabolism and the diel oxygen technique:State of the science[J].Limnology&OceanographyMethods,2010,8(8):268-644.
[17]Hu Z,Xiao Q,Yang J,et al.Temporal dynamics and drivers ofecosystem metabolism in a large subtropical shallowlake(Lake Taihu)[J].International Journal ofEnvironmental Research&Public Health,2015,12(4):3691-706.
[18]Mcnair J N,Gereaux L C,Weinke A D,et al.New methods for estimating components of lake metabolism based on free-water dissolved-oxygen dynamics[J].Ecological Modelling,2013,263(1765):251-263.
[19]Hanson P C,Carpenter S R,Kimura N,et al.Evaluation of metabolism models for free-water dissolved oxygen methods in lakes[J].Limnology&OceanographyMethods,2008,6(5):454-465.
Preliminary Study on the DO Eco-Model in the Ocean Ranch
MENG Xin1,WANG Dong2,LI Pei-liang1,FAN Kai-guo3,GU Yan-zhen1
1.Collage of Ocean and Atmospheric Sciences,Ocean University of China,Qingdao 266100,Shandong Province,China;
2.Navigation Guarantee Center of North China Sea,Ministry of Transport,Tianjin 300202,China;
3.Troop 91039 of the PLA,Beijing 102401,China;
Based on the real-time high-frequency onsite data including temperature,salinity,depth,dissolvedoxygen (DO)and chlorophyll concentration collected by the Observation Network in the Ocean Ranch of Shandong Province,the water environment factors of two selected ocean ranches are analyzed to show the diel and seasonal variations among ranches on the same time.The selected ranches include Weihai Xiaoshi Island ranch during Jun to Nov,2016,and Rongcheng Xixiakou during Jun to Oct,2016.The'Free-Water'technique,which is firstly applied in researching China's offshore marine ranches,is utilized in the DO Eco-model to calculate the ecosystem metabolic rates,so that the inter-monthly variations of GPP,R and NEP are well showed for each ocean ranch.Combined with real-time data and undersea HD video,some rational suggestions are proposed concerning the Xixiakou ocean ranch,the one with bad ecosystem stability.It is also indicated that,in terms of these two shallow coastal aquatic breeding ocean ranch types,the DO concentration never comes to 100%of air saturation,and the physical process contribution to the DO diurnal change corresponds to the biological processes.
dissolved oxygen(DO);ocean ranch;metabolism;primary productivity
X834;P714+.5
A
1003-2029(2017)05-0120-07
10.3969/j.issn.1003-2029.2017.05.019
2017-04-10
中央高校基本科研业务费资助专项(201562013);国家自然科学基金资助项目(41476002);国家高技术研究发展计划(863计划)重点项目资助(2012AA09A403);2016年山东省重点研发计划资助项目(2016ZDJS09A02)
孟鑫(1993-),女,硕士研究生,主要从事海洋牧场研究。E-mail:xizi1993425@sina.com
顾艳镇,E-mail:564337843@qq.com
